博文
氢气抗炎症效应的发现【经典】
||
氢气抗炎症作用的发现【经典】
本文是氢气医学奠基性研究,美国匹兹堡大学Nakao教授团队的工作,率先证明氢气吸入对于预防小肠移植导致的小肠组织损伤和炎症反应,这一研究第一次明确了氢气的抗炎症作用,为后续炎症相关疾病的研究打开了大门,是推动氢气医学蓬勃发展的重要推手。该论文2008年发表在《美国移植杂志》American Journal of Transplantation上。
摘要
氢气吸入可改善移植引起的肠道移植物损伤中的氧化应激
小肠移植(SITx)过程中的缺血/再灌注(I/R)损伤常常导致包括运动功能障碍、炎症和器官衰竭在内的并发症。最近的证据表明,氢气吸入可以消除有毒的羟基自由基。在Lewis大鼠中进行了同基因、原位SITx,冷缺血时间为3小时。供体和受体都在手术前后接受了空气或2%氢气吸入处理。SITx导致胃肠传输延迟以及术后24小时空肠环肌收缩活动减弱。氢气处理显著改善了胃肠传输,以及对贝坦诺醇反应的空肠平滑肌收缩力。氢气减轻了移植引起的炎症介质CCL2、IL-1β、IL-6和TNF-α的上调。与空气处理的移植物中升高的组织丙二醛水平相比,氢气显著减少了脂质过氧化,显示出抗氧化效果。组织病理学上的粘膜糜烂和增加的肠道通透性表明移植后粘膜屏障功能受损,而氢气处理显著减轻了这一现象。在受体肺中,氢气处理还显著减少了炎症mRNA的诱导并降低了中性粒细胞的招募。氢气吸入显著改善了肠道移植损伤,并通过其抗氧化作用防止了远端器官炎症。围手术期氢气的管理可能是一种强效且适用于临床的治疗肠道I/R损伤的策略。
前言
氢气是最轻和最丰富的化学元素之一,构成了宇宙元素质量的近75%,并通过与氦的核聚变提供了恒星诞生的质量以及太阳的能量来源。相比之下,地球大气中的氢气含量不到1ppm。超过5%的浓度时,氢气可以与空气形成爆炸性混合物,这已被1937年的兴登堡号飞艇灾难所神话化。大量的氢气吸入浓度被用作深海潜水的混合气体——氢氦氧混合气(分别为49%、50%和1%的混合物),因为它缩短了解压时间,预防了解压病,并避免了氮麻醉(1)(注:此处存在不严谨的说法。高压潜水员使用氢气的关键是降低氧气毒性和减少呼吸阻力,避免氮气麻醉和缓解高压神经综合征)。在两次深海潜水(HYDRA 8和HYDRA 10)期间,出现了神经肌肉驱动的变化,骨骼肌肉功能下降和心率减慢。但是,这些变化主要归因于高压环境,而不是特定于氢气吸入(2,3)(注:潜水医学的结论是,数十个大气压的高压氢气确实具有抑制心率的作用)。据我们所知,关于潜水员使用氢气时肠道运动变化的报道不存在。
从生理上讲,每天约有150毫升的氢气由多种肠道细菌在主要是大肠中发酵不可消化的碳水化合物产生,并作为腹部气体的自然成分排出(4),呼出或被结肠菌群进一步代谢(5)。呼出氢气是常规使用的氢气呼气测试的基础,用于胃肠传输和评估小肠细菌过度生长(6,7)。众所周知,抗生素治疗可以通过减少厌氧产氢微生物来改变H2呼气测试的结果(8)。与其他胃肠道的气态细菌代谢产物相比,氢气似乎具有改变运动性的特性。事实上,以产甲烷细菌为主的肠易激综合症(IBS)患者的胃肠传输与产氢者相比显著减慢(9)。在IBS中占主导地位的氢气生产者中,用抗生素清除细菌过度生长会导致腹泻症状缓解,这表明H2产生细菌诱导了过度收缩(10)。有趣的是,结肠菌群代谢氢气的能力被认为在防止深水潜水时的不良影响中很重要(11,12)。
最近,有报道称吸入氢气具有抗氧化和抗细胞凋亡的特性,可以通过选择性中和羟基自由基来保护大脑和肝脏免受缺血/再灌注(I/R)损伤(13,14)。肠道的I/R损伤发生在多种临床情况下,例如肠系膜动脉闭塞、低血容量性休克和小肠移植(SITx)(15,16)。缺血的肠道可能成为促炎介质的主要来源,这不仅加剧了局部肠道损伤和功能障碍,还增强了导致多器官衰竭的全身性炎症反应(17,18)。尽管已经提出了导致I/R损伤后肠道功能障碍的各种机制,但活性自由基无疑在其中扮演了关键角色。超氧阴离子(·O2-)自由基是通过线粒体电子传递链泄漏产生的,并由代谢氧化酶产生(19)。·O2-自由基的过量产生推动了H2O2的产生,并通过芬顿反应继而产生羟基自由基(OH·)。OH·是最强的氧化物质种类,并且无差别地与膜脂质过氧化、氧化DNA和使蛋白质变性(20,21)。
哺乳动物物种缺乏内源性的OH·自由基解毒系统;因此,在肠道I/R损伤过程中清除或减轻OH·可能对改善患者结果具有显著的有益效果(22,23)。H2的质子已被证明能够通过形成水来选择性地失活OH·。因此,由于失活的独特选择性,H2被认为不会显著改变控制炎症和凋亡的其他活性氧分子细胞内信号传导途径。在培养中,质子被报道可以防止DNA氧化,保持线粒体膜电位从而ATP合成,以及维持细胞形态(14)。在体内,氢气吸入在中脑动脉闭塞模型中显示出减少梗死面积和改善神经功能的潜力(14)。此外,在肝IR损伤模型中,氢气吸入防止了肝细胞死亡,并降低了血清丙氨酸氨基转移酶和肝组织丙二醛(MDA)水平(13)。在本研究中,我们假设氢气吸入可以改善SITx后的肠道I/R损伤。我们利用已建立的原位同基因SITx大鼠模型来测试这一假设,并发现氢气可以减少移植物的氧化损伤和炎症。与内腔内给予产氢细菌的方法(12,24)相比,外源性补充氢气允许在没有细菌过度生长的风险和不适的情况下使用氢气的有益效果,例如肠道移植物内的感染性肠炎。
研究方法
动物
自Harlan Sprague Dawley公司(印第安纳波利斯,IN)购买体重为200-250克的近交雄性LEW(RT.1l)大鼠,并在匹兹堡大学的层流动物设施中饲养,提供标准饮食和随意饮水。所有程序均按照匹兹堡大学IACUC的指南进行。
移植手术和氢气处理
如前所述(25,26),进行了原位同基因SITx,伴有3小时的冷缺血,保存在冰镇的乳酸钠林格溶液中。每例移植的供体和受体都在手术前1小时开始通过麻醉气体蒸发器利用面罩(13)供应空气或2%氢气/98%空气(Praxair,Danbury,CT)。受体在手术期间和手术后1小时继续吸入治疗。未经手术的假手术动物也在异氟醚全身麻醉下给予空气或2%氢气2小时。因此,使用了四个实验组:Shamair,ShamH2,SITxair和SITxH2。每组实验的数量(N)指的是用于每个终点的个体动物的数量;从每个个体动物获得的观察数量在适当的地方表示为数量(n)。
胃肠传输
通过测量口服非吸收性荧光素标记的葡聚糖(Molecular probes,Eugene,OR;分子量= 70-ƒ000)在术后24小时的动物中的分布,研究了氢气对胃肠功能的影响(每组N = 6)。在90分钟的体内胃肠传输时间后,动物被牺牲,构建了个别胃肠传输分布直方图,并如前所述进行了统计分析(27),同时使用计算的几何中心(28)进行了统计分析。
体外空肠平滑肌收缩性
为了确定氢气对假手术和移植肠道的直接影响,如前所述(27,29,30),测量了空肠环形平滑肌的机械活动。在SITx后24小时取出中空肠段,这是已知与SITx相关的肠蠕动被最大程度抑制的时间点(27,30,31)。通过显微解剖去除粘膜层,并以标准化的方式准备肌肉条。将肌肉条安装在水平机械器官室中,并通过等长力传感器(ADInstruments,科罗拉多斯普林斯,CO)监测收缩性(每组N = 6,每只动物n = 4)。加入贝坦诺醇(0.3-300 μM)引起环形肌肉收缩性的浓度依赖性增加。通过积分收缩下的面积来测量收缩活动,并通过将条带的重量和长度转换为组织平方毫米(1.03 mg/mm2)进行归一化,并报告为g/mm2/s。组织病理学分析
手术后3小时取出全肠道的六个部分(两个近端、两个中间和两个远端),每个部分长度为1英寸(每组N = 6,每只动物n = 6)。小肠组织用10%缓冲福尔马林固定,石蜡包埋,切成4μm厚的切片,并用苏木精和伊红染色。根据Park等人报道的标准,以盲法对粘膜损伤进行显微镜下分级。粘膜损伤程度用0-5级评分量表评估:0级等于健康粘膜,1-5级表示绒毛损伤程度逐渐增加。
接收者肺组织也用10%福尔马林固定,石蜡包埋,切成6μm厚度,并使用萘酚AS-D氯醋酸盐酯酶染色试剂盒(Sigma Diagnostics, St. Louis, MO)染色,以便检测粒细胞的存在(每组N = 5)。以盲法计算阳性染色细胞,结果呈现为每×200高倍视野(HPF)的阳性细胞数。
qRT-PCR
假手术动物和移植受体的收获小肠的外层肌肉在移植物再灌注后3小时剥离,并迅速在液氮中冷冻(每组N = 10)。接收者的肺组织也在处死后取出,并在-80°C保存直到分析。使用SYBR Green两步法实时RT-PCR,如前所述(参考文献26,34),对以下mRNA进行定量:磷酸甘油醛脱氢酶(GAPDH)、趋化因子(C-C模体)配体2(CCL2)、白细胞介素1β(IL-1β)、白细胞介素6(IL-6)、肿瘤坏死因子(TNF)-α和白细胞介素10(IL-10)。qRT-PCR引物序列列于补充表S1中。
移植物氧化损伤评估
每个实验组冲洗过的空肠全厚度片段在再灌注后3小时取出并均质化(每组N = 7)。使用制造商的试剂盒(Kit MDA-586; Oxidresearch, Portland, OR)确定组织MDA浓度,即脂质过氧化的标志。全厚度空肠样本也用商业试剂盒Total Antioxidant Power分析了还原能力(Oxford Biomedical Research, Oxford, MI)(每组N = 7)。
移植物壁通透性
使用公认的翻转肠囊法(参考文献30,35,36),在术后3小时测定肠移植物壁的通透性。翻转的肠段在冰冷的改良Krebs-Henseleit碳酸氢盐缓冲液(KHBB; pH 7.4)中准备,并在含有FD4(平均M.W. 4000 Da)的80 ml KHBB中悬浮,温度为37°C。经过30分钟孵化后,收集肠囊内的液体,并使用Perkin-Elmer LS-50荧光分光光度计(Palo Alto, CA)测量荧光。通透性以FD4的清除率表示,使用先前描述的方程计算(参考文献30,37)。
数据分析
结果以均值 ± 标准误差(SEM)表示。统计分析使用不成对的学生t检验或方差分析(ANOVA),视情况而定。使用Microsoft Excel的EZAnalyze插件进行F检验,并在适当的情况下进行Bonferroni事后组间比较。p值小于0.05被认为具有统计学意义。
研究结果
血氢气和甲烷水平
动脉血样中的氢气水平通过气相色谱法(Biogas分析仪BAS-1000,Mitleben,Osaka,日本)测量。在室内空气吸入的假手术动物平均动脉氢水平为158.5 ± 6.4 ng/mL。吸入2%氢气2小时导致动脉氢水平显著升高至578 ± 63.6 ng/mL。这些结果表明,通过吸入,氢气有可能系统地传递到啮齿动物的组织中。
肠道细菌将氢气转化为甲烷的显著腔内转化似乎并未发生,因为空气吸入动物的动脉血中甲烷浓度平均为158.6 ± 8.9 ng/mL,而2小时的氢气吸入并未改变血中甲烷水平(154.1 ± 8.8 ng/mL)(p < 0.05)。
氢气吸入预防肠道动力障碍
麻醉和2%氢气吸入并未改变从假手术动物测量的胃肠传输分布直方图,因为在两组中,大部分不可吸收的荧光葡聚糖位于小肠远端和盲肠(图1A)。如之前所示(参考文献27),SITx在术后24小时导致胃肠传输显著延迟。在空气处理的SITx受体(SITxair)中,荧光传输标记主要发现在胃和小肠近端。相比之下,用氢气处理的移植动物(SITxH2)显示出显著改善的胃肠传输,荧光标记的葡聚糖向下移动到小肠远端(图1B)。肠道吻合部位似乎不影响传输。每组的平均计算几何中心以直方图形式绘制在图1C中。这些数据显示,与空气吸入相比,氢气吸入治疗显著改善了移植动物的推进性运动(p < 0.05)。SITxair(53.3 ± 1.5 cm)和SITxH2动物(51.8 ± 0.7 cm)之间的小肠长度没有差异(p > 0.05)。
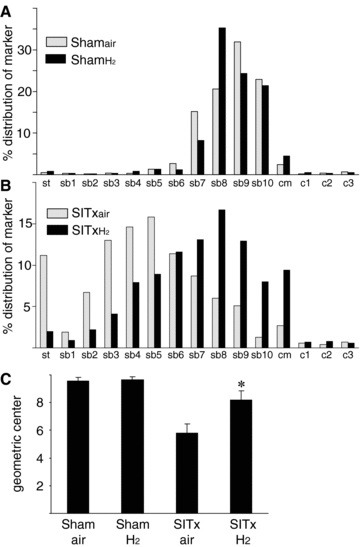
图1胃肠道传输。胃肠道传输直方图显示,在Shamair和ShamH2中,口服给予的荧光标记物在口服后90分钟的肠道分布相似(每组N = 6)(A)。长时间的冷保存导致的肠道移植显著延迟了胃肠传输。氢气吸入显著改善了再灌注后24小时的肠动力(每组N = 6)(B)。计算的传输几何中心(GC)测量表明,氢气吸入治疗显著保护了进行SITx的大鼠的胃肠功能(*p < 0.05 vs. SITxair,每组N = 6)(C)。
氢气改善了肠移植物的空肠平滑肌收缩力
体外空肠环肌条对增加浓度的毒蕈碱激动剂贝塔尼科林的反应进行了量化。来自Shamair动物的肌肉条产生了规律的自发收缩,这种活动并没有因氢气假手术处理而显著改变。尽管移植导致了SITxair动物的自发肌肉收缩活动显著减少(图2A和B),但与空气吸入的移植移植物相比,从SITxH2动物收获的空肠肌条倾向于展示出显著更强的自发收缩活动。向器官浴灌注液中添加贝塔尼科林(0.3-300 μM)在Shamair和ShamH2动物中引发了类似的浓度依赖性增加的环状平滑肌收缩力。SITxair动物显示出贝塔尼科林刺激的收缩显著受抑(图2A和B)。相比之下,SITxH2动物显示出比SITxair更强大的贝塔尼科林刺激的环状平滑肌收缩反应,接近假肌肉反应(p < 0.05)。每组对贝塔尼科林(100 μM)的反应的平均重量/长度调整值为Shamair= 2.6 ± 0.26,ShamH2= 2.7 ± 0.34,SITxair= 1.3 ± 0.33和SITxH2= 2.6 ± 0.27 g/mm²/s。
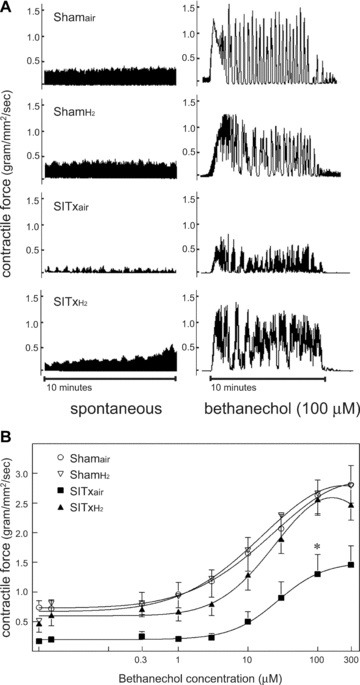
图2展示了空肠平滑肌收缩活动的代表性追踪(A)。代表性的机械追踪显示了自发性收缩活动(左面板)和对贝塔尼科林(100 μM)刺激的最大收缩反应(右面板)。假手术组的动物肌肉条产生了规律的自发性和对贝塔尼科林的大幅度相位性和紧张性反应。长时间的冷缺血再灌注(I/R)损伤导致自发或刺激的肌肉收缩活动显著减少。氢气吸入在SITx后24小时显示出更大的自发性收缩活动,无论是自发的还是贝塔尼科林刺激的收缩活动。每组的代表性图片来自24个独立追踪。计算的空肠平滑肌对贝塔尼科林的收缩反应(B)。来自假手术对照动物(空心圆)和接受氢气吸入的假手术动物(空心三角)的空肠环肌条显示出对贝塔尼科林剂量依赖性的收缩面积增加。这种活动在移植后24小时取得的移植肌肉中显著减弱(实心方块)。在氢气处理的移植动物中测量到显著改善(实心三角)(*p < 0.05 vs. SITxair,每组N = 6,每个动物n = 4)。
氢气抑制了肌层炎症mRNA的上调
与空气吸入的肠道移植显著诱导了IL-1β、IL-6和CCL2的促炎mRNAs,在移植后3小时内分离出的肠道肌层中。氢气处理显著阻止了这些炎症介质mRNA水平的诱导(p < 0.05)。已知为抗炎细胞因子的IL-10的mRNA水平,在同一时间点移植后也显著上调。然而,氢气处理并没有显著影响IL-10 mRNA的表达(图3)。
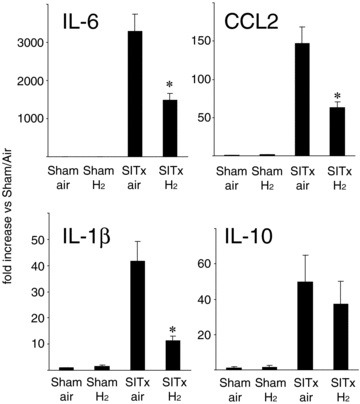
图3实时RT-PCR分析显示,与假手术处理的动物相比,移植后3小时的移植肌层中IL-1β、IL-6和CCL2的mRNA表达显著增加。氢气吸入处理导致这些炎症介质的上调显著减少(*p < 0.05 vs. SITxair,每组N = 10)。IL-10表达在SITx后上调超过40倍,但氢气吸入并没有影响再灌注后3小时IL-10的表达。
氢气减轻了粘膜形态损伤并防止了肠屏障功能的损害
再灌注后3小时的肠道内膜组织病理学特征显示,SITxair移植物出现明显的粘膜糜烂和大面积上皮提升。氢气处理显著减轻了这些粘膜改变(图4A和B)。I/R损伤导致的肠粘膜损伤会导致肠通透性增加,从而导致细菌易位。SITxair移植物在手术后3小时导致肠屏障功能显著受损(p < 0.05 vs. Shamair)。然而,氢气处理显著预防了这种通透性的降低(图4A和C)。
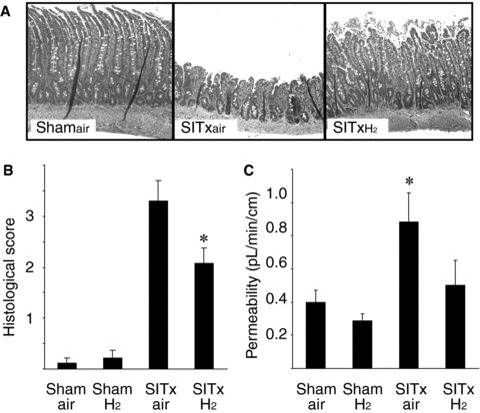
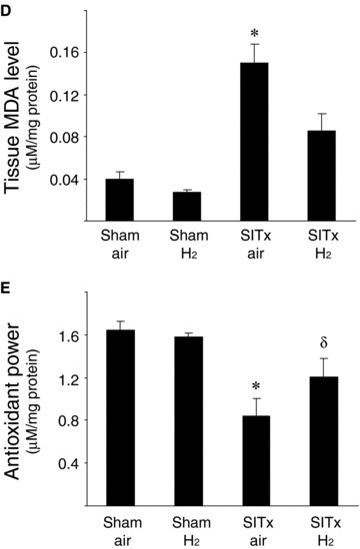
图4再灌注后3小时对肠移植物的组织病理学分析显示,空气对照移植物出现明显的粘膜糜烂和大面积上皮提升。这些粘膜损伤被氢气处理显著减轻(苏木精-伊红染色,原始放大倍数×200)(A)。肠道损伤程度以每只动物的平均分数表示。氢气处理显著改善了SITx后3小时的组织病理学损伤(*p < 0.05 vs. SITxair,每组N = 6,每只动物n = 6)(B)。肠通透性在SITx后3小时增加,表明粘膜屏障功能丧失(*p < 0.05,每组N = 11)。氢气显著预防了肠通透性的增加,避免了粘膜屏障破坏(C)。氧化损伤的肠移植物标记(D)。通过测量组织MDA浓度来确定移植物的氧化损伤,这是脂质过氧化的标记。展示出抗氧化效果,氢气吸入后的移植物在SITx后3小时与空气处理的肠移植物相比,没有显著诱导脂质过氧化(*p < 0.05 vs. SITxair,每组N = 7)。(E)再灌注后3小时,空气处理的肠移植物中的还原能力显著恶化。氢气处理的移植物保持了还原能力,显示氧化损伤较少(*p < 0.05 vs.假手术组和δp < 0.05 vs. SITxair,每组N = 7)。
氢气减少了移植物氧化损伤
通过测量组织MDA水平和肠粘膜及肌层的还原能力,确定了氢气吸入的潜在抗氧化特性。MDA水平,即脂质过氧化的标记,在SITxair动物的组织中移植后3小时增加(图4D)(p < 0.05 vs. Shamair)。围手术期氢气吸入抑制了脂质过氧化,使得MDA水平不再比Shamair和ShamH2动物显著升高。同样,每个样本的还原水平通过评估由于样本中所有抗氧化剂的共同作用而从Cu2+还原得到的Cu+来确定。氢气处理并没有增强假手术处理动物肠道的总还原能力。然而,SITxair动物的移植损伤导致肠移植物的还原能力下降,这表明肠道抗氧化剂的消耗。氢气处理显著延缓了移植后移植物组织的还原能力(图4E)(*p < 0.05 vs. Shamair和δp < 0.05 vs. SITxair)。这些结果表明,氢气处理显著减轻了由于移植物低温保存和再灌注引起的肠道氧化损伤。
氢气防止了受体肺部的系统性炎症反应
严重移植损伤的肠移植物可能是促进局部肠道炎症反应的多种介质的主要来源。此外,肠移植可能对包括肺在内的非缺血器官产生有害的全身效应。在SITxair动物的肺部明显出现了系统性细胞炎症反应,与Shamair和ShamH2动物相比,移植宿主动物手术后3小时浸润的中性粒细胞数量分别显著增加了14倍和8倍。有趣的是,与SITxair动物的肺中性粒细胞积聚相关,宿主肺也明显出现了系统性分子炎症反应,表现为再灌注后3小时肺源性促炎细胞因子IL-6和TNF-α mRNA的显著诱导。除了对肠道的影响外,氢气吸入显著减少了中性粒细胞进入受体肺的招募30%(图5A),并限制了肺源性IL-6和TNF-α mRNAs的上调(图5B)。
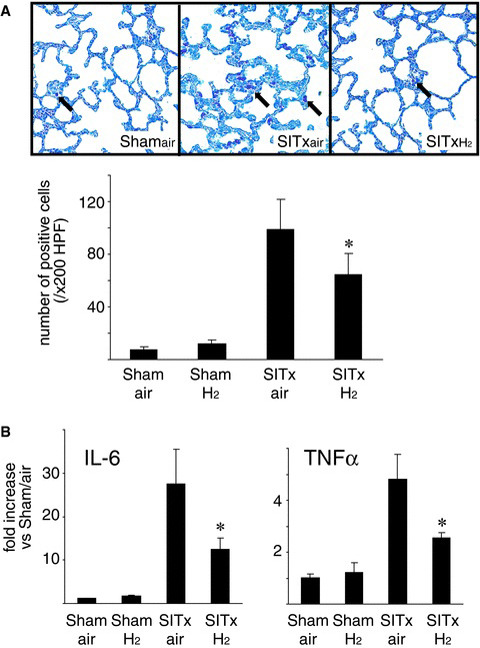
图5展示了受体肺中的炎症反应。代表性的受体肺染色图片显示了中性粒细胞,以及定量分析受体肺中浸润中性粒细胞的直方图。氢气减少了再灌注后3小时受体肺中增加的浸润中性粒细胞数量。MPO阳性细胞被计数,并以每×200高倍视场(HPF)的阳性细胞数呈现(*p < 0.05 vs. SITxair,每组N = 5)(A)。受体肺炎症与促炎细胞因子mRNA的上调有关,如IL-6和TNFα。氢气处理显著抑制了再灌注后3小时这些细胞因子的变化(*p<0.05 vs. SITxair,每组N = 5)(B)。
讨论
本研究证明,围手术期吸入2%氢气可使动脉氢气水平提高3.5倍,这种提升显著改善了移植诱导的肠道供体移植物损伤和受体中的系统性炎症反应。氢气疗法减轻了移植诱导的肠动力抑制,抑制了肌层外部促炎细胞因子的诱导,并保护了粘膜屏障,这与组织MDA水平的降低和抗氧化状态的改善有关。此外,氢气显著减弱了宿主肺部的系统性炎症反应。
小肠移植(SITx)被认为是治疗因全胃肠外营养(TPN)而产生危及生命并发症的肠衰竭患者的一种治疗选择(参考文献39,40)。尽管由于新的强效免疫抑制方案,肠移植物存活率已显著提高,但要接近肺同种异体移植物的70%存活率,预防和缺血/再灌注(I/R)损伤在SITx中是强制性的主要导致受体发病率和死亡率的原因。在冷藏过程中,缺氧导致三磷酸腺苷(ATP)的产生减少,导致细胞内离子浓度的改变和细胞毒性酶的激活。此外,低温本身也会因抑制Na+/K+泵活性而导致细胞损伤(参考文献41)。在血管再灌注时,会产生大量的超氧阴离子(·O2-)和过氧化氢(H2O2),导致移植物损伤(参考文献42)。在低浓度下,这些活性氧(ROS)作为必需的信号分子发挥作用,并关键地调节免疫系统的激活,从而参与抗菌防御(参考文献43)。然而,当它们超过宿主细胞的抗氧化能力时,它们变得极为有害。在高浓度下,它们与催化铁反应生成高度活性的羟基自由基(OH·),通过哈伯-魏斯反应或芬顿反应(参考文献20,21)。羟基自由基激烈且不加选择地破坏细胞大分子,包括DNA、蛋白质和脂质,导致与移植相关的移植物功能和形态变化。超氧阴离子和H2O2被内源性细胞抗氧化剂解毒,如超氧化物歧化酶、过氧化氢酶、过氧化物酶或谷胱甘肽过氧化物酶。然而,目前还没有已知的内源性酶途径可以中和OH·自由基。
因此,针对羟基自由基的治疗可能是改善移植诱导的移植物损伤的关键。许多试剂已在实验中用于清除移植环境中的自由基,包括超氧化物歧化酶、α-生育酚、谷胱甘肽、别嘌呤醇、氧嘌呤醇、去铁胺、二甲基硫脲和二甲基亚砜(参考文献44,45)。从概念上讲,氢气的选择性OH·清除活性应该提供类似于铁螯合剂去铁胺、二甲基硫脲和二甲基亚砜的保护效果,避免OH·自由基的损害作用(参考文献46,47)。事实上,氢气吸入可能比当前的药物治疗有多个潜在优势,因为它具有高度的扩散性,并且可能到达线粒体和细胞核等亚细胞部分,这些部分是ROS生成和DNA损伤的主要部位,但也是药物难以达到的部位。氢气清除OH·将保持线粒体膜电位,维持ATP合成,防止DNA损伤并减少脂质过氧化(参考文献14)。其次,氢气对人类吸入是生理安全的,氢气由结肠细菌在体内不断产生,并正常循环于血液中(参考文献43)。有趣的是,与小肠相比,结肠在热缺血和冷缺血/再灌注损伤的犬模型中对缺血损伤更具抵抗力,这可能部分是由于局部氢气消除羟基自由基的作用(参考文献44)。
2001年,Gharib等研究人员使用慢性感染性肝病模型报告称,在富氢高压舱环境中的动物显著地受到了保护,免于肝脏损伤,这一结论是通过较少的纤维化、改善的血液动力学、增加的一氧化氮合酶II活性、增强的抗氧化酶活性、降低的脂质过氧化物水平以及降低的循环肿瘤坏死因子-α(TNF-α)水平来评估的(参考文献48)。最近,Ohsawa等人证明,氢气在体外选择性地降低了羟基自由基的水平,并且在大鼠脑缺血模型中也能发挥强大的体内抗氧化活性(参考文献14)。此外,同一研究小组还表明,吸入氢气减少了肝脏温缺血/再灌注(I/R)损伤,这与氧化应激减少有关(参考文献13)。我们的结果显示,氢气显著地防止了移植诱导的胃肠动力抑制和空肠肌肉收缩力。从机制上讲,改善的肌肉功能与促炎细胞因子IL-1β和IL-6的mRNA诱导减少有关。研究表明,羟基自由基是IL-1β和IL-6的强诱导剂(参考文献49, 50, 51)。此外,通过氢气吸入,移植诱导的趋化因子CCL2 mRNA的表达也显著减少。与白细胞介素一样,CCL2容易被OH·自由基诱导,而通过二甲基硫脲和二甲基亚砜(即OH·清除剂)的铁螯合作用已被证明可以通过NF-κB依赖的途径抑制TNF-α和黄嘌呤氧化酶诱导的CCL2基因在内皮细胞和单核细胞中的表达(参考文献47)。与促炎介质相反,本研究中移植诱导的抗炎介质IL-10和HO-1的mRNAs(数据未显示)并未因氢气吸入而改变。实际上,我们确实在文献中找到了一个引用,其中一个羟基自由基清除剂导致了IL-10诱导的增加(参考文献52)。因此,羟基清除似乎保留了有益的抗炎介质IL-10和HO-1。
已知肠道粘膜对I/R产生的ROS损伤特别敏感。因此,我们假设氢气OH·清除也可能防止移植引起的粘膜损伤。对再灌注移植物的组织学检查表明,氢气吸入显著地防止了粘膜结构损伤并改善了肠屏障功能。氢气吸入带来的这些改善与肠MDA产生的减少和肠移植后组织氧化潜力的改善有关。通过4-羟基-反式-2-壬烯醛免疫组织化学观察,氢气吸入也显著减少了脑缺血后的神经脂质过氧化(参考文献14)。
氢气维持粘膜通透性和改善植入移植物的屏障功能可能具有重要的全身益处,因为已经证明肠道来源的内毒素血症在肝脏和肠道移植后会发生(参考文献18, 53)。因此,除了来自移植物的促炎介质释放减少外,还可以预测远处器官中的系统性炎症反应也将减少。在我们最后一系列的实验中,我们确实测量到了宿主肺部内促炎分子反应的减少,这伴随着术后中性粒细胞招募到肺泡中的显著减少。由于氢气是系统性吸入的,对这些参数的有益影响可能是由于对宿主肺部的间接和直接抗氧化作用。
医用气体疗法是一个新颖且相对未被探索的科学领域,据我们所知,氢气吸入疗法从未在任何移植模型中进行过测试。临床上,氢气气体疗法可以通过多种系统交付,包括使用呼吸机回路、面罩或鼻导管进行简单吸入。此外,氢气气体疗法也可以通过亲本氢气释放剂和/或富含氢气的流体进行给药。当前研究的结果继续验证了医用气体疗法的治疗潜力,证明了围手术期氢气吸入显著地保护了移植物结构和功能,并减弱了移植物和系统性分子炎症反应。
致谢
本研究得到了国家卫生研究院(NIH grants R01-GM58241, R01-DK068610和P50-GM53789)的资金支持。我们感谢日本大阪Mitleben研究所的Hideo Ueda博士进行氢气含量的测量。
https://blog.sciencenet.cn/blog-41174-1428766.html
上一篇:微压氧到底有没有作用?
下一篇:我们是否误解了进化?