博文
同一伦理委员会的批准号能否用于近250篇不同临床研究论文?
|
众所周知,临床研究受到伦理制度和法律规章的严格规定。在提交和审查过程中,这些研究是否符合所在国的法律规定,并不总是由作者或编辑决定的。最近,有一项研究回顾了法国某研究所发表的456项研究,发现了一系列与所声明的研究授权有关的问题,包括伦理上和潜在法律上的问题。在这些研究中,其中248项的研究对象、样本和不同地区的研究居然都是在同一个伦理委员会审批下进行。更有甚者,39项涉及人的研究甚至都没有伦理委员会声明(图1)。
图1. 一项研究调查了(位于法国马赛的)地中海感染研究所发表的456份研究论文,发现了一系列与声明的研究授权有关在伦理和法律上的不当问题(图片来自https://osf.io/rymtz/)。
这项调查报告提供了详细的结果,主要针对该研究所既往发表的研究论文,并与《赫尔辛基人类实验宣言》准则有关已发表的道德声明进行核对和审查。调查发现其中一个机构审查委员会(IRB)的批准号(09-022)出现在好几篇已发表论文中,而这些论文的研究主题和涉及的研究对象(临床患者)却明显不同。调查人员使用 "谷歌学者 "来确定这个批准号的所有出现情况。经过统计,IRB批准号在12年内(2009年至2021年之间)被使用了248次。如果这些论文来自伦理委员会最初批准的研究项目,并且符合当地与临床研究相关的法律,那么重复使用该批准号是允许的。然而,这248篇论文涵盖了大量的不同样本(粪便、分泌物、尿液、手术过程中采集的组织标本),以及大量的不同人群(成人、儿童、健康志愿者、肥胖患者......)和不同国家(法国、塞内加尔、尼日尔、加蓬、沙特阿拉伯......),如图2所示。
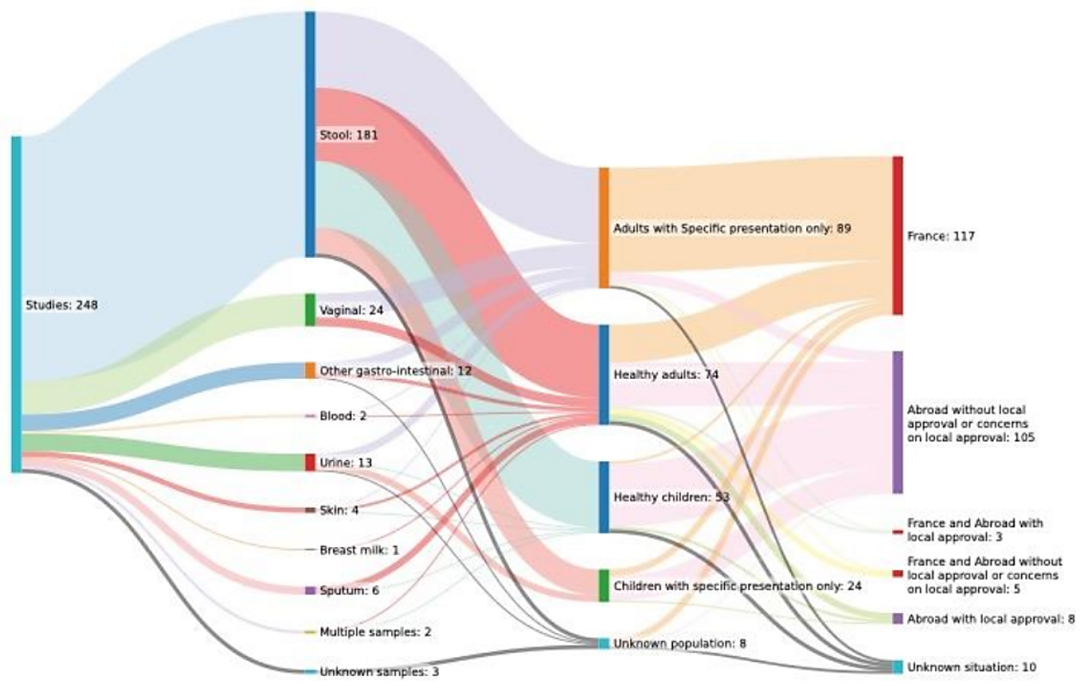
图2. 编号为09-022IRB的审查批件出现在248份研究论文中,这些论文涉及的研究横跨12年,涵盖不同领域、研究样本、研究人群和国家(图片来自OSF Preprints | Issues with Ethics in Research – A Case Study of the IHU Mediterranee Infection)。
针对上述问题,法国立法在2016年完善了关于临床研究的Jardé法。任何关于人类的实验都必须得到独立的伦理委员会的批准,根据方案的复杂性,还需要获得额外的授权,特别是关于体液的收集,如粪便、阴道分泌物或尿液)。在上述确定的248项研究中,调查人员发现至少有一项是在Jardé法实施后进行的,还有许多不能确定的病人入组日期的研究论文是在2016年后发表的。作者:美捷登Daniel,转载请联系美捷登授权并注明来源美捷登。
对该研究所的进一步调查显示,有456项研究可能存在相同类型的伦理和法律问题,即在同一个IRB进行多项不同的研究,没有法律授权,或在授权之前开始招募受试者等。生物医学研究的道德规范通常受《赫尔辛基宣言》(图3)的约束,该宣言由世界医学协会于1964年通过,以确保尊重那些将自己的时间和安全委托给科研人员的人。它强调了 "研究人员、作者、赞助商、编辑和出版商在发表和传播研究成果方面都有道德义务"。大多数出版公司都签署了这一宣言,这也是COPE的建议。
图3. 世界医学协会《赫尔辛基宣言》官方网页截图(图片来自https://www.wma.net/policies-post/wma-declaration-of-helsinki-ethical-principles-for-medical-research-involving-human-subjects/)
这篇文章及其报告的研究强调了研究机构、出版商和资助机构的重要性,确保研究人员在另一个国家进行研究时获得当地伦理批准并遵守司法管辖区的标准。如果研究计划和研究成果没有提到当地的伦理审查或伦理标准,这是一个很大的危险信号。
尽管多数出版商都签署了《赫尔辛基宣言》,但编辑部在核实临床研究的伦理和合法性方面的做法非常不一致。因此,笔者认为编辑部同行之间应统一思想,达成共识:每个临床研究都需要经过伦理委员会的审查和批准,以确保研究符合伦理原则和法律法规的要求,保护研究对象的权益和安全。每个研究都有其独特的研究目的、方法、人群样本和风险评估,因此需要进行独立的伦理审查、多方面进行评估,并根据具体情况决定是否批准研究进行。
科研诚信是科技创新的基石,遵守科研道德是科技工作者的基本行为准则,恪守科研伦理是科学家的重要社会责任。科技期刊作为科研成果展示的重要载体,在维护和促进科研诚信的过程中发挥着关键的作用。科技期刊的编辑人员作为期刊工作的具体执行者,将肩负起捍卫科研诚信、抵制学术不端的神圣使命。
附1
2023年2月18日,我国国家卫生健康委、教育部、科技部、国家中医药局四部委联合制定发布《涉及人的生命科学和医学研究伦理审查办法》,自发布之日生效。新《办法》在2016年《涉及人的生物医学研究伦理审查办法》(卫生计生委令11号)的基础上,对涉及生命科学和医学伦理审查进行了全新的调整和规范。
哪些研究,需要伦理审查
涉及人的生命科学和医学研究活动需要伦理审查。即以人为受试者或者使用人(研究参与者)的生物样本、信息数据的研究活动。具体包括以下四类
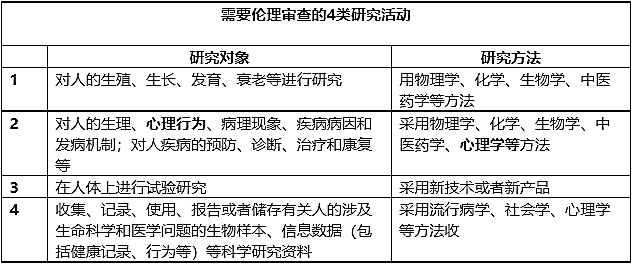
特别保护和特别关注的情形:新《办法》在伦理审查的基本要求中明确提出了“特殊保护”的要求,规定对涉及儿童、孕产妇、老年人、智力障碍者、精神障碍者等特定群体的研究参与者,应当予以特殊保护,对涉及受精卵、胚胎、胎儿或者可能受辅助生殖技术影响的,应当予以特别关注。
哪些单位,需要设立伦理审查委员会
涉及生命科学和医学研究的以下四类单位是伦理审查的主体,需要成立伦理审查委员会:
(1)二级以上医疗卫生机构;(2)设区的市级以上卫生机构(包括疾病预防控制、妇幼保健、采供血机构等);(3)高等学校;(4)科研院所。
伦理审查委员会合规要求

伦理审查内容及标准
伦理审查委员会重点审查内容及参考标准如下:

知情同意的要求
(1)同意方式
同意方式有两种:一是口头同意+录音录像;二是书面同意
(2)无民事、限制行为能力人
做到两个层次:监护人同意+争取本人同意。
(3)告知内容
共计12项,此处不赘述。
(4)事后告知
1)适用情形:在心理学研究中,因知情同意可能影响研究参与者对问题的回答,而影响研究结果准确性的,确保研究参与者不受伤害
2)适用程序:经伦理审查委员会审查批准
3)事后告知:研究者可以在研究完成后充分告知研究参与者并征得其同意。
(5)再次告知
三种情况需要再次告知并取得同意:
1)研究内容发生实质变化的;
2)风险实质性提高的;
3)研究参与人行为能力等级提高的。
医疗机构伦理审查违规行为和处罚
(1)伦理审查委员会9种违规处罚情形
有下列情形之一,由县级以上地方卫生健康主管部门对有关机构和人员依法给予行政处罚和处分:

(2)研究者6种违规情形
有下列情形之一,由县级以上地方卫生健康主管部门对有关机构和人员依法给予行政处罚和处分:

新办法下,备案时限特别说明
《涉及人的生命科学和医学研究伦理审查办法》2023年2月18日 发布,自发布之日起施行。
本办法施行前,从事涉及人的生命科学和医学研究的机构已设立伦理审查委员会的,应当自本办法施行之日起6个月内按规定备案,并在国家医学研究登记备案信息系统上传信息。已经伦理审查批准开展的涉及人的生命科学和医学研究,应当自本办法实施之日起9个月内、在国家医学研究登记备案信息系统完成上传信息。逾期不再受理。
附2
国际医学期刊编辑委员会(ICMJE)要求作者投稿的每篇文章都应该严格遵守人类和实验动物在医学研究过程中应该遵守的所有伦理原则。
1. 对临床试验研究的文章中涉及伦理学内容的要求:
(1) 伦理审查:以科学研究为目的涉及人体受试者的研究均需要经过伦理审查。文章中需提供批准此次临床研究的伦理委员会名称及其批准号。如果文章未体现出伦理审查,本刊将不予接受。如研究涉及多中心临床试验,先由组长单位获得伦理审批号,然后各个分中心需重新经过伦理审查。如涉及我国人类遗传资源开展的国际合作科学研究,应由合作双方共同提出申请,并经过国务院科学技术行政部门的批准,才能开展国际合作。
(2) 免知情同意:文章中应交代研究过程中是否签署患者知情同意书。若提出研究不需要/未获得知情同意,则需要合理的理由进行解释:①因研究目的而采集的样本,签署的知情同意书上已明确写明可以用于后续的临床研究;②已经留存的剩余样本;③在伦理批件之前的日期留取的标本;④上述样本充分做到对受试者信息及隐私的保护;经过伦理委员会充分讨论,权衡风险收益比后可免知情同意。
(3) 签署知情同意:在通过伦理审查之后留存的剩余标本,在伦理批件之后的日期留取的标本,在留取标本前必须获得受试者的知情同意;如果需要进行基因检测等方面的研究,即使对于既往留存的样本,也需要重新取得捐赠者的知情同意。
(4) 研究注册:本刊要求所有在人体中进行或涉及人体标本试验的前瞻性研究,均需在招募受试者前,在国际认可的临床试验注册平台,如北美临床试验注册中心(http://www.clinicaltrials.gov)、国际临床试验注册中心(ISRCTN)、中国临床试验注册中心(ChiCTR)进行注册。文章投稿时需提供国际认可(WHO Registry Network)的临床试验注册平台的名称、注册号及注册时间,并标记于文章摘要中。
(5) 研究注册时间要求:前瞻性、干预性临床试验研究,以评估该干预(例如药物、外科手术、器械、行为治疗)对健康结局的影响,需要提供临床试验注册平台进行的前瞻性注册号;回顾性的干预性临床研究建议补注册;纯粹的观察性研究可不注册。
(6) 无论是前瞻性研究还是回顾性研究,临床研究一律应该有机构伦理审批:回顾性研究的伦理审批内容可以是“本项临床研究为回顾性研究,仅采集患者临床资料,不干预患者治疗方案,不会对患者生理带来风险,研究者会尽全力保护患者提供的信息不泄露个人隐私,特申请免除知情同意。”
(7) 应用患者在临床诊断治疗过程中弃用的血样、影像学资料:也同样需要经过机构伦理委员会审查,并由伦理委员会决定是否需要签署知情同意书。
2. 对动物实验研究文章中涉及伦理学内容的要求:
(1) 伦理要求:文章中需提供批准动物实验的动物伦理委员会机构名称和其批准号,即对动物研究报告结果“方法”部分内容均应描述有这样的“该方案经XXX大学动物实验伦理委员会批准(批准号:xxx,批准时间:xxx),实验动物在麻醉下进行所有手术(如有必要应提供安乐死方法),并尽一切努力最大限度减少其疼痛、痛苦和死亡。”
(2) 写作要求:医学科研人员在动物实验中需遵循国际实验动物护理和使用指南的建议,即Weatherall(2006)报告和NC3Rs指南。涉及动物实验研究的文章应遵循ARRIVE写作指南(http://www.nc3rs.org.uk/arrive-guidelines),并建议在投稿时提交文章自查清单。
(3) 数据共享要求:本刊对动物实验研究文章中数据表述的要求是,文章中用以得到论文结论的数据及方法需要实行数据共享原则,以便他人重复验证研究结果。① 在投稿时建议提供原始实验数据或将数据在国际数据库注册获DOI标识码,以便为审稿人审稿和其他读者阅读时提供参考;② 原始数据中如涉及基因、蛋白质、突变体和疾病内容,需在建议的国际公共数据库注册,并在投稿时提供注册号,本刊建议的国际公共数据库有Figshare或re3data;③ 原始数据中如有少量的或特殊的数据,可以作为论文附件在投稿时和论文一起上传,论文发表时将以辅文形式在线出版;④ 如果是从其他渠道获取的开放获取的数据,作者必须明确说明数据来源。作者:美捷登Daniel,转载请联系美捷登授权并注明来源美捷登。
参考资料
1.OSF Preprints | Issues with Ethics in Research – A Case Study of the IHU Mediterranee Infection
2.https://www.wma.net/policies-post/wma-declaration-of-helsinki-ethical-principles-for-medical-research-involving-human-subjects/
3. 《涉及人的生命科学和医学研究伦理审查办法》文件解读_政策解读_中国政府网 (www.gov.cn)
4. 你必须知道医学科研中的伦理问题 - 知乎 (zhihu.com)
https://blog.sciencenet.cn/blog-475824-1393275.html
上一篇:谈谈我作英文编辑时发现的常见问题及其改进的方法
下一篇:美捷登精彩点评2023JCR受关注的SCI期刊影响因子
