博文
番茄侧根形成需氢气参与的生长素信号通路调控
||
番茄侧根形成需氢气参与的生长素信号通路调控
本研究对于提升氢气的生物学地位具有重要价值。氢气既往主要是药物作用,但生理作用的研究非常少见。显然,生理作用地位远远高于药理地位。因为生理作用意味着离不开,药理作用只能对于非生理病理状态的意义。研究中没有对动物相关基因进行分析,逻辑上,植物和动物同属于一域,相关性远远超过真菌和细菌的关系。个人感觉,这一研究和多年轻北京工业大学关于植物线粒体产氢气的研究也有一定关联性。本研究是针对侧根研究,也可拓展到叶子花果等地上部分的效应研究。另外可进行不同发育阶段的基因表达控制,以确定其作用细节。关于光照和节律的研究,本研究从氧气和缺氧效应进行分析,或许需要进行具体的氧气浓度作用的研究。例如在暗处理增加氧气的供应,在关照阶段阻断氧气作用等。
高等植物中的内源性氢(H₂)合成途径近百年来一直是个谜。在此,我们报道番茄 Nuclear Architecture Related 1(NAR1)蛋白是植物来源 H₂ 的酶促来源。突变实验发现,其产氢氢化酶活性与四个 H-簇配位半胱氨酸残基密切相关,并在黑暗中受到正向调控。在 SlNAR1 过表达和突变体中分别观察到 H₂ 产生和侧根(LR)形成的相反变化。敲除番茄 NAR1 也表现出纯合致死效应。遗传学和解剖学证据证实,NAR1 对内源 H₂ 的调控是一种信号机制,可通过调节极性生长素转运蛋白的表达来影响生长素在侧根原基和振荡区的积累,从而促进侧根形成。盆栽实验显示,过表达 SlNAR1 的转基因番茄植株具有更加发达的根系。这些发现为通过改变 NAR1 依赖的 H₂ 来调控根器官发生提供了遗传工程的新机制。
Wang Y, Cheng P, Jiang K, Gong J, Liu Z, Shen W. Tomato lateral root branching requires Nuclear Architecture Related 1 via auxin signaling, a process involving hydrogen gas. Plant J. 2026 Jan;125(1):e70678.
引言
根系结构对植物感知和吸收矿物质及水分的能力具有重要影响(Banda et al., 2019)。因此,优化根系结构是提高作物产量的重要途径,尤其是在全球人口增长和气候变化带来的挑战下(Dorlodot et al., 2007)。根系的有益作用部分取决于侧根(LR)形成所增加的表面积(Banda et al., 2019)。LR 形成主要由侧根原基(LRP)的形成决定,而 LRP 起源于侧根创始细胞(Vilches-Barro & Maizel, 2015)。LR 的生长受多种因素调控,并在响应环境变化、激素信号和多种气体信号分子时表现出高度可塑性(Luschnig & Friml, 2024;Wang et al., 2022)。然而,阐明与 LR 形成相关的整个复杂信号网络,尤其是内源性促进因子,仍然是科学界的一大挑战。
氢是地球大气中最丰富的元素,对流层中约 80% 的氢气(H₂)损失归因于土壤吸收(Constant et al., 2009)。在各种地质环境中,H₂ 普遍存在于地球内部,在某些情况下会泄漏到地表(Zgonnik, 2020)。这种 H₂ 可能有利于土壤微生物以及植物根系的生长发育。与此一致,在温室或更大规模的田间试验中,外源 H₂ 供应可提高水稻(Cheng et al., 2021)、番茄(Li et al., 2024)、草莓(Li et al., 2022)和蓝莓(Jin et al., 2024)的品质或产量。因此,氢气的应用被认为是解决农业和粮食生产挑战的可持续策略(Alwazeer et al., 2024)。尽管在正常和胁迫环境下,高等植物的叶绿体和组织中早已观察到生物产氢现象(Maione & Gibbs, 1986;Renwick et al., 1964),但对其详细合成途径的了解仍然有限。
与高等植物不同,藻类中的产氢机制已开始被阐明。莱茵衣藻(Chlamydomonas reinhardtii)是研究产氢的藻类模型,其中 [Fe-Fe] 氢化酶(CrHYD1)是主要的酶促来源(Yacoby et al., 2011)。此前,我们发现在拟南芥(Su et al., 2021;Zhang et al., 2020)和番茄(Wang et al., 2024)中异源表达藻类氢化酶基因(HYDA1)后,内源 H₂ 产量显著提高,并观察到根系结构的促进作用。这些结果表明高等植物中存在具有氢化酶活性的蛋白。Nuclear Architecture Related 1(NAR1)是一种胞质 Fe-S 簇组装因子,在水稻中被注释为推定的氢化酶,与 CrHYD1 具有 28.31% 的序列同一性(Shao et al., 2023)。尽管这种蛋白已在拟南芥(Luo et al., 2012;Nakamura et al., 2013)、番茄和其他植物物种中被鉴定(图 S1 和 S2),但高等植物中 NAR1 同源物是否具有潜在的氢化酶活性及其可能的生理功能仍未完全证实。
在本研究中,我们发现内源 H₂ 稳态与 LR 形成之间存在可能的因果关系,并进一步揭示了番茄 NAR1 在体外和体内均具有催化产氢的氢化酶活性。突变实验证实,四个 H-簇配位半胱氨酸残基和可能的 Fe-S 簇对其氢化酶活性至关重要,这与藻类氢化酶部分相似。进一步的遗传和分子证据表明,NAR1 依赖的 H₂ 通过调控极性生长素运输驱动的局部生长素积累,在 LR 发育中发挥重要作用。
研究结果
内源 H₂ 稳态对侧根形成至关重要
本研究以番茄 LR 发育为易于量化的模型,研究 H₂ 稳态及其合成如何影响根器官发生。如图 1A、B 所示,番茄植株中的内源 H₂ 稳态呈现可能的昼夜节律,在黑暗期间 H₂ 水平相对较高,且根系中的变化大于地上部。为了评估植物来源 H₂ 的生物学功能,我们测试了多种实验光照条件,包括适度的短期意外黑暗(uD)和低光照(LL),以诱导内源 H₂ 稳态的适度但可控的扰动,从而模拟植物发育过程中自然发生的波动。如图 1C–H 所示,适度的短期 uD 和 LL 处理不仅促进了 H₂ 产生,还促进了 LR 发育。
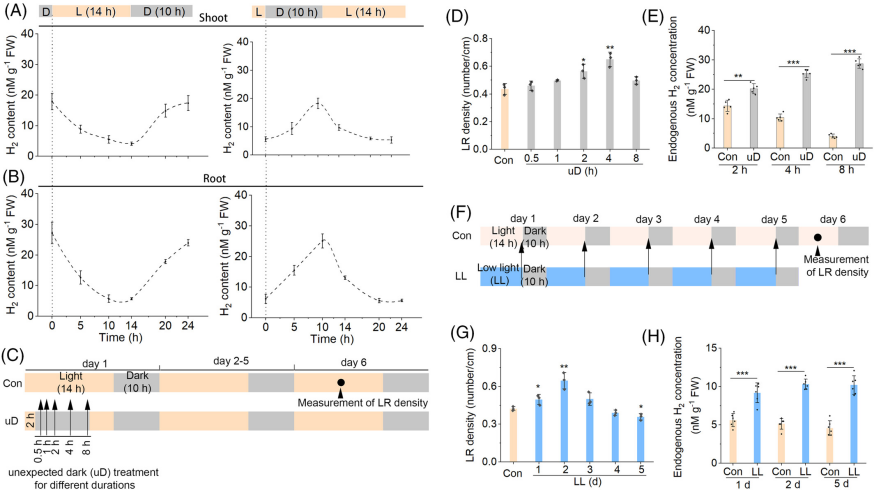
图 1
氢气稳态启动侧根(LR)形成。
在指定时间点,将在 1/2 MS 培养基中培养 5 天的番茄(Alisa Craig)幼苗切段,分为地上部(A)和根部(B),然后测量体内 H₂ 水平的动态变化(n = 3;每处理/重复约 0.5 g 样品)。意外黑暗处理的 LR 发育实验示意图(C)。番茄幼苗在正常光照下培养 2 小时,然后在光照期给予 0.5–8 小时的黑暗处理。5 天后测量 LR 密度(D;n = 3)。进一步测量番茄根组织中的内源 H₂ 浓度(E;n = 6;每处理/重复约 0.5 g 样品)。低光照(LL)条件下 LR 发育实验示意图(F)。番茄幼苗在正常光照下培养,部分幼苗转移至 LL 条件下 1–5 天。然后测量 LR 密度(G)。同时检测番茄根组织中的内源 H₂ 水平(H)。采用 Student’s t 检验,*P < 0.05,P < 0.01,*P < 0.001。
在 uD 条件下(2、4 和 8 小时),根组织中的内源 H₂ 水平逐渐增加,但与 4 小时 uD 相比,更长时间的 uD(8 小时)并未进一步增加 LR 密度(图 1C–E)。与过度 uD 处理类似,在 LL 处理时间较长(超过 2 天,尤其是 5 天)后,内源 H₂ 浓度和 LR 密度也观察到相反的变化(图 1F–H)。这些结果表明,内源 H₂ 稳态与 LR 形成之间存在因果关系,并响应光照条件的变化。
番茄 NAR1 蛋白在体外具有活性和功能的氢化酶活性
由于番茄或其他高等植物中的特异性氢化酶尚未被功能鉴定,而我们之前的研究表明,在拟南芥(Zhang et al., 2020)和番茄(Wang et al., 2024)中过表达藻类氢化酶基因(HYDA1)后内源 H₂ 水平增加,因此我们基于蛋白质 BLAST 进行了生物信息学分析。番茄 NAR1 蛋白(SlNAR1)与 HYDA1 的序列相似性最高(图 S1),并且与其他六种来自绿藻的已知氢化酶具有明显的序列同源性(图 S2)。
根据 NCBI 序列查看器,SlNAR1 包含两个具有重叠序列的不同转录本,全长 mRNA 的编码序列完全包含较短转录本的编码序列(图 2A)。为了研究 SlNAR1 的生化作用,我们将全长和截短的 SlNAR1 均克隆到原核表达载体中。尽管使用了多种载体和大肠杆菌菌株,但 IPTG 诱导后全长 SlNAR1 的表达仍未检测到。与截短 SlNAR1 相比,全长 SlNAR1 的编码序列额外包含 228 个核苷酸(红色框标注),其编码的肽段(76 个氨基酸)在空间结构中形成一条长链,远离蛋白质的疏水结构中心(图 S3)。然而,截短版本的 SlNAR1 表达量很高,在 SDS-PAGE 凝胶上约为 44 kD(图 2B),与根据其氨基酸序列计算的理论分子量相符。
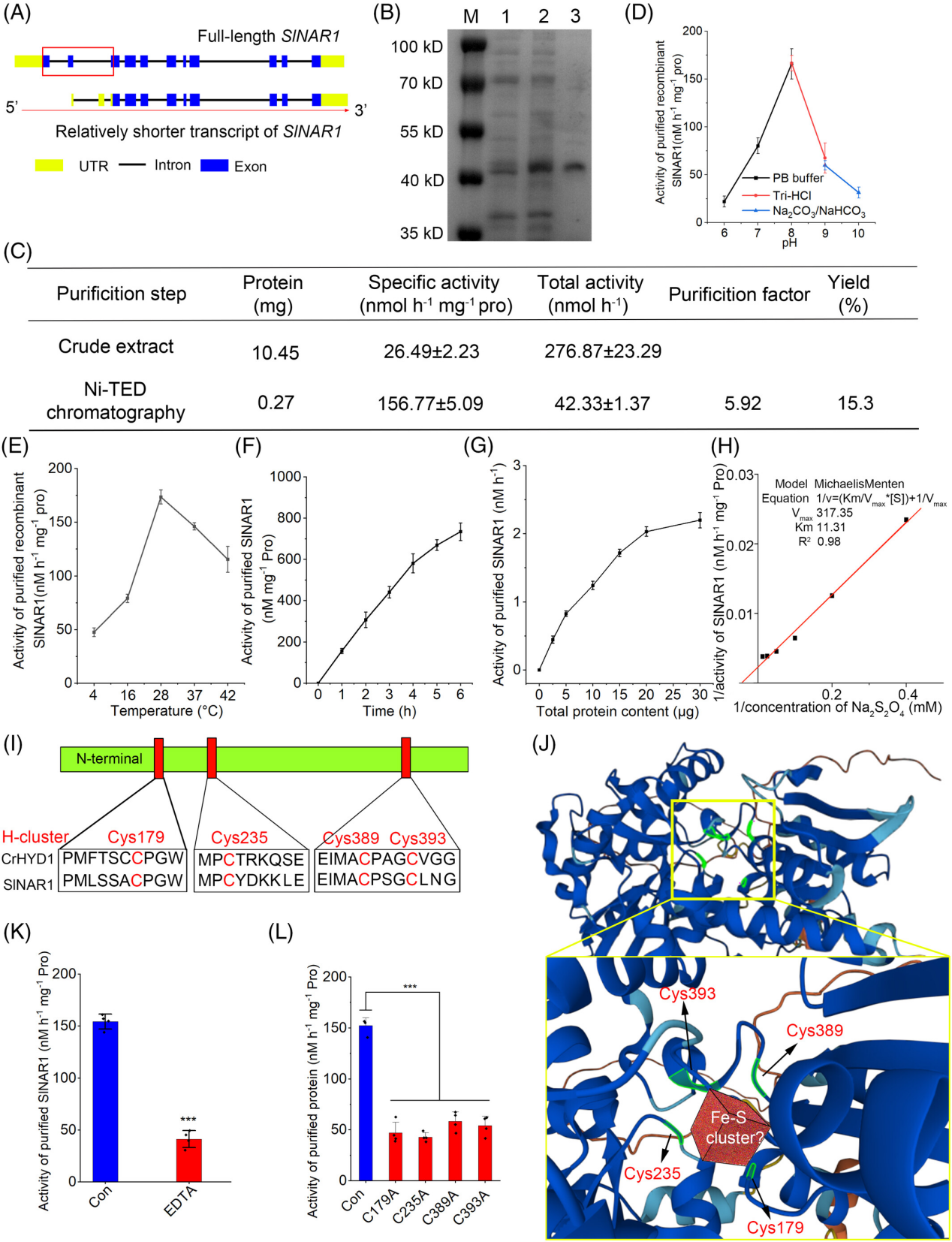
图 2
番茄 NAR1 蛋白是一种潜在的氢化酶。
SlNAR1 全长和较短转录本的示意图(A;数据来自 NCBI;红色框表示全长转录本中的额外序列)。未加 IPTG(第 1 行)和加 IPTG(第 2 行)的粗蛋白以及诱导后纯化的蛋白(第 3 行)的 SDS-PAGE 图(B;M 表示蛋白标志物)。重组 SlNAR1 的氢化酶活性(比活性和总活性)、纯化倍数和产率(C)。测量最适 pH(D)、最适温度(E)以及时间(F)和剂量(G)依赖曲线。通过米氏方程拟合酶动力学常数(H)。最终值需减去空白对照(加入等量煮沸蛋白溶液,其他条件不变)。莱茵衣藻氢化酶(CrHYD1)和 SlNAR1 中 H-簇配位的四个半胱氨酸残基(红色标记)的简要示意图(I)。SlNAR1 的空间结构,其中四个 H-簇配位半胱氨酸残基以绿色标记,Fe-S 簇的可能位置以红色立方体表示(J)。加入 100 mM EDTA 处理 1 小时以去除 SlNAR1 中的 Fe-S 簇后,测量其氢化酶活性(K)。将四个 H-簇配位半胱氨酸残基(Cys179、Cys235、Cys389 和 Cys393)分别突变为丙氨酸,并测量其氢化酶活性(L)。采用 Student’s t 检验,*P < 0.001。
与藻类中的氢化酶类似(Yacoby et al., 2011),SlNAR1 对氧气(O₂)敏感。当携带 NAR1 蛋白的大肠杆菌 BL21 置于空气中并暴露于 O₂ 时,其产氢能力迅速下降至原来的 1/180(图 S4)。由于厌氧手套箱空间有限,我们无法在完全厌氧环境中完成蛋白纯化过程。因此,纯化过程中可能会损失部分氢化酶活性,导致催化活性相对较低。通过 Ni-TED 柱纯化后(图 2B),重组 SlNAR1 的产氢活性从 10.45 mg 粗蛋白中纯化了 5.92 倍,比活性为 156.77 ± 5.09 nmol h⁻1 H₂ mg⁻1 蛋白(图 2C)。同时,SlNAR1 的最适 pH 和温度分别约为 8.0 和 28°C(图 2D、E)。进一步的动力学分析表明,当反应时间长达 4 小时且蛋白含量低于 20 μg 时,SlNAR1 的酶反应几乎呈线性(图 2F、G)。使用米氏方程计算得到 SlNAR1 对底物连二亚硫酸钠(Na₂S₂O₄)的 Km 值和 Vmax 分别为 11.31 μM 和 317.35 nmol h⁻1 mg⁻1 蛋白(图 2H)。
进一步的蛋白质 BLAST 分析显示,SlNAR1 与拟南芥、水稻和黄瓜等多种模式植物和园艺作物的推定 NAR1 蛋白具有高度同源性(表 S1)。这些结果表明,NAR1 依赖的产氢生化基础可能存在于所有高等植物中。
半胱氨酸残基是 SlNAR1 氢化酶活性所必需的
与莱茵衣藻的 HYD1 类似,SlNAR1 具有四个 H-簇配位半胱氨酸残基(图 2I)。结构分析发现,这四个半胱氨酸残基在空间上彼此接近(图 2J)。在绿藻中,氢在 H-簇中产生,该簇由常规 Fe-S 簇组成(Schilter et al., 2016)。然而,这四个 H-簇配位半胱氨酸残基和 Fe-S 簇对 SlNAR1 氢化酶活性的确切作用仍不清楚。
借鉴早期研究(Mulder et al., 2009),我们用 EDTA 处理纯化的 SlNAR1 以去除 Fe-S 簇。如图 2K 所示,EDTA 处理显著消除了 SlNAR1 的产氢活性,表明 Fe-S 簇对其比活性至关重要。有报道称,四个 H-簇配位半胱氨酸残基对氢化酶中的 Fe-S 簇至关重要(Peters, 1999)。因此,我们分别将负责配位 Fe-S 簇的半胱氨酸残基(Cys179、Cys235、Cys389 和 Cys393)突变为丙氨酸。如图 2L 所示,Cys(C)突变为 Ala(A)后,其氢化酶活性明显降低。我们的结果清楚地表明,高等植物中的潜在氢化酶 SlNAR1 的作用机制与藻类氢化酶部分相似。
NAR1 对植物发育至关重要
利用由其天然启动子驱动的 β-葡萄糖醛酸酶(GUS)报告基因,我们研究了 SlNAR1 在番茄中的表达模式(SlNAR1pro:GUS)。我们在所有器官中均观察到 GUS 染色(在光照下,尤其是在黑暗下;图 3A;图 S5),尤其是在叶和根组织中,包括 LR 形成位点和 LRP。不同器官中的 GUS 染色与 RT-qPCR 检测到的 SlNAR1 转录本丰度密切相关(图 3B),也与氢化酶活性(图 3C)和内源 H₂ 浓度(图 3D)一致。这些结果表明,SlNAR1 依赖的内源 H₂ 从种子萌发开始就在植物生长中发挥关键作用,尤其是在根发育过程中。我们还发现 SlNAR1 转录本随光照条件或黑暗而变化(图 3E),这与可能由 SlNAR1 催化的内源 H₂ 变化相符(图 1A、B 和 3E)。这些结果进一步表明,NAR1 依赖的内源 H₂ 与根发育之间存在潜在的因果关系。
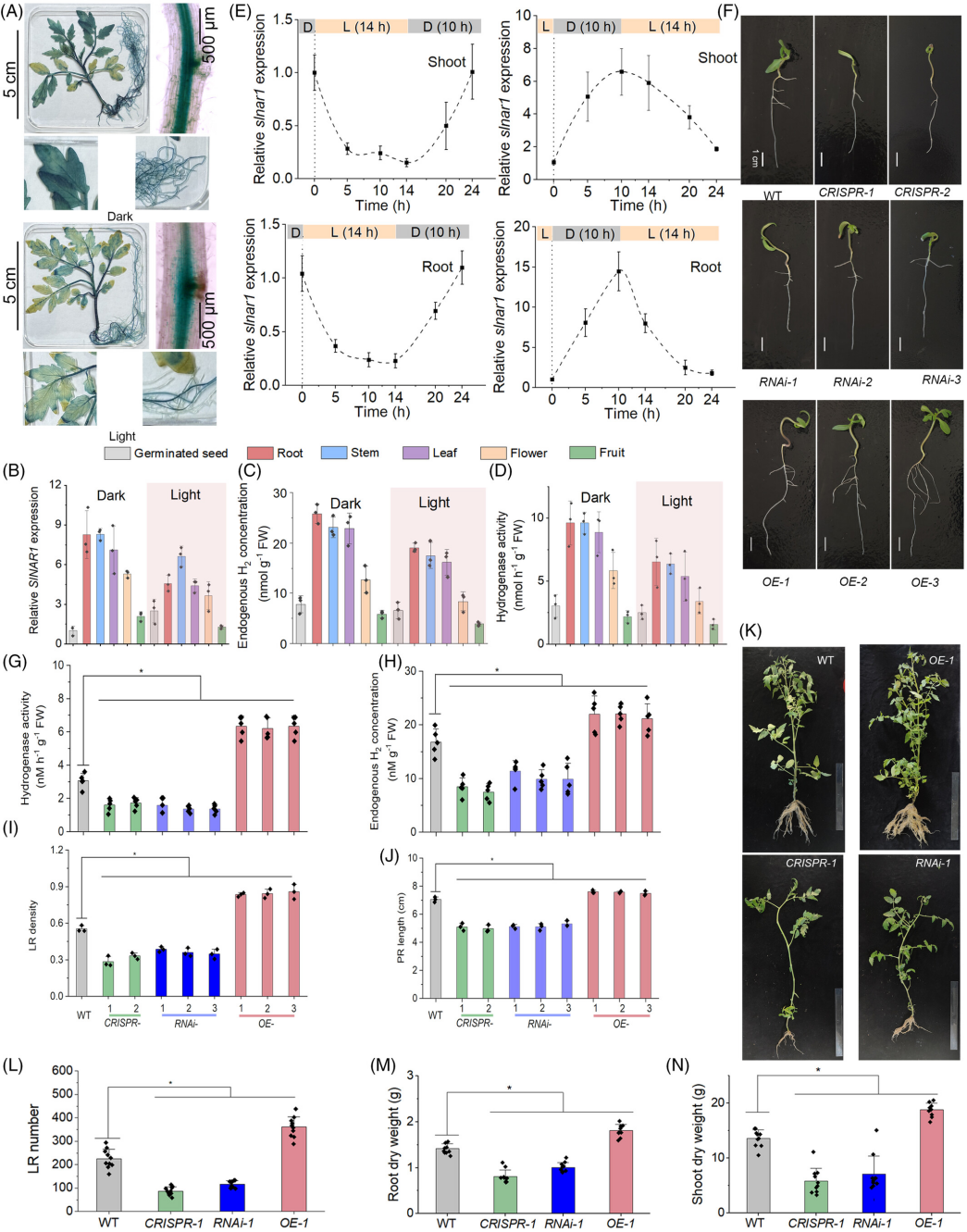
图 3
SlNAR1 依赖的内源 H₂ 调控侧根(LR)发育。
染色后,拍摄表达 SlNAR1pro:GUS 的转基因番茄在光/暗周期的黑暗或光照期的代表性图片(A)。同时测量不同组织在光/暗周期的黑暗或光照期的 SlNAR1 转录本(B)、氢化酶活性(C)和内源 H₂ 浓度(D)。检测两种光照条件下 SlNAR1 转录本的昼夜变化(第一种条件:第一个时间点为前一个黑暗期结束;第二种条件:第一个时间点为前一个光照期结束)(E)。拍摄 10 日龄野生型、slnar1(两个 CRISPR 突变体和三个 RNAi 系)和三个 SlNAR1 过表达植株(OE)的代表性照片(F)。然后测量氢化酶活性(G)、内源 H₂ 浓度(H)、LR 密度(I)和主根(PR)长度(J)。生长 2 个月后,拍摄盆栽番茄植株的代表性照片(K),并测量每株植物的 LR 数量(L)、根干重(M)和地上部干重(N)。标尺长度为 30 cm。采用 Student’s t 检验,*P < 0.05。
为了探索上述可能的因果关系,我们获得了三种 CRISPR nar1 突变体(一个纯合子和两个不同的杂合子),均表现出氢化酶活性和内源 H₂ 浓度降低(图 S6)。然而,纯合 T0 CRISPR nar1 番茄幼苗出现严重发育缺陷,导致致死,因此未产生种子。此外,来自两个杂合 T0 番茄植株的 T1 后代中,在基因组水平上均未发现纯合插入缺失突变。
与此一致(Nakamura et al., 2013),在拟南芥中敲低 NAR1 也观察到致死效应(图 S7)。具体而言,我们使用 CRISPR-Cas9 系统敲除了 SlNAR1 的同源基因 AtNAR1。与非纯合 T0 突变体类似,来自同一杂合植株的 T1 后代中未发现纯合子(检测了 60 株幼苗)。这些结果表明,敲除植物 NAR1 具有纯合致死效应。对来自同一杂合 T1 拟南芥突变体的 40 株 T2 植株进行测序分析,其中 25 株为杂合突变体(25/40,62.5%,接近预期的 2/3 比例)。这些发现表明,NAR1 对植物发育至关重要。
NAR1 依赖的内源 H₂ 调控侧根形成
尽管 CRISPR 突变体中纯合致死效应的复杂性限制了对内源 H₂ 在番茄发育中作用的深入研究,但我们在杂合 CRISPR nar1 番茄和拟南芥中均观察到侧根(LR)发育受损,且两者的 H₂ 产量均降低(图 3F–H;图 S8)。我们构建了三个 SlNAR1 表达降低的 SlNAR1-RNAi 突变体(图 S9)和三个 SlNAR1 表达升高的 SlNAR1 过表达番茄品系(35S::NAR1-GFP)(图 S10)。我们注意到,SlNAR1 的过表达或突变会分别促进或破坏 H₂ 产生的昼夜节律(图 S11)。与野生型(WT;图 1A)尤其是过表达品系不同,NAR1 突变明显扰乱了内源 H₂ 的稳态。与此一致,通过侧根密度测量发现,与野生型相比,SlNAR1 突变体(两个杂合 CRISPR 系和三个 RNAi 系)的 LR 发育诱导显著受损(图 3I)。相反,在所有三个 NAR1-OE 品系中均观察到 LR 发育显著增强。与 LR 发育的变化一致,在 SlNAR1 突变体和 NAR1-OE 品系中,内源 H₂ 水平、氢化酶活性(图 3G、H)以及主根(PR)长度(图 3J)均呈现相反的变化。SlNAR1 突变显著削弱了 4 小时 uD 处理对氢化酶活性、内源 H₂ 水平以及随后 LR 发育的促进作用(图 S12)。结合外源性 H₂(通过添加已知的释氢化合物 NH₃·BH₃)可部分挽救 nar1 突变体和 SlNAR1-RNAi 幼苗的 LR 缺陷(图 S13)(Wang et al., 2024),上述结果证实 NAR1 对 LR 发育的调控部分依赖于 H₂。在拟南芥中过表达 SlNAR1 进一步验证了 SlNAR1 在产氢及随后 LR 形成中的正向作用(图 S8)。
番茄是一种可食用果实,其根系发育与果实品质和产量呈正相关(Dezhabad & Haghighi, 2020;Nagel et al., 2009)。盆栽实验表明,与 nar1 突变体的表型相反,与野生型相比,SlNAR1 过表达植株表现出更显著的 LR 密度以及更高的根和地上部生物量(图 3K–N)。与植株发育的变化一致,光合参数(包括 PSII 最大光化学效率、PSII 光化学效率、光化学猝灭系数和净光合速率)也呈现相反的变化(图 S14)。因此,NAR1 对地上部和根系发育以及光合作用的协同调控作用仍需在未来进一步研究。
为了进一步探究 NAR1 依赖的 H₂ 在 LR 发育中的作用,我们进行了 LRP 分期分析。与 LR 形成的变化一致,在相同的遗传材料中观察到总 LRP 数量呈现类似的交替模式(图 S15)。具体而言,LRP 起始通常分为四个阶段(I–III 期、IV–V 期、VI–VII 期和 VIII 期)(Liu et al., 2022)。进一步的解剖学实验表明,两个杂合 CRISPR Slnar1 突变体和三个 SlNAR1-RNAi 系的 LRP 起始显著延迟,表现为四个阶段的 LRP 数量均减少,尤其是 VIII 期(也称为出露期;图 4A、B)。相反,在三个 SlNAR1 过表达番茄品系中,各阶段的 LRP 均丰富。与野生型相比,SlNAR1 过表达系中 I–III 期 LRP 的比例更高(图 S16)。这些结果进一步支持了 NAR1 依赖的内源 H₂ 在 LR 形成中起关键作用,且 LRP 起始可能是其主要作用靶点的假设。
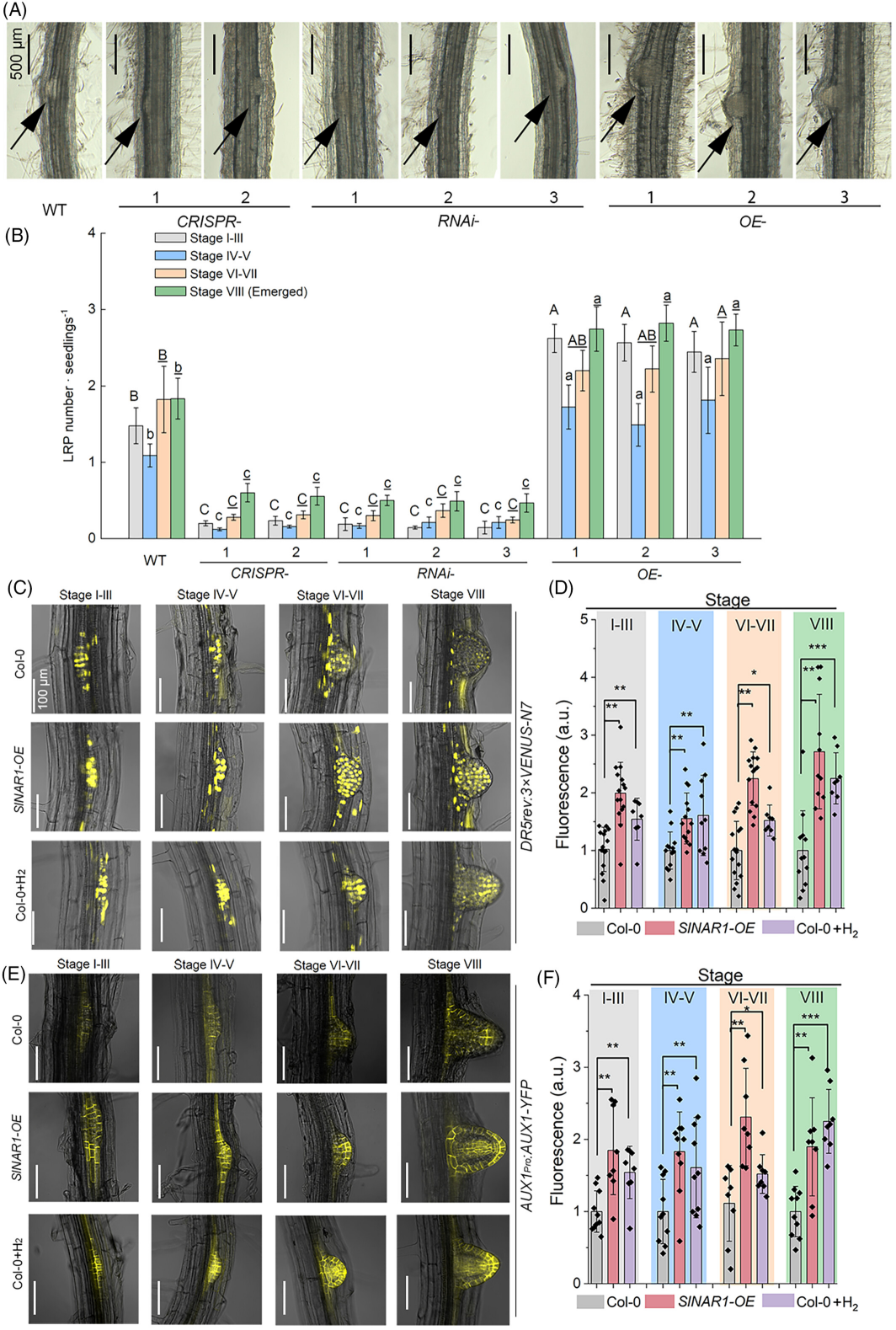
图 4
侧根(LR)分期的变化。
野生型、Slnar1 突变体和 SlNAR1 过表达番茄幼苗中侧根原基(LRP)的代表性图片(A)。不同阶段 LRP 的数量(B)。数据以平均值 ± SD 表示(n = 3;每处理/重复 30 株)。不同字母表示经 Duncan 多重范围检验存在显著差异(P < 0.05;大写字母,I–III 期;小写字母,IV–V 期;带下划线的大写字母,VI–VII 期;带下划线的小写字母,VIII 期)。Col-0、Col-0/SlNAR1-OE 以及经 H₂ 处理的 Col-0 幼苗(使用释氢化合物;含 1 mg L⁻1 NH₃·BH₃ 的 1/2 MS 固体培养基)在不同阶段拟南芥 LRP 中 DR5rev:VENUS-N7(C)和 AUX1Pro:AUX1-YFP(E)的表达及相应定量(D 和 F;n ≥ 8)。采用 Student’s t 检验,*P < 0.05,P < 0.01,*P < 0.001。
通过调控生长素极性运输促进局部生长素积累
由于生长素的积累和运输是 LRP 起始的关键早期事件(Xuan et al., 2016),我们检测了 LRP 中 DR5rev:VENUS 信号。与 Col-0 相比,SlNAR1 过表达幼苗在 LRP 起始的四个阶段均表现出显著增强的 DR5rev:VENUS 表达(图 4C、D)。LRP 处的局部生长素积累是 LR 形成所必需的,并由生长素流入或流出载体驱动的极性生长素运输机制调控(Du & Scheres, 2018)。与生长素积累一致,在 SlNAR1 过表达幼苗的 LRP 四个阶段均观察到更显著的 AUX1-YFP 信号(图 4E、F)。外源性 H₂ 处理也能模拟 SlNAR1 过表达所引起的上述变化。这些结果进一步表明,生长素信号在 NAR1 催化的 H₂ 调控 LR 形成中起关键作用。
为了验证这一假设,我们分别使用了两种生长素合成抑制剂 Yucasin(Yuc)(Nishimura et al., 2014)和 L-犬尿氨酸(Kyn)(He et al., 2011),以及两种生长素极性运输抑制剂萘基邻氨甲酰苯甲酸(NPA)(Samakovli et al., 2021)和 2,3,5-三碘苯甲酸(TIBA)(Singh et al., 2023)。正如预期的那样,添加生长素极性运输抑制剂(尤其是)或合成抑制剂后,uD 处理对 LR 形成的促进作用显著受损(图 S17)。遗传实验表明,与野生型相比,NPA 处理显著消除了 SlNAR1 过表达番茄(图 5A、B)和拟南芥(图 S18)中更高的 LR 密度。我们还注意到,NPA 显著抑制了 SlNAR1 过表达对 LRP 起始的促进作用(图 5C)。然而,NPA 存在时内源 H₂ 水平不受影响(图 S19)。

图 5
SlNAR1 通过维持生长素转运蛋白的表达驱动生长素积累。
10 日龄野生型和三个 SlNAR1 过表达番茄幼苗(OE)在有无萘基邻氨甲酰苯甲酸(NPA)存在下的代表性图片(A)。同时测量相关的侧根(LR)密度(B)和不同阶段的侧根原基数量(C)。不同字母表示经 Duncan 多重范围检验存在显著差异(P < 0.05;大写字母,I–III 期;小写字母,IV–V 期;带下划线的大写字母,VI–VII 期;带下划线的小写字母,VIII 期)。7 日龄 Col-0(有无 H₂ 处理)和 Col-0/SlNAR1-OE 幼苗根尖、分生区和振荡区 DR5rev:VENUS-N7 的表达(D)及相应定量(E)。Col-0 和 Col-0/SlNAR1-OE 幼苗根分生区中 PIN1-GFP(F 和 G)、PIN2-GFP(H)、PIN7-GFP(I 和 J)以及 AUX1-YFP(K 和 L)信号的定位和定量(n > 8)。采用 Student’s t 检验,*P < 0.05,P < 0.01,*P < 0.001。
根尖和振荡区的生长素积累是 LR 形成所必需的(Blilou et al., 2005),而这一早期事件主要由生长素流入和流出载体驱动的极性生长素运输机制调控(Grieneisen et al., 2007)。我们测量了根尖和振荡区生长素响应报告基因 DR5 的表达。与野生型相比,Col-0/SlNAR1-OE 幼苗在根尖和振荡区的 DR5rev:VENUS 表达显著增强(图 5D、E)。野生型幼苗经外源性 H₂ 处理后也出现相同变化。这些结果表明,SlNAR1 通过重编程生长素极性运输相关基因的表达来诱导生长素积累。为了验证这一假设,我们检测并比较了野生型和 Col-0/SlNAR1-OE 植株中生长素运输载体 PIN1pro:PIN1-GFP、PIN2pro:PIN2-GFP、PIN7pro:PIN7-GFP 和 AUX1pro:AUX1-YFP 的表达模式。PIN1 定位于中柱,介导生长素从地上部向根部的极性运输(Blilou et al., 2005)。如图 5F、G 所示,与野生型相比,SlNAR1 过表达的转基因拟南芥品系和经 H₂ 处理的野生型幼苗根中柱的 PIN1 丰度均显著增加。SlNAR1 过表达或外源性 H₂ 处理也促进了基部质膜处的 PIN2-GFP 信号(图 5H)以及根尖的 PIN7-GFP 信号(图 5I、J)。相比之下,中柱处的 PIN7-GFP 信号未观察到明显变化。与 LRP 处 AUX1-YFP 信号的积累一致(图 4E、F),在 Col-0/SlNAR1-OE 和 H₂ 处理的野生型幼苗根尖观察到更显著的 AUX1-YFP 信号(图 5K、L)。更重要的是,4 小时 uD 处理后也观察到类似的生长素运输载体表达模式变化(图 S20)。
SlPIN1、SlPIN2、SlPIN3/SlPIN4 和 SlLAX1/SlLAX4 的同源基因分别是 AtPIN1、AtPIN2、AtPIN7 和 AtAUX1(Pattison & Catalá, 2012)。进一步的 RT-qPCR 结果显示,SlPIN1、SlPIN2、SlPIN3/SlPIN4 和 SlLAX1/SlLAX4 的 mRNA 水平在 SlNAR1 过表达系和相关突变体(CRISPR 和 RNAi)中呈现相反的变化(图 S21)。这些结果进一步强调了 NAR1 依赖的 H₂ 介导的生长素信号在 LR 形成中的关键作用(图 6)。
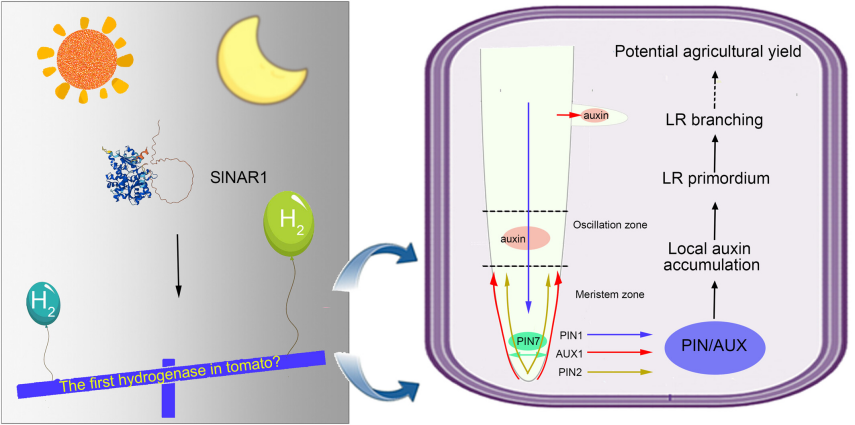
图 6
SlNAR1 依赖的 H₂ 调控侧根(LR)发育的工作模型。
SlNAR1 是番茄中一种具有活性和功能的氢化酶,对黑暗条件有响应。SlNAR1 依赖的内源 H₂ 通过整合 PIN 和 AUX 的表达,增强振荡区和侧根原基中的局部生长素积累,从而启动侧根形成。
讨论
产氢(H₂)现象广泛存在于几乎所有类型的原核生物、某些厌氧微生物真核生物、单细胞绿藻,甚至高等植物和动物中。氢生物学的最新进展提出了一个基本科学问题:高等植物甚至哺乳动物是否以及如何内源性产生 H₂(Ohsawa et al., 2007;Wang, 2014;Wang et al., 2022;Yacoby et al., 2011)?据我们所知,这是首次对园艺作物中的 NAR1 蛋白进行纯化和详细生化表征的报道。我们发现,这种番茄蛋白具有功能性氢化酶活性,可作为植物来源 H₂ 的酶促来源。重要的是,进一步的遗传学和解剖学研究揭示了其作为信号体通过生长素信号调控 LR 形成的生理功能。
我们的综合研究揭示了番茄 NAR1 蛋白的一个先前未被认识的功能:作为一种普遍存在于几乎所有生物体中的胞质 Fe-S 簇组装因子(Nakamura et al., 2013),它还能催化 H₂ 的产生(图 2)。一般认为,质子和电子是氢化酶驱动产氢的底物(Vignais & Bernard, 2007)。尽管本研究未进行同位素实验(因为电子无法用同位素标记,且氢同位素的测量本身具有挑战性)(Lim & Kitagawa, 2021),但通过气相色谱(GC)明确证实了 NAR1 在体外(蛋白纯化后)和体内(遗传学方法)的产氢催化活性(图 2C 和 3G、H),GC 是一种灵敏且可靠的 H₂ 测定方法(Boshagh & Rostami, 2020)。酶动力学实验进一步证实 SlNAR1 是番茄中的一种新型氢化酶(图 2D–H)。
与藻类中的氢化酶类似(Grossman et al., 2011),序列分析和点突变实验证明,至少在我们的实验条件下,四个 H 簇配位半胱氨酸残基和 Fe-S 簇对 SlNAR1 的潜在氢化酶活性至关重要(图 2I–L)。当然,每个半胱氨酸残基在产氢过程和/或铁硫簇组装中的具体贡献仍需进一步探索。SlNAR1 对氧气极其敏感(图 S4),这与之前在藻类中著名的氢化酶 HYD1 中观察到的现象一致:在正常氧条件下其产氢活性迅速下降(Happe et al., 2002)。这些结果表明,高等植物中的氢化酶(NAR1)可能与低等植物中的氢化酶具有相似的反应机制。值得注意的是,无论是否重新置于低氧环境,在有氧环境中纯化过程中可能会损失相当比例的氢化酶活性。这一意外发现部分解释了此前难以鉴定植物产氢酶的原因。
番茄地上部和根系中的 H₂ 稳态呈现潜在的昼夜节律,在黑暗中检测到的水平相对较高(图 1A、B)。内源 H₂ 水平的周期性变化与 NAR1 表达的变化呈正相关(图 3E)。有趣的是,尽管 nar1 突变体仍表现出部分 H₂ 产生的昼夜节律,但在 SlNAR1 过表达植株中该节律仍被增强(图 S11)。考虑到氧气对 NAR1 活性的抑制作用(图 S4)以及自然黑暗或其他胁迫导致的植物体内周期性缺氧(Triozzi et al., 2024),周期性的 NAR1 依赖 H₂ 可能发挥意想不到的功能。
主根上周期性的 LR 形成对于植物探索基质中的水分和养分至关重要。由于根系组织中光合作用有限或不存在(Van Dongen & Licausi, 2015),根系组织中的氧浓度低于地上部。氧气对人类生命不可或缺;然而,越来越多的临床前研究表明,
(Rogers & Mootha, 2025)。在植物的特定组织(如地上部或根分生组织等)中,内源性低氧微环境自然存在,并在植物发育中作为调控中枢发挥作用(Borisjuk & Rolletschek, 2009;Shukla et al., 2019;Weits et al., 2021)。尽管在根系发育建立过程中也需要生理水平的缺氧(Borisjuk & Rolletschek, 2009;Weits et al., 2021),但长期(4 天)缺氧条件会抑制 LR 发育(Shukla et al., 2019)。在植物中,夜间体内氧水平下降可产生周期性缺氧(Triozzi et al., 2024)。根系可能已进化出多种适应自然黑暗的策略,而根系中内源 H₂ 浓度高于地上部(图 1A、B)可能是其中之一(Zhang et al., 2024)。
材料与方法
植物材料
本研究使用的番茄(Solanum lycopersicum L.)均为 Ailsa Craig(AC)野生型背景。Slnar1 突变体由武汉伯远生物技术有限公司通过 CRISPR-Cas9 基因组编辑产生。相关靶点和引物序列信息列于表 S2 和图 S6。上述突变体通过基因组 PCR(特异性引物列于表 S2)和测序(由南京擎科生物技术有限公司完成)进行鉴定。
SlNAR1 过表达番茄由武汉伯远生物技术有限公司构建。番茄 NAR1 基因(SlNAR1)的编码序列通过 PCR 从番茄 cDNA 中扩增,并插入到 pBWA(V)HS-35S-GFP 载体中。将所得质粒转化到 AC 番茄中,获得 SlNAR1-OE 番茄。引物列于表 S2。SlNAR1-RNAi 番茄也由武汉伯远生物技术有限公司构建。通过 PCR 扩增 SlNAR1 的两段 201 bp 靶序列(引物列于表 S2),并插入到 pBWA(V)HS-ccdB 质粒中。将上述质粒转化到 AC 番茄中,获得 SlNAR1-RNAi 番茄。
拟南芥材料,包括 PIN1pro:PIN1-GFP、PIN2pro:PIN2-GFP、PIN7pro:PIN7-GFP、AUX1pro:AUX1-YFP、DR5pro:VENUS-N7,均由南京农业大学宣伟教授惠赠。将由 CaMV 35S 启动子驱动的 SlNAR1 CDS 序列的质粒转化到上述生长素相关材料和野生型(Col-0)拟南芥中。通过含卡那霉素的培养基筛选后,在基因组水平通过 PCR(SlNAR1 序列)进一步鉴定转基因材料。用于鉴定 CRISPR-Cas9 系统产生的 atnar1 突变体的特异性引物也列于表 S2。
植物培养与表型参数测量
所有处理中,番茄种子用 5% 次氯酸钠溶液表面灭菌,并在黑暗中(24°C ± 1°C)萌发 3 天。将胚根长度基本一致的番茄幼苗转移到另一个培养皿中,在正常光照条件下(14 h 光照 / 10 h 黑暗,200 μmol m−2 sec−1)培养 2 天。对于根系生长相关表型分析,将 5 日龄番茄幼苗分别在正常光照(200 μmol m−2 sec−1)、低光照(LL,70 μmol m−2 sec−1)和短期黑暗(uD,具体条件见图例)下的 1/2 MS 固体培养基中生长(Muralidhara et al., 2021)。处理 5 天后,测量侧根数、主根长度和侧根密度。
对于生长素相关药理学实验,5 日龄番茄幼苗在含 DMSO(对照)、2.5 μM L-犬尿氨酸(Kyn)、5 μM NPA、5 μM TIBA 或 50 μM Yucasin 的 1/2 MS 固体培养基中生长(Alaguero-Cordovilla et al., 2021)。对于氢相关药理学实验,将常规释氢化合物 NH3·BH3(Wang et al., 2024)加入 1/2 MS 固体培养基中以提供外源 H2。根据先前描述(Liu et al., 2022),番茄侧根原基(LRP)的发育分为四个阶段:I–III、IV–V、VI–VII 和 VIII。在指定时间点测量不同阶段的 LRP 数量(Wang et al., 2024)。
对于盆栽实验,将上述 5 日龄番茄幼苗移栽到装有蛭石和泥炭(3:1,v/v)的花盆中(直径 14.0 cm,高度 17.0 cm)。花盆置于南京农业大学生命科学学院温室中。每 3 天用 1/2 强度 Hoagland 溶液浇水。2 个月后,测量根系鲜重和侧根数,并拍摄代表性照片。
拟南芥种子用 5% 次氯酸钠溶液表面灭菌,并在 4°C 黑暗中春化 24 h。种子在正常光照条件下培养 5 天。对于根系生长相关表型分析,将 5 日龄拟南芥幼苗在正常光照(200 μmol m−2 sec−1)或 uD 条件下的 1/2 MS 固体培养基中生长(具体条件见图例)。对于生长素相关药理学实验,5 日龄拟南芥幼苗在含 DMSO(对照)或 5 μM NPA 的 1/2 MS 固体培养基中生长 5 天。为探究遗传操作(SlNAR1)引起的生长素运输变化,将表达 SlNAR1 的野生型(Col-0)和荧光报告系(PIN1pro:PIN1-GFP、PIN2pro:PIN2-GFP、PIN7pro:PIN7-GFP、AUX1pro:AUX1-YFP、DR5pro:VENUS-N7)在正常光照条件下再生长 2 天,并观察荧光。为探究 uD 诱导的内源 H2 引起的生长素运输变化,将上述 5 日龄拟南芥材料置于正常光照或 4 h uD 条件下。同时,将 5 日龄荧光报告系用外源 H2(含 1 mg L−1 NH3·BH3 的 1/2 MS 固体培养基)处理 4 h 作为阳性对照。在正常光照条件下再培养 2 天后,观察荧光。
原核蛋白表达、点突变与纯化
His 标签融合蛋白按照先前研究通过大肠杆菌系统表达(Yacoby et al., 2011)。将 SlNAR1 的编码序列克隆到 pCold 质粒中(引物列于表 S2)。使用 Mut Express II Fast Mutagenesis Kit V2(Vazyme)对 SlNAR1 中的四个半胱氨酸进行定点突变(引物列于表 S2)。将上述载体转化到大肠杆菌 BL21(DE3)菌株中。在 37°C 下将大肠杆菌培养至 A600 为 0.4。加入 IPTG(终浓度 1 mM)和新鲜柠檬酸铁铵(终浓度 2.5 mM),并在 16°C 下诱导 SlNAR1 表达(Yacoby et al., 2011)。随后在厌氧条件下继续表达 24 h。使用 Ni-TED 柱(BBI Life Science)纯化 SlNAR1 蛋白,所有溶液均含 10 mM 连二亚硫酸钠以去除氧气。通过 BCA 法测定纯化蛋白浓度。之后按照图例说明进行动力学常数及相关分析。
内源 H2 浓度与氢化酶活性测定
对于内源 H2 浓度测定,将约 0.5 g 新鲜植物组织用 1.5 ml PBS 缓冲液(pH 7.5)研磨。将匀浆立即转移至 GC 样品瓶中,并用纯氮气置换瓶内空气。在使用顶空 GC(GC 7980,天美,上海)测量前,将样品瓶煮沸以将溶解的 H2 释放至顶空(Cheng et al., 2023)。
氢化酶活性也通过顶空 GC 测定。除图例中指定的缓冲液类型和 pH 外,使用含 5%(v/v)甘油、0.25 M KCl、20 mM 连二亚硫酸钠和 10 mM 甲基紫精的 20 mM PBS 缓冲液(pH 8)作为反应缓冲液(Yacoby et al., 2011)。将反应缓冲液和蛋白(包括植物粗蛋白或纯化蛋白)加入样品瓶中,并用纯氮气置换空气。在指定时间点反应后(见图例),将样品瓶煮沸以释放溶解的 H2 至顶空。最终值需减去空白对照(加入等量煮沸蛋白溶液,其他条件不变)。通过 BCA 法测定纯化蛋白浓度。
细胞水平 H2 产生活性检测
将含或不含 SlNAR1 编码序列的 pCold 质粒(EV)转化到大肠杆菌 BL21(DE3)中。在 37°C 下将大肠杆菌培养至 A600 为 0.4。随后将 BL21 转移至厌氧手套箱中,加入 IPTG(终浓度 1 mM)和新鲜柠檬酸铁铵(终浓度 2.5 mM)。密封后在 16°C 下诱导 24 h,并在厌氧条件下继续表达 24 h。之后将 LB 分为两部分:一部分从厌氧环境移至空气中 2 h,另一部分继续置于厌氧环境中。根据先前的实验方案(Kosem, 2023),将 200 μl 上述 LB 培养物和 1.8 ml 反应缓冲液(20 mM PBS,pH 8,20 mM 连二亚硫酸钠,10 mM 甲基紫精)加入样品瓶中。反应 1 h 后,通过 GC 测定瓶内气相(顶空)中的 H2。
RT-qPCR 分析
使用 Trizol 试剂提取番茄总 RNA。使用 HiScript IV RT SuperMix(Vazyme)进行反转录。qPCR 在 Mastercycler ep realplex 实时 PCR 系统(Eppendorf)上进行,使用 ChamQ SYBR qPCR Master Mix(Vazyme)。相对基因表达量按先前描述计算(n = 3)(Livak & Schmittgen, 2001)。基因特异性引物列于表 S3。
植物蛋白提取与免疫印迹分析
植物样品在提取缓冲液(BC3720,Solarbio)中匀浆,并在 12,000×g 下离心 10 min。通过 BCA 法(E112,Vazyme)定量后,将上清液调整至相同浓度。将定量蛋白或从大肠杆菌纯化的 NAR1 蛋白与 5× 蛋白上样缓冲液(P0015,Beyotime)混合,并在 95°C 下变性 5 min。通过 SDS-PAGE(12%,E304,Vazyme)分离蛋白,并转移至 0.2 μm 聚偏二氟乙烯(PVDF)膜(Roche)上。使用抗 GFP(K200047M,Solarbio)或抗 His(K200060M,Solarbio)在 4°C 下孵育过夜。二抗为抗小鼠抗体(SE131,Solarbio)。
GUS 染色分析
为观察 NAR1 的表达模式,在光/暗周期的暗期对表达 SlNAR1pro:GUS 的转基因番茄进行 GUS 染色(Beeckman & Engler, 1994)。使用 ZEISS Axio Observer 3 显微镜观察染色后的植物样品。
共聚焦显微镜与定量分析
使用 Zeiss 800 激光扫描显微镜观察根部 GFP 荧光(激发波长 488 nm,发射波长 509 nm,收集带宽 55 nm)和 VENUS 信号(488 nm 激光,功率强度 5.00%;发射波长 462–517 nm)(Zhang et al., 2024)。
光合特性分析
根据先前方法(Zhang et al., 2023),使用 LI-6800 光合仪(LI-COR)和 IMAG-MAX 调制叶绿素荧光仪(WALZ)测定番茄幼苗的光合参数。使用 30 日龄 WT、SlNAR1-OE、CRISPR 和 RNAi 突变体植株的第六片叶进行测量。
https://blog.sciencenet.cn/blog-41174-1518915.html
上一篇:开放科学运动真的如支持者所言那般有益吗?
下一篇:动态“舞蹈分子”纳米材料突破血脑屏障,减轻缺血性脑卒中后炎症损伤