博文
持续释氢辅助干细胞移植促进骨关节炎软骨再生
||
持续释氢辅助干细胞移植促进骨关节炎软骨再生
今天(1月8日)晚上8点,我们将有机会聆听,本文第一作者,上海交通大学氢科学中心陈胜强博士,对该文章等内容的学术报告。这次报告会是医学气体杂志组织的线上交流活动。
我把本文的中文翻译放在这里,供大家参考使用。
Chen, Shengqiang, et al. "Local sustained H2 release assisted stem cell transplantation for enhanced osteoarthritic cartilage regeneration." Cell Biomaterials (2025).
干细胞移植(SCT)已获临床批准用于组织再生,但在骨关节炎(OA)这类恶性病理微环境中,移植干细胞存在快速失活和异常分化的问题,这成为干细胞移植临床应用的一大挑战。本研究发现,氢气(H₂)可通过靶向线粒体功能障碍,将骨关节炎软骨细胞逆转为透明软骨表型,进而调控干细胞向透明软骨方向分化。基于此,我们构建了一种创新型移植体系——将具有持续水解释氢能力的硅化镁(Mg₂Si)纳米片(MSN)与脂肪干细胞微球共包埋于水凝胶中。该体系能够通过抑制炎症和软骨退变,成功重塑骨关节炎微环境,显著提高移植干细胞的体内存活率,维持其向透明软骨分化的特性,从而增强干细胞对骨关节炎临界尺寸软骨缺损的再生修复疗效。
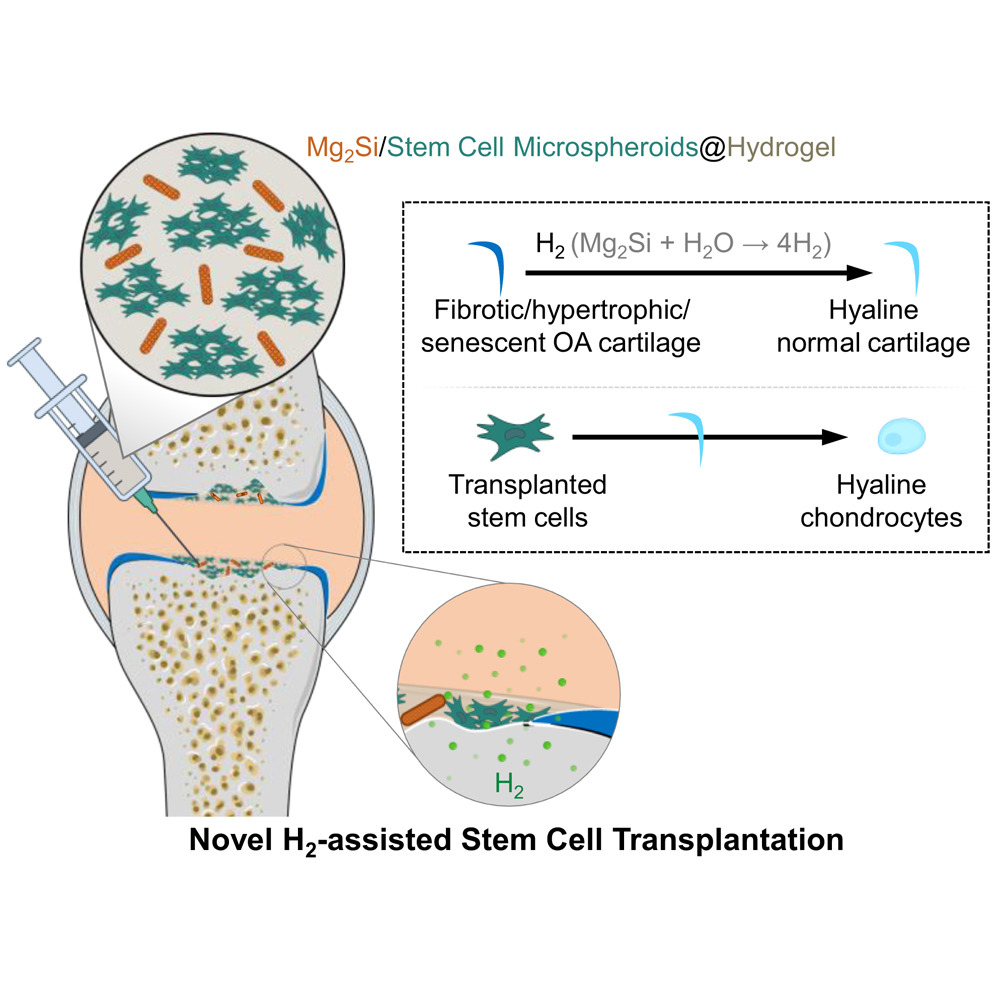
核心亮点
* 发现氢气可逆转骨关节炎软骨细胞的表型
* 制备出具备超长时程水解释氢能力的硅化镁纳米片
* 建立局部持续供氢辅助干细胞移植的治疗策略
摘要
骨关节炎(OA)微环境会导致移植干细胞快速失活和异常分化,这对干细胞移植(SCT)技术的临床转化构成巨大阻碍。本研究发现,氢气通过靶向线粒体功能障碍,能够恢复骨关节炎微环境中软骨细胞丢失的透明软骨表型。为此,我们研发了尺寸与水解释氢特性可调控的硅化镁(Mg₂Si)纳米片(MSN),并将其与脂肪干细胞微球共包埋于甲基丙烯酰化明胶(GelMA)/甲基丙烯酰化透明质酸(HAMA)水凝胶中,构建出可实现长达28天持续释氢的水凝胶移植体系。该移植体系通过抑制炎症和软骨退变来重塑骨关节炎微环境,显著提升移植干细胞的体内存活率,维持其向透明软骨分化的固有特性,进而增强干细胞对骨关节炎临界尺寸软骨缺损的再生修复效果。本研究提出的局部持续供氢重塑恶性病理微环境的策略,为提高细胞移植疗效开辟了新的思路。
正文
干细胞移植(SCT)通过移植干细胞,助力修复受损组织自身再生能力的不足,是再生医学领域的一项前沿技术¹²。基于干细胞强大的扩增潜能、多向分化可塑性、低免疫原性以及丰富的来源等优势,干细胞移植技术已取得长足发展,目前已有27种干细胞治疗产品获批临床应用,同时还有大量利用干细胞开展治疗的临床试验正在进行³⁴。然而,干细胞移植仍面临一大关键挑战:当干细胞被移植到恶性病理微环境中后,极易发生快速失活与异常分化。将恶性病理微环境重塑为适宜干细胞生存的生理性“庇护所”,对于提升干细胞移植的治疗效果至关重要,但这一目标的实现仍存在诸多困难⁵⁶⁷⁸。
骨关节炎(OA)微环境对募集或移植的干细胞具有极强的“杀伤性”,其典型特征包括慢性高炎症状态(活性氧(ROS)、白介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)等)、软骨基质降解(Ⅱ型胶原/透明质酸(HA)网络崩解、聚集蛋白聚糖流失等)、软骨细胞肥大分化(Ⅹ型胶原、基质金属蛋白酶13(MMP-13)等)以及衰老相关分泌表型(SASP)成分(IL-6、MMP-3等)的释放⁹¹⁰¹¹。软骨细胞是关节软骨的核心功能细胞,负责分泌软骨基质和旁分泌因子,以此诱导干细胞向软骨方向分化,维持软骨组织稳态¹²¹³。在骨关节炎微环境中,慢性炎症与氧化应激(OS)会打破这种稳态,诱导透明软骨细胞向纤维化、肥大化及衰老表型转变,最终导致软骨退变和骨关节炎进展,而这一病理过程在临床上难以得到有效遏制和逆转。与此同时,恶劣的骨关节炎微环境会导致移植干细胞快速失活,并抑制其向透明软骨方向分化⁹¹⁴。因此,有效重塑骨关节炎恶性微环境,尤其是消除炎症、将骨关节炎软骨细胞逆转为透明软骨表型,是提升干细胞移植治疗骨关节炎软骨再生疗效的关键,但目前该问题的解决仍面临巨大挑战。
氢分子(H₂)具有高效清除羟自由基(·OH)的能力¹⁵¹⁶¹⁷,因此具备广谱抗氧化应激、抗炎、抗凋亡及抗衰老功效;在低于饱和浓度(0.8 mM)的条件下,氢分子具有极高的生物安全性,对正常细胞/组织无明显毒副作用¹⁸¹⁹²⁰²¹²²²³;同时,氢分子还具有强大的软骨/骨组织穿透能力²⁴²⁵²⁶,在辅助骨关节炎软骨修复与再生方面展现出巨大潜力。已有研究表明,氢分子可通过抗氧化作用,在体外实验中阻止过氧化氢(H₂O₂)对软骨细胞透明表型的破坏和活性的损伤²⁷,但氢分子能否在骨关节炎微环境中逆转骨关节炎软骨细胞的异常表型,目前尚不明确。若氢分子具备这一功能,那么它就有可能纠正骨关节炎软骨细胞对移植干细胞软骨分化的不良诱导作用,进而为重塑骨关节炎微环境、支持干细胞介导的骨关节炎软骨再生提供新的思路。此外,实现氢分子的靶向、足量递送,对于充分发挥其调控骨关节炎病理进程的功能至关重要。移植可水解产氢的水凝胶或支架材料,是实现氢分子局部足量递送的理想策略,但现有水解产氢材料的释氢时长通常不超过7天,难以匹配骨/软骨组织修复的时间窗口。
本研究首次发现,持续的氢分子孵育可通过靶向线粒体功能障碍,清除骨关节炎软骨细胞的氧化应激与炎症,将其逆转为透明软骨表型,进而恢复其诱导干细胞向透明软骨方向分化的能力。在此基础上,我们设计并构建了一种MSN/SCM@Gel复合移植材料:将脂肪干细胞微球(SCMs)和尺寸可调控的硅化镁(Mg₂Si)纳米片(MSNs)包埋于甲基丙烯酰化明胶(GelMA)/甲基丙烯酰化透明质酸(HAMA)水凝胶中,实现了长达28天的局部持续水解释氢。在大鼠骨关节炎临界尺寸软骨缺损模型中,MSN/SCM@Gel复合移植材料释放的持续氢分子通过消除炎症、将纤维化、肥大化及衰老的骨关节炎软骨细胞逆转为透明软骨表型,成功重塑了骨关节炎微环境,显著提升了移植干细胞的体内存活率,并维持了其向透明软骨分化的特性,最终增强了干细胞介导的骨关节炎软骨再生疗效(见示意图1)。所研发的MSN/SCM@Gel复合移植材料兼具高生物安全性、治疗有效性与临床可操作性,具有良好的临床转化潜力。
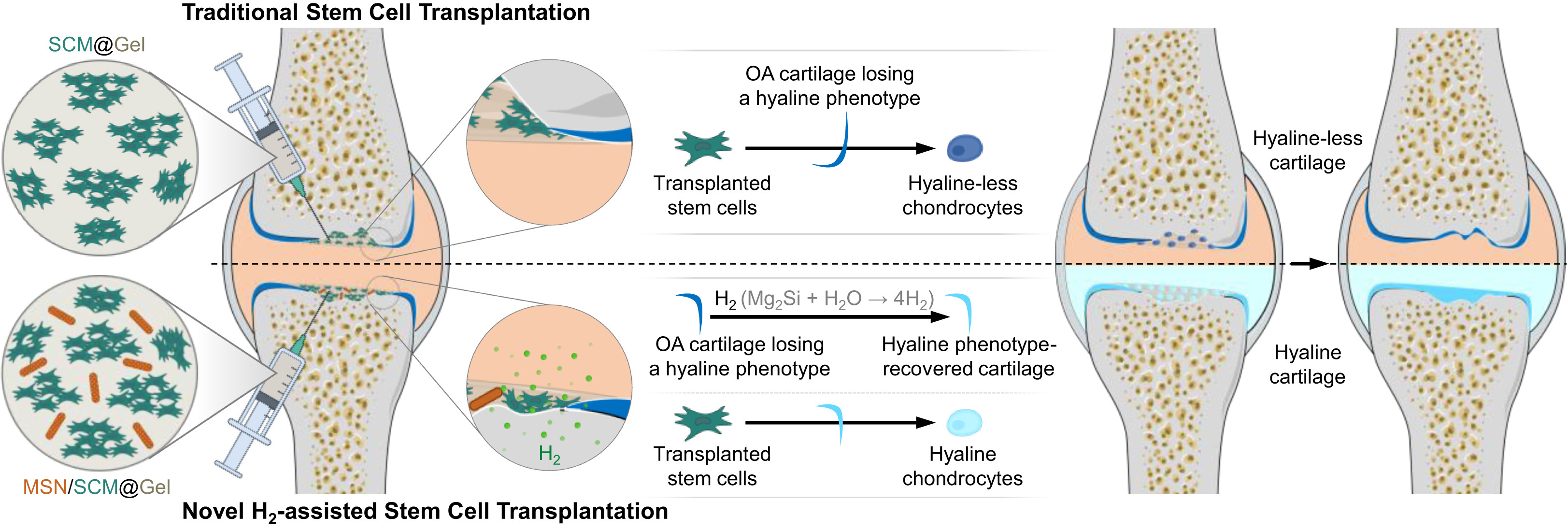
示意图1 氢分子辅助干细胞移植治疗骨关节炎软骨再生的技术方案
结果
氢分子逆转骨关节炎软骨细胞表型,保障干细胞微球在骨关节炎微环境中定向分化为透明软骨
此前研究证实,氢分子可在体外实验中阻止过氧化氢破坏软骨细胞的透明表型²⁷,但氢分子能否在骨关节炎微环境中逆转骨关节炎软骨细胞的异常表型,尚未可知。为此,我们首先采用IL-1β诱导软骨细胞2天以构建骨关节炎软骨细胞模型,随后将其置于特制的氢分子培养箱(含5% CO₂、21% O₂、60% H₂及14% N₂)中孵育3天,探究氢分子对骨关节炎软骨细胞表型的影响,实验流程见图1A。原代软骨细胞的分离参照已报道的方法²⁸,并通过甲苯胺蓝强染色、Ⅱ型胶原(Col2)高表达及Ⅹ型胶原(Col10)低表达进行鉴定(见图S1)。随后,我们检测了不同浓度IL-1β对软骨细胞内活性氧水平的影响,结果发现,采用40 ng/mL IL-1β孵育2天(骨关节炎组)可诱导软骨细胞产生显著的氧化应激反应(见图S2),同时显著增强炎症水平(IL-1β表达阳性),促进软骨细胞向纤维化(Col1表达阳性)和肥大化(Col10表达阳性)表型转变,并抑制其透明软骨表型(Col2表达阴性)(见图1A、1B),呈现出典型的骨关节炎软骨细胞特征。而经过氢分子持续孵育3天后(骨关节炎-氢组),骨关节炎软骨细胞的炎症水平显著降低(IL-1β表达阴性),其透明软骨表型(Col2表达阳性)得到恢复,纤维化(Col1表达阴性)和肥大化(Col10表达阴性)表型则被逆转至正常水平(见图1A、1B)。此外,在骨关节炎患者来源的软骨细胞(p-OA)中也观察到了类似结果(见图S3A、S3B)。同时,氢分子孵育可诱导骨关节炎患者来源软骨细胞表达IL-4、IL-10等抗炎因子(见图S3A、S3B),进一步证实氢分子能够逆转骨关节炎患者来源软骨细胞的异常表型。上述结果表明,持续供给氢分子确实能够逆转因子诱导型和患者来源型骨关节炎软骨细胞的异常表型。

图1 氢分子通过靶向线粒体功能障碍,逆转骨关节炎软骨细胞为透明软骨表型,进而纠正其对干细胞微球在骨关节炎微环境中软骨分化的诱导作用。
为揭示氢分子逆转骨关节炎软骨细胞表型的作用机制,我们开展了RNA测序(RNA-seq)分析。首先,样本相关性分析(见图S4A)、主成分分析(见图S4B)、差异表达基因(DEGs)韦恩图(见图S5A)和火山图(见图S5B)结果均显示,骨关节炎-氢组与骨关节炎组之间存在显著的基因表达差异。京都基因与基因组百科全书(KEGG)富集分析结果表明,差异表达基因主要富集于炎症及代谢相关通路(见图1C)。其中,氧化磷酸化通路(OXPHOS)的富集因子排名第一,是最值得关注的通路(见图1C)。从图1D的热图和图1E的基因集富集分析(GSEA)结果可以明确看出,氢分子处理可显著上调氧化磷酸化通路的活性(q=0)。此外,氢分子处理还能显著激活线粒体呼吸链(见图1F)及呼吸链上的各复合体(见图S6),同时抑制糖酵解过程(包括丙酮酸代谢、半乳糖代谢以及果糖和甘露糖代谢,见图S7)。上述结果提示,氢分子可抑制骨关节炎软骨细胞的炎症反应,恢复其线粒体能量代谢功能,从而终止细胞对糖酵解途径的能量代偿。我们进一步验证发现,氢分子处理能够彻底清除骨关节炎软骨细胞的氧化应激,恢复受损的线粒体膜电位(见图1G、1H)和能量代谢水平(见图1I)。在骨关节炎患者来源的软骨细胞中,氢分子处理同样能恢复受损的线粒体膜电位和能量代谢,这一结论还通过细胞内钙离子水平降低、还原型烟酰胺腺嘌呤二核苷酸(NADH)水平升高及耗氧率上升等指标得到进一步证实(见图S8)。此外,氢分子处理还可显著促进IL-10的正向调控(见图S9A)和转化生长因子-β(TGF-β)信号通路的激活(见图S9B),同时抑制细胞衰老(见图S9C)和糖胺聚糖(GAG)降解(见图S9D)。
基于上述结果,我们提出了氢分子逆转骨关节炎软骨细胞表型的作用机制(见图1J):骨关节炎软骨细胞内的氧化应激会导致线粒体电子传递链(ETC)发生电子泄漏,进而产生大量羟自由基和活性氧,损伤线粒体膜蛋白及线粒体功能,最终引发炎症反应,并促使软骨细胞从透明表型向纤维化、肥大化及衰老表型转化。而线粒体细胞色素中的铁卟啉可在局部催化氢分子,使其发挥清除羟自由基的作用¹⁵¹⁶,进而抑制线粒体功能障碍,纠正线粒体代谢紊乱,最终将骨关节炎软骨细胞逆转为透明软骨表型。
随后,我们探究了经氢分子逆转后的骨关节炎软骨细胞对干细胞成软骨分化的诱导作用。鉴于脂肪组织是自体干细胞移植的丰富来源,我们分离并鉴定了原代脂肪干细胞(ADSCs)(见图S10),并利用V型96孔板在1天内制备得到脂肪干细胞微球(SCMs)。基于9.5% GelMA与0.5% HAMA复合水凝胶的高生物安全性及其诱导干细胞成软骨分化的能力²⁹,我们选用该水凝胶包埋干细胞微球,随后将其与软骨细胞共同置于transwell小室中共培养7天,实验流程见图1K、1L。结果显示,在无成软骨诱导培养基的条件下,正常对照组中的干细胞微球@水凝胶(SCM@Gel)即可高表达Col2,同时低表达Col1(见图1K),这可能得益于GelMA/HAMA水凝胶基质提供的利于成软骨分化的三维微环境,以及软骨细胞分泌的旁分泌信号分子²⁹³⁰³¹³²。与正常对照组相比,骨关节炎组的骨关节炎软骨细胞会诱导干细胞微球高表达Col10(肥大表型标志物)和Col1(纤维化表型标志物),同时低表达Col2(透明软骨表型标志物);而经氢分子预处理的骨关节炎软骨细胞,其诱导干细胞微球向透明软骨分化的能力可恢复至正常水平,与正常软骨细胞的诱导效果一致。利用骨关节炎患者来源的软骨细胞及人骨髓间充质干细胞(hBM-MSCs)构建的干细胞微球@水凝胶进行实验,进一步验证了上述结论(见图S11)。这表明氢分子不仅能逆转骨关节炎软骨细胞的异常表型,还能恢复其诱导干细胞分化的正常功能。此外,我们还发现,与单独使用经氢分子处理的骨关节炎患者来源软骨细胞(p-OA_H₂)共培养相比,将经氢分子处理的骨关节炎患者来源软骨细胞与人骨髓来源巨噬细胞(hBMDMs)联合共培养时,干细胞微球@水凝胶向透明软骨方向分化的能力更强(见图S12)。这提示人骨髓来源巨噬细胞可能通过旁分泌作用,进一步增强氢分子辅助干细胞移植的治疗效果³³³⁴。
MSN/SCM@Gel复合水凝胶的设计、制备及释氢特性
为实现氢分子的局部持续供给,本研究设计了一种包埋水解产氢材料的复合水凝胶移植体系。在各类水解产氢材料中,具有AB型层状结构的硅化镁(Mg₂Si)是理想的候选材料,原因在于:其一,其尺寸可调控,能够实现水解产氢的可控释放;其二,水解产氢容量高达1.3 L/g;其三,水解产物硅酸氢氧化镁(Mg₂SiO₃(OH)₂,MSO)具有较高的生物安全性¹⁷³⁵。本研究在惰性气氛下采用球磨法合成并分离了一系列不同尺寸的硅化镁纳米片(MSNs),旨在筛选出释氢时长约为1个月的材料。扫描电子显微镜(SEM)图像显示(见图S13),5种硅化镁纳米片样品的厚度和宽度存在明显差异:M1样品的宽度约为150 nm、厚度约为10 nm,而M5样品的宽度约为400 nm、厚度约为120 nm;在相同颗粒浓度下,样品颜色从M1的棕黄色逐渐过渡到M5的紫红色。元素分布图谱和X射线衍射(XRD)结果表明,这5种样品均具有相同的硅化镁晶相/成分,且均沿(111)晶面择优取向生长(见图S13、S14)。正如预期,纳米片尺寸越大,水解产氢的持续性越强(见图S15)。针对本研究中的软骨再生需求,我们选择释氢时长最长(约1个月)的M5样品开展后续所有实验(见图2A-2E)。

图2 MSN/SCM@Gel复合水凝胶的设计、制备与表征
为支持干细胞微球/硅化镁纳米片的共移植,我们选用由9.5% GelMA和0.5% HAMA组成的复合水凝胶(Gel)作为载体,对硅化镁纳米片和干细胞微球进行共包埋(见图2H)。该复合水凝胶具有高生物相容性、促进干细胞向透明软骨分化的能力以及光控交联特性,可实现局部注射与原位固定。此前研究已证实,9.5% GelMA与0.5% HAMA的组合为最优配比,能够为软骨细胞提供最适宜的基质硬度,并增强其诱导软骨基质沉积的能力²⁹。为确定水凝胶中干细胞微球和硅化镁纳米片的最佳含量,我们探究了二者浓度对水凝胶pH值、凝胶时间及细胞活性的影响。结果显示(见图2E),当硅化镁纳米片浓度超过200 μg/mL时,会影响水凝胶的凝胶时间,这可能与紫红色硅化镁纳米片的吸光特性有关。硅化镁纳米片水解后会持续释放镁离子和硅离子(见图S16),导致pH=7.4的磷酸盐缓冲液(PBS)体系pH值升高(见图2F)。pH值过快升高至8以上可能会影响细胞活性³⁶,但浓度为200 μg/mL的硅化镁纳米片在降解4天后,仅将PBS的pH值升高至7.98±0.04。在体内环境中,降解产物(Mg²⁺、SiO₃²⁻和OH⁻)可通过代谢排出,从而避免移植部位pH值过度升高,降低其潜在的不良影响。图2G结果显示,在较宽的浓度范围内(6.25-200 μg/mL),硅化镁纳米片与脂肪干细胞、软骨细胞共孵育7天后,不会对细胞活性造成影响;但当浓度超过100 μg/mL时,硅化镁纳米片会显著延长MSN@Gel水凝胶的凝胶时间(见图2I),这与其具有从紫外到近红外波段的可见光吸收特性有关(见图S17)。因此,本研究选择100 μg/mL作为硅化镁纳米片的包埋浓度,所制备的MSN@Gel水凝胶具有高亲水性、高润湿性(见图S18)以及对脂肪干细胞和软骨细胞的高细胞相容性(见图S19),同时还能轻微延长水解产氢的持续时间(见图2E)。扫描电子显微镜图像显示(见图S20),在模拟生理条件下,水凝胶的疏松多孔结构会随时间逐渐塌陷,表明其可在1个月内实现持续降解,这一特性既有利于MSN/SCM@Gel复合水凝胶在软骨修复期间固定于缺损部位,又能促进其与宿主组织的逐步整合。高浓度的干细胞微球(12.5-1000 微球/mL)不会影响水凝胶的凝胶时间(见图S21),但当浓度超过400 微球/mL时,干细胞微球在7天培养过程中的活性会明显受损(见图2J)。因此,本研究选择400 微球/mL作为干细胞微球的包埋浓度。后续所有实验均采用包埋浓度为100 μg/mL硅化镁纳米片和400 微球/mL干细胞微球的MSN/SCM@Gel复合水凝胶开展。
MSN/SCM@Gel 水凝胶通过逆转骨关节炎软骨细胞表型,维持包埋干细胞微球的透明软骨分化特性
随后,我们验证了所构建的 MSN/SCM@Gel 水凝胶 是否能与前述氢分子培养箱一样,实现骨关节炎软骨细胞表型的逆转。实验流程如图3A所示:首先用白细胞介素-1β(IL-1β)诱导生成骨关节炎软骨细胞,随后将其与 MSN/SCM@Gel 水凝胶置于 Transwell 小室中共培养;分别在培养第7天时,检测小室下层骨关节炎软骨细胞的相关指标(图3B、3C)及培养基中的旁分泌因子水平(图3F);在培养第21天时,检测小室上层干细胞微球的分化情况。
图3B和3C的结果显示,MSN@Gel 水凝胶与 MSN/SCM@Gel 水凝胶均能有效清除骨关节炎软骨细胞内的高水平活性氧(ROS),抑制细胞凋亡(TUNEL染色阴性、B细胞淋巴瘤因子2(Bcl2)表达阳性)与炎症反应(IL-1β表达阴性),同时抑制软骨细胞的纤维化(Ⅰ型胶原(Col1)表达阴性)、肥大化(Ⅹ型胶原(Col10)表达阴性)及衰老表型(衰老相关β-半乳糖苷酶(SA-β-Gal)、p16基因表达阴性),并增强其透明软骨表型(Ⅱ型胶原(Col2)表达阳性)。这一结果与前述氢分子培养箱的实验数据完全一致(图1);而 MSO@Gel 水凝胶在上述各方面均未表现出显著效果。这一差异应归因于 MSN/SCM@Gel 水凝胶中硅化镁纳米片(MSN)的持续释氢作用。
另一方面,在软骨细胞存在的条件下,无论是氢分子还是硅化镁纳米片的降解产物镁离子(Mg²⁺),均不会直接影响 SCM@Gel 水凝胶中干细胞的成软骨分化(图S22)。此外,SCM@Gel 水凝胶与 MSO/SCM@Gel 水凝胶对骨关节炎软骨细胞的凋亡(TUNEL染色阴性)、炎症(IL-1β表达阴性),以及纤维化、肥大化、衰老与透明软骨表型均有轻微的正向调节作用,如图3F所示,这可能与干细胞微球的旁分泌调控作用相关³²。相比之下,氢分子在上述各方面的调控效果显著更强。
更重要的是,在氢分子与干细胞微球的协同作用下,MSN/SCM@Gel 水凝胶处理组的培养基中,白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)等典型炎性细胞因子的水平被显著抑制;同时,胰岛素样生长因子-1(IGF-1)、骨形态发生蛋白2(BMP-2)、转化生长因子-β3(TGF-β3)等促进透明软骨分化的细胞因子分泌量显著升高(图3F)。上述结果表明,MSN/SCM@Gel 水凝胶成功将恶性骨关节炎微环境重塑为适宜干细胞微球生存的“庇护所”,而这一作用主要依赖于氢分子对骨关节炎软骨细胞表型的逆转功能。

图3 MSN/SCM@Gel 水凝胶逆转骨关节炎软骨细胞为透明软骨表型,维持包埋干细胞微球的透明软骨分化特性
接下来,我们通过荧光染色与实时荧光定量聚合酶链式反应(qPCR)检测,进一步分析干细胞微球的分化趋势。图3D和3E的荧光染色结果显示,经过21天的持续共培养,与 SCM@Gel 水凝胶组相比,MSN/SCM@Gel 水凝胶组的干细胞微球呈现出更低的活性氧水平(ROS染色阴性)、更少的凋亡细胞(TUNEL染色阴性)、更高的细胞存活率(活细胞染色阳性、死细胞染色阴性)、更低的炎症水平(IL-1β表达阴性),同时其肥大化(Col10表达阴性)与纤维化(Col1表达阴性)表型受到抑制,透明软骨表型(Col2表达阳性)则显著增强。
对应的基因表达分析进一步证实,经 MSN/SCM@Gel 水凝胶培养21天后,干细胞来源软骨细胞的透明软骨表型标志物(*Col2*、*Sox9*)表达显著上调,纤维化(*Col1*)与肥大化(*Col10*、*MMP13*)表型标志物表达则显著下调(图S23)。此外,MSN/SCM@Gel 水凝胶组中干细胞微球的恶性生存微环境被稳定重塑后,干细胞来源软骨细胞的活性也得到显著提升(图S24)。这一现象可能正是骨关节炎微环境被重塑为干细胞友好型微环境的直接结果。
综上,MSN/SCM@Gel 水凝胶通过局部、长期递送高浓度氢分子,逆转骨关节炎软骨细胞表型,进而重塑恶性骨关节炎微环境,最终维持了包埋干细胞微球的透明软骨分化特性,这一特性对体内干细胞移植治疗具有重要意义。
#MSN/SCM@Gel 水凝胶重塑体内骨关节炎微环境,为干细胞移植提供支持
随后,我们进一步验证了 MSN/SCM@Gel 水凝胶移植后,是否能在大鼠骨关节炎临界尺寸软骨缺损部位,发挥与体外模拟骨关节炎微环境中相同的作用——即重塑恶性骨关节炎微环境,并维持包埋干细胞微球的透明软骨分化能力。
实验流程如图4A所示:首先对大鼠实施前交叉韧带离断术(ACLT),术后21天诱导其形成自发性骨关节炎;随后在滑车沟处制造临界尺寸软骨缺损;最后将硅化镁纳米片、干细胞微球与水凝胶的混合液注射到缺损部位,通过光交联完成 MSN/SCM@Gel 水凝胶的原位移植。
术后21天,显微计算机断层扫描(μCT)结果显示,模型组大鼠股骨头出现骨赘增生(图S25A、S25B);番红O-固绿(SOFG)染色结果显示,软骨基质发生降解,番红O染色呈现不均匀、染色浅的特征(图S25C)。上述结果共同证实,骨关节炎模型构建成功,且根据退行性关节病(DJD)评分标准,该模型处于中度骨关节炎阶段。
在 MSN/SCM@Gel 水凝胶移植后的不同时间点,我们收集缺损部位的关节组织,采用气相色谱法(GC)检测组织内的氢分子浓度,以此分析水凝胶在体内的释氢特性。图4B与图S26的结果显示,MSN/SCM@Gel 水凝胶在体内可实现长达28天的高浓度氢分子持续释放,这一特性与体外释氢实验结果一致(图2E),为氢分子长期辅助干细胞移植治疗奠定了基础。此外,小氢气生物探针等更先进的氢分子检测技术的发展,将有助于实现体内氢分子空间分布与代谢过程的实时监测。

图4 MSN/SCM@Gel 水凝胶持续释氢,重塑骨关节炎微环境,维持移植干细胞微球的透明软骨分化特性
MSN/SCM@Gel 水凝胶移植术后30天,我们分别提取缺损周围软骨组织(图4C-4E)与缺损部位新生组织(图4F-4I),分析软骨细胞的活性与表型特征。结果显示,与 SCM@Gel 水凝胶组相比,MSN/SCM@Gel 水凝胶组缺损周围软骨组织的氧化应激水平更低(活性氧水平降低,图4C),能量代谢水平更高(线粒体膜电位与三磷酸腺苷(ATP)水平升高,图4C、4D)。
基因表达检测结果进一步证实,MSN/SCM@Gel 水凝胶组缺损周围软骨组织中,炎症相关基因(*IL-1β*、*TNF-α*)及纤维化、肥大化软骨表型基因(*Col1*、*Col10*、*MMP13*)的表达显著下调;抗凋亡基因(*Bcl2*、*Bcl6*)与透明软骨表型基因(*Sox9*、*Col2*、*ACAN*)的表达则显著上调(图4E)。相比之下,MSO/SCM@Gel 水凝胶处理组在抗氧化应激、抗炎及软骨表型逆转方面均未表现出显著作用。上述结果表明,MSN/SCM@Gel 水凝胶通过局部持续释氢,有效清除骨关节炎炎症、逆转软骨细胞表型,进而成功重塑体内恶性骨关节炎微环境,这一结论与前述体外实验结果高度一致(图3)。
此外,我们对缺损部位新生组织的细胞活性与表型进行了检测。与 SCM@Gel 水凝胶组相比,MSN/SCM@Gel 水凝胶组新生组织中存活软骨细胞分布更密集(图4F、4G),番红O染色着色更深(图4H),与正常软骨组织的形态特征更为接近。基因表达分析结果进一步显示,MSN/SCM@Gel 水凝胶组新生组织中炎症基因(*IL-1β*、*TNF-α*)表达显著下调,抗凋亡基因(*Bcl2*、*Bcl6*)表达显著上调;细胞衰老(*p16*、*p21*)、纤维化(*Col1*)及肥大化(*Col10*、*MMP13*)表型的转变受到显著抑制,透明软骨表型(*Col2*、*ACAN*)则得到有效恢复(图4I)。
上述结果表明,MSN/SCM@Gel 水凝胶移植通过重塑体内恶性骨关节炎微环境,清除炎症并逆转软骨细胞表型,最终维持了移植干细胞的活性及透明软骨分化趋势,这一作用对促进骨关节炎软骨的干细胞再生修复至关重要。
#MSN/SCM@Gel 水凝胶提升干细胞修复骨关节炎软骨缺损的疗效
基于 MSN/SCM@Gel 水凝胶在体内外均能有效重塑骨关节炎微环境、维持移植干细胞微球活性及透明软骨分化趋势的优良特性,我们进一步评估了该水凝胶移植术后3个月对骨关节炎软骨缺损的修复效果。
关节软骨缺损部位的数码照片(图5A)、显微计算机断层扫描图像(图5B、5C)、番红O-固绿染色切片(图5D)及苏木精-伊红(H&E)染色切片(图5E)结果显示:对照组(未进行任何细胞或基质移植的骨关节炎模型组)缺损周围软骨组织退变严重,表现为缺损范围扩大、边缘侵蚀、炎症细胞浸润、软骨下骨破坏及明显的骨赘增生。
相比之下,Gel 水凝胶组与 MSO@Gel 水凝胶组的软骨退变情况未得到任何改善;MSN@Gel 水凝胶组与 SCM@Gel 水凝胶组虽能部分缓解软骨退变,但无法实现骨关节炎软骨缺损的有效修复。这可能是因为单纯的氢分子递送仅能轻微改善炎症,单纯的干细胞微球移植仅能发挥微弱的旁分泌调控作用,二者均不足以实现骨关节炎软骨表型的逆转与微环境的重塑(图3、图4)。
与之形成鲜明对比的是,MSN/SCM@Gel 水凝胶处理组完全阻断了软骨退变进程(图5G),显著抑制骨赘增生(图5C、5F);缺损部位成功再生出一片形态均一、表面光滑的软骨组织,其结构完整、细胞密度正常、糖胺聚糖(GAG)含量充足,与天然软骨组织高度相似,且与周围宿主软骨实现了完美整合(图5D、5E)。
MSN/SCM@Gel 水凝胶移植后展现出的优异软骨再生效果,应归因于持续释氢与干细胞微球移植的协同作用——二者共同有效重塑了恶性骨关节炎微环境,并促进干细胞微球向透明软骨方向定向分化。此外,国际骨关节炎研究协会评分(OARSI评分,图5H)与曼金评分(Mankin评分,图5I)的结果进一步证实,MSN/SCM@Gel 水凝胶移植既能有效抑制骨关节炎的疾病进展,又能显著促进骨关节软骨缺损的再生修复。
图S27的检测结果显示,MSN/SCM@Gel 水凝胶组新生软骨的弹性模量与周围软骨及正常软骨相近,表明该水凝胶实现了理想的软骨再生。图5D与5E的苏木精-伊红染色及番红O-固绿染色结果进一步证实,MSN/SCM@Gel 处理组的新生软骨与周围软骨组织整合良好。

图5 MSN/SCM@Gel 水凝胶移植术后3个月,高效修复骨关节炎临界尺寸软骨缺损
最后,我们从生物力学角度出发,通过步态分析评估了治疗后3个月大鼠的关节运动功能恢复情况。我们记录并分析了大鼠右后肢的多项典型步态指标,包括步态荧光轨迹图(图6A)、步态模式图(图6B)、相应的支撑时长(图6C)、足印面积(图6D)及足印强度(图6E)。
结果显示,与对照组相比,MSN/SCM@Gel 水凝胶组大鼠的足印面积更大、足印强度更高,步态模式更规律协调;而 Gel 水凝胶组、MSO@Gel 水凝胶组、MSN@Gel 水凝胶组、SCM@Gel 水凝胶组及 MSO/SCM@Gel 水凝胶组的各项步态指标均未得到明显改善。
综上,MSN/SCM@Gel 水凝胶处理可全面改善大鼠的关节运动功能(图6),而这一疗效得益于其对骨关节软骨缺损的高效修复作用。
为探究硅化镁纳米片在体内的代谢情况,我们采用电感耦合等离子体(ICP)技术,实时监测了大鼠主要脏器中的镁、硅元素浓度。图S28的结果显示,镁、硅信号主要分布于治疗关节部位,而在心脏、肝脏、脾脏、肺脏、肾脏及淋巴结等其他脏器中几乎未检出;且大部分镁、硅元素在术后1个月内,从关节缺损部位被逐步清除。这一结果提示,MSN/SCM@Gel 水凝胶移植后,硅化镁纳米片在完成1个月的持续释氢后,其另一降解产物硅酸镁需要更长时间才能从治疗关节部位完全清除。
尽管如此,已知在当前实验浓度下,硅酸镁及其降解产物(镁离子、硅酸根离子)均具有良好的生物相容性与生物安全性。此外,我们在治疗后3个月对各组大鼠进行了生物安全性评估。结果显示,所有治疗方案均未对大鼠的肝肾功能造成损伤(图S29),未影响血常规指标(图S30),也未引起心脏、肝脏、脾脏、肺脏、肾脏等主要脏器的任何组织病理学改变(图S31),证实了该治疗策略具有优异的生物相容性。
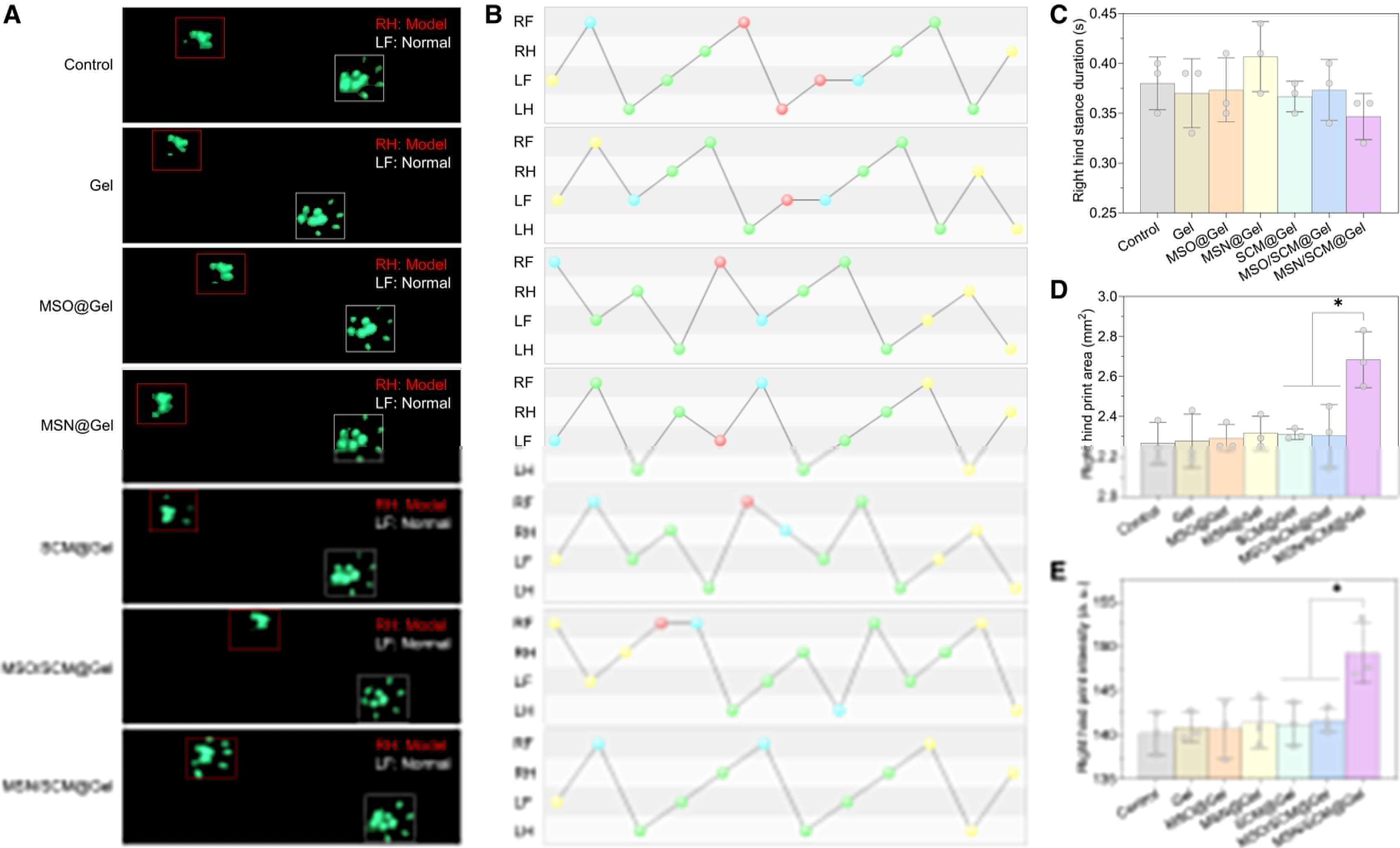
图6 MSN/SCM@Gel水凝胶处理改善骨关节炎临界尺寸软骨缺损大鼠的关节运动功能
讨论
在骨关节炎的慢性炎症微环境中,负责维持软骨稳态的软骨细胞会发生一系列病理改变,具体表现为氧化应激、代谢紊乱(合成代谢减弱、分解代谢激活)以及表型异常。本研究首次证实,氢分子可通过靶向线粒体功能障碍与代谢紊乱,实现骨关节炎软骨细胞表型的逆转。但仅进行MSN@Gel水凝胶移植时,并未取得上述理想的软骨再生效果。这表明,单纯的氢分子递送很难像在体外实验中那样,实现体内骨关节炎微环境的有效重塑,其原因可能在于体内骨关节炎微环境更为复杂且具有更强的“恶性”。
尽管本研究采用的白细胞介素-1β体外诱导法,相较于以往报道的过氧化氢诱导法³⁷³⁸更具优势,但仍无法完全模拟体内真实的骨关节炎微环境。为此,我们进一步采用骨关节炎患者来源的软骨细胞开展实验,以验证上述研究结论。
持续释放的氢分子虽能有效清除骨关节炎的慢性炎症²⁷³⁵³⁹,但在及时修复骨关节炎软骨缺损、阻断或逆转骨关节炎疾病进展方面,似乎难以发挥作用。而在缺乏氢分子供给的情况下,移植的干细胞既无法重塑骨关节炎微环境,反而会因恶性微环境的影响,出现活性丧失,并向肥大化、纤维化及衰老表型转化。
因此,持续氢分子递送与干细胞移植的协同作用尤为关键:氢分子可清除骨关节炎炎症、逆转软骨细胞表型,从而保障移植干细胞的存活,并维持其向透明软骨分化的特性;而移植的干细胞则能加速软骨再生进程,缓解损伤诱导的骨关节炎炎症,二者共同实现骨关节炎微环境的重塑。值得注意的是,MSN/SCM@Gel水凝胶通过协同递送氢分子与干细胞,成功将骨关节炎软骨退变的恶性循环,转变为抗炎与促再生的良性循环。
本研究提出的氢分子辅助干细胞移植策略,可为提升临床细胞移植治疗的疗效提供新思路。未来,仍需借助更先进的动物模型开展进一步评估,并推进相关临床试验,以促进该技术的临床转化。在此过程中,氢分子的最低有效剂量仍有待探索,这一参数将直接决定产氢材料的使用剂量,以及其体内代谢规律与生物安全性。
与其他传统抗氧化剂不同,氢分子具有极高的生物安全性——在低于饱和浓度的条件下,对正常细胞无任何毒性。线粒体中的铁卟啉可作为氢分子的靶向结合位点,因此氢分子能够靶向作用于线粒体,在局部清除活性氧,从而保护线粒体功能。基于这一独特机制,氢分子不仅能清除氧化应激与炎症,还能改善软骨细胞的代谢紊乱与表型异常,而这是传统抗氧化剂无法实现的。
此外,作为自然界中最小的分子,氢分子具有超强的组织穿透能力,能够轻松穿透软骨细胞微球及软骨/骨组织的深层结构,充分发挥其抗氧化与抗炎功效(见图S32),而这是其他常规治疗药物难以企及的¹⁸¹⁹²⁰²⁴²⁵³⁵。因此,氢分子是辅助组织工程修复的理想治疗分子。
由于组织修复与再生通常需要较长周期,实现氢分子的局部持续释放成为一大技术挑战。我们此前采用高能超声剥离法,制备出厚度仅为0.8 nm的硅化镁纳米片,该材料在生理条件下的水解释氢时长仅为7天,仅能匹配烧伤创面的修复时间窗口,无法满足软骨缺损修复的需求。
鉴于超声剥离法所需的瞬时能量较高,本研究创新性地采用剪切力更温和的球磨法,制备出厚度为10~120 nm的硅化镁纳米片,实现了长达28天的持续释氢。这一技术方案为调控金属硅化物的尺寸结构及水解释氢特性,提供了重要参考。
方法
#原代细胞的分离、培养与鉴定
所有动物实验均严格遵循上海交通大学实验动物伦理委员会批准的相关准则开展(批准号:A2023167-002)。选取4周龄雄性斯普拉格-道利(SD)大鼠(购自浙江维通利华实验动物技术有限公司),采用颈椎脱臼法处死。处死的大鼠经体积分数75%乙醇溶液浸泡5分钟,进行体表消毒。
原代软骨细胞分离:分离大鼠后肢股骨两端的软骨帽,剪切成碎片,经磷酸盐缓冲液(PBS)洗涤后,采用Ⅱ型胶原酶(货号17101015,购自Gibco公司,浓度1 mg/mL)消化6小时。收集消化后的细胞悬液,离心后重悬于高糖达尔伯克改良伊格尔培养基(DMEM)完全培养基中,经细胞筛过滤纯化,随后通过形态学观察、甲苯胺蓝染色(货号G3660,购自Solarbio公司),以及Ⅱ型胶原(货号ab34712,购自Abcam公司)、Ⅹ型胶原(货号14-9771-80,购自Invitrogen公司)免疫荧光染色进行细胞鉴定。
骨关节炎患者来源软骨细胞分离:软骨组织取自金华市中心医院膝关节置换术患者,原代软骨细胞的提取方法同上。
脂肪间充质干细胞(ADSCs)分离:分离大鼠腹股沟脂肪组织,经杜氏磷酸盐缓冲液(DPBS)洗涤5次后,采用含0.1%Ⅰ型胶原酶(货号17100017,购自Gibco公司)、1%牛血清白蛋白(BSA)及2 mM氯化钙的DPBS溶液,于37℃条件下间歇振荡消化1小时。剧烈振荡10秒后,将细胞悬液于300 × g条件下离心5分钟,收集沉淀细胞,重悬于DMEM完全培养基中,经细胞筛过滤纯化,随后通过形态学观察,以及CD90(货号ab307736,购自Abcam公司)、CD105(货号67075-1-Ig,购自Proteintech公司)免疫荧光染色进行细胞鉴定。
干细胞微球(SCM)的制备
取第1~3代脂肪间充质干细胞,接种于含1%青霉素-链霉素混合液(货号2321125,购自Gibco公司)及10%胎牛血清(FBS,货号10099141C,购自Gibco公司)的DMEM培养基中,以适宜细胞密度接种于V型96孔板(货号MS-9096VZ,购自Stemgent公司),培养1天,即形成干细胞微球。采用人骨髓间充质干细胞(hBM-MSCs,货号HUM-iCell-s011,购自iCell公司),以相同方法制备干细胞微球。
骨关节炎软骨细胞的体外诱导
为探究不同浓度白细胞介素-1β(货号400-01B-10UG,购自Peprotech公司)对软骨细胞的影响,将原代软骨细胞以5×10⁴个/孔的密度接种于24孔板,采用不同浓度白细胞介素-1β(0~80 ng/mL)处理2天。用无血清培养基洗涤细胞后,采用活性氧检测试剂盒(货号S0035M,购自Beyotime公司)进行染色,在超高分辨率共聚焦激光扫描显微镜(型号Leica STELLARIS 5)下观察成像。本研究最终选取40 ng/mL白细胞介素-1β处理2天的方法,进行骨关节炎软骨细胞的体外诱导。
氢分子孵育对骨关节炎软骨细胞的影响及软骨细胞对干细胞微球分化的调控作用
将第1~3代软骨细胞以2×10⁴个/孔的密度接种于24孔板,分为三组:正常对照组(不进行任何诱导)、骨关节炎组(采用40 ng/mL白细胞介素-1β处理2天)、骨关节炎-氢组(经白细胞介素-1β诱导为骨关节炎软骨细胞后,转移至含60% H₂、14% N₂、21% O₂、5% CO₂的氢分子培养箱(购自谱合生物科技有限公司)中,继续培养3天)。骨关节炎患者来源的软骨细胞无需额外诱导,直接作为病理细胞进行相同的氢分子处理。检测三组细胞的三磷酸腺苷(ATP)水平、活性氧水平、线粒体膜电位、炎症水平,以及透明软骨/纤维化/肥大化表型标志物的表达情况。
为探究软骨细胞对干细胞微球分化的调控作用,将采用0.5%甲基丙烯酰化透明质酸(HAMA)/9.5%甲基丙烯酰化明胶(GelMA)水凝胶及400个/mL干细胞微球制备的SCM@Gel水凝胶,置于Transwell小室中,与上述三组软骨细胞在含10%胎牛血清的培养基中共培养7天。检测三组SCM@Gel水凝胶中细胞的炎症水平及透明软骨/纤维化/肥大化表型标志物的表达情况。
为探究经氢分子预处理/未预处理的骨关节炎患者来源软骨细胞,以及其与人骨髓来源巨噬细胞(hBMDMs)共培养体系对干细胞微球分化的影响,将SCM@Gel水凝胶置于Transwell小室上室,将软骨细胞与巨噬细胞按5:1的比例接种于下室,在含10%胎牛血清的培养基中共培养7天。
转录组测序(RNA-seq)分析
分别收集在普通培养箱(含74% N₂、21% O₂、5% CO₂)和氢分子培养箱(含60% H₂、14% N₂、21% O₂、5% CO₂)中培养3天的骨关节炎软骨细胞,每组设置4个生物学重复,送至北京基因组研究所(BGI)进行转录组测序分析。简要流程如下:完成RNA提取、纯化、文库构建及测序(测序平台:MGISEQ-2000,购自华大基因);将高质量测序读段比对至大鼠参考基因组(版本号GCF_015227675.2_mRatACCORIDNGBN7.2,来源于NCBI);采用华大基因自主研发的Dr.Tom系统(官网:https://biosys.bgi.com)进行基因表达分析、火山图绘制、京都基因与基因组百科全书(KEGG)富集分析、热图绘制及主成分分析;采用Dr.Tom、GraphPad Prism 8及Origin软件进行绘图。
免疫荧光染色
细胞经预冷多聚甲醛(PFA)固定20分钟后,用磷酸盐缓冲液洗涤2次;采用免疫染色通透液(货号P0097,购自Beyotime公司)处理细胞15分钟,以通透细胞膜;室温下采用封闭液(货号P0260,购自Beyotime公司)封闭30分钟;随后加入一抗,4℃孵育过夜;弃去一抗,加入二抗,37℃孵育2小时;最后采用4',6-二脒基-2-苯基吲哚(DAPI,货号C1002,购自Beyotime公司)复染细胞核5分钟,在超高分辨率共聚焦激光扫描显微镜下观察成像。
本实验所用一抗如下:抗CD90抗体(货号ab307736,购自Abcam公司,稀释比例1:500)、抗CD105抗体(货号67075-1-Ig,购自Proteintech公司,稀释比例1:300)、抗Ⅱ型胶原抗体(货号ab34712,购自Abcam公司,稀释比例1:500)、抗Ⅹ型胶原抗体(货号14-9771-82,购自Invitrogen公司,稀释比例1:300)、抗Ⅰ型胶原抗体(货号sc-59772,购自Sant Cruz公司,稀释比例1:200)、抗白细胞介素-1β抗体(货号ab283818,购自Abcam公司,稀释比例1:500)、抗B细胞淋巴瘤因子2(Bcl2)抗体(货号A20777,购自ABclonal公司,稀释比例1:200)、抗白细胞介素-4抗体(货号ab62351,购自Abcam公司,稀释比例1:500)、抗白细胞介素-10抗体(货号ab133575,购自Abcam公司,稀释比例1:500)、抗聚集蛋白聚糖抗体(货号13880-1-AP,购自Proteintech公司,稀释比例1:200)、抗性别决定区Y框蛋白9(Sox9)抗体(货号ab76997,购自Abcam公司,稀释比例1:500)、抗p16抗体(货号PA5-20379,购自Invitrogen公司,稀释比例1:300)。
所用二抗如下:Alexa Fluor 647标记山羊抗小鼠免疫球蛋白G(H&L)(货号ab150115,购自Abcam公司,稀释比例1:300)、Alexa Fluor 488标记山羊抗兔免疫球蛋白G(H&L)(货号ab150081,购自Abcam公司,稀释比例1:500)。
活性氧水平检测
细胞经无血清培养基洗涤后,直接加入活性氧工作液(货号S0033S,购自Beyotime公司),37℃孵育30分钟;采用DAPI复染细胞核15分钟,在超高分辨率共聚焦激光扫描显微镜下观察成像。
对于缺损周围软骨组织分离的线粒体,采用线粒体分离试剂盒(货号ab288084,购自Abcam公司)提取线粒体;将纯化后的线粒体与活性氧工作液混合,37℃避光孵育30分钟;采用多功能酶标仪(型号Varioskan Flash,购自Thermo公司)检测2',7'-二氯荧光素(DCF)的荧光强度(激发波长/发射波长=488 nm/525 nm);以蛋白浓度进行归一化处理,活性氧水平以对照组的百分比表示。
钙离子水平检测
细胞经无血清培养基洗涤后,直接加入罗丹明-2(Rhod-2)染色液(货号S1062S,购自Beyotime公司),37℃孵育15分钟;采用DAPI复染细胞核15分钟,在超高分辨率共聚焦激光扫描显微镜下观察成像。
耗氧率检测
采用耗氧率荧光检测试剂盒(货号E-BC-F068,购自Elabscience公司),按试剂盒说明书操作。简要流程如下:细胞经磷酸盐缓冲液洗涤后,加入工作液,37℃孵育30分钟;依次加入反应探针与封闭液;采用多功能酶标仪检测荧光强度(激发波长405 nm,发射波长675 nm)。
还原型烟酰胺腺嘌呤二核苷酸(NADH)水平检测
细胞经磷酸盐缓冲液洗涤后,加入NADH提取液;将细胞裂解液于4℃、12000 × g条件下离心10分钟,收集上清液作为待测样本;严格按照NADH检测试剂盒(货号S0175,购自Beyotime公司)说明书操作:加入工作液,37℃避光孵育10分钟;加入显色液,37℃避光孵育15分钟;采用酶标仪检测450 nm波长处的吸光度值。
阿尔新蓝染色
SCM@Gel水凝胶经预冷磷酸盐缓冲液洗涤后,包埋于最优切割温度包埋剂(OCT,货号4583,购自Sakura公司)中,立即投入液氮中速冻;采用冷冻切片机(型号CM1950,购自Leica公司)将包埋块切成14 μm厚的切片;将切片置于37℃烘箱中烘烤15分钟;经4%多聚甲醛固定15分钟后,采用阿尔新蓝染色液(货号C0155S,购自Beyotime公司),室温下在湿盒中染色90分钟;经磷酸盐缓冲液洗涤后,梯度乙醇脱水,进行分色处理。
糖胺聚糖(GAG)含量测定
SCM@Gel水凝胶经预冷磷酸盐缓冲液洗涤后,置于液氮中,采用匀浆器充分研磨;将研磨液于2000 × g条件下离心15分钟,收集上清液;采用总糖胺聚糖检测试剂盒(货号ab289842,购自Abcam公司)测定上清液中糖胺聚糖的含量;采用二喹啉甲酸(BCA)蛋白定量试剂盒(货号P0011,购自Beyotime公司)检测上清液中的蛋白浓度;以蛋白浓度进行归一化处理,计算糖胺聚糖的相对含量。
电感耦合等离子体(ICP)检测
将浓度为100 μg/mL的硅化镁纳米片混悬液装入超滤管(截留分子量3 kDa)中,置于无镁离子磷酸盐缓冲液中透析;在不同时间点收集超滤管外的上清液,采用电感耦合等离子体发射光谱仪检测其中硅、镁离子的含量。
收集MSN@Gel水凝胶移植后不同时间点大鼠的主要脏器(淋巴结、关节、心脏、肝脏、脾脏、肺脏、肾脏),称重后冷冻干燥;将干燥后的组织样本进行酸消解处理;采用电感耦合等离子体发射光谱仪(型号NexION2000G,配备NexSAR高效液相色谱系统,购自赛默飞世尔科技公司)检测消解液中硅、镁离子的含量。
三磷酸腺苷水平检测
采用三磷酸腺苷检测试剂盒(货号S0027,购自Beyotime公司),按试剂盒说明书操作。简要流程如下:裂解软骨细胞3分钟;将细胞裂解液于4℃、16000 × g条件下离心5分钟,收集上清液;向黑色96孔板中依次加入50 μL上清液与100 μL三磷酸腺苷工作液;采用多功能酶标仪检测荧光强度;根据标准曲线计算三磷酸腺苷的浓度,并以蛋白浓度进行归一化处理。
对于软骨组织样本,采用线粒体分离试剂盒提取缺损周围软骨组织的线粒体,再采用上述方法检测线粒体中的三磷酸腺苷水平。
线粒体膜电位检测
采用5,5',6,6'-四氯-1,1',3,3'-四乙基咪唑碳菁碘化物(JC - 1)检测试剂盒(货号C2003S,碧云天生物技术有限公司),按标准流程开展线粒体膜电位检测。将软骨细胞置于JC - 1工作液中,37℃孵育20分钟,随后在超高分辨率共聚焦激光扫描显微镜(徕卡STELLARIS 5型)下观察成像。观察JC - 1单体时,激发波长与发射波长分别设为488nm和520-550nm;观察JC - 1聚集体时,激发波长与发射波长分别设为535nm和560-590nm。
检测缺损周围软骨组织分离所得线粒体的膜电位时,取总蛋白含量为50μg的线粒体0.1mL,与0.9mL JC - 1染色工作液混合,37℃孵育10分钟,之后采用多功能酶标仪(赛默飞世尔科技Varioskan Flash型)检测。其中JC - 1单体的激发/发射波长设为490/530nm,JC - 1聚集体的激发/发射波长设为525/590nm。
末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(TUNEL)染色
细胞凋亡检测流程如下:用预冷的多聚甲醛固定细胞30分钟,随后用磷酸盐缓冲液洗涤;用免疫染色通透液(货号P0097,碧云天生物技术有限公司)处理细胞15分钟以通透细胞膜;使用TUNEL染色试剂盒(货号C1088,碧云天生物技术有限公司),37℃避光染色1小时,荧光素标记的脱氧尿苷三磷酸(dUTP - FITC)会对凋亡细胞进行染色;最后用4',6 - 二脒基 - 2 - 苯基吲哚(DAPI)复染细胞核5分钟,在超高分辨率共聚焦激光扫描显微镜(徕卡STELLARIS 5型)下观察成像。
活/死细胞染色检测
将细胞用磷酸盐缓冲液洗涤2次后,加入活/死细胞染色试剂盒工作液(货号L32250,英潍捷基公司),37℃孵育30分钟;再用DAPI复染细胞核15分钟,在超高分辨率共聚焦激光扫描显微镜(徕卡STELLARIS 5型)下观察成像。
β - 半乳糖苷酶染色
细胞衰老检测步骤为:先用汉克平衡盐溶液(货号C0218,碧云天生物技术有限公司)洗涤细胞;用衰老相关β - 半乳糖苷酶染色试剂盒(货号C0602,碧云天生物技术有限公司)中的专用固定液固定细胞15分钟;加入工作液,37℃避光孵育过夜(用封口膜密封);弃去工作液并洗涤后,在光学显微镜(奥林巴斯CKX53型)下观察细胞染色情况。
硅化镁纳米片(MSN)的制备与表征
在惰性气体保护下,以乙醇为分散剂,采用湿法研磨法合成硅化镁纳米片。将100mg硅化镁原料粉末(货号M485339,阿拉丁试剂有限公司)加入40mL乙醇中,剧烈搅拌使其分散均匀,随后转移至研磨仪(MITR GMS1 - 4型)中。研磨24小时后,用乙醇洗涤颗粒3次。通过设置0-400×g、400-1500×g、1500-3500×g、3500-6000×g、6000-14000×g这5种不同离心转速,收集到不同粒径的硅化镁纳米片,依次命名为M5、M4、M3、M2、M1。
对照组所用的降解产物硅酸镁(MSO)制备方法如下:将5.2μM氯化镁、5.2μM氢氧化钠与2.6μM硅酸钠混合反应1小时,离心后收集产物。将硅化镁纳米片水凝胶(MSN@Gel)置于含10%胎牛血清的培养基中培养,每3天更换一次培养基,在特定时间点收集水凝胶降解样本。
采用扫描电子显微镜(蔡司Gemini 300型)、原子力显微镜(牛津仪器MFP - 3D型)对合成的硅化镁纳米片进行形貌观察、元素分布分析及晶体结构表征。扫描参数设定为体素大小12μm、射线源电压85kV、电流200μA、积分时间384毫秒、铝制1mm扫描滤光片。使用NRecon软件(1.7.4.2版本)进行图像重建,借助CTvox软件(1.20.3.0版本),通过灰度原始图像的距离变换法,由轮廓化二维图像生成三维图像。利用CT分析仪(1.20.3.0版本)和DateViewer软件(1.5.6.2版本)开展三维与二维图像分析。
组织学染色
1. 关节组织染色:将关节组织置于预冷的中性多聚甲醛缓冲液中固定72小时,随后用乙二胺四乙酸(EDTA)脱钙液(货号G1055,Servicebio公司)脱钙20天;梯度脱水后,将关节组织包埋于石蜡中,切成6μm厚的切片;采用苏木精 - 伊红染色试剂盒(货号G1076,Servicebio公司)、番红O - 固绿染色试剂盒(货号G1053,Servicebio公司)进行组织学染色。
2. 主要脏器染色:将心脏、肺脏、肝脏、肾脏、脾脏等脏器组织置于预冷的多聚甲醛缓冲液中固定72小时,包埋于石蜡后切成6μm厚的切片;采用苏木精 - 伊红染色试剂盒(货号G1076,Servicebio公司)染色,观察组织形态变化。
实时荧光定量聚合酶链式反应(qPCR)
将提取的软骨组织匀浆后,用Trizol试剂(货号9109,宝生物工程有限公司)提取并纯化RNA;通过纳米微量分光光度计(Nanodrop 2000型)检测260nm波长处的吸光度,确定RNA浓度。使用PrimeScript逆转录试剂盒(货号RR037A,宝生物工程有限公司)将RNA逆转录为互补DNA(cDNA);采用Quantitect SYBR Green聚合酶链式反应预混液(货号RR420A,宝生物工程有限公司),在PCR扩增仪(Biometra型)上进行实时荧光定量聚合酶链式反应。采用2^(-ΔΔCt)法计算目的基因表达量,以甘油醛 - 3 - 磷酸脱氢酶(GAPDH)基因为内参,结果以目的基因与内参基因的表达量比值表示。本实验所用引物序列详见表S1。
步态分析
借助全自动动物步态分析系统(Noldus Catwalk XT型)采集并分析大鼠自主行走时的足印数据。先对大鼠进行3天适应性训练:每天将大鼠置于玻璃通道中,使其自由从左侧走向右侧,训练时长10分钟。正式检测时,将大鼠单独放入通道,使其自由行走,系统自动记录足印并分析。通过Catwalk XT 10.6软件分析支撑时长、足印面积(爪子与玻璃接触的平均面积)及足印强度(爪子与玻璃接触的平均压力)等指标。
血液毒性及肝肾功能检测
采用异氟醚麻醉大鼠后,从眼眶静脉采血0.2mL,利用血细胞分析仪(迈瑞BC - 30VET型)检测血常规指标。另取全血,在4℃、1500×g条件下离心10分钟,分离血清;使用生化分析仪(罗氏Cobas c 311型)检测血清,评估肝肾功能相关指标。
统计学分析
采用GraphPad Prism 8软件与Origin 2021软件进行统计学分析。所有实验数据均以“平均值±标准差”表示。多组间比较采用单因素方差分析,两组间比较采用双尾学生t检验。以p<0.05为差异具有统计学意义,其中*p<0.05、p<0.01、*p<0.001、p<0.0001。文中图1A、图1K、图2H、图3A、图4A及示意图1均通过BioRender.com绘制。
https://blog.sciencenet.cn/blog-41174-1517584.html
上一篇:开放科学运动真的如支持者所言那般有益吗?
下一篇:斯坦福人工智能通过一晚睡眠预测疾病风险