博文
更精准的新一代核医疗技术《科学》
|
更精准的新一代放疗

田纳西州橡树岭国家实验室7920号楼:从冷战遗迹到抗癌同位素“农场”
田纳西州橡树岭国家实验室的7920号楼,是一座外立面刷成白色的冷战时期仓库,它既是过去的遗迹,也是未来的灯塔。这座建筑建于1966年,其诞生源于物理学家格伦·西博格的构想——他曾在曼哈顿计划期间助力发现钚元素,而当时的目标是合成比钚更重的元素。如今,7920号楼却成了一处特殊的“农场”:这里存放着一小批被实验室物理学家称为钍“奶牛”的装置,它们是装满淡黄色胶状物的超大号试管,其中含有放射性同位素钍-229。技术人员在含铅玻璃和一米厚混凝土墙的防护下,操控机械臂从这些试管中“挤奶”——提取微量到几乎不可见的物质,即钍的主要衰变产物之一:锕-225。这种稀有的放射性同位素处于癌症治疗的前沿领域,其需求如此旺盛,以至于近期的短缺曾导致一项前景良好的临床试验陷入停滞。
锕-225的“紧缺潮”,正是放射性药物重新引发广泛关注的信号之一。放射性药物是一类特殊药物,它们将具有细胞杀伤作用的放射性物质,与能将同位素递送至癌细胞的分子“导航剂”结合。相比许多传统化疗药物(这类药物的杀伤作用会作用于全身所有快速分裂的细胞),此类疗法产生的副作用可能更少。目前,数百项针对靶向放射性同位素的临床试验正在推进,标志着这个曾一度沉寂的领域迎来了重大发展加速期。
放射性药物的概念已有数十年历史,但药物三大核心组件的技术改进,正为该领域的爆发式增长注入动力。多年来,肿瘤学家仅能利用少数几种放射性同位素,而如今研究人员正在探索新型同位素——包括锕-225在内,这些同位素能在不同时间段释放不同类型的辐射。另一部分研究聚焦于药物的第二个组件:研发新型抗体、肽类和小分子物质,以更精准地引导放射性同位素到达特定类型的肿瘤。药物的第三个组件是连接同位素与靶向分子的化学连接剂,这类物质过去常被视为“功能性部件”,如今也迎来了重新设计:通过优化连接剂,可控制放射性同位素在体内的代谢过程,最终实现副作用最小化的目标。
通过对这三大组件进行组合与搭配,研究人员正打造一系列新型放射性药物,这些药物经过定制,可针对从白血病等弥漫性血液癌症,到乳腺癌、结肠癌等大型实体肿瘤在内的多种恶性肿瘤。哈佛大学达纳-法伯癌症研究所核医学临床主任希瑟·雅森表示:“对于核医学领域而言,当下是一个极具振奋性的时代。”
这个领域同样让投资者感到兴奋,他们正不断投入资金用于研发。诺华公司的两款药物—— Lutathera(镥氧奥曲肽)和 Pluvicto(镥-177标记的前列腺特异性膜抗原靶向药物),是吸引投资的重要推动力。这两款药物分别将放射性同位素镥-177靶向递送至胃肠道肿瘤细胞和前列腺癌细胞,在临床试验中取得显著成功后,去年的合并销售额近20亿美元。数十家初创公司和大型制药企业纷纷入局,希望打造出下一款放射性药物“重磅产品”。致力于研发多种癌症放射性药物的生物技术公司Telix Pharmaceuticals首席医疗官大卫·凯德表示:“这个领域现在热度极高。”
哈佛大学医生索尔·赫兹是首位尝试将放射性同位素靶向递送至特定组织的研究者。1941年,他给一位格雷夫斯病患者喝下一杯含有放射性碘-131的水。格雷夫斯病由甲状腺功能亢进引起,可能导致中风。甲状腺细胞会从血液中筛选碘元素以合成必需的激素,因此赫兹推断,放射性碘可能会在甲状腺细胞中积聚,选择性地杀死部分细胞并恢复甲状腺的正常功能。盖革计数器记录到患者颈部的放射性水平上升,这表明碘-131成功找到了目标。此后,赫兹继续为甲状腺功能亢进患者使用这种同位素,他的早期实验显示,治疗成功率约为80%。
如今,碘-131放射性药物已成为治疗格雷夫斯病和各类甲状腺癌的首选药物,其他同位素也成为治疗某些类型前列腺癌和多种骨髓癌的常用疗法。21世纪初,美国监管机构批准了两款将放射性同位素与靶向血液癌细胞的抗体结合的药物,它们成为如今新一代更精准放射性药物的“前身”。但长期以来,新型放射性药物的研发进展一直远远落后于传统化疗药物。阿拉巴马大学伯明翰医学院放射科医生乔纳森·麦康纳西表示:“在很长一段时间里,这个领域几乎毫无进展。”
这在很大程度上是因为放射性同位素的研究与应用极具挑战性。临床中偏好使用的同位素,半衰期通常只有几天到几周——这样的设计是为了减少它们在体内代谢时对健康组织的损伤,但这也意味着其杀伤癌细胞的能力会迅速减弱,因此放射性药物无法像传统药物那样进行库存储备。例如,在橡树岭国家实验室生产的同位素,必须装入带铅衬里的容器中,紧急运往制药公司的实验室;在实验室里,化学家将同位素与靶向分子结合,制成特定的放射治疗药物;随后,药物被送往医院,并迅速用于等待治疗的患者。而在整个流程的每一步,都需要经过专业培训的工作人员、护士和医生,以及专用设备来确保安全操作。

布克海文国家实验室的“热室”:抗癌同位素生产的核心设施
像布克海文国家实验室这类“热室”(高放射性物质操作屏蔽室),主要用于生产锕-225及其他可用于抗癌药物的放射性同位素。(图片来源:杰西卡·罗特凯维奇/布克海文国家实验室)
数十年来,这些技术挑战一直制约着该领域的发展。但这一局面在2017年迎来转折——欧洲药品管理局(EMA)批准将Lutathera(镥氧奥曲肽)用于治疗一种罕见且难治的肠道肿瘤。从化学构成来看,这种药物名为177Lu-DOTATATE(镥-177标记的生长抑素类似物):其分子结构中,镥-177原子被包裹在DOTA(1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸)这一“分子手套”中,再通过TATE(奥曲肽)这一肽类物质,靶向结合神经内分泌肿瘤(一种胃肠道肿瘤)表面的生长抑素受体。镥-177衰变时释放的高能粒子能够杀死癌细胞并缩小肿瘤。2018年,美国食品药品监督管理局(FDA)也批准了该药物的使用;去年,FDA更是将Lutathera列为首款获批用于治疗儿童神经内分泌肿瘤的药物。最新临床试验显示,该药物可使成年患者的无肿瘤进展中位生存期延长23个月。
另一款靶向镥-177的药物Pluvicto(镥-177标记的前列腺特异性膜抗原靶向药物),于2022年获FDA批准用于治疗转移性前列腺癌。在最新临床试验中,它将患者的无肿瘤进展中位生存期翻倍,达到12个月。
凯德表示,这些药物在临床与商业上的双重成功,为整个领域敲响了“警钟”:“正是这些成果让所有人恍然大悟,意识到这个领域蕴藏着巨大潜力。”
这种潜力的释放,促使制药企业在2024年掀起了总值达90亿美元的并购浪潮,目的是抢占先机,争取研发出下一款“重磅药物”。对部分企业而言,放射性药物操作难度大这一特点反而增加了其吸引力——因为这会延缓竞争对手研发类似仿制药的速度。此外,许多企业希望借助一系列创新成果实现突破。
Lutathera和Pluvicto中使用的镥-177会释放β粒子(高能电子与正电子),通过损伤癌细胞的DNA来发挥杀伤作用。但近期,研究焦点逐渐转向了威力更强的放射性同位素——α粒子发射体,这类同位素会释放由两个质子和两个中子构成的α粒子。β粒子的作用范围可达数毫米,而α粒子会将所有能量集中在仅覆盖几个细胞的极小区域内。这种高度集中的“冲击力”能直接将DNA双螺旋链彻底切断,而非像β粒子那样通常仅破坏单链,从而大幅降低DNA修复酶修复损伤的可能性。加州大学旧金山分校的放射肿瘤学家托马斯·霍普形象地比喻:“α粒子发射体就像重型卡车,威力十足。”目前正在进行的临床试验,将进一步明确α粒子发射体的强大杀伤力究竟会增加危险副作用,还是会因辐射高度集中而减少副作用。
目前已有一款α粒子发射体放射性药物在美国获批——2013年获批的镭-223类药物。由于镭-223在化学性质上与钙相似,因此会被转移性前列腺癌细胞侵袭的骨骼主动吸收,但它同时也可能损伤健康的骨髓细胞。而以锕-225等新一代α粒子发射体为核心研发的药物,在靶向精准度上进行了优化。这类药物大多仍处于临床前研究或早期患者安全性试验阶段,但有一款已取得阶段性进展:由圣地亚哥放射性药物初创企业RayzeBio(近期被百时美施贵宝收购)研发的实验性药物RYZ101。
霍普正针对Lutathera治疗无效的肠道肿瘤患者开展RYZ101的临床试验。该药物与Lutathera采用相同的DOTATATE靶向复合物,但将其与锕-225结合。霍普表示,在早期安全性研究中,曾接受过Lutathera治疗的患者对RYZ101耐受性良好,且锕-225释放的α粒子具有更强的“杀伤力”,可能对癌细胞产生更显著的杀伤效果。目前,霍普正牵头负责该药物在美国的大规模多中心疗效试验受试者招募工作,他透露试验结果将于明年公布,若结果理想,后续将很快提交FDA审批申请。“这个领域充满了乐观预期与巨大潜力。”
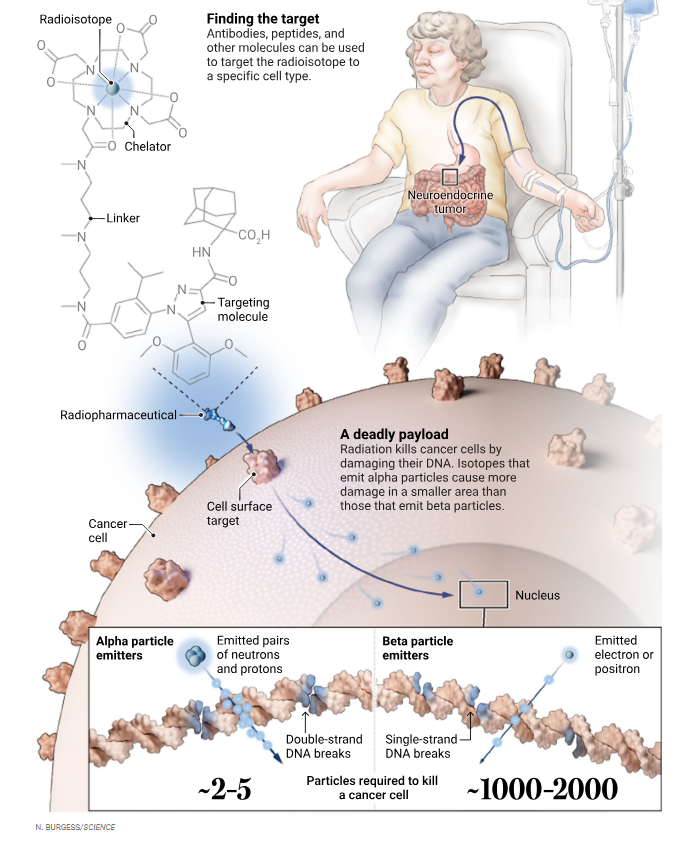
一场“核”击:新一代靶向放射性同位素抗癌药物的研发与挑战
研究人员正研发新一代抗癌药物,这类药物可将放射性同位素递送至特定类型的癌细胞。名为“螯合剂”的化学基团负责“承载”同位素,连接分子则将这一复合物与靶向分子相连——这些靶向分子经设计可与癌细胞表面的蛋白质结合。
(图片来源:N. 伯吉斯/《科学》杂志)
根据医疗放射性同位素分析机构MEDraysintell的分析师理查德·齐默尔曼在2024年《核医学杂志》上发表的综述,目前还有26种基于锕-225的放射性药物处于研发阶段,其中13种已进入临床试验。齐默尔曼认为,到2030年,这些化合物中约有12种可能获得美国食品药品监督管理局(FDA)批准。若这一预测成真,他估计到2032年,全球将有50万名癌症患者(约占患者总数的1%)接受基于锕-225的放射性药物治疗。
然而,需求的增长可能会加剧供应短缺的问题。橡树岭国家实验室的钍“奶牛”目前是全球最大的锕-225来源,初创公司泰拉能源同位素公司(TerraPower Isotopes)正复制这一生产流程以增加供应。但即便如此,每年“挤奶”产出的锕-225总量还不足一粒沙子的重量,仅够治疗数百名患者。橡树岭国家实验室放射性同位素项目负责人罗伊·科平表示:“我们需要填补的缺口还很大。”且供应短缺并非仅限于锕-225——随着其他实验性同位素的研发推进,短缺问题正不断蔓延,尽管各国国家实验室和企业都在竞相满足需求(见下文侧边栏)。


橡树岭国家实验室的技术人员在如下这类“热室”(高放射性物质操作屏蔽室)中操控机械臂,提取锕-225及其他对癌症治疗至关重要的放射性同位素。(上图)美国能源部、橡树岭国家实验室(版权协议:CC BY-NC-ND);(下图)贾森·理查兹/美国能源部、橡树岭国家实验室(版权协议:CC BY-NC-ND)
这些新型同位素还具备其他优势,例如半衰期比锕-225的10天更短。锕-225的半衰期对于放射治疗同位素而言过长,会增加其损伤健康细胞的风险,进而引发副作用,这可能限制其在年轻患者或身体状况较好患者中的使用。此外,锕-225衰变时还会产生多种具有潜在毒性的放射性子体化合物。
半衰期更短的α粒子发射体有望降低这些风险,例如半衰期为7小时的铅-212和半衰期为10小时的砹-211——这两种同位素都有可能在医院或附近实验室中生产。制药企业正争相对其进行测试:RadioMedix公司与Orano Med公司近期合作开展的2期临床试验显示,他们研发的靶向神经内分泌肿瘤生长抑素受体的铅-212化合物,在54%的患者中产生了可测量的积极疗效;去年,RadioMedix公司还获得了FDA授予的“突破性疗法认定”——这是针对潜在救命药物的快速审查通道。霍普表示:“α粒子发射体无疑具有巨大潜力,但我无法预测两年半后,哪种放射性核素会成为最受关注的焦点。”
寻找精准靶向剂的竞争也日益激烈,Telix公司便是该领域的领军者之一。其研发的单克隆抗体以前列腺特异性膜抗原(PSMA)为靶点——这种蛋白质在癌细胞中表达量升高,也是Pluvicto药物递送镥-177时的作用靶点。但“前列腺特异性膜抗原”这一名称存在误导性:PSMA也存在于前列腺及身体其他部位的健康细胞中,这使得这些细胞可能受到同位素的间接损伤。为此,Telix公司的科学家对该抗体进行了修饰:修饰后的抗体仍能靶向前列腺癌细胞上的PSMA,但不会与白细胞和肾脏细胞结合——肾脏细胞因需过滤血液,对放射性药物尤其敏感。该公司的临床试验表明,修饰后的抗体不仅能避开非目标细胞,还能通过肝脏和胃肠道以快50%的速度排出体外,而这一排泄途径受辐射损伤的风险更低。针对前列腺癌的3期临床试验预计将于2027年完成。
其他企业也在探索更精准靶向前列腺癌细胞的方法。Philochem AG公司的研究人员近期利用DNA条形码技术,对包含580万个潜在小分子药物的文库进行筛选,以找出能将镥-177递送至前列腺酸性磷酸酶(ACP3)的最佳分子。前列腺酸性磷酸酶是一种在前列腺癌细胞中大量存在,但在健康器官中几乎不存在的酶。该公司去年在《核医学杂志》上发表的研究显示,其中三种与镥-177结合的化合物,在缩小小鼠肿瘤方面效果显著。
针对其他多种器官癌症的靶向剂也在研发中。雅森表示:“新靶点的开发速度非常快。”据奥本海默公司的放射性药物行业分析师杰夫·琼斯整理的最新数据,企业目前正为近36个不同靶点验证和研发放射性药物,其中超过12种靶向化合物已进入1期人体安全性试验阶段。
精准命中靶点
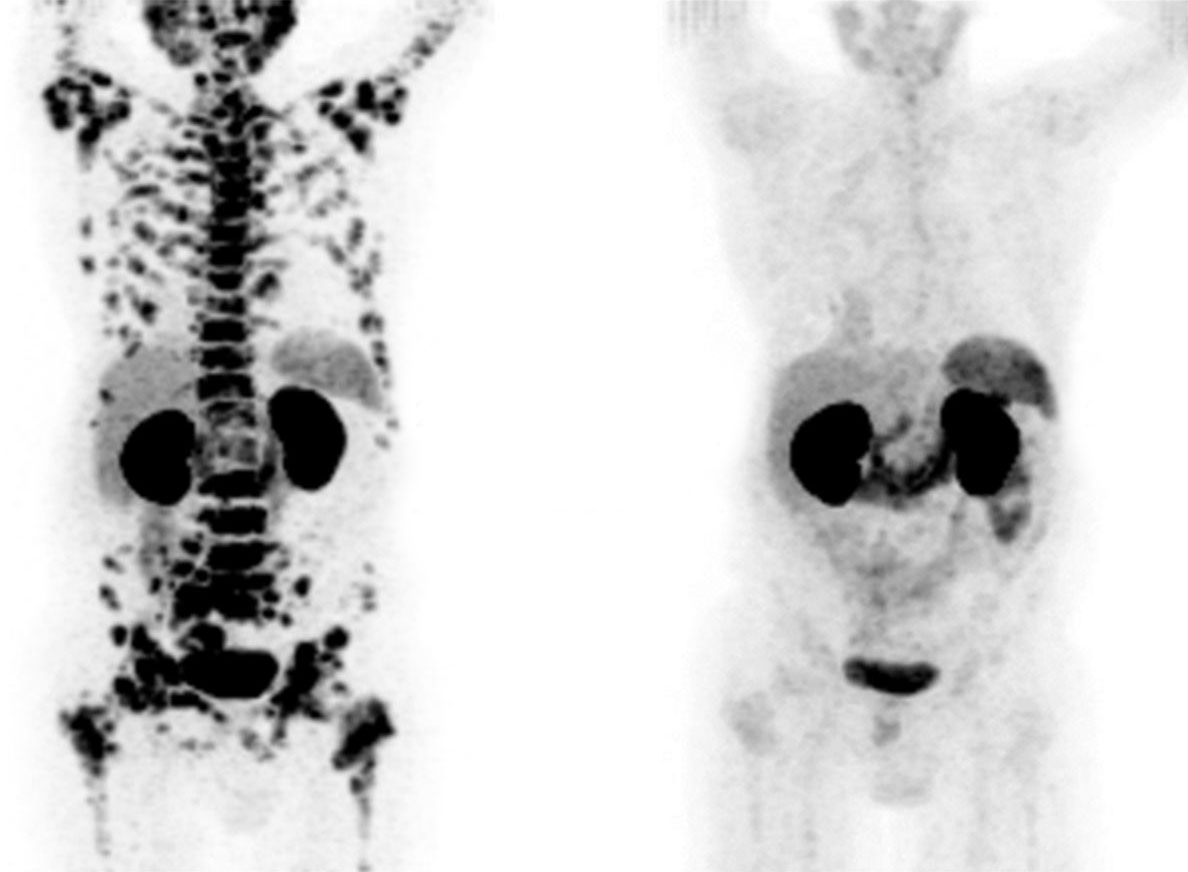
一名前列腺癌患者的正电子发射断层扫描(PET)图像显示,癌细胞已扩散至全身(左图);在使用靶向前列腺癌细胞表面蛋白质的放射性同位素治疗后,癌细胞明显消退(右图)。
(图片来源:C. 克拉托奇维尔等,《核医学杂志》,57:1941,2016年)
当精准靶向剂与镓-68、锆-89等损伤性较低的放射性同位素结合时,还能帮助医生实现癌症可视化——这些同位素在正电子发射断层扫描中会发出“信号”。斯坦福大学放射科医生海伦·纳德尔表示,这类图像可追踪治疗进展,让肿瘤学家能够调整治疗方案:“现在我能‘看见’癌症,就能针对性地治疗它。”
放射性同位素研发人员还可通过第三种方式改进药物:调整将靶向化合物与放射性同位素结合的分子连接器,直至药物能在肿瘤中“定植”。这一步的目标通常是加速药物从体内排出,以减少副作用。例如,京都大学的研究人员率先开发出一种短肽,可将靶向剂与用于“承载”放射性同位素的金属结合化合物(即螯合剂)相连。这种连接肽经设计后,会被某些肾脏细胞中的蛋白切割酶识别并降解——这些酶能释放同位素,防止其在肾脏中滞留。动物研究表明,该策略可使肾脏受到的辐射暴露降低高达75%。
另一家企业福森制药公司(Fusion Pharmaceuticals)则研发了一种特殊连接器:当靶向药物未与癌细胞结合时,这种连接器会被正常细胞的“清理机制”快速降解。该公司数据显示,这种连接器不会影响癌细胞对药物的摄取,但能使辐射的排泄速率提高3倍。这种方法可能适用于多种癌症,目前已有多款使用该连接器的靶向放射性药物进入早期临床试验阶段。布克海文国家实验室同位素研究与生产负责人凯西·卡特勒表示:“新的(连接器)技术层出不穷,令人惊叹。借助这些技术,我们能……提高药物的摄取效率和清除速度,这一点至关重要。”
新一代放射性药物未必需要单独使用,它们还可与传统化疗和免疫疗法协同作用。例如,Telix公司正在开展一项3期临床试验,将其靶向PSMA的镥-177抗体药物与抑制雄激素(雄激素会促进前列腺癌细胞增殖)的传统药物联合使用。
另有研究将放射性药物与阻断DNA修复酶的药物联用,以防止肿瘤细胞修复辐射造成的损伤并存活。近期已有四项针对乳腺癌及其他肿瘤的早期临床试验启动,用于测试这种联合疗法。雅森指出:“过去,放射性药物常被视为单一疗法,但联合疗法的潜力非常大——因为并非所有患者都能对放射性药物或其他化合物产生良好反应。”
鉴于新型放射性药物的激增以及潜在联合疗法的多样性,霍普认为,未来几年内,临床医生可能会面临数量庞大的新型肿瘤治疗药物选择。他说:“我甚至无法想象,我们该如何判断对哪些患者优先使用哪种药物。”但对患者和医生而言,这无疑是一个“幸福的烦恼”。

离子创新
努萨诺公司(Nusano)的离子源通过磁场约束离子,并剥离其剩余电子,使电场能够将离子加速至高能状态。(图片来源:努萨诺公司,经C. 比克尔/《科学》杂志改编)
为新一代抗癌药物提供动力的放射性同位素,其短暂的“生命周期”往往始于老旧的核反应堆。但初创企业努萨诺公司正打造一种更灵活的新型同位素来源。今年秋季,工程师将启动一台可产生6万伏电压的设备,使氦原子和氘原子云电离,随后将这些离子射向尺寸不超过邮票的金属箔片——这一过程可将金属原子转化为多达40种不同的放射性同位素。
努萨诺公司是多家采用新技术以满足医疗放射性同位素激增需求的企业之一。近期的科学进展催生了新一代靶向药物(这类药物可将放射性同位素递送至特定类型的癌细胞,详见上文主要报道),而早期临床试验的成功也引发了医生和患者对该领域的广泛关注。
然而,一些最具潜力的放射性同位素目前供应短缺,且它们较短的半衰期意味着无法进行库存储备。努萨诺公司联合创始人霍华德·莱文打了个比方:“我们卖的就像冰块——有些融化得很快,只够保存几小时;有些则慢一些。”在这短暂的时间里,同位素必须与靶向化合物进行化学结合、运送到医疗中心,再注射到患者体内。莱文表示:“这是一条极具挑战性的供应链。”
现有同位素来源存在诸多局限:生产大部分同位素的大型政府核研究反应堆已使用数十年,不仅老旧,还时常需要长时间停机维护;此外,这些反应堆的使用日程通常被研究人员排满,无法根据市场需求快速调整所生产的同位素种类。部分研究型医院配备了名为“回旋加速器”的紧凑型环形加速器,但这类设备的产量较低,且无法生产一些需求量极大的同位素。
努萨诺公司的设备是一台直线加速器,安装在犹他州盐湖城附近(便于向全美快速运输),设计目标是大量生产数十种放射性同位素。该设备的核心是一种新型离子源,可产生大量双电离氦原子——这些原子能被加速至高能状态。其关键创新在于使用超导磁体,对初始产生的离子进行短暂约束,直至这些离子与更多电子碰撞,最终产生数量空前的双电荷离子。随后,振荡电场将这些离子加速至光速的1/6,磁体则将它们引导至12个独立工作站——在这些工作站中,离子撞击不同的靶材,从而生成不同的同位素。莱文形容这一过程:“就像炼金术。”
莱文表示,该设施应能快速切换所生产的同位素种类。澳大利亚放射性药物企业Telix的首席医疗官大卫·凯德评价:“这将为该领域提供极大的灵活性。”莱文特别指出,该设施应能帮助缓解锕-225等同位素的短缺问题——这类同位素属于α粒子发射体,是许多新型放射性药物的核心成分。与旧药物中使用的β粒子发射体相比,这些同位素能在更集中的区域释放更多能量。
努萨诺公司也面临竞争对手:在威斯康星州贝洛伊特市,北极星医疗放射性同位素公司(NorthStar Medical Radioisotopes)正在完成其专属直线加速器的建造,该设备将专门用于生产锕-225,计划于今年晚些时候开始供货;另一家企业泰拉能源同位素公司(比尔·盖茨投资的核能公司旗下分支)则从橡树岭国家实验室20世纪60年代核反应堆实验遗留的钍-229及其他材料库存中提取锕-225——钍-225会通过放射性衰变自然产生锕-225。
闪耀科技公司(SHINE Technologies)则开创了一种完全不同的方法,基于全球首个商用核聚变技术:小型加速器使原子核相互碰撞引发核聚变,产生大量中子——这些中子可将核反应堆的乏燃料转化为用于医学成像和治疗的同位素。
奥本海默公司的放射性药物分析师杰夫·琼斯表示,尽管目前判断哪些企业会成为最终赢家还为时过早,但对新型同位素来源的需求已毋庸置疑:“对于未来的医疗治疗而言,这将是一项关键的赋能技术。”
https://blog.sciencenet.cn/blog-41174-1504822.html
上一篇:纳米气泡热酸稳定性研究
下一篇:富氢水对职业足球运动员延迟性肌肉酸痛的影响