博文
通过在真菌中植入细菌来诱导新的内共生【全文】  精选
精选
|
通过在真菌中植入细菌来诱导新的内共生
点评:我认为这是一种新研究范式。首先是好玩,经过最新的流体力显微镜技术,将细菌注射到真菌细胞内。然后对这种好玩的注射共生体进行观察,观察其生长过程。最后根据共生体相互影响的情况对共生过程的分子基础进行研究。这背后的细节不可能很快弄明白,但这一技术给研究细胞共生提供了可能性。随后会有一波跟踪研究出现,也能验证这种方法的可行性和研究结果的可靠性。这一技术也给更多细胞操作提供了极大方便。细胞注射技术早就获得很多应用。最经典的细胞核移植和膜片钳技术,这些技术取得的成绩都已经获得过诺贝尔奖。对比现在的细菌水平的细胞注射技术,过去的注射简直就是极端粗糙。流体力显微镜注射这一精细技术将有可能完全颠覆既往细胞注射方法。给细胞注射领域带来动力。当然也许在大型细胞上的操作,粗糙方法更合理,至少更便宜。

内共生对生命的进化产生了深远的影响,并继续塑造着许多物种的生态学。它们产生了促进创新和多样化的生化能力的新组合1,2.尽管生命之树上有许多已知的内共生的例子,但它们的重新出现是罕见的,而且回想起来很难发现3、4、5.在这里,我们将细菌植入丝状真菌 Rhizopus microsporus 中,以遵循人工诱导的内共生的命运。虽然植入胞质溶胶中的大肠杆菌诱导了隔膜形成,有效地阻止了内共生,但根霉菌以低频率垂直传播给后代。内共生的连续正选择在适应性进化时将初始适应度限制减轻了几个数量级。随着系统稳定,宿主中突变的积累强调了表型变化。该细菌在其新宿主中产生根瘤菌素同系物,证明代谢功能通过诱导内共生转移。因此,单细胞植入为研究内共生发生开始时的关键事件提供了一种强大的实验方法,并为设计具有所需性状的内共生的合成方法提供了机会。
主要
细胞内共生是生物体之间非常亲密的相互作用。它们以分隔的方式连接两个复杂的代谢网络,并作为一个单元受到自然选择。这种代谢整合使内共生倾向于实现进化中的重大转变1,2.容纳内共生体可以通过获得化学防御系统和解锁必需的营养物质或新的能源来使宿主受益2,6,7,8.然而,许多障碍限制了从头内共生3、4、5.除了宿主细胞进入的第一个障碍外,潜在的内共生体还必须克服与免疫反应、新陈代谢和生长同步相关的挑战3、9、10.即使理论上联合代谢维持稳定生长11,不稳定无法稳定垂直传播的结果是普遍的常态。.
研究已建立的自然伙伴关系为了解现存内共生的复杂相互作用提供了见解。这些包括作为古代细菌内共生体残余物的线粒体和叶绿体,以及长期垂直传播并经历基因组缩减的昆虫内共生体13.然而,伙伴之间不断变化的控制平衡、稳定和不稳定的阶段以及共生和对抗之间的模棱两可的界限模糊了进化轨迹13、14、15、16 .因此,内共生发生的最早步骤仍然难以揭示15.综合方法可以提供明确的起点来跟踪稳定和不稳定的结果。干预性研究主要集中在昆虫上,其中转染揭示了内共生发生的重要方面,例如控制细菌复制17,18 和代谢合作19,20 .然而,在其他门中的尝试,例如在酵母中安装工程大肠杆菌或蓝细菌21,22 ,在严格选择下未产生稳定的内共生。
在这里,我们着手在非宿主丝状真菌中产生一种新的内共生伙伴关系。模型系统由早期发散真菌 Rhizopus microsporus 和胞质细菌内共生体 Mycetohabitans rhizoxinica 组成23,24 .R. microsporus 的某些宿主菌株含有 Mycetohabitans 内共生体25.在这些中,垂直遗传是严格的,因为没有内共生体,真菌就无法孢子形成,内共生体可靠地定植孢子26,27 .这可能会推动共同多元化25.这种关联被认为是互惠互利的28,与细菌产生的根瘤菌素同系物29,30 通过防止变形虫和线虫提供真菌适应性优势31,并通过引起水稻幼苗枯萎病来帮助获取养分23.两种伴侣都可以轴向培养,并且从内共生体治愈的宿主菌株很容易被根瘤分枝杆菌再次感染26,32 .相比之下,非宿主菌株抵抗自然定植,不需要内共生体来形成孢子囊孢子33,34 .在本研究中,使用了 R. microsporus 菌株 EH (内共生体携带) 和菌株 NH (非携带)。
为了研究初始内共生事件,我们使用单细胞方法在环境选择起作用之前观察细胞反应。流体力显微镜 (FluidFM)35最近适应了将细菌注射到哺乳动物细胞中,绕过细胞进入步骤,能够评估工程对以测试细胞内生长36,37 .由于真菌菌丝体的复杂性、坚硬的细胞壁和高膨胀压力,将这种流体力显微镜应用于真菌是具有挑战性的38,39 .在这项工作中,我们报道了一种将细菌植入 R. microsporus 的程序,该程序能够使用共聚焦显微镜进行实时跟踪,并在稳定的选择压力下表征内共生的早期适应。
将细菌递送到真菌菌丝中
我们之前已经表明,使用 流体力显微镜可以将细菌注射到哺乳动物细胞中36,37 并且可以将小分子注射到真菌中39.然而,这种技术尚未实现将细菌物理放置在真菌菌丝中,并且在实验上更具挑战性。我们使用孔径尺寸为 500-1,000 nm 的圆柱形探针,以允许细菌通过,同时最大限度地减少伤口大小。为了提高我们穿刺真菌细胞的能力,我们使用聚焦离子束铣削将圆柱形 FluidFM 探针的尖端锐化为双点(图 D)。1) 并增加了施加的力。此外,使用渗透保护溶液中的酶混合物软化的细胞壁。尽管进行了这种处理,但注射需要高达 6.5 bar 的压力。通过这种方法,我们能够在每次注射事件中将大约 1-30 个细菌植入 R. microsporus 胚芽中。该工作流程还允许分离注射的胚芽,随后对宿主细胞内荧光标记的细菌进行成像,并在琼脂平板上培养分离的胚芽以使其生长直至孢子形成(图 D)。1).
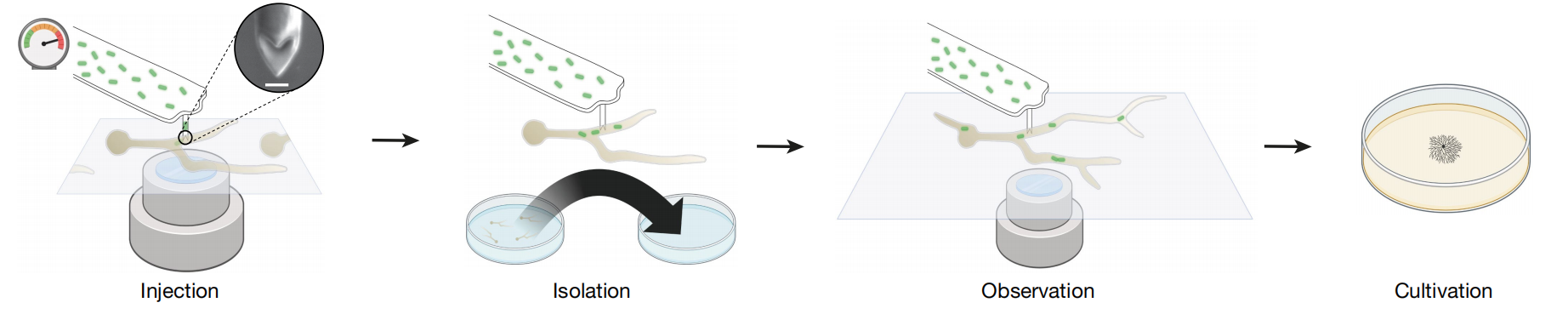
图 1:将细菌注射到真菌胚芽中的工作流程。
FluidFM 注射发生在放置在倒置共聚焦光学显微镜上方的玻璃皿表面。探针顶点被锐化为孔径为 500 至 1,000 nm 的双点。插图:探针顶点的聚焦离子束图像;比例尺,500 nm。通过施加高达 6.5 bar 的超压来克服菌丝的膨胀。注射后,可以将仍然附着的胚芽分离到空培养皿中,在其中可以观察到微生物的恢复和生长。随后可以将注射的胚芽从探针上分离并转移到培养皿中进一步培养直至孢子形成。
将用绿色荧光蛋白 (GFP) 标记的根瘤分枝杆菌注射到其天然宿主小孢子菌菌株 EH 中证实,双方都在注射过程中存活下来。通过显微镜观察验证定植 (补充视频 1)。根据速度、双向性、所走的轨迹以及与一般细胞质内容物相关的运动,细菌可能通过沿微管的主动运输和通过细胞质整体流的被动运输来移动(补充视频 2 和 3)。微管已被证明参与果蝇中含沃尔巴克氏体的囊泡的运输40,但不在直接胞质内共生体或真菌的运输中。我们推测 M. rhizoxinica 可能能够通过真菌货物衔接蛋白或搭便车衔接蛋白附着在微管依赖性马达动力蛋白和驱动蛋白上41.瞬时暴露于 ciliobrevin D(一种可逆且可渗透的小分子)对动力蛋白的抑制,导致细菌在胚芽内的运输瞬时停止(补充视频 4)。
为了跟踪这种重组的自然内共生体中内共生体的预期垂直传递,我们使用荧光激活细胞分选 (FACS) 和显微镜对大量孢子的定植状态进行准确分类,以确定它们与荧光标记的细菌的定植状态。该分析证实了植入的细菌在孢子中的稳定遗传。
将大肠杆菌注射到根霉中
在重组自然内共生作为概念验证后,我们调查了小孢子菌内先验非内共生但细胞内存活的大肠杆菌的命运。 大肠杆菌已被证明在哺乳动物细胞的胞质溶胶中快速繁殖,导致宿主细胞被杀伤36.我们将 GFP 标记的大肠杆菌注射到小孢子菌菌株 EH 和菌株 NH 中(图 D)。2a 和补充视频 5 和 6)。注射后,两个伴侣都保持活力,但大肠杆菌的细胞内复制和定位动力学与其天然宿主中的根瘤分枝杆菌截然不同。 大肠杆菌在菌丝内增殖得更快,分裂的细菌通常保持在一起,产生的细菌团块沿着菌丝内的细胞质体流动缓慢分散(补充视频 5 和 6)。这些动态结合起来,导致了具有高细菌密度的局部热点的出现。真菌在这些稠密的区域周围形成隔膜,导致有和没有大肠杆菌的隔室。无细菌的隔室继续正常生长,而有细菌的隔室则完全充满,偶尔会爆裂(补充视频 5 和 6)。以前已经观察到通过隔膜形成进行防御,R. microsporus 菌株 EH 响应缺乏效应菌胞转录激活因子样效应子 1 (MTAL1) 的根瘤分枝杆菌突变体,这可能有助于细菌躲避真菌防御42.尽管一些大肠杆菌细胞在单个菌丝内分散了较远的距离,导致在远离原始物理递送的部位形成隔膜(图 D)。2a 和补充视频 5),根据 FACS 评估,在从注射真菌收集的孢子中未检测到大肠杆菌(检测限 1/1,000,000 个阳性孢子,n = 3;Fig.。这些实验表明,真菌识别出不适应的细菌入侵者,并触发防御反应,将细菌物理地包含在单独的菌丝隔室中,从而允许在未感染的菌丝中正常生长。
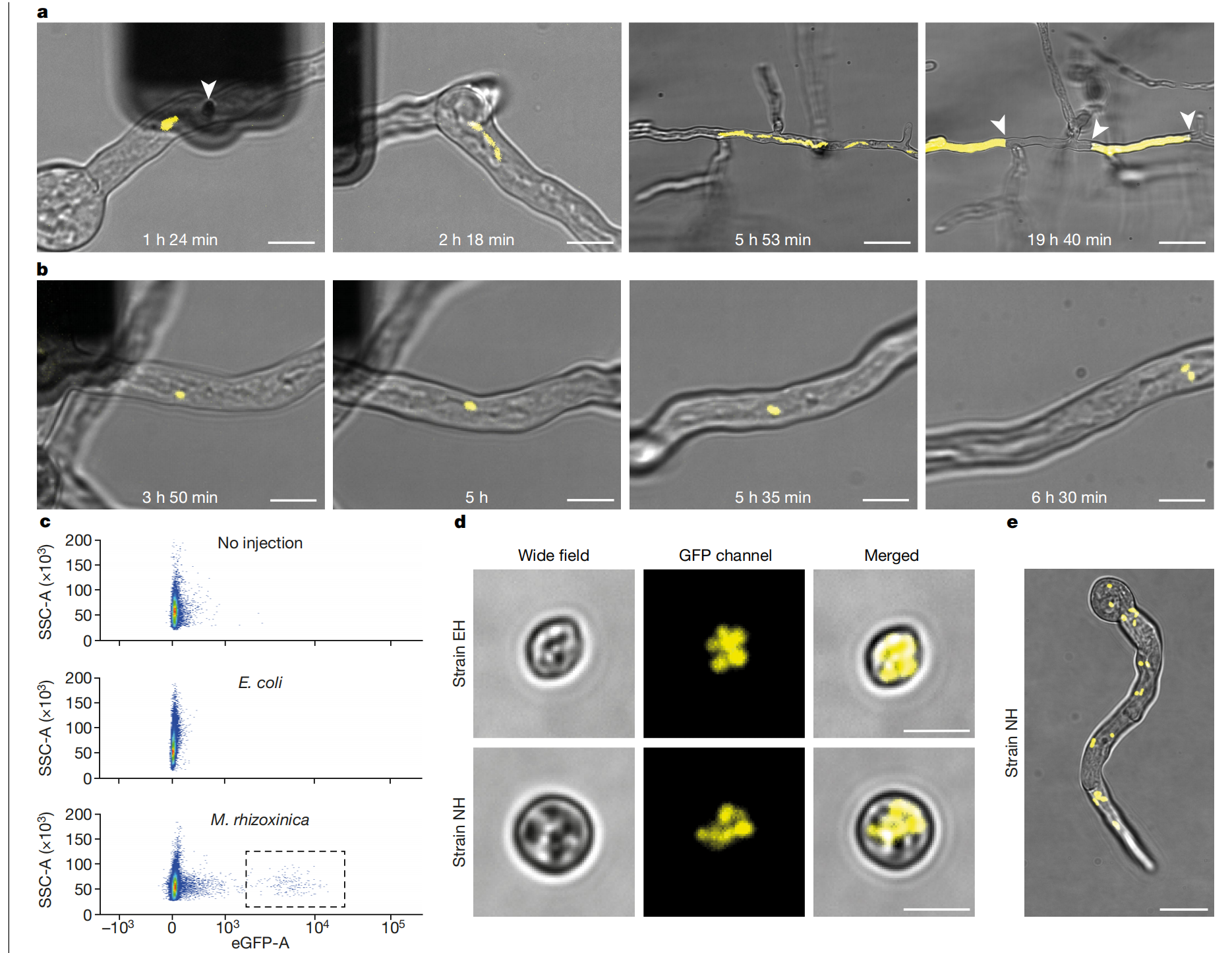
图 2:注射根瘤分枝杆菌,而不是大肠杆菌,导致内共生体的垂直传播。
a,图像显示了真菌和大肠杆菌细胞(黄色)在不同时间点的生长情况。在左图中,深色形状是 FluidFM 探针,白色箭头标记插入胚芽中的探针的顶点。在右图中,白色箭头表示形成的隔垫可防止细菌传播。具有不同放大倍率的图像具有不同的照明设置和对比度调整。在 R. microsporus 菌株 EH 和菌株 NH 中各进行 3 次大肠杆菌注射,结果相似 (总 n = 6)。此处显示的是菌株 EH。b, M. rhizoxinica 在 R. microsporus 菌株 NH 中复制(另见补充视频 4)。实验进行了四次,结果相似。c,未注射细菌(上)、注射大肠杆菌(中)和注射根瘤分枝杆菌后(下)从小孢霉菌株 NH 收集的孢子的流式细胞术图。注射根瘤分枝杆菌后,观察到来自标记细菌的高 GFP 信号分数(灰色虚线矩形)。实验进行了 3 次,结果相似。样品在同一台机器上在不同日期运行。d,图像显示阳性 FACS 分选孢子与细胞内细菌。上图:宿主 R. microsporus 菌株 EH 填充了天然内共生体。下图:注射的 R. microsporus 菌株 NH 填充有 M. rhizoxinica。实验进行了四次,结果相似。e,图像显示注射根瘤分枝杆菌的小孢子菌株 NH 的阳性分选孢子部分的胚芽。细菌分布在整个胚芽中,并且比注射后以更高的密度存在。实验进行了四次,结果相似。对于 a,b,d,e 图像显示单 z 层宽场图像,上面覆盖着黄色 GFP 信号 z 堆栈的二维投影。比例尺,10 μm(a,两张左图,b)、40 μm(a,两张右图)、5 μm (d) 和 20 μm (e)。
接下来,我们试图通过将 GFP 标记的根瘤分枝杆菌植入小孢霉菌株 NH 中来产生一种新的内共生关系,该菌株没有自然内共生体,并且在没有细菌存在的情况下很容易形成孢子。注射后,细菌分裂并表现出与其宿主菌株 EH 中观察到的相似的运输动力学(图 D)。2b 和补充视频 7 和 8)。FACS 显示,由注射和培养的胚芽产生的孢子子集被细菌定植(图 D)。我们在显微镜下证实,阳性分选的孢子 (≤4%;扩展数据表 1)确实藏匿了细菌(图 1)。当暴露于丰富的培养基中时,一些阳性孢子成功发芽并保留了大量通过菌丝传播的复制细菌(图 D)。这些发现表明,根瘤分枝杆菌可以在 R. microsporus 菌株 NH 中垂直传播,并且 FluidFM 的植入结合 FACS 的选择可以将内共生细菌的宿主范围扩展到新的宿主。
内共生的适应性进化
在观察到的 M. rhizoxinica 植入新型宿主 R. microsporus 菌株 NH 的垂直传播的基础上,我们接下来进行了适应性实验室进化实验。为了施加严格的选择压力,通过 FACS 对含有细菌的孢子进行分类,并通过连续几轮的生长和选择进行繁殖(图 D)。首先,对来自单个注射胚芽的孢子进行分类。阳性孢子被分成 10 行,随后分别繁殖 7 轮(见图 D)。3a 和 Methods 了解详细信息)。三个高性能品系和剩余的 7 个品系再繁殖三轮。在每轮孢子形成后,我们测量了含有细菌的孢子的百分比(阳性分数),以及这些孢子的发芽成功率。在进化实验开始时,阳性孢子的发芽成功受到严重损害。虽然没有细菌的孢子的发芽成功率为 63%,但含有细菌的孢子的发芽成功率降低了 10 倍,只有 6.3%(图 D)。3b),这表明细菌的存在会给宿主的适应性带来巨大的成本。阳性孢子的发芽成功率在第十轮增加到 75%,不再与没有细菌的孢子区分开来(图 D)。图 3b 和扩展数据图同样,在实验结束时,阳性分数从 0.01% 增加到高达 24.1%(图 D)。发芽成功率和阳性分数都直接影响进化意义上的内共生的适应性(即具有内共生体的活后代的总量)。因此,我们将内共生结果的适应度指数定义为两个值的乘积。到第 7 轮,适应度指数从最初的 0.0006% 增加到高达 8.7%,平均为 4.4%(图 D)。第 10 轮的平均适应度指数达到 14.0%,其中第 4 行的最高值为 25.3%。在进化过程中观察到的真菌的另一个成本是,与没有细菌的孢子相比,有细菌的孢子的发芽延迟(图 D)。综上所述,适应性实验室进化实验的结果表明,人工诱导的内共生可以在正选择后在新宿主中稳定繁殖。随着时间的推移,内共生的适应指数增加,表明适应于改善传播。
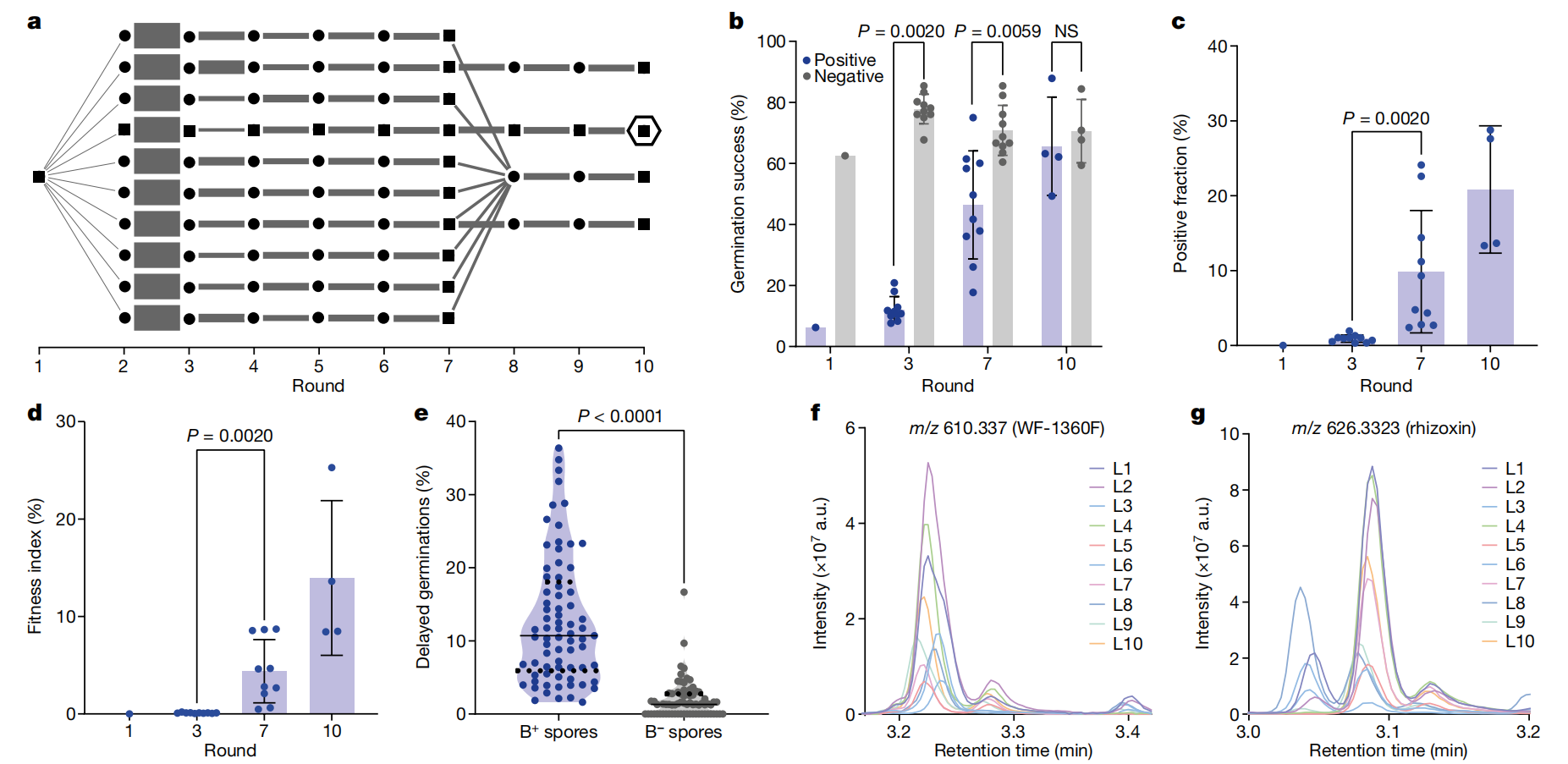
图 3:适应性实验室进化实验导致诱导的内共生的更高适应性。
a,整个实验中的种群规模和品系管理方案。黑点表示孢子收集事件,测量阳性组分和发芽成功率,以及阳性孢子的分类。黑色方块标记收集事件,此外,还从群体中分离基因组 DNA 并对其进行测序。灰色条表示铺板的阳性孢子的数量。第 1 轮孢子收集是注射了根瘤分枝杆菌的小孢子菌株 NH 胚芽。六边形标记第 4 行的第 10 轮。b, 细菌阳性孢子 (蓝色) 和细菌阴性孢子 (灰色) 在不同繁殖轮次下的发芽成功率。NS,不显著。c,FACS 测量的阳性分数随着时间的推移而增加。d,适应度指数,通过将 c 的正分数乘以 b 的发芽成功率计算得出。e,与细菌阴性 (B) 相比,细菌阳性 (B) 孢子表现出更高的延迟发芽水平+−) 孢子贯穿整个定向进化实验。实线表示平均值;虚线表示四分位数。n = 73 个板。P < 0.0000000000001.在 b-d 中,对于第 1 轮,n = 1,第 3 轮和第 7 轮,n = 10 和第 10 轮,n = 来自一个实验的 4 个生物样品。在 b-d 中,数据表示为 s.d ±平均值。在 b-e 中,双侧 Wilcoxon 匹配对有符号秩检验。f,在诱导的内共生中可以检测到细菌产生的根瘤菌素前体 WF-1360F。g, 在诱导的内共生中可以检测到复合根瘤菌素。在 f,g 中,通过液相色谱-串联质谱分析来自适应性实验室进化实验第 7 轮的所有十行 (L1-L10) 的平板提取物。在所有十行中检测到分子。所示为 m/z 610.337 (WF-1360F;f) 和 m/z 626.3323(根瘤菌素;a.u.,任意单位。
诱导根霉产生根瘤菌素
我们测试了根瘤分枝杆菌作为新的内共生体掺入非宿主菌株 NH 是否会导致天然产物的生物合成转移,类似于天然宿主-内共生体系统。在自然系统中,根瘤菌产生大环聚酮,如 WF-1360F,可被小孢杆菌修饰形成根瘤菌素和其他同系物29,并归因于生存优势23,29,30,31.根瘤菌素对真核细胞有毒,因为它们结合 β-微管蛋白并干扰微管形成43.真菌对根瘤菌素的抗性是由于 β-微管蛋白中的单个氨基酸取代,该取代存在于大多数毛霉菌中,包括本研究中使用的两种小孢霉菌株28.我们用液相色谱-串联质谱法测试了根瘤菌素在诱导内共生中产生的根瘤菌素。第 7 轮 10 个进化系的平板的所有提取物均含有根瘤菌素同系物。具体来说,WF-1360F 和根瘤菌素均存在于所有品系中(图 D)。3f,g)。根瘤菌素的检测验证了代谢性状向菌株 NH 的转移,该菌株不会自然产生天然产物。
验证进化共生中的适应度
为了验证诱导的内共生的适应性显着增加是由于适应性进化,并测试一个或两个伙伴是否适应,我们进行了交叉实验。对于祖先伴侣,我们使用与注射相同的起始原种来开始进化实验,对于进化的伴侣,我们选择了十轮繁殖后表现最好的品系(第 4 行)。我们在进化结束时从第 4 行 (BEvn)并将其重新注射到祖先真菌 (Fanc),并相互注射祖先细菌 (Banc) 转化为进化的真菌 (FEvn;使用第 4 行第十轮的无细菌孢子)。在注射后的第一轮中,两种交叉配对都取得了很高的发芽成功率,Fanc– B Evn66% ± 17% 和 FEvn– B anc88% ± 5%。因此,F 的发芽成功Evn– B anc与进化对相似 (88%) 并显著高于祖先对 (39% ± 29%;Fig4a)。当我们在下一轮中确定正分数时,FEvn– B anc表现出 51% ± 13% 的正分数(扩展数据表 2)。这甚至高于进化对的 (29%),表明高适应性并表明真菌基因组适应的可能性。
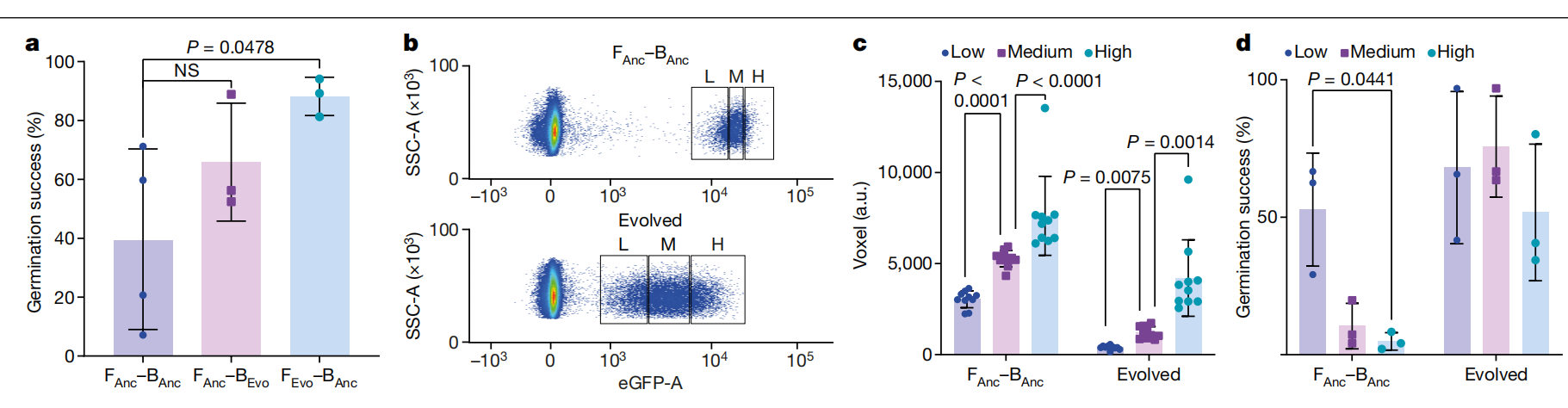
图 4:交叉注射实验表明,诱导的内共生在整个进化实验中适应。
a, F 中进化的真菌Evn– Banc与 F 中未进化的真菌相比,注射后立即发芽成功率更高anc– Banc.数据以 ± s.d. 的平均值表示,并使用双侧未配对 t 检验和 Welch 校正进行比较。n = 3 个生物样品 b,侧向散射面积 (SSC-A) 与增强 GFP 面积 (eGFP-A) 的流式细胞术图显示,与 F 相比,第 10 轮第 4 行(进化)的细菌阳性孢子的 GFP 强度降低anc– Banc孢子。门说明了用于对 c,d 中描述的样本进行排序的近似设门策略,阳性群体被划分为低 (L) 、中 (M) 和高 (H)-GFP 信号分数。先前的流式细胞术门控施加了大小限制并选择用于单个孢子(方法)。c,根据 b 中的门控策略收集的低、中和高级分每级分 10 个孢子的细菌载量。细菌载量与流式细胞术测量的信号强度之间存在显着相关性。通过量化单个孢子的 z 堆栈图像的荧光体素来确定细菌载量。数据以 s.d. ±平均值表示,并使用双侧未配对 t 检验和 Welch 校正进行比较;n = 10 个技术重复。P = 0.00000000022 (左);P = 0.000016 (右)。来自进化对(第 10 轮第 4 行)的孢子的细菌载量低于 Fanc– Banc(所有馏分合并,P = 0.00000013,双侧非配对 t 检验,带 Welch 校正,n = 30 个技术重复)。d,较低的细菌载量与祖先对较高的发芽成功率相关 (Fanc– Banc).在进化对中未检测到这种相关性,它们总体上具有较低的细菌载量和较高的发芽成功率。数据以 s.d. ±平均值表示,并使用具有个体方差和两阶段设置的双侧配对 t 检验进行比较。n = 3 个生物样品。
除了在整个进化实验中阳性分数和发芽成功率的增加外,我们还观察到来自进化对的阳性孢子与祖先对相比,阳性孢子的 GFP 信号强度较低(图 D)。为了确定进化的孢子是否含有较少的细菌,或者存在的细菌表达较少的 GFP,我们通过收集阳性群体的亚群,将从 FACS 获得的 GFP 信号与细菌载量相关联(图 D)。4b) 并显微镜评估孢子中的细菌体积(方法,细菌载量的测定)。来自较低强度门的孢子比来自高强度门的孢子具有较低的细菌体积(图 D)。4c 和扩展数据图2),将 FACS 测量的高 GFP 强度与较高的细菌载量相关联。为了评估细菌载量是否影响孢子的发芽能力,我们确定了这些种群的发芽成功率(图 D)。在祖先对中,我们发现来自细菌载量较低的部分的孢子比细菌载量高的孢子具有更高的发芽成功率。在进化对中,与祖先对相比,所有孢子的细菌载量都相对较低。比较来自不同细菌载量水平的进化对孢子,我们仍然发现了一个趋势,但细菌载量和发芽成功之间没有显着的相关性(图 D)。这些发现表明,高细菌载量会降低孢子的发芽能力,并且诱导的内共生适应于通过减少细菌载量来抵消这个问题。
为了测试细菌的存在如何影响孢子随着年龄的增长而发芽的能力,我们在 27 天内定期检查了发芽情况。在此期间,不含细菌的孢子的发芽成功率保持相对恒定(扩展数据图3). 相比之下,含细菌孢子的发芽成功率对于 Fanc– Banc随着时间的推移,进化对从超过 50% 大幅下降到大约一个月后的 5% 以下,这表明细菌的存在对孢子造成了持续的损失。
共生伙伴的遗传变化
接下来,我们分析了进化实验中的表型适应是否与进化种群的遗传变化相关。我们从适应性进化实验开始就使用长读长和短读长测序数据进行了从头杂交基因组组装,以组装菌株 NH 的参考基因组。短读长测序用于跟踪几轮实验的变化(图 D)。3a) 对真菌和细菌都有影响。在细菌中,我们在整个进化实验中没有检测到任何突变变化。在真菌中,我们在四个不同的品系中总共鉴定了 9 种不同的突变,这些品系的等位基因频率至少为 50%(扩展数据图 5)。在最适者行第 4 行中检测到 4 个突变,其中我们跟踪了每个传代的遗传变化。携带突变的读数的相对频率在实验结束时急剧增加,并与第 4 行中观察到的适应度指数的增加相吻合(图 D)。我们进一步研究了 FEvn– Banc配对与已鉴定的突变相关,并在所有三个注射的 F 中发现了所有四个突变EvnGermlings 的。在三个胚芽中的两个中,突变以 85-100% 的读数的高频率发生,而在一次胚芽中,频率要低得多,只有 18-35% 的读数(请注意,根霉的无性孢子是多核的44).然而,在这种胚芽中,在 61% 的读数中发现了另一个突变(扩展数据图 .从第 6 轮开始,可以在第 4 行群体中检测到第五个突变,但未达到 50% 的频率阈值(扩展数据表 3)。目标基因的功能仍然是推测性的。使用 InterPro 进行注释45和使用 STRING 进行交互预测46表明它们可能与内吞作用有关,而在其他细胞系中,转录、翻译、线粒体维持和离子转运可能受到影响(扩展数据表 4)。总之,序列分析的结果证实,在适应性进化实验期间,基因组变化发生在宿主侧,而不是内共生体中。
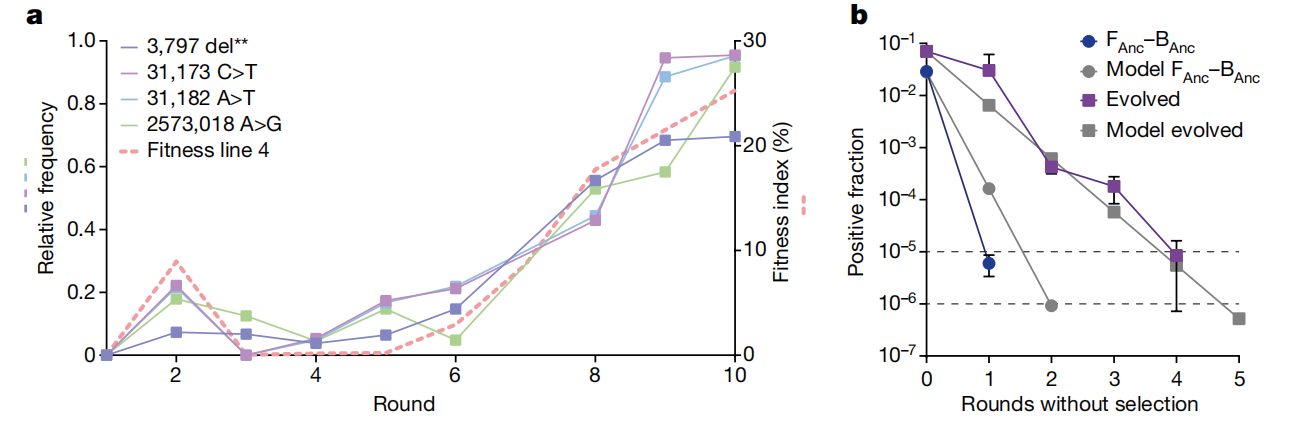
图 5:进化的内共生的适应性和稳定性的增加与真菌种群的遗传变化相关。
a,在适应性进化实验期间,第 4 行的 4 个突变在宿主种群中普遍存在,与适应度指数的增加相关。该图在左侧 y 轴上用实线描述了与参考序列相比,具有相应突变的读取的相对频率。右侧 y 轴上的虚线描述了第 4 行在实验过程中的适应度指数。显示达到 50% 以上相对频率的突变。'del**' 表示两个碱基对 (CGG>C) 的缺失。b,进化的内共生比祖先内共生更稳定(Fanc– Banc) 在没有人工选择的情况下。该图以彩色显示了在没有FACS人工选择的情况下细菌阳性孢子的分数,灰色显示了基于数学模型预测的阳性分数。该模型使用细菌阳性和细菌阴性孢子的发芽成功率和分数来预测在没有选择的情况下,细菌阳性孢子在几轮繁殖中的分数。上面的虚线表示传播和稀释的阈值 (1/100,000);下虚线表示检测限 (1/1,000,000)。测量为 0 正分数的值不会显示在对数图上。数据以 n = 3 个生物样品的平均值 ± s.d. 表示。
进化内共生的稳定性
在上述适应性实验室进化实验中,我们使用 FACS 施加了严格的正选择压力。在自然界中,选择压力可能源于细菌转移的代谢性状,在这种情况下是根瘤菌素的产生26,31 .然而,我们对诱导内共生的初步表征也显示出与细菌占据相关的大量成本,这导致内共生最初适应性较低(图 D)。因此,我们推断,在没有正选择的情况下,诱导的内共生会很快丢失,但在适应和减轻一些适应性成本后会持续更长时间。
为了测试内共生的稳定性,我们实验测量了无阳性选择的情况下五轮繁殖的阳性分数,并将数据与预测细菌阳性孢子随时间变化的分数的简单数学模型进行比较。数学模型的参数基于起点的测量值,即发芽成功率和初始正分数,我们认为这是最决定性的因素。对于实验,根据进化实验中的标准条件对阳性分选的孢子进行接种。此后,收集 100,000 个孢子用于进一步培养,而不选择细菌定植,同时测量阳性分数(图 D)。对于祖先对,阳性孢子在一轮内稀释到低于繁殖阈值 (<1/100,000),但仍可检测到 (>1/1,000,000),这甚至比模型预测的还要快。然而,对于进化的一对,内共生维持的时间更长,因为阳性孢子在四到五轮后以模型预测的速度稀释掉。这支持了早期的发现,即适应性进化增加了诱导的内共生的稳定性,并且阳性分数和发芽成功是系统适应性的有效预测指标。
讨论
新的内共生体的出现仍然是一个观察和研究的挑战。我们开发了一种实验系统,可以实时研究真菌宿主与细胞内细菌结合的初始步骤。这种遭遇被认为在自然界中经常发生,但主要是不稳定和短暂的3、4、11、47 .直接植入可以监测具有不同预适应程度的对的即时反应,并与菌丝进入脱钩。
大肠杆菌植入小孢杆菌菌株 EH 和 NH 中导致系统在单一真菌一代中崩溃,强调了新的内共生配对的预期不稳定性4.尽管大肠杆菌在胞质溶胶中迅速分裂(图 D)。2a),它无法定植 R. microsporus 的孢子,这代表了内共生的进化死胡同。真菌通过诱导隔膜的形成包埋了密集生长的大肠杆菌(图 D)。2a 和补充视频 5),可能是由于其先天免疫系统的认可,目前尚不清楚42,48 .然而,低密度的大肠杆菌并未始终被密封,这表明 R. microsporus 缺乏清除其胞质溶胶中低丰度细菌的特异性。这一观察结果表明,如果大肠杆菌生长较慢,则更有可能垂直传播36和/或扩散到整个菌丝体中。这种配对说明了内共生发生充分预适应的必要性,否则自然选择就无法开始生效。
相比之下,植入非宿主 R. microsporus 菌株 NH 的 M. rhizoxinica 在真菌菌丝中繁殖和分散,对真菌没有明显的伤害,也没有诱导隔膜的形成(图 D)。2b 和补充视频 7)。细菌到达了孢子的一个子集(图 D)。2c,d),其中一些发芽,允许垂直遗传(图 D)。我们推测细菌沿着微管主动运输,可能是通过搭囊泡运输的便车41.这可能有助于细菌在菌丝体中传播(补充视频 2、3 和 8)并到达孢子形成的部位。孢子在菌株 NH 中的定植是显着的,因为这种真菌菌株尚未进化到将孢子形成与细菌存在相结合26.尽管证明了垂直遗传,但在没有正选择的情况下,内共生关系会迅速丢失(图 D)。5b),可能是由于无细菌孢子的竞争以及观察到的定植孢子延迟发芽和发芽成功率降低的成本(图 D)。3b,e)。这些结果与内共生体的资源开发一致,这是以前在昆虫中观察到的效果17,18 .
当使用 FACS 承受强大的选择压力时,人工诱导的内共生关系逐渐变得更加稳定,当选择压力升高时,内共生体的损失较慢就证明了这一点(图 D)。5b). 促成这种增强的两个主要表型因素是阳性孢子分数的增加和受损发芽成功的“恢复”(图 D)。3b,c)。我们的交叉验证植入表明,真菌的适应是稳定化的主要贡献者。基因组分析证实了这一发现,基因组分析显示真菌种群中存在富集突变,但细菌种群中没有富集突变(图 D)。图5a 和扩展数据图这一观察结果与昆虫的发现形成鲜明对比,在昆虫中,细菌基因组适应得更快49.在真菌同胞系统中,每个核复制都会增加宿主多样性,可能使真菌迅速适应。
这种基底真菌的基因组未得到充分探索,因此很难得出关于哪些分子机制对适应诱导的内共生至关重要的确切结论,并且不能排除对宿主或内共生侧的额外表观遗传效应。此外,短读长测序可能会遗漏基于重排或较大缺失或重复的遗传变化。然而,受突变影响的几个基因可能参与转录和翻译的调节以及内吞作用(扩展数据表 4)。尽管确切的机制尚不清楚,但我们可以从表型上显示该系统进化为增加细菌的孢子数量,并且我们确定孢子中细菌载量的减少是发芽成功率增加的重要因素(图 D)。4b-d)。
我们的研究结果表明,M. rhizoxinica 与非宿主 R. microsporus 菌株 NH 在很大程度上兼容,但维持内共生体需要选择压力。在天然内共生对中,滋生细菌的成本可能被真菌的好处所抵消,例如共同产生根瘤菌素23,31 .我们发现植入的细菌在 R. microsporus 菌株 NH 中产生了 WF-1360F。我们还检测到了根瘤菌素,它是当 R. microsporus 环氧化 WF-1360F 同系物时产生的29,表明修饰 WF-1360F 的能力并不完全存在于进化为根瘤分枝杆菌的 R. microsporus 菌株中。菌株 NH 产生根瘤菌素表明,代谢能力可以通过植入和随后的选择人工诱导内共生而转移到新的生物体中。
总之,我们已经成功地采用了 FluidFM 技术将活细菌植入真菌中。这种单细胞方法能够对随后的相互作用进行实时成像,并研究内共生发生的先决条件,即使在短暂和不稳定的配对中也是如此。结合 FACS 的高通量性质和灵敏度,可以在严格选择下分析和培养罕见的垂直传播事件。我们发现,尽管初始成本很高,但适应性进化增加了诱导的内共生的稳定性。启动内共生和探索稳定遗传的边界条件的能力推进了对生物技术相关的设计内共生体的综合方法,并阐明了塑造内共生的进化力量。
实验方法
菌株和标准培养方法
使用的菌株和化学品列于补充表 1 和 2 中。大肠杆菌 K-12 BW25113 pDGUV-GFP50在补充有 100 μ g ml 的 Luria-Bertani 肉汤 (Sigma-Aldrich) 中培养−1羧苄青霉素 (Roth)。R. microsporus 菌株 NH 是 R. microsporus CBS 631.82;R. microsporus 菌株 EH 是 R. microsporus ATCC62417。如既往报道,对根瘤菌 HKI-0454 和小孢菌 R. microsporus 进行培养42在 28 °C 下,使用 pBBR-P12-GFP 用胞质 GFP 对根瘤分枝杆菌进行荧光标记51.将 R. microsporus 在 28 °C 下用 20 μg ml 在马铃薯葡萄糖琼脂 (ThermoFisher) 上生长−1庆大霉素。在所有实验中,根据细菌培养的需要,使用相应的用于质粒保留的抗生素,包括真菌内细菌的生长,在这种情况下,此外,庆大霉素用于防止细胞外细菌生长。
使用 FluidFM 进行细菌注射
仪器的基本设置、FluidFM 探针加工步骤、探针清洁和探针涂层如前所述36,但压力由 FlowEZ 7000 (Fluigent) 控制,压力范围为 0–7,000 mbar,使用 AT550-9L 压缩机 (WenLing) 作为压力源。如前所述,使用 Helios 5UX DualBeam 聚焦离子束扫描电子显微镜 (ThermoFisher) 锐化探针顶点36,52 ,而是转换为一个新的形状,从而产生一个尖锐的双点,如图 1 所示。1、从正面瞄准探头并塑造一个圆心角为 60° 的中心点。所用探头的悬臂标称刚度为 1.6 N m−1.通过将孢子接种在 50 mm WillCo 玻璃底培养皿 (WillCo Well) 中并加入 4 ml 含有 34 μg 的马铃薯葡萄糖肉汤 (PDB) 培养基 (ThermoFisher) 来制备真菌样品−1氯霉素,在室温下孵育 14-16 小时,用 4 ml PDB 洗涤 1-3 次,取决于胚芽浓度,将培养基换成原生混合物(软化但不完全分解细胞壁;1.6 g 纤维素酶 Onozuka R10 (Duchefa Biochemie),40 mg 几丁质酶 (Merck),40 ml 冰镇 MMB(0.5 M 甘露醇,0.05 M 马来酸盐 pH 5.5), 通过 0.22 μm 针式过滤器过滤),并在室温下再孵育 3-5 小时。如果胚芽太稠,则通过 0.22 μm 针式过滤器过滤样品上清液。将大肠杆菌样品在带挡板的摇瓶中的 10 ml 培养物中于 37 °C 下培养过夜,在 Hepes2 缓冲液(10 mM HEPES,150 mM NaCl,pH 7.4)中洗涤 3 次,并在 600 nm 处调节至 2 光密度。将根瘤分枝杆菌样品在 2 ml 培养物中在 12 ml 培养管中于 28 °C 下培养 3 至 5 天,并像大肠杆菌培养物一样制备。将细菌悬浮液 (15 μl) 移液到 FluidFM 探针的储液器中。将探针移向目标胚芽旁边的玻璃表面 (z = 0 μm),然后缩回至 +8 至 +10 μm 的 z 值。胚芽的注射部位是根据直接接近玻璃表面来选择的,更喜欢较厚的胚管部分。由于探针的柔软性而无法进行力控穿刺,因此将探针向前推进 10 μm(对应于 +1 μm 至 -2 μm 的标称 z 值),保持该位置 5 s,然后缩回至 +1 至 +3 μm 的 z 值,从而刺破胚芽。通过观察细胞质流动,可以用宽视场照明监测胚芽的成功穿刺。在细菌穿刺后,立即用 3-4 bar 对微流体系统加压,阻止膨胀诱导的回流到探针中。随后,将压力增加到 6.5 bar,直到注意到液体流入胚芽,然后迅速降低到 3-4 bar 以防止胚芽爆裂。通过切换到荧光通道来确认细菌注射,然后将压力缓慢降低至 0 mbar 以允许恢复胚芽。3-10 分钟后,或胚芽重新开始生长后,将注射的胚芽分离到装有回收培养基(3.8 ml MMB、1 ml PDB、160 μl 4 M 山梨醇)的新鲜培养皿中。通过提起 FluidFM 并将样品皿更换为回收皿进行分离,使胚芽粘附在探针上。使用宽场和荧光通道中的延时和 z 堆栈图像可视化胚芽的恢复和随后的动力学。一些注射是在原生持久混合物和回收培养基中添加 1:1,000 钙荧光白 (Merck) 以进行的,以观察细胞壁。胚芽在恢复培养基中生长过夜,然后使用超压、提起 FluidFM 并用塑料移液器吸头刮擦从探针上分离。然后将菌丝体转移到马铃薯葡萄糖琼脂平板上,并在 28 °C 下孵育。
孢子采集
注射或接种孢子后 6 ± 1 天收集孢子。将孢子溶液(8.5% NaCl,1% 吐温 20)加入板中(方板为 16 ml;圆板为 12 ml),并使用刮刀彻底分离孢子。将剩余的菌丝体聚集起来,用刮刀轻轻按压,以从菌丝体中释放孢子溶液。孢子溶液通过 10 μm CellTrics 过滤器 (Sysmex) 过滤。用 1 ml Hepes2(相对离心力为 8,000;2 分钟)洗涤孢子 3 次,并在 4 °C 下储存过夜以进行 FACS,或在 -20 °C(用于工作储备液)或 -80 °C(用于长期储存)下储存在 50% 甘油中。
流式细胞术和细胞分选
孢子的分析和分选是在 ETH 流式细胞术核心设施的 FACSAria Fusion BSL2 细胞分选仪 (BD) 上进行的。使用 SSC-A-FSC-A 和 FSC-H-FSC-A 门选择单个孢子。使用 SSC-A-eGFP-A 门检查细菌的定植。(见补充图1 表示门控策略)。对于怀疑自发荧光会使阳性门定位复杂化的样品,使用 mCherry-A 与 PerCP-Cy5-5-A 通道来检查自发荧光,但不包括在门控中。为了测定阳性孢子的分数,根据分数的大小分析 100,000 至 1,000,000 个孢子。对于批量分选,将孢子分选到 1.5 ml Eppendorf 管中。为了确定发芽成功率,将单个孢子分选到含有 125 μl PDB + 34 μg ml 的 96 孔板中−1氯霉素每孔。为了验证阳性门,在显微镜下间歇性地检查批量分选的孢子。使用 FlowJo v10 软件 (BD) 分析收集的数据。为了对阳性孢子的高、中、低部分进行分类,在阳性群体中定性设置门,如图 1 所示。4b.
发芽成功的确定
将单孢子分选的 96 孔板在 28 °C 下孵育,并使用蔡司 SteREO Discovery.V8 显微镜 (蔡司) 目视检查胚芽的外观。对每个样品的 3 板阳性孢子和 1 板阴性孢子进行分类。在适应性实验室进化实验的第 1 轮中,每个样品分拣了 5 个阳性板。分选后 1 天和 2 天对胚芽进行计数,之后没有发现新的胚芽。对于阳性板,在第 1 天在显微镜下检查了 5 个胚芽,以确认荧光细菌的存在。如果无法确认胚芽具有内胚菌,则再检查五个胚芽。没有样品因超过 20% 的胚芽而未通过这种控制,而没有容易检测到的内胚。为了计算延迟发芽的百分比,计算第 1 天未检测到但在第 2 天检测到的发芽的百分比(100% 对应于第 2 天检测到的发芽数)。
细菌分离
为了从小孢子菌中分离根瘤分枝杆菌,50 ml MGYM9 + 34 μg ml −1将氯霉素接种在 500 mL 带挡板的摇瓶中,并在 100 rpm 下振荡孵育 5-7 天。用手轻轻摇晃和倾斜会定期冲洗掉墙上的菌丝体堆积。一旦培养基变得浑浊,就将接种环插入培养基中,避免菌丝团块并用于在琼脂平板上划线。每天检查板 3 天,如果检测到生长的真菌,则切除生长的真菌。根据标准方案进一步培养带有细菌菌落的平板,并用于制备低温储备液。或者,使用 2 μm 针式过滤器 (Merck) 将细菌与菌丝体和孢子分离,滤液用于在液体中进一步培养。
适应性实验室进化实验
对于进化实验,对注射后第一轮收集的孢子进行分类以确定发芽成功,其余孢子对阳性孢子进行批量分类。阳性孢子被分成 10 等行,每行大约有 300 个孢子。此后,这十行被分开。测定每行每轮的发芽成功率和阳性孢子的分数,在第 1 轮之后的每一轮,冷冻保存一些阳性和阴性分选的孢子,并从 10,000 个阳性分选孢子中分离出细菌(第 1 轮约 300 个)。计算正分数和发芽成功的乘积以给出适应度指数,该指数表示在没有选择的情况下在下一轮开始时会产生细菌填充的发芽的孢子的百分比。在 120 × 120 mm 见方的培养皿 (Greiner) 上进行进化实验的电镀,以增加可用表面积。将要接种的孢子吸收在 100 μl 缓冲液中,将其移液成五条平行线,在板上间距相等。高孢子数量的标准铺板以前已被证明会导致孢子形成不一致。从第 2 轮开始,随着阳性孢子比例的增加,高密度的孢子可以接种到下一轮。对于制作第 3 轮板,种子的孢子数量最多,每板高达 830,000 个孢子,而对于第 4 轮和第 5 轮,数量略有变化,约为 100,000 个,从那时起,所有轮次和线都使用 100,000 个。接种孢子的数量显示在图 1 的源数据中。3a. 第 7 轮后,只有根据适应度指数表现最好的 3 个品系(第 2、4 和 7 行)单独生长,而其他 7 个品系通过混合等量的阳性孢子合并到第 P 行。表明孢子种群大小和混合机制的方案可以在图 1 中找到。3a.
根瘤菌素的检测
从第 7 轮开始,每条线总共接种 10,000 个阳性分选的孢子。由 M. rhizoxinica 定植的菌株 EH、轴系菌株 NH 和 M. rhizoxinica 的液体培养物用作对照。将板生长 11 天,并用 50 ml 乙酸乙酯提取,在 28 °C 下以 100 rpm 振荡过夜。 分离有机相,用硫酸钠干燥,经纸过滤器过滤,用旋转真空蒸发器蒸发。将样品加入 1 ml 乙腈中,以 20,000g 离心 10 分钟,并将 800 μl 上清液储存在 −80 °C 下,直至进行液相色谱-串联质谱 (LC-MS/MS) 分析。使用 Thermo Ultimate 3000 UHPLC 系统 (Thermo Scientific) 和 C18 反相色谱柱(Kinetex XB-C18 色谱柱,粒径 1.7 μm,孔径 100 Å;尺寸 50 mm × 2.1 mm,Phenomenex)进行液相色谱分离。溶剂 A 为 0.1% (v/v) 甲酸的水溶液,溶剂 B 为 0.1% 甲酸的乙腈溶液,流速为 500 μl min−1.溶剂 B 的变化如下:0 min,25%;3 分钟,90%;5 分钟,90%;5.3 分钟,25%;随后,将色谱柱在初始条件下平衡 2 min。注射量为 2 μl。
使用 Thermo QExactive plus 仪器 (Thermo Fisher Scientific) 在正傅里叶变换质谱模式下进行 MS 产物反应监测分析。以 35,000 (m/z = 200) 的质量分辨率进行 MS 1 级扫描,以 17,500 的质量分辨率进行 MS 2 级扫描。母离子在 m/z 594.34、610.337、612.3531、626.3323 和 628.348 处以单位分辨率分离,并通过高能 C 陷阱碰撞解离碎裂,应用归一化碰撞能量 28 eV。使用加热的电喷雾电离探针,源参数如下:蒸发器温度,380 °C;鞘气,50;辅助气体,20;扫气,0;射频电平,50.0;毛细管温度,275 °C。 见补充图。2 用于相关光谱。
基因组学
为了生成根瘤分枝杆菌的测序样品,从相应的时间点分离后,根据标准培养条件培养细菌(方法,细菌分离),并通过以 11,000 的相对离心力旋转 1 分钟,将 4 ml 样品调节至 600 nm 处的光密度为 1 沉淀。使用 MasterPure DNA 纯化试剂盒 (LGC) 制备基因组 DNA。基因组 DNA 用干冰送至 BMKGene (Biomarker Technologies) 进行进一步处理。
为了生成 R. microsporus 的测序样品,将菌丝体在 2 升摇瓶中的 500 毫升麦芽提取物肉汤(Thermo Fisher Scientific)中生长用于 Illumina 测序,或在 5 升摇瓶中的 1.5 升麦芽提取物肉汤中生长,用于 PacBio 测序,在 37 °C 下,加入庆大霉素和氯霉素 5 天。然后在 110 mm 滤纸上过滤菌丝体,并用双蒸 H 彻底洗涤2O 和 Illumina 样品,另外加入 150 ml 70% 乙醇。然后从滤纸中取出菌丝体,装入 50 ml 螺旋盖管中,并在液氮中冷冻。然后将样本送到 BMKGene (Biomarker Technologies) 进行进一步处理。
对于小孢子菌 CBS 631.82 的基因组组装,使用 RS II 的 Pacbio HiFi 测序在 353,300 个平均长度为 10.9 kb 的读数中共产生了 3,867,257,442 个碱基对 (bp),平均质量评分为 30.3。读取是使用 Flye (v2.9.2) 组装的53带有 --pacbio-hifi 标志,产生 118 个重叠群,总长度为 55,743,399 bp,N50(最大重叠群集合中最短的重叠群,占组装体的 50%)为 1,370,944 bp。BUSCO (v5.4.7)54使用谱系数据集 mucorales_odb10 检查组装的质量,得出以下结果:C(完整):97.5%,S(单拷贝):5.1%,D(重复):92.4%,F(碎片化):1.7%,M(缺失):0.8%,n(基因数):2,449。因此,尽管几乎完成,但基因组似乎也在很大程度上是重复的。使用 BRAKER (v3.0.6) 对组装进行基因调用55,56,57,58,59,60,61,62,使用 —fungus 标志,然后使用 eggNOG-mapper (v2.1.12) 进行功能注释63使用选项 --target_taxa Fungi。BUSCO 报告称,所调用基因的完整性略有提高:C:99.8% [S:1.4%,D:98.4%],F:0.1%,M:0.1%,n:2,449。
对于来自 R. microsporus 和 M. rhizoxinica 的适应性进化实验的调用突变,使用了 BMK 提供的短读 Illumina 序列。通过使用 BBTools v38.18 去除接头序列、低质量末端修剪和去除低质量读数来清洁所得的原始读长。用于质量控制的命令可在微生物组学方法网页 上找到。使用两种不同的工具(Snippy 和 bcftools)调用单核苷酸多态性64.对于使用 bcftools 的变体检出,首先将读数与 R. microsporus CBS 631.82 的 PacBio 组装或使用 BWA-MEM v0.7 的根瘤分枝杆菌参考基因组 (GCF_000198775.1) 比对(参考文献。65).使用 GATK4 v4.2 (MarkDuplicates) 标记和删除重复读长66.使用 bcftools call 命令调用变体。通过比较两个独立工具获得的结果来验证单核苷酸多态性检出。使用 bcftools-isec 从所有进化样本中过滤掉在祖先样本中检测到的所有变异,以研究进化实验期间出现的变异。使用 bcftools 使用以下标准过滤生成的 VCF 文件:-Ov -sLowQual -g5 -G10 -e 'QUAL < 200 ||DP4[2] < 3 ||DP4[3] < 3 ||(DP4[2] + DP4[3])/sum(DP4) < 0.1 ||MQ < 50'。通过使用 samtools 堆积分析变体位置的读取比对,手动检查每个工具产生的每个变体调用。使用 SnpEff 对突变进行注释67和 InterProScan45.STRING 用于根据 STRING 数据库中发现的真菌最接近的相关基因搜索相互作用,从而识别推定的生物过程46.
无选择压力的健身
首先从根据适应性实验室进化实验的标准条件生长的平板中收集第 0 轮的孢子。为此,来自新鲜 F 的孢子anc– Banc对注射板进行批量分选,并接种 100,000 个阳性孢子。对于 FEvn– Banc,生长来自注射板的冷冻阳性孢子,然后接种 100,000 个阳性孢子;用于 FEvn– BEvn,生长来自第 10 轮第 4 行进化实验的冷冻孢子,然后接种 100,000 个阳性孢子。从这些板中收集了第 0 轮的孢子。然后对 100,000 个孢子进行批量分选,仅对单个孢子设门,但忽略孢子的 GFP 信号强度,用于后续轮次。每轮分析每个样品 1,000,000 个孢子,以确定阳性孢子的比例。一旦阳性分数低于 1/100,000 个孢子的阈值,则认为内共生已褪去,在该阈值下,预计不会为下一轮接种阳性孢子。实验在第 5 轮后停止。正分数的理论轨迹使用公式计算
细菌载量的测定
在宽场和 GFP 通道中对分选为高、中、低强度的孢子进行成像,以创建 z 堆栈。每个样本群体 10 个孢子的叠加显示在扩展数据图 中。2a,b 并作为通过 FACS 测量的 GFP 强度与细菌种群规模相关性的视觉确认。对比度和亮度保持不变。被认为是细菌的体素的体积是使用 Matlab2018a (Mathworks) 使用已发布代码的部分计算的36.为了测量适当的阈值,目视检查了生成的体素云的三维渲染,并检查了单个粒子的直径。样品的三维渲染结果示例显示在 Extended Data Fig 中。2c.
孢子寿命
按照标题为“无选择压力的适应性”一节中的描述生长样品。将单个孢子分选到含有 75 μl Hepes2 + 34 μg ml 的 96 孔板中−1每孔中含有氯霉素。每个样品对 15 个具有阴性孢子的板和 15 个具有阳性孢子的板进行分类。然后将板在 16 °C 下孵育。 在标称时间点前一天,通过加入 125 μl PDB + 34 μg ml 激活每个条件的三个板−1将氯霉素添加到每个孔中,并在 28 °C 下孵育。
统计分析
图例中指示的统计测试是使用 GraphPad Prism v9.0.0 运行的。
https://blog.sciencenet.cn/blog-41174-1460017.html
上一篇:干燥综合征患者氢疗案例【台湾】
下一篇:CRISPR 编辑西红柿又大又甜!《自然》by中国农业科学院深圳分院