博文
电催化氢气免疫疗法新概念【合肥】
||
肿瘤的电催化氢免疫治疗新概念
调制MnNi2S3纳米电极的电子结构以激活焦亡用于电催化氢免疫疗法
氢气(H₂)疗法已显示出抗癌效果,但治疗效果受到氢气低溶解性和非靶向递送的限制。通过电催化剂电解水可持续释放大量氢气,并激发了氢气在肿瘤治疗中的精准递送。本文设计了锰掺杂的Ni2S3纳米电极(MnNi2S3 NEs),用于电催化氢气递送和激活抗癌免疫反应,有效增强氢气免疫疗法。镍原子具有空的3d轨道,通过促进H₂O的吸附降低了氢析出反应(HER)的初始能垒。此外,不同电负性的锰原子调节了镍原子的电子结构,促进了生成氢气的脱附,从而增强了MnNi2S3 NEs的HER活性。基于高HER活性,以电压依赖方式实现了电催化氢气疗法(EHT)中氢气的可控递送。从机制上讲,MnNi2S3 NE介导的EHT诱导线粒体功能障碍和氧化应激,随后通过典型的ROS/caspase-1/GSDMD信号通路激活焦亡。此外,MnNi2S3 NE介导的EHT增强了CD8⁺ T淋巴细胞向肿瘤的浸润,并逆转了免疫抑制微环境。这项工作展示了一种具有高HER活性的电催化剂,用于协同气体免疫疗法,可能激发基于电催化剂的肿瘤治疗策略。
介绍
作为新兴的气体分子,氢气(H₂)在治疗各种疾病方面已显示出疗效,包括恶性肿瘤、阿尔茨海默病、关节炎和中风,且具有良好的生物安全性。[1] 由于其小的分子尺寸,H₂可以自由穿透生物膜,包括细胞膜、线粒体膜和核膜。特别是,H₂参与有氧呼吸通过干扰电子传递链[2]和抑制三磷酸腺苷(ATP)的合成[3]来诱导线粒体功能障碍。另一方面,肿瘤细胞的高代谢通过过表达活性氧物种(ROS)建立了高氧化还原状态,ROS的减少或增加诱导细胞内氧化应激。作为抗氧化剂,H₂选择性清除如羟基自由基和过氧亚硝酸盐阴离子等ROS,并破坏肿瘤细胞中的氧化还原平衡。[4] 更重要的是,由H₂诱导的氧化还原失衡通过ROS/NLRP3/caspase-1/GSDMD信号通路激活焦亡细胞死亡。[5] 然而,氢气疗法的抗癌效果受到氢气低溶解性(≈1.6 ppm)和非靶向扩散的限制。此外,肿瘤部位累积的低浓度氢气可能会通过其抗凋亡效应促进肿瘤生长。[6] 为了可控和精确地递送氢气,设计并应用了各种释放氢气的微/纳米材料,包括酸响应释放氢气的纳米材料(NH₃•BH₃、CaH₂和Fe微球)[7]、光催化释放氢气的纳米催化剂(PdH0.2、SnS1.68-WO2.41和Fe-TPP)[3, 8]和声催化释放氢气的纳米催化剂(SnS和C3N4)[9]。尽管如此,中等疗效显示了这些氢气纳米发生器的有限穿透深度和低催化效率。因此,在氢气疗法中保持高剂量和精确控制的靶向递送仍然是一个挑战。
通过电解水提供可持续和可控的氢气生成途径,即氢析出反应(HER),[11]激发了一种创新的氢气递送方法。先前的研究表明,商用针灸铁针可以在电场下生成氢气。[12]然而,治疗效果受到低电催化活性的限制,并且由于铁针的不稳定性引发了潜在的生物安全问题。因此,需要具有高HER活性和稳定性的催化剂用于电催化氢气疗法(EHT)。[13] HER过程涉及两电子转移反应,包括在活性位点上吸附H₂O/H⁺(Volmer步骤)和从催化剂表面脱附氢气(Heyrovsky步骤或Tafel步骤)。[14]作为贵金属的替代品,过渡金属基电催化剂,包括过渡金属碳化物、氧化物、磷化物和硫化物,引起了广泛关注。[15]考虑到它们在酸性条件下的稳定性和活性,如NiS、Ni2S3、Ni3S4和NiS2等镍硫化物在电催化氢气生产方面表现出巨大潜力。镍原子具有空的3d轨道,容易与H₂O/H⁺形成吸附键,降低了HER过程的初始能垒。[16]然而,镍原子与氢气的高吸附能量阻碍了生成氢气的脱附,导致电催化剂的催化活性减弱。[17]为了提高HER活性,引入异质原子调节镍原子的电子结构是一种有前景的策略。例如,锰原子与镍原子具有相似的原子尺寸但完全不同的电负性。[18]因此,将锰原子引入镍硫化物中会诱导电子构型重建,促进H₂O的吸附,降低生成氢气的脱附能量,从而增强HER活性。
除了作为氢气生成的驱动力外,电场还作为调节肿瘤免疫微环境的外部刺激。在特定穴位进行电针疗法可以通过迷走神经-肾上腺轴激活炎症反应[19],并通过促进CD8⁺T淋巴细胞的浸润来增强抗肿瘤免疫[20]。然而,由于穴位的复杂性,用电场调节肿瘤免疫微环境仍然具有挑战性。基于电催化剂的合理设计,用于EHT的外加电场有望激发有效的抗肿瘤免疫,并抑制肿瘤生长、转移和复发。
在此,我们合成了锰掺杂Ni2S3纳米电极(MnNi2S3 NEs),用于电催化氢气递送和激活抗肿瘤免疫,以增强有效的氢气免疫治疗(见图示1)。处于高氧化态的镍原子具有空的3d轨道,有效地促进了H₂O的吸附,并降低了HER的初始能垒。此外,引入锰原子调节了镍原子的电子结构,促进了生成氢气的脱附,从而增强了MnNi2S3 NEs的电催化活性。由于MnNi2S3 NEs优异的HER活性和长期稳定性,以电压依赖的方式实现了用于EHT的大量氢气可控递送。正如预期的那样,MnNi2S3 NE介导的EHT通过在安全的外加电压下诱导线粒体功能障碍和细胞内氧化应激,引发了有效的细胞死亡。有趣的是,通过典型的ROS/caspase-1/GSDMD信号通路激活了焦亡。细胞焦亡随后导致了促炎性免疫原性细胞死亡(ICD)的产生,释放了损伤相关分子模式(DAMPs)以引发潜在的免疫反应。实际上,MnNi2S3 NE介导的EHT通过促进CD8⁺T细胞向肿瘤的浸润,激发了抗肿瘤免疫,调节了免疫抑制微环境。由于强大的免疫反应,联合氢气免疫疗法通过CTLs成功迁移到远处肿瘤以及记忆T淋巴细胞的分化,有效地抑制了肿瘤转移和复发。因此,我们的工作提供了一种具有高HER活性的电催化剂,用于协同气体免疫疗法,突出显示了基于电催化剂的肿瘤治疗的发展。
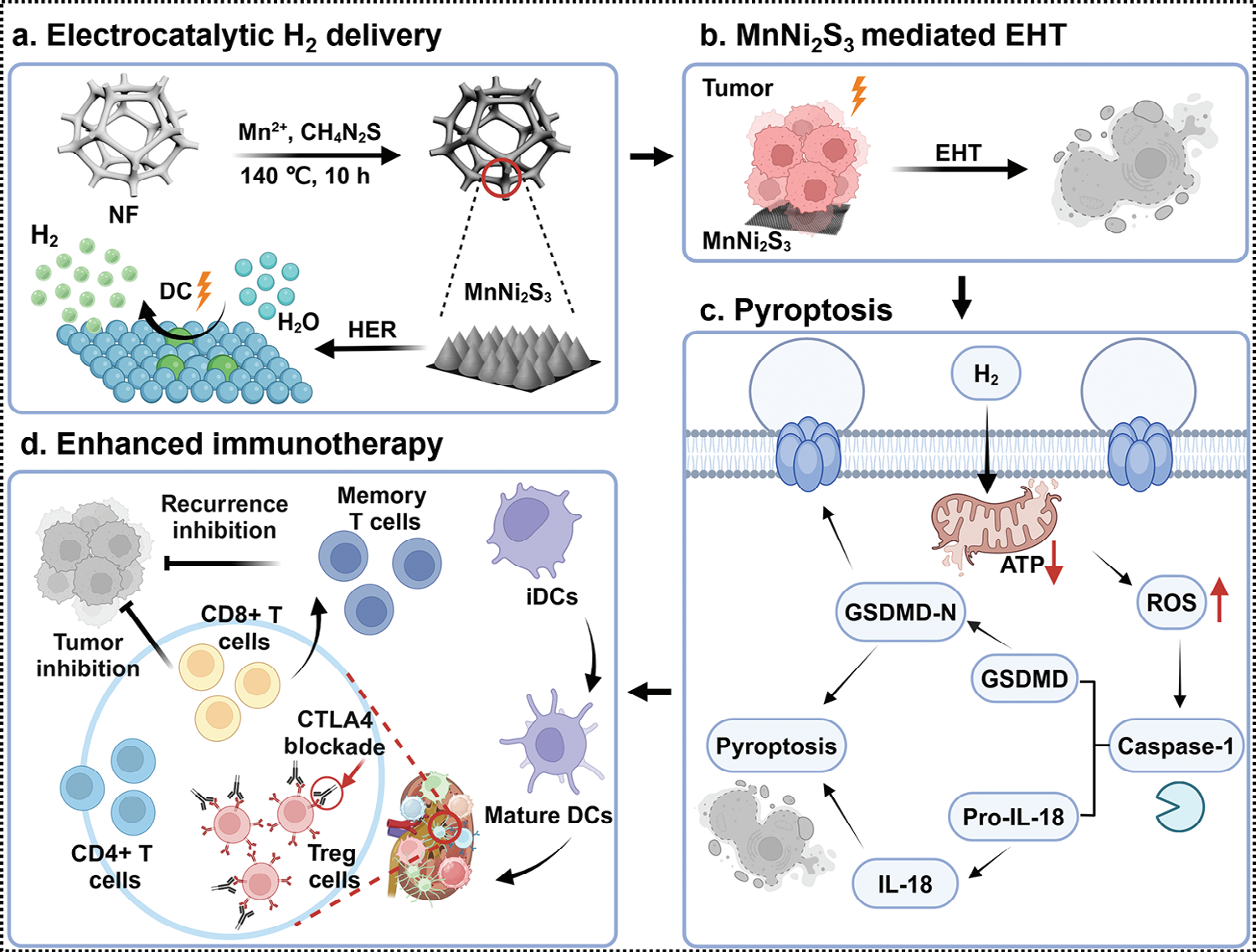
图示1 调节MnNi2S3纳米电极的电子结构,用于电催化氢气递送和增强基于T细胞的氢气免疫疗法。a) 将锰原子掺入MnNi2S3 NEs中以提高HER活性。b,c) 将MnNi2S3 NEs应用于电催化氢气疗法,通过典型的ROS/caspase-1/GSDMD途径诱导氧化应激和细胞焦亡。d) MnNi2S3 NE介导的EHT通过促进CTLs浸润提高了肿瘤的免疫原性,有效抑制了肿瘤生长、转移和复发。
结果与讨论
2.1 MnNi2S3 NEs的合成与表征
通过简便的水热法在三维网络结构的镍泡沫(NF)上合成了锰掺杂的镍三硫化物纳米阵列(MnNi2S3 NAs)(见图1a)。NF、MnCl₂和硫脲分别作为Ni、Mn和S源,用于MnNi2S3的生长。为了优化结构,在不同水热温度下合成了MnNi2S3。在100°C时MnNi2S3的生长受到限制,而在160°C时MnNi2S3聚集形成大团簇(见图S1,支持信息)。相反,在140°C时,在NF表面形成了一层均匀的MnNi2S3 NAs,这被选为后续的水热反应温度(见图1b和图S2,支持信息)。所制备的MnNi2S3 NAs形成了具有有序锥形形态的多孔结构,这与未掺杂的Ni2S3 NAs一致,表明锰原子的掺杂对形态没有影响(见图1c和图S3,支持信息)。MnNi2S3 NAs的晶格间距为2.86 Å,归属于Ni2S3 heazlewoodite相的(−110)晶面(2.865 Å)(见图1d,e)。MnNi2S3 NAs的X射线衍射(XRD)图谱在31.15°、37.77°和49.77°处显示出特征峰,分别归属于heazlewoodite相中的(−110)、(111)和(120)晶面(JCPDS No. 73-0698,见图1f)。值得注意的是,与Ni2S3相比,MnNi2S3的特征峰显示出轻微的蓝移,这表明由于锰原子取代镍原子导致晶格膨胀。MnNi2S3 NAs的元素映射图像和元素分散光谱(EDS)谱图揭示了Mn、Ni和S的均匀分布(见图1g和图S4、S5,支持信息),进一步证实了MnNi2S3 NAs的成功合成。此外,通过感应耦合等离子体质谱(ICP-OES)测定的MnNi2S3 NAs中锰的比例约为8.3 wt%。
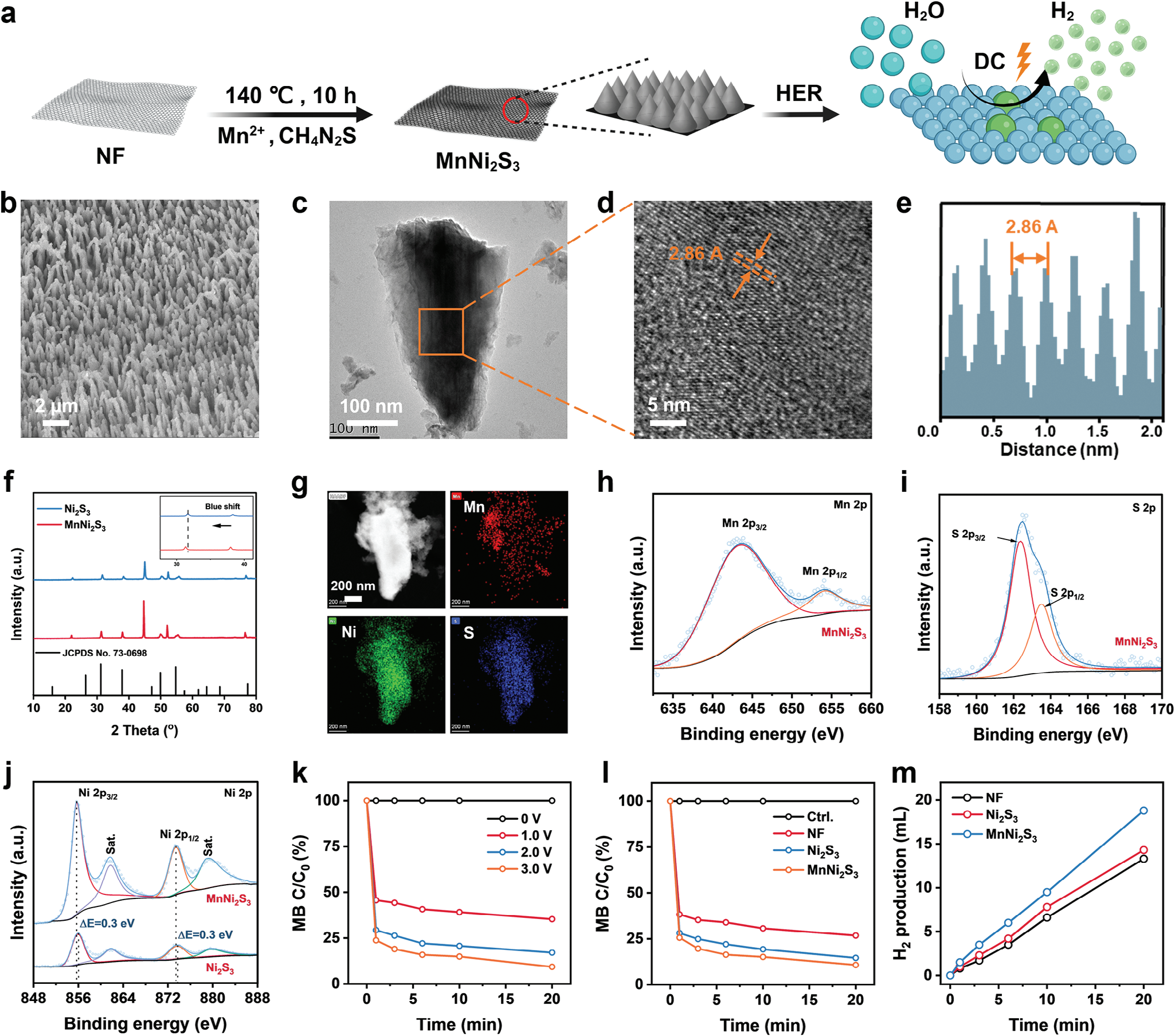
图1 MnNi2S3纳米电极的合成、表征和H2生成。a) MnNi2S3纳米电极合成的示意图。b) 扫描电子显微镜图像,c) 透射电子显微镜图像,d) 高分辨率透射电子显微镜图像,以及e) MnNi2S3纳米阵列的晶格间距。f) Ni2S3和MnNi2S3纳米阵列的X射线衍射(XRD)图谱。g) MnNi2S3纳米阵列的能量色散谱(EDS)元素映射图像。h) Mn 2p, i) S 2p, 和j) Ni 2P在MnNi2S3纳米阵列中的X射线光电子能谱(XPS)谱图。k) 不同应用电压下MnNi2S3纳米电极生成H2的亚甲基蓝降解速率图示,以及l) 在3.0 V时各种电极的比较。m) 通过气相色谱法对各种电极生成H2的定量测量。
镍原子的电子结构对基于镍催化剂的电催化活性有重要影响。处于高氧化态的镍原子,如Ni3+,有利于表面吸附H2O/H+,降低初始能量并改善析氢反应(HER)动力学。[16] 为了评估引入锰原子后镍原子电子结构可能发生的变化,进行了X射线光电子能谱(XPS)测量。MnNi2S3纳米阵列中Mn 2p光谱的两个特征峰分别位于643.76 eV和654.26 eV,对应于Mn2+ 2p3/2和Mn2+ 2p1/2(图1h)。对于MnNi2S3纳米阵列中S 2p光谱的特征峰,可以分解为一对S2− 2p3/2和S2− 2p1/2峰,分别位于≈162.38 eV和≈163.48 eV(图1i)。值得注意的是,与Ni2S3纳米阵列相比,MnNi2S3纳米阵列的S 2p光谱没有明显偏移(图S6,支持信息)。MnNi2S3纳米阵列的Ni 2p光谱显示了一对自旋-轨道双重峰,结合能分别为855.68 eV和873.48 eV,分别归属于Ni3+ 2p3/2和Ni3+ 2p1/2,同时还有两个振激伴峰(记为Sat.,图1j)。与Ni2S3纳米阵列中的Ni 2p相比,MnNi2S3纳米阵列中的Ni 2p的结合能负向移动了≈0.3 eV(855.98 eV对应于Ni3+ 2p3/2,873.78 eV对应于Ni3+ 2p1/2)。理论上,XPS峰的负向移动反映了由于掺杂外来原子引起的电子转移而导致的电子结构重构。因此,Ni 2p峰的负向移动表明由于引入锰原子导致镍原子的价态较低且结构富电子。重要的是,在MnNi2S3纳米阵列中未检测到Ni2+,这表明MnNi2S3中的镍原子处于高氧化态。
由于其优越的结晶性和成功的电子结构调节,MnNi2S3纳米电极被用作电解水制氢的电催化剂。使用基于MB-Pt的比色法来量化氢气的生成(图S7,支持信息)。随着施加电压的增加,MB的降解速率增加(图1k和图S8,支持信息),表明氢气生成受外部电场控制。此外,与NF和Ni2S3电极相比,MnNi2S3纳米电极产生了更多的氢气(图1l和图S9,支持信息)。进一步通过气相色谱法研究了氢气生成。在低应用电压下短时间内产生的大量氢气,表明MnNi2S3纳米电极在氢气疗法中有潜力实现高效和可控的氢气输送。
2.2 MnNi2S3纳米电极的析氢反应(HER)活性
为了揭示增强氢气生成的机制,采用三电极系统在中性电解质溶液(0.1 m PBS,pH = 7.0)中测量了MnNi2S3纳米电极的HER活性。MnNi2S3纳米电极作为工作电极,而石墨板作为对电极(图S10,支持信息)。在相同条件下也调查了Ni2S3、NF和商用Pt/C(20% Pt,负载于NF)电极的催化性能进行比较。值得注意的是,MnNi2S3纳米电极在测试的电极中表现出最佳的HER活性(图2a)。MnNi2S3纳米电极在电流密度为10 mA cm−2时的过电势(η10)为23 mV,甚至低于Pt/C电极(37 mV)。重要的是,Ni2S3纳米电极的η10显著降低,表明引入锰提高了HER性能(图2b)。与其他先前报道的基于镍的电催化剂相比,具有如此低过电势的MnNi2S3纳米电极表现更佳,例如CDs-Ni2S3(87 mV)、MnNiS2(71 mV)和CoNiSe2(82 mV),以及基于MOF、LDH和单原子催化剂的电催化剂。[18, 21] 为了进一步阐明增强的HER活性的机制,计算了测试样品的Tafel斜率。MnNi2S3纳米电极显示出31 mV dec−1的Tafel斜率,表明MnNi2S3表面的HER途径遵循Tafel反应(图1c)。此外,MnNi2S3纳米电极的Tafel斜率低于其他测试电极,表明MnNi2S3纳米电极的反应动力学更快。降低的过电势和Tafel斜率表明,通过引入锰原子调节镍原子的电子结构,增强了Ni2S3催化剂的HER活性。
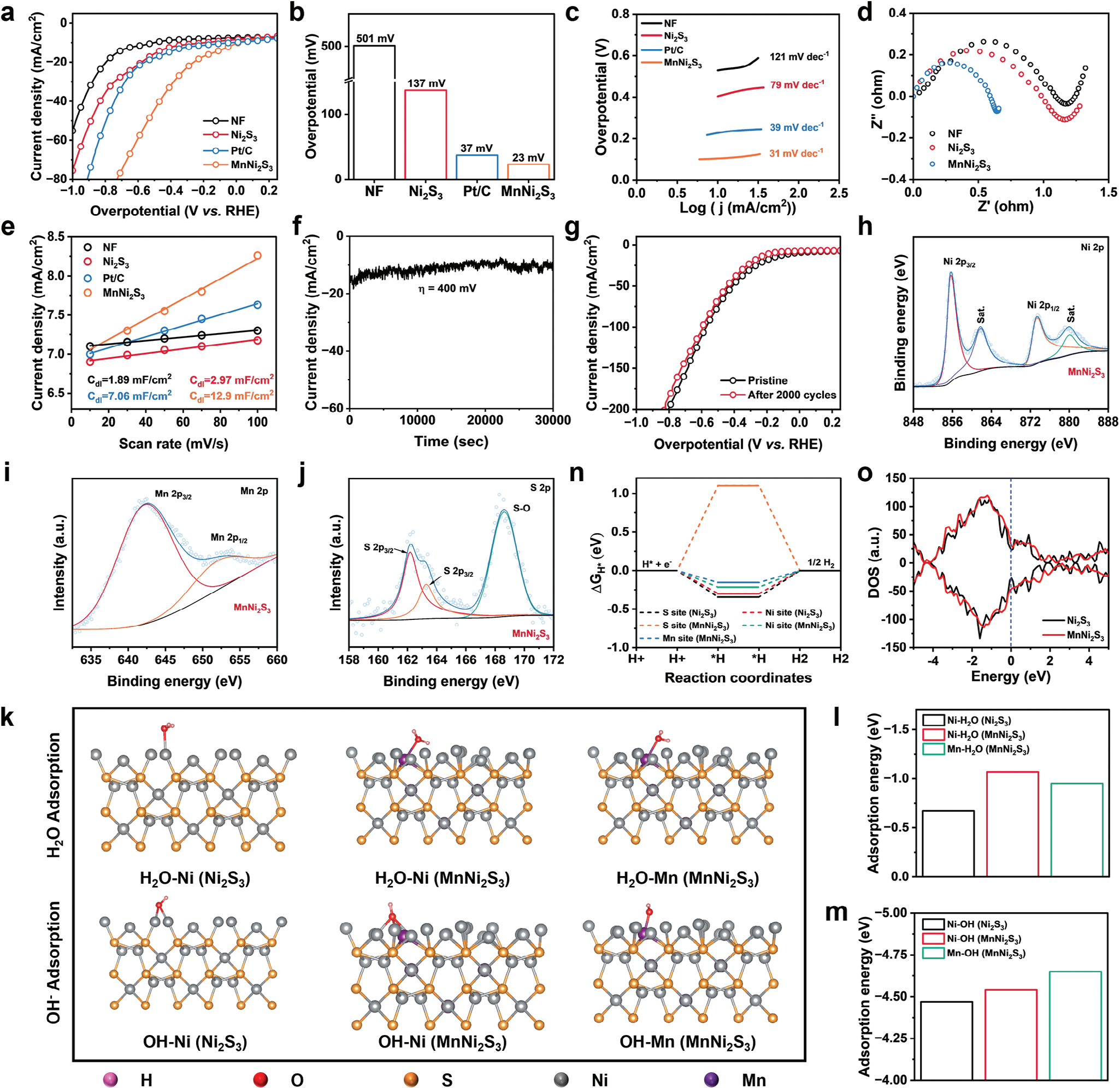
图2 MnNi2S3纳米电极的析氢反应活性和稳定性。a) 线性扫描伏安法曲线,b) 在10 mA cm^-2电流密度下的过电势,c) Tafel斜率,d) 电化学阻抗谱曲线,e) 双电层电容图示。f) MnNi2S3纳米电极在400 mV过电势下的长期稳定性测试。g) MnNi2S3纳米电极在2000个循环伏安周期前后的线性扫描伏安法曲线。h) 运行8小时后的XPS光谱,包括i) Ni 2p, j) Mn 2p和k) S 2p。l) H2O和m) OH^-在Ni2S3和MnNi2S3纳米电极(−110)晶面上的吸附能。n) Ni2S3和MnNi2S3纳米电极在不同活性位点的理论HER自由能图。o) Ni2S3和MnNi2S3纳米电极表面的态密度。
在电化学过程中,通过记录被测电极的电化学阻抗谱(EIS)来研究电阻。与其它电极相比,MnNi2S3纳米电极表现出较小的电荷转移电阻值(Rct,即EIS谱的半圆部分),表明其电子传导性增强(图1d)。此外,通过测量不同扫描速率的循环伏安曲线(CV)上的双层电容(Cdl)评估了电化学活性表面积(ECSA)。MnNi2S3纳米电极的Cdl为12.9 mF cm^-2,远高于未掺杂的Ni2S3纳米电极(2.97 mF cm^-2)、Pt/C(7.06 mF cm^-2)和NF(1.89 mF cm^-2),表明MnNi2S3纳米电极具有最多的HER过程活性位点(图2e和图S11,支持信息)。
电极的长期稳定性是电催化剂的另一个关键特性。通过在0.1 m PBS(pH = 7)中以400 mV的过电势应用计时电流法评估了MnNi2S3纳米电极的稳定性。在8小时的测量过程中,电流密度从约15 mA略微衰减到约11 mA,表明MnNi2S3在生理条件下具有良好的稳定性(图2f)。尽管电流密度有轻微减少,但MnNi2S3用于体外或体内电催化H2治疗的时间仅为5–15分钟,在此期间电流密度几乎保持不变。此外,进行了加速降解测试(ADT)以进一步检查MnNi2S3纳米电极的稳定性。MnNi2S3纳米电极的线性扫描伏安法曲线在2000个CV周期后没有明显变化,验证了该电催化剂的优异稳定性(图2g)。此外,MnNi2S3纳米电极在HER过程中没有降解,并且在2000个CV周期后没有从NF上脱落(图S12,支持信息)。通过XPS检查了ADT后Ni、Mn和S的价态。Ni 2p和Mn 2p的结合能与ADT之前相比没有明显变化。由于S 2p峰的氧化,出现了一个归因于S─O键的新峰(168.48 eV)(图2h–j)。
基于密度泛函理论(DFT)的模拟计算进一步阐明了掺杂Mn原子对MnNi2S3纳米电极内在HER活性的影响。(−110)晶面用于模拟计算,因为该表面暴露在MnNi2S3纳米电极的表面,如透射电子显微镜(TEM)图像所示(图1c,d)。由于MnNi2S3纳米电极的晶体结构与未掺杂的Ni2S3纳米电极一致,因此计算采用由2个Mn原子、23个Ni原子和38个S原子组成的模型(掺杂比例为8.3%,Mn原子在Ni原子的替换位点)。在中性条件下,HER通过吸附H2O并裂解H─O键生成吸附的H(Hads)和OH^-(Volmer步骤)开始。因此,计算了H2O和OH^-在Ni2S3和MnNi2S3表面上的吸附能,以评估Mn掺杂对Ni位点的电子结构的调节(图2k)。MnNi2S3纳米电极在Ni位点(-0.96 eV)和Mn位点(-1.01 eV)的ΔEH2O绝对值明显高于Ni2S3纳米电极(Ni位点,-0.68 eV),表明Mn原子的替代成功降低了吸附H2O的能量障碍(图2l)。在Mn位点和Ni位点也观察到ΔEOH绝对值的增加(图2m)。|ΔEH2O|和|ΔEOH|的增加主要归因于Mn原子由于未充满的3d轨道而具有的电负性和化学吸附能力,这显著加速了初始Volmer步骤。随后,MnNi2S3纳米电极表面上生成的Hads会结合生成H2。在催化剂表面上吸附的H*(ΔGH*)的吉布斯自由能是描述HER活性的关键指标。较小的|ΔGH*|意味着生成的H2更倾向于从催化剂表面脱附。由于在Ni2S3的Ni位点ΔGH*(-0.30 eV)远低于0 eV,H2的生成受到强烈阻碍(图2n)。相比之下,MnNi2S3纳米电极在Ni位点(-0.19 eV)和Mn位点(-0.15 eV)表现出更小的|ΔGH*|,表明Ni与H之间的结合能降低。考虑到Ni原子是H2生成的主要活性位点,这些结果表明H2的吸附-脱附特性显著改善。此外,计算了表面总态密度(DOS)以研究催化剂的电导率。MnNi2S3纳米电极表面的DOS分布和费米能级附近的电子占据情况较未掺杂的Ni2S3纳米电极有所增加,表明引入Mn原子后MnNi2S3纳米电极的电导率提高(图2o)。这种改进的电导率归因于Mn原子的引入,它加速了电荷转移速率以提高MnNi2S3纳米电极的HER活性。
基于上述结构分析和理论模拟计算,MnNi2S3纳米电极(NEs)优异的HER活性可归因于以下几方面的综合作用。首先,由NF支撑的多孔三维结构的圆锥形MnNi2S3 NEs为HER反应物(H2O、OH⁻等)的接触和生成的H2气体的释放提供了丰富的活性位点。同时,引入低电负性的Mn原子诱导电子从Mn向Ni原子转移,将Ni原子调节为富电子位点。因此,MnNi2S3对H2O和OH⁻吸附的能量障碍降低,而Ni─H键的强度减弱,从而促进H2脱附。另一方面,引入的Mn原子本身作为H2O裂解和H2生成的活性位点,进一步改善了MnNi2S3 NEs的HER活性。最后,MnNi2S3在Ni泡沫支撑上的直接生长保证了电极的高导电性,通过掺杂Mn异原子进一步增强。此外,坚固的NF骨架与MnNi2S3的良好结合显著提高了电极的长期稳定性。
2.3 体外MnNi2S3介导的氢气疗法
精确控制大量H2的传递有望提高氢气疗法的疗效。[22]受控H2生成的显著HER活性启发,MnNi2S3 NEs随后被用于EHT(图3a)。首先通过与人类脐静脉内皮细胞(HUVECs)不同时间的孵育来研究MnNi2S3 NEs对正常细胞的毒性。HUVECs的细胞活力与对照组相当,表明MnNi2S3 NEs对正常细胞无明显细胞毒性(图S13,支持信息)。为了研究MnNi2S3 NEs在EHT中的体外抗癌性能,用不同的应用电压处理CT26肿瘤细胞(图3b)。当施加的电压低于1.5 V时,CT26细胞的活力几乎没有变化。相比之下,当电压为2.0 V和3.0 V时,细胞活力分别降至约52.9%和16.7%,表明MnNi2S3 NE介导的EHT具有优越的抗癌效果。此外,虽然单独的MnNi2S3 NEs没有明显的细胞毒性,但MnNi2S3 NEs加直流电导致约83.1%的细胞死亡(图3c)。还施加了一个外部直流电场进行比较,结果导致约62.5%的细胞死亡。EHT后,用Calcein-AM和碘化丙啶(PI)对CT26细胞进行双染,以可视化活细胞和死细胞。与MTT结果一致,经过EHT处理的CT26细胞显示出强烈的红色荧光,进一步证实了MnNi2S3 NE介导的EHT的抗癌功效(图3d)。此外,通过流式细胞术分析定量研究了各种治疗后的细胞死亡情况(图3e)。MnNi2S3 NE介导的EHT比其他治疗引发了更多的细胞死亡。有趣的是,与对照组相比,早期和晚期凋亡过程中细胞的比例减少,而非凋亡细胞(Annexin-V−PI+)的比例显著增加,这表明EHT引发的细胞死亡不是通过凋亡途径发生的(图3f)。在HER过程中,H2O还原为H2和OH⁻离子,导致肿瘤微环境(TME)的pH值增加。为了探讨细胞死亡是否由pH值增加引起,将CT26细胞在不同pH值(4至10)的培养基中孵育(图S14,支持信息)。有趣的是,尽管酸性培养基诱导了明显的细胞死亡,碱性培养基并未抑制细胞增殖。此外,MnNi2S3 NEs在EHT过程中保持稳定,未释放对正常细胞有毒的高浓度Ni3+或Mn2+离子(图S15和S16,支持信息)。所有这些结果表明,MnNi2S3 NE介导的EHT引发的细胞死亡是由于电催化生成的H2而不是由于pH变化或金属离子的释放引起的。

图3 MnNi2S3 NE介导的电催化H2治疗的体外实验。a) MnNi2S3 NE在直流电场下诱导细胞死亡的示意图(G1:对照组,G2:MnNi2S3 NEs,G3:DC,G4:MnNi2S3 NEs加DC)。b) 在不同电压下用MnNi2S3 NEs加DC电场处理后CT26细胞的细胞活力。c) 各种处理后CT26细胞的细胞活力。d) 各种处理后用Calcein-AM和PI共染的CT26细胞的共聚焦图像。e) 流式细胞术分析和f) 各种处理诱导的CT26细胞死亡定量分析。g) 各种处理后用JC-1染色的CT26细胞的共聚焦图像。h,i) 流式细胞术分析各种处理后CT26细胞线粒体膜电位变化。j) 各种处理后CT26细胞内ATP合成情况。k) 各种处理后用DCFH-DA染色的CT26细胞的共聚焦图像,显示细胞内ROS水平。n.s.: p > 0.05, *p < 0.05, **p < 0.01, ***p < 0.001,数据表示为平均值 ± 标准差。
作为一种小气体分子,H2能够自由穿透膜系统参与多种生化反应。由于其内在的抗氧化特性,H2参与了有氧呼吸的电子传递链。为了阐明MnNi2S3 NE介导的EHT诱导的细胞死亡机制,我们首先用JC-1指示剂研究了线粒体功能。一般来说,JC-1探针在线粒体基质中聚集发出红色荧光,并随着线粒体膜电位(MMP)的损失而解聚,产生绿色荧光。结果显示,MnNi2S3 NE单独作用诱导的MMP变化可以忽略不计(图3g)。相比之下,DC处理后红色荧光信号强度降低,绿色信号强度增加。经过MnNi2S3 NE介导的EHT处理后,指示MMP损失的绿色荧光信号进一步增强。此外,通过流式细胞术分析定量检查了线粒体膜的去极化(图3h,i)。与对照组相比,MnNi2S3 NE介导的EHT组细胞中JC-1单体比例增加了约44.1%,进一步验证了线粒体功能障碍。线粒体是能量生产工厂,线粒体功能障碍导致ATP生成减少。如预期的那样,与对照组相比,经MnNi2S3 NE介导的EHT处理的CT26细胞产生的ATP减少了约68.1%(图3j)。线粒体功能障碍导致氧化应激增强。实际上,细胞内ROS水平的流式细胞术分析显示,与对照组相比,MnNi2S3 NE介导的EHT诱导的氧化应激增加(图S17,支持信息)。然后通过共聚焦显微镜可视化了各种处理后的细胞内ROS水平。与其他组相比,经MnNi2S3 NE介导的EHT处理的CT26细胞显示出最亮的绿色荧光信号,表明EHT诱导了增强的氧化应激(图3k)。由于其抗氧化和抗炎作用,H2气体已被用于治疗恶性肿瘤。[1]然而,氢疗法的抗癌机制仍然不明确。以前的研究表明,H2气体与羟基自由基(•OH)反应并在肿瘤细胞中修复线粒体功能。[2,4]然而,这些研究是在低浓度的H2气体下进行的,ROS的清除有促进肿瘤生长和转移的风险。与传统的H2释放平台不同,具有出色HER活性的MnNi2S3 NE在低过电位下释放大量H2气体。大量的H2气体扩散到细胞胞质和细胞器中,通过使MMP去极化破坏了细胞内的氧化还原平衡,导致细胞死亡。
2.4 MnNi2S3介导的EHT诱导的焦亡和ICD
MnNi2S3 NE通过电催化还原H2O产生的大量H2气体强烈影响了肿瘤细胞的氧化还原平衡。然而,EHT诱导的细胞死亡并未通过凋亡过程发生(图3e)。因此,MnNi2S3 NE介导的EHT的机制仍有待发现。由于H2气体诱导细胞内氧化应激,我们假设细胞中的大量H2将导致焦亡,其特征是细胞膜肿胀。为了验证这一假设,用PI和Annexin-V FITC对MnNi2S3 NE介导的EHT后的CT26细胞进行双重染色,分别可视化细胞核和细胞膜。如预期的那样,处理后的CT26细胞表现出典型的焦亡特征,具有肿胀的细胞膜和大泡(红色箭头,图4a)。处理后的细胞核被PI染色,显示出红色荧光信号,一些细胞膜破裂,留下裸露的细胞核。为了进一步阐明细胞死亡机制,使用包括凋亡抑制剂Z-VAD-fmk(ZVAD)、坏死抑制剂necrostatin-1(Nec-1)和焦亡抑制剂VX765在内的各种细胞死亡抑制剂进行了细胞活力研究。虽然凋亡抑制剂和坏死抑制剂未能挽救EHT诱导的细胞死亡,但焦亡抑制剂提高了EHT后CT26细胞的活力,表明细胞死亡是通过焦亡途径诱导的(图S18,支持信息)。此外,调查了EHT后的乳酸脱氢酶(LDH)释放以进一步验证焦亡。值得注意的是,虽然MnNi2S3 NE单独未诱导LDH释放,但MnNi2S3 NE加DC促进了约160%的LDH释放增加,表明细胞膜渗透性增强(图4c)。为了阐明MnNi2S3 NE介导的EHT诱导的细胞焦亡机制,通过蛋白质印迹法研究了典型焦亡信号通路中节点蛋白的表达。值得注意的是,MnNi2S3 NE介导的EHT显著增加了切割的caspase-1的表达,而caspase-1的活性在EHT后下调(图4b和图S19,支持信息)。此外,MnNi2S3 NE介导的EHT下调了GSDMD的表达,上调了GSDMD-N的表达,表明成功切割并暴露了GSDMD的N端。[23]尽管caspase-3的表达水平下降,但EHT后未观察到切割的caspase-3的表达(图S20和S21,支持信息)。也没有检测到GSDME-N的表达,表明焦亡不是通过caspase-3/GSDME途径发生的。此外,促炎细胞因子IL-18的分泌在EHT后也增加。蛋白质印迹分析表明,MnNi2S3 NE介导的EHT诱导的焦亡依赖于典型的ROS/caspase-1/GSDMD途径。
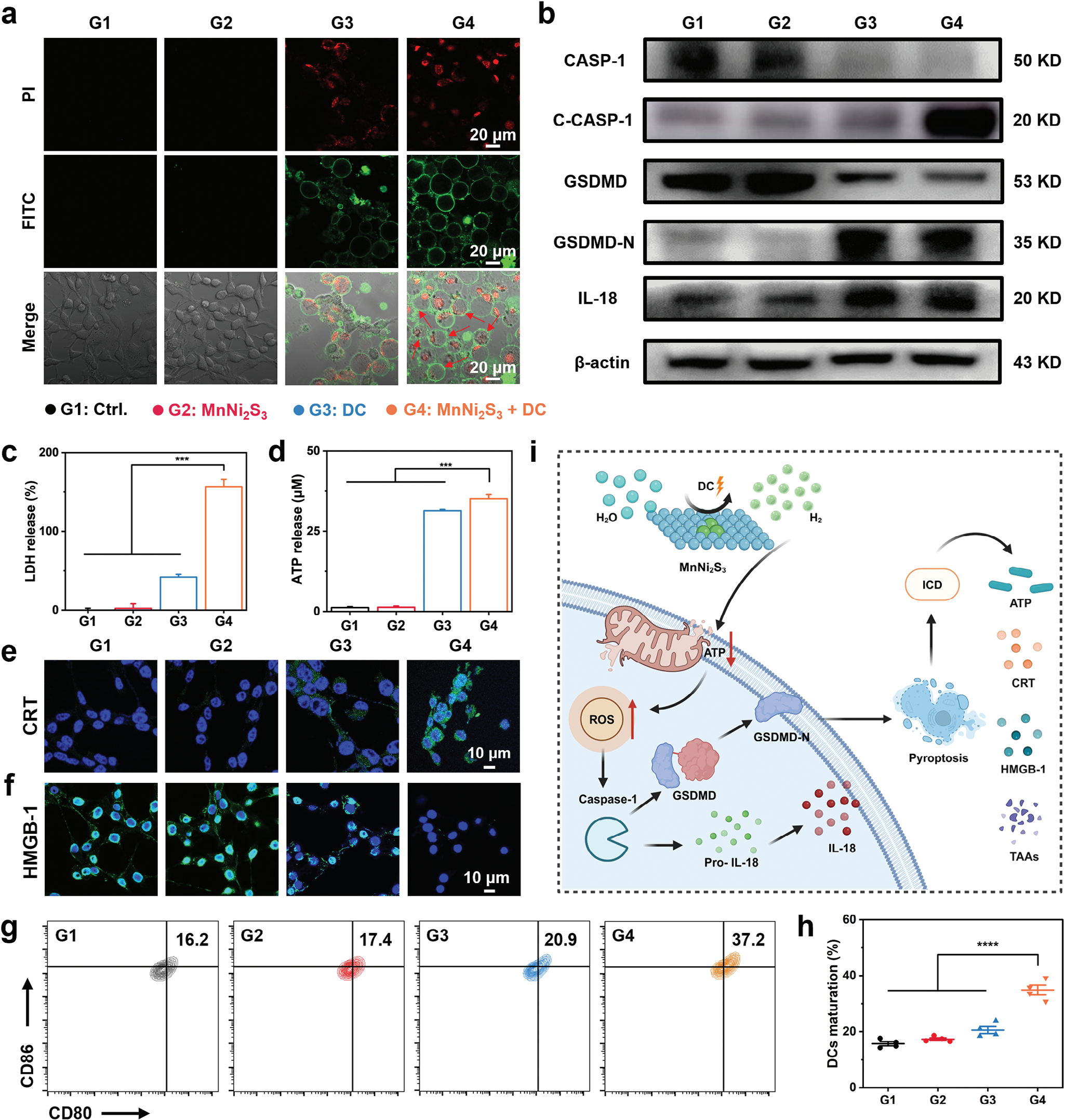
图4 MnNi2S3 NE介导的电催化H2治疗的体外实验。a) MnNi2S3 NE在直流电场下诱导细胞死亡的示意图(G1:对照组,G2:MnNi2S3 NEs,G3:DC,G4:MnNi2S3 NEs加DC)。b) 在不同电压下用MnNi2S3 NEs加DC电场处理后CT26细胞的细胞活力。c) 各种处理后CT26细胞的细胞活力。d) 各种处理后用Calcein-AM和PI共染的CT26细胞的共聚焦图像。e) 流式细胞术分析和f) 各种处理诱导的CT26细胞死亡定量分析。g) 各种处理后用JC-1染色的CT26细胞的共聚焦图像。h,i) 流式细胞术分析各种处理后CT26细胞线粒体膜电位变化。j) 各种处理后CT26细胞内ATP合成情况。k) 各种处理后用DCFH-DA染色的CT26细胞的共聚焦图像,显示细胞内ROS水平。n.s.: p > 0.05, *p < 0.05, **p < 0.01, ***p < 0.001,数据表示为平均值 ± 标准差。
作为一种小气体分子,H2能够自由穿透膜系统参与多种生化反应。由于其内在的抗氧化特性,H2参与了有氧呼吸的电子传递链。为了阐明MnNi2S3 NE介导的EHT诱导的细胞死亡机制,我们首先用JC-1指示剂研究了线粒体功能。一般来说,JC-1探针在线粒体基质中聚集发出红色荧光,并随着线粒体膜电位(MMP)的损失而解聚,产生绿色荧光。结果显示,MnNi2S3 NE单独作用诱导的MMP变化可以忽略不计(图3g)。相比之下,DC处理后红色荧光信号强度降低,绿色信号强度增加。经过MnNi2S3 NE介导的EHT处理后,指示MMP损失的绿色荧光信号进一步增强。此外,通过流式细胞术分析定量检查了线粒体膜的去极化(图3h,i)。与对照组相比,MnNi2S3 NE介导的EHT组细胞中JC-1单体比例增加了约44.1%,进一步验证了线粒体功能障碍。线粒体是能量生产工厂,线粒体功能障碍导致ATP生成减少。如预期的那样,与对照组相比,经MnNi2S3 NE介导的EHT处理的CT26细胞产生的ATP减少了约68.1%(图3j)。线粒体功能障碍导致氧化应激增强。实际上,细胞内ROS水平的流式细胞术分析显示,与对照组相比,MnNi2S3 NE介导的EHT诱导的氧化应激增加(图S17,支持信息)。然后通过共聚焦显微镜可视化了各种处理后的细胞内ROS水平。与其他组相比,经MnNi2S3 NE介导的EHT处理的CT26细胞显示出最亮的绿色荧光信号,表明EHT诱导了增强的氧化应激(图3k)。由于其抗氧化和抗炎作用,H2气体已被用于治疗恶性肿瘤。[1]然而,氢疗法的抗癌机制仍然不明确。以前的研究表明,H2气体与羟基自由基(•OH)反应并在肿瘤细胞中修复线粒体功能。[2,4]然而,这些研究是在低浓度的H2气体下进行的,ROS的清除有促进肿瘤生长和转移的风险。与传统的H2释放平台不同,具有出色HER活性的MnNi2S3 NE在低过电位下释放大量H2气体。大量的H2气体扩散到细胞胞质和细胞器中,通过使MMP去极化破坏了细胞内的氧化还原平衡,导致细胞死亡。
2.4 MnNi2S3介导的EHT诱导的焦亡和ICD
MnNi2S3 NE通过电催化还原H2O产生的大量H2气体强烈影响了肿瘤细胞的氧化还原平衡。然而,EHT诱导的细胞死亡并未通过凋亡过程发生(图3e)。因此,MnNi2S3 NE介导的EHT的机制仍有待发现。由于H2气体诱导细胞内氧化应激,我们假设细胞中的大量H2将导致焦亡,其特征是细胞膜肿胀。为了验证这一假设,用PI和Annexin-V FITC对MnNi2S3 NE介导的EHT后的CT26细胞进行双重染色,分别可视化细胞核和细胞膜。如预期的那样,处理后的CT26细胞表现出典型的焦亡特征,具有肿胀的细胞膜和大泡(红色箭头,图4a)。处理后的细胞核被PI染色,显示出红色荧光信号,一些细胞膜破裂,留下裸露的细胞核。为了进一步阐明细胞死亡机制,使用包括凋亡抑制剂Z-VAD-fmk(ZVAD)、坏死抑制剂necrostatin-1(Nec-1)和焦亡抑制剂VX765在内的各种细胞死亡抑制剂进行了细胞活力研究。虽然凋亡抑制剂和坏死抑制剂未能挽救EHT诱导的细胞死亡,但焦亡抑制剂提高了EHT后CT26细胞的活力,表明细胞死亡是通过焦亡途径诱导的(图S18,支持信息)。此外,调查了EHT后的乳酸脱氢酶(LDH)释放以进一步验证焦亡。值得注意的是,虽然MnNi2S3 NE单独未诱导LDH释放,但MnNi2S3 NE加DC促进了约160%的LDH释放增加,表明细胞膜渗透性增强(图4c)。为了阐明MnNi2S3 NE介导的EHT诱导的细胞焦亡机制,通过蛋白质印迹法研究了典型焦亡信号通路中节点蛋白的表达。值得注意的是,MnNi2S3 NE介导的EHT显著增加了切割的caspase-1的表达,而caspase-1的活性在EHT后下调(图4b和图S19,支持信息)。此外,MnNi2S3 NE介导的EHT下调了GSDMD的表达,上调了GSDMD-N的表达,表明成功切割并暴露了GSDMD的N端。[23]尽管caspase-3的表达水平下降,但EHT后未观察到切割的caspase-3的表达(图S20和S21,支持信息)。也没有检测到GSDME-N的表达,表明焦亡不是通过caspase-3/GSDME途径发生的。此外,促炎细胞因子IL-18的分泌在EHT后也增加。蛋白质印迹分析表明,MnNi2S3 NE介导的EHT诱导的焦亡依赖于典型的ROS/caspase-1/GSDMD途径。
基于MnNi2S3 NE介导的EHT良好的生物安全性和出色的体外抗癌性能,进行了体内肿瘤治疗。CT26肿瘤被接种在小鼠后肢的皮下。当肿瘤达到≈150 mm3时,将荷瘤小鼠随机分组并进行以下处理。在第1组中,荷瘤小鼠未接受任何治疗(标记为Ctrl)。在第2组中,通过微创手术将MnNi2S3 NE植入肿瘤中。在第3组和第4组中,分别将NF电极和MnNi2S3 NE植入肿瘤中并连接到电源进行EHT(图5a)。MnNi2S3 NE的植入并没有抑制肿瘤生长(图5b)。DC抑制了肿瘤进展约27%(图S26,支持信息)。然而,治疗后的第10天肿瘤生长增加,表明疗效适中。值得注意的是,MnNi2S3 NE介导的EHT诱导了肿瘤的完全反应(CR),肿瘤抑制率为100%(图5c)。更重要的是,在整个治疗过程中没有观察到肿瘤复发。各种治疗后小鼠的照片进一步展示了肿瘤的大小。对照组的肿瘤迅速发育,而接受MnNi2S3 NE介导的EHT治疗的小鼠在肿瘤部位出现瘢痕,治疗后逐渐消退(图5d)。此外,接受MnNi2S3 NE介导的EHT治疗的小鼠表现出延长的生存期,并且在治疗期间没有死亡(图5e)。为了检验MnNi2S3 NE介导的EHT的生物安全性,对主要器官进行H&E染色以评估组织损伤。在所有治疗组中,心脏、肝脏、脾脏、肺或肾脏组织中均未检测到明显损伤,表明MnNi2S3 NE介导的EHT具有良好的生物安全性(图S27,支持信息)。所有组的小鼠体重均无变化,进一步验证了EHT的良好生物安全性(图S28,支持信息)。此外,对EHT后肿瘤附近的皮肤组织进行H&E和Ki67染色以检查可能由暴露的H2引起的损伤。结果显示,EHT后皮肤组织没有明显变化。这归因于从肿瘤组织扩散出来的低水平H2对正常组织无毒性(图S29,支持信息)。此外,研究了EHT后MnNi2S3 NE的形态和结构。MnNi2S3 NE不会从镍泡沫上脱落,并在体外和体内EHT后保持完整的锥形形状(图S30,支持信息)。此外,MnNi2S3 NE在体内EHT后的XRD图案没有明显变化,表明MnNi2S3 NE在EHT过程中保持稳定(图S31,支持信息)。通过H&E染色和Ki67免疫组化染色进一步研究了MnNi2S3 NE介导的EHT的抗癌效果。经过MnNi2S3 NE介导的EHT处理的肿瘤组织显示出最大的损伤面积,并且没有明显观察到Ki67表达(图5f,g)。此外,经过MnNi2S3 NE介导的EHT处理的肿瘤组织的TUNEL染色揭示了强烈的荧光信号,进一步验证了EHT的出色治疗效果(图5h)。为了确定MnNi2S3 NE介导的EHT诱导的ROS水平,用DCFH-DA探针染色肿瘤组织。与体外结果一致,MnNi2S3 NE介导的EHT后的肿瘤组织中的ROS水平显著高于其他组(图5i)。这些体内抗癌结果共同揭示,MnNi2S3 NE介导的EHT有效地消除了肿瘤,并且具有良好的生物安全性。
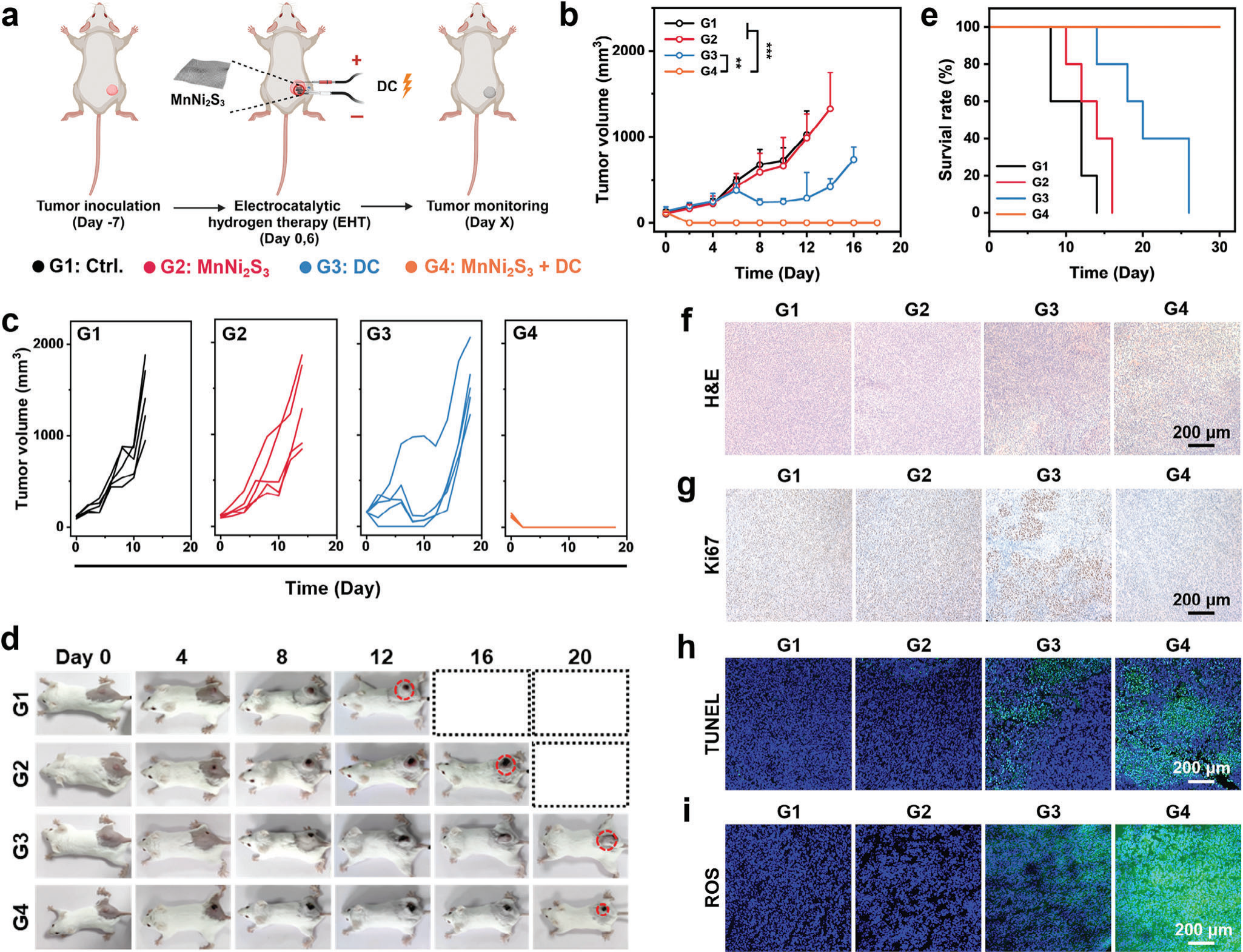
图5 MnNi2S3 NE介导的电催化氢气疗法的体内抗癌表现。(a)MnNi2S3 NE介导的电催化氢疗法的治疗程序(G1:对照组,G2:MnNi2S3 NE植入,G3:DC,G4:MnNi2S3 NE加DC)。b)各治疗组小鼠的肿瘤体积和c)个体小鼠的肿瘤生长曲线。d)治疗过程中不同处理后CT26荷瘤小鼠的数字照片。e)各处理后CT26荷瘤小鼠的生存时间。显微镜图像显示f)H&E染色和g)Ki67染色的肿瘤组织切片。共聚焦图像显示h)TUNEL和i)ROS染色的肿瘤组织切片。n.s.: p > 0.05, *p < 0.05, **p < 0.01, ***p < 0.001,数据表示为平均值±标准差。
2.6 体内免疫评估
基于体外细胞焦亡和ICD由EHT诱导的结果,我们推测该治疗激活了强大的免疫反应(图6a)。为了评估这一假设,用荧光探针偶联抗体染色不同处理后的肿瘤组织来研究体内ICD。如预期的那样,MnNi2S3 NE介导的EHT后的肿瘤显示出强烈的绿色荧光信号,表明CRT上调(图6b)。此外,MnNi2S3 NE介导的EHT还促进了HMGB-1的分泌。体内ICD诱导促使我们评估治疗后肿瘤和肿瘤引流淋巴结(TDLNs)中的免疫反应。与对照组相比,MnNi2S3 NE处理组表现出可忽略不计的树突状细胞成熟(图6c)。相比之下,MnNi2S3 NE介导的EHT显著刺激了树突状细胞的成熟至≈49.6%,因为垂死细胞中存在大量的TAAs。作为APCs,成熟的树突状细胞对于向T细胞呈递抗原以实现适应性抗肿瘤免疫非常重要。MnNi2S3 NE介导的EHT促进的树突状细胞成熟促进了T细胞活化以消除肿瘤细胞。[24] 因此,分析了不同处理后肿瘤中特定的T细胞。与其他组相比,MnNi2S3 NE介导的EHT后的肿瘤组织中检测到更多的CD3+ T细胞和CD8+ T细胞,表明EHT促进了T细胞浸润(图6d)。此外,通过流式细胞术评估了CD3+CD4+ T细胞(Th细胞)和CD3+CD8+ T细胞(CTLs)的细胞谱。一致性地,MnNi2S3 NE介导的EHT显著增加了Th细胞和CTLs的比例(图6e,f)。与对照组相比,Th细胞和CTLs的比例分别增加了≈11.6倍和≈11.2倍,表明基于T细胞的适应性免疫反应被有效激发。成功浸润到肿瘤部位的CTLs归功于MnNi2S3 NE介导的EHT所诱导的深刻ICD。[25] 值得注意的是,应用的DC电场也有助于CTLs的迁移。与对照组相比,DC电场促进了CTLs比例的增加。
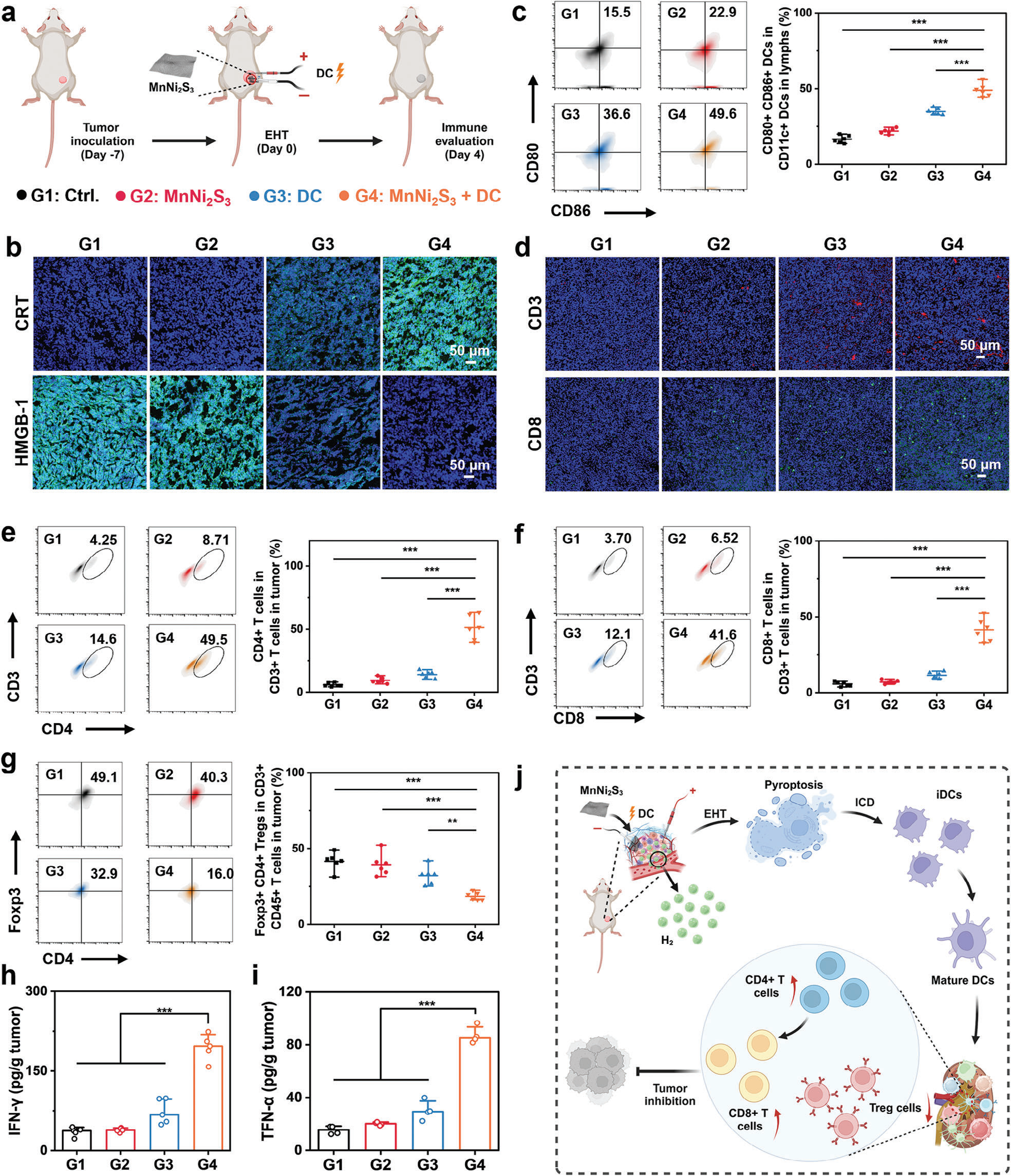
图6 MnNi2S3 NE介导的H2治疗诱导的免疫反应的体内评估。a) 体内免疫评估程序的示意图(G1: 对照组,G2: MnNi2S3 NE植入,G3: DC,G4: MnNi2S3 NE加DC)。b) 经各种处理后的肿瘤组织切片用荧光抗体染色的共聚焦图像,显示了CRT表达和HMGB-1分泌。c) 淋巴结中成熟树突状细胞(CD11c+CD80+CD86+)的代表流式细胞术分析和量化。d) 经各种处理后的肿瘤组织切片用CD3+和CD8+荧光抗体染色的共聚焦图像。e) CD4+T细胞在CD3+细胞中的代表流式细胞术分析和量化。f) CD8+T细胞在CD3+细胞中的代表流式细胞术分析和量化。g) 经各种处理后,肿瘤中Foxp3+CD4+调节性T细胞(Tregs)在CD3+CD45+细胞中的代表流式细胞术分析和量化。h) 经各种处理后,肿瘤中TNF-α和IFN-γ的分泌水平。i) 机制:MnNi2S3 NE介导的EHT激活的免疫反应(图6j)。n.s.: p > 0.05, *p < 0.05, **p < 0.01, ***p < 0.001,数据以平均值±标准差表示。
尽管有效的树突状细胞成熟和T淋巴细胞浸润,但抑制性的肿瘤免疫微环境减弱了适应性抗肿瘤免疫的抗肿瘤效果。因此,研究了EHT对免疫抑制性TME的调节作用。有趣的是,MnNi2S3 NE介导的EHT显著降低了Foxp3+CD4+调节性T细胞(Tregs)的比例(图6g)。先前研究表明,低剂量的H2可以通过消除ROS逆转Tregs的损失。相比之下,MnNi2S3 NE产生的大量H2引发了氧化应激,从而下调了Tregs。此外,EHT引发的ROS通过激活NF-κB通路将M2型巨噬细胞极化为M1型巨噬细胞。[26] 如预期的那样,MnNi2S3 NE介导的EHT有效促进了M1型巨噬细胞的表达,并减少了M2型巨噬细胞的比例(图S32和图S33,支持信息)。下调包括Tregs和M2型巨噬细胞在内的免疫抑制细胞,以及上调免疫支持性M1型巨噬细胞,有利于通过激活CTLs来消融肿瘤。此外,通过酶联免疫吸附试验(ELISA)检测了肿瘤中促炎细胞因子(如IFN-γ、TNF-α、IL-1β、IL-6和IL-12p70)和抗炎细胞因子(如IL-10)的分泌水平。结果显示,促炎细胞因子的表达显著增加,而抗炎细胞因子的表达减少(图6h、i和图S34,支持信息),表明成功调节了肿瘤免疫微环境。这些结果共同阐明了由MnNi2S3 NE介导的EHT引发的免疫反应机制(图6j)。简而言之,由EHT引发的免疫原性焦亡释放了大量TAAs,刺激了树突状细胞的成熟,随后向CTLs呈递抗原,从而实现有效的抗肿瘤免疫。下调Tregs和M2型巨噬细胞以及上调M1型巨噬细胞导致免疫抑制性TME的调节,进一步促进了适应性免疫反应,有效消融肿瘤。
2.7 H2免疫疗法与肿瘤再挑战联合治疗
基于ICB的免疫疗法的适度疗效可归因于由Tregs、MDSCs、M2型巨噬细胞和抗炎细胞因子等调节性免疫细胞建立的免疫抑制性肿瘤环境。受到MnNi2S3 NE介导的EHT有效CTLs浸润和免疫TME调节的鼓舞,我们将抗CTLA-4抗体(αCTLA-4)、一种CTLA-4抑制剂与EHT结合使用(称为EHIT),以抑制肿瘤生长、转移和复发。双侧荷瘤小鼠随机分为四组,接受以下治疗:1) 空白对照(称为Ctrl.);2) αCTLA-4注射(i.v.);3) MnNi2S3 NE介导的EHT;4) MnNi2S3 NE介导的EHT加αCTLA-4注射(i.v.,图7a)。由于免疫抑制性TME,基于αCTLA-4的单药治疗未能明显抑制原发或远处肿瘤(图7b–d和图S35,支持信息)。有趣的是,MnNi2S3 NE介导的EHT完全消融了原发肿瘤并抑制了远处肿瘤。这归功于MnNi2S3 NE介导的EHT激活的抗肿瘤免疫,且CTLs迁移到远处肿瘤进行肿瘤消除。此外,联合EHIT诱导了原发肿瘤的消融并显著抑制了远处肿瘤,暗示EHIT引发了出色的免疫反应。αCTLA-4的应用进一步阻断了Tregs,否则会下调CTLs的抗肿瘤效应。治疗后14天的小鼠照片进一步验证了EHIT的抗肿瘤效果(图7e)。此外,联合EHT延长了小鼠的生存时间,并且在治疗期间未因远处肿瘤引发死亡(图7f)。所有组的小鼠体重均无变化,表明EHIT具有良好的生物安全性(图S36,支持信息)。为进一步检验治疗效果,将经过各种处理后的肿瘤组织用H&E和Ki67染色。如预期,经过EHIT处理的肿瘤组织显示出最大的组织损伤和最低的Ki67表达,确认了EHIT的远端效应(图7g)。为了阐明EHIT抑制远处肿瘤的机制,将远处肿瘤中的CD3+T细胞和CD8+T细胞用荧光探针偶联抗体染色。有趣的是,EHIT显著促进了CD3+T细胞和CD8+T细胞浸润到远处肿瘤中(图7h)。这些结果表明,MnNi2S3 NE介导的EHT与ICB结合增强了抗肿瘤免疫,通过促进CTLs浸润到远处肿瘤中。
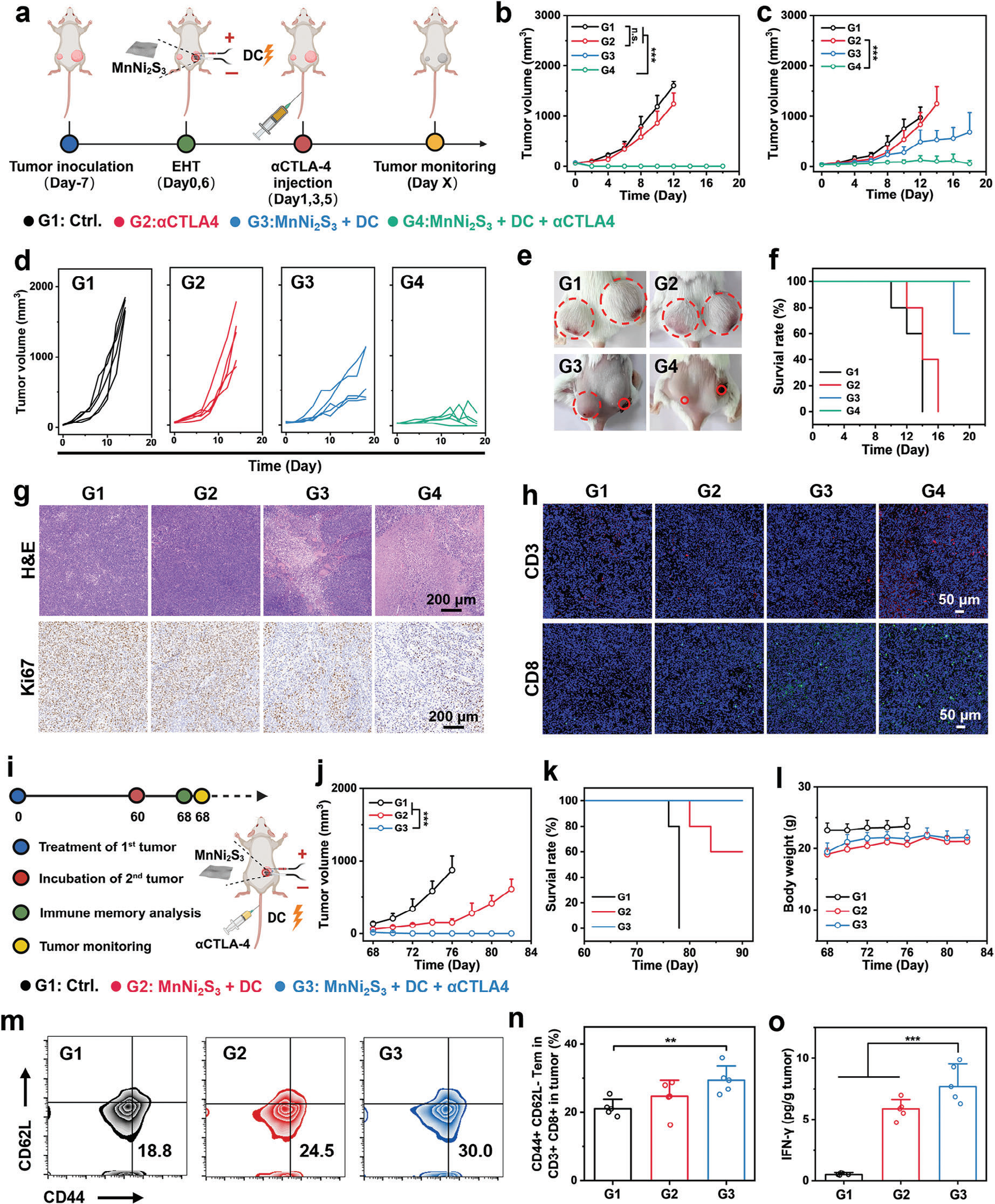
图7 MnNi2S3 NE介导的EHT与αCTLA-4联合治疗激活的抗癌性能和免疫记忆反应。a) 联合治疗程序,包括MnNi2S3 NE介导的H2 气体和αCTLA-4抗体(G1: 对照,G2: αCTLA-4注射,G3: MnNi2S3 NEs加DC,G4: MnNi2S3 NEs加DC和αCTLA-4注射)。b) 各种治疗后原发肿瘤的体积和c) 远处肿瘤的体积。d) 各种治疗后远处肿瘤的生长曲线。e) 各种治疗后CT26荷瘤小鼠的数字照片(第20天)。f) 各种治疗后CT26荷瘤小鼠的生存率。g) 各种治疗后用H&E和Ki67染色的肿瘤组织切片的显微镜图像。h) 各种治疗后用CD3+ 和CD8+ 荧光抗体染色的肿瘤组织切片的共聚焦图像。i) 联合治疗程序,包括MnNi2S3介导的EHT和αCTLA-4治疗(G1: 对照,G2: MnNi2S3 NEs加DC,G3: MnNi2S3 NEs加DC和αCTLA-4注射)。j) 各种治疗后肿瘤的体积,k) 生存时间和l) 小鼠的体重。m) 各种治疗后CD3+CD8+ T细胞中CD44+CD26L− Tem细胞的代表流式细胞术分析和n) 量化。o) 各种治疗后小鼠血液中IFN-γ的分泌水平。n.s.: p > 0.05, *p < 0.05, **p < 0.01, ***p < 0.001,数据以平均值±标准差表示。
MnNi2S3 NE介导的EHT刺激了CTLs浸润到肿瘤中以进行适应性抗肿瘤免疫。肿瘤消除后,一部分CTLs分化成记忆T淋巴细胞,产生长期抗肿瘤效果。[27] 为了检查EHIT是否刺激了记忆T细胞的表达,对CT26荷瘤小鼠进行了MnNi2S3 NE介导的EHT和EHIT治疗,以完全消除肿瘤。60天后,通过皮下注射CT26细胞进行了肿瘤再挑战(图7i)。与对照组相比,MnNi2S3 NE介导的EHT组在再挑战组中明显抑制了肿瘤生长,这归功于强大的免疫反应和CTLs激活(图7j)。此外,经过MnNi2S3 NE介导的EHIT处理的小鼠在肿瘤再挑战后没有发展出肿瘤,表明显著的长期免疫记忆效应。EHIT还延长了小鼠的生存时间(图7k)。此外,所有组的小鼠体重相似,进一步证实了EHT和EHIT的良好生物安全性(图7l)。为了阐明长期免疫记忆效应的机制,分析了各种治疗后第60天小鼠血液中记忆T细胞的细胞表型。效应记忆T细胞(CD3+CD8+CD44+CD62L−)的比例在EHIT组中显著高于对照组(图7m, n)。此外,EHIT上调了血液中IFN-γ的分泌(图7o)。当小鼠遇到相同的肿瘤细胞时,由EHIT激活的效应记忆T细胞迅速分化为效应T淋巴细胞,通过分泌IFN-γ消除肿瘤细胞。
3 结论
总之,MnNi2S3 NEs被设计用于电催化释放H2 以诱导焦亡,这有效地增强了肿瘤消除和抗肿瘤免疫,以抑制肿瘤转移和复发。具有3d空轨道的Ni原子通过促进表面吸附H2O来降低HER的初始能量。MnNi2S3 NEs的电催化活性通过引入Mn原子得到提升,这调节了Ni原子的电子结构。因此,具有高HER活性的MnNi2S3 NEs有利于以电压控制方式输送H2。体外结果表明,MnNi2S3 NE介导的EHT通过低施加电压有效诱导细胞死亡,破坏了线粒体功能和氧化状态。有趣的是,MnNi2S3 NE介导的EHT通过典型的ROS/caspase1/GSDMD信号通路诱导了焦亡。焦亡随后导致了促炎性ICD,释放TAAs和DAMPs以激活免疫反应。实际上,抗肿瘤免疫被激发,增强了CTLs浸润到肿瘤中并下调了抑制性肿瘤免疫微环境。由于强大的免疫反应,MnNi2S3 NE介导的EHT进一步与ICB结合使用,以抑制肿瘤转移和复发,这表明成功地将CTLs迁移到远处肿瘤并分化出记忆T淋巴细胞。因此,这项工作可能启发基于电催化剂和电激活的肿瘤免疫治疗策略的发展。
4 实验部分
材料与试剂
泡沫镍(NF)购自江苏A.K.X.材料科技有限公司。氯化锰(MnCl2)购自上海源叶生物科技有限公司。硫脲、氯铂酸(H2PtCl6)、亚甲基蓝(MB)和硼氢化钠(NaBH4)均购自上海阿拉丁生化科技股份有限公司。所有化学试剂均为分析纯,未经进一步提纯即直接使用。
MnNi2S3 NAs的制备
锰掺杂的镍三硫化物纳米阵列(MnNi2S3 NAs)通过水热法在NF表面制备。通常,将NF切成1 × 1 cm2(≈400 mg)的小块,并用乙醇和1.0 M 盐酸清洗30分钟,以去除表面污染物和氧化物(如NiO)。然后将150 mg硫脲和40 mg MnCl2溶解在25 mL去离子(DI)水中搅拌。将洗净并干燥的NF加入上述混合物中,并将整个系统转移到带有内衬特氟龙的高压釜中,在140 °C下进行水热生长10小时。最后,将制得的MnNi2S3 NAs用DI水洗涤并在60 °C下过夜干燥以备后续使用。通过调整水热温度(100–160 °C)来优化MnNi2S3 NAs的晶体结构。另外,通过类似程序制备了Ni2S3 NAs。
表征
扫描电子显微镜(SEM)图像通过Gemini500 SEM获得。透射电子显微镜(TEM)图像、元素映射图像和MnNi2S3 NAs的EDS光谱由Talos 200X TEM获取。Ni2S3 和MnNi2S3 NAs的XRD图谱由Empyrean sharp Alpha 1 XRD衍射仪记录。Ni2S3 和MnNi2S3 NAs的XPS光谱由ESCA Lab 250Xi XPS光谱仪获得。紫外-可见吸收光谱由PerkinElmer Lambda 750 UV-vis-NIR分光光度计记录。Mn和Ni在MnNi2S3 NAs中的含量通过PerkinElmer ICP-OES测定。
电催化H2 释放曲线通过气相色谱(GC2060,TCD检测器和Ar载体)测量。MnNi2S3 NEs的电化学性能,包括CV曲线、LSV曲线和EIS光谱,由CHI600D电化学工作站(上海晨华)研究。细胞凋亡、线粒体膜电位变化、胞内ROS水平、高迁移率蛋白1(HMGB1)和钙网蛋白(CRT)表达、树突状细胞成熟、CD4+ T和CD8+ T细胞、Treg细胞以及M1/M2型巨噬细胞的流式细胞分析由BD Biosciences Accuri C6流式细胞仪进行。活/死CT26肿瘤细胞、线粒体膜电位变化、胞内ROS水平、焦亡过程中形态变化的荧光图像、HMGB1分泌、CRT表达、TUNEL和ROS染色的肿瘤组织、HMGB1和CRT染色的肿瘤组织以及CD3+ T细胞和CD8+ T细胞的荧光染色由Zeiss Axio-Imager LSM-800共聚焦显微镜获取。
MnNi2S3 NEs的电催化H2 生成
MnNi2S3 NEs的电催化H2 生成首先通过MB-Pt比色法研究。通常,MB可以通过Pt纳米颗粒(Pt NPs)的催化被H2 降解。MB在664 nm处的吸光度与H2 的量线性相关。Pt NPs通过向2 mL氯铂酸(0.5 wt%)中逐滴加入100 µL硼氢化钠(2.0 mg mL−1)并在搅拌下合成。将制备的Pt NPs加入到MB溶液中制备MB-Pt探针。为了探讨各种电极的HER活性,MnNi2S3 NEs、Ni2S3和NF被引入MB-Pt探针溶液中。在不同电压(0–3 V)下施加直流(DC)20分钟。每个时间间隔,记录探针溶液的UV–vis光谱并计算生成的H2 气体量。此外,通过气相色谱(GC 2060,TCD检测器和Ar载体)定量检测MnNi2S3 电解催化生成的H2。
MnNi2S3 NEs的电催化活性
MnNi2S3 NEs的电催化HER活性在电化学工作站上使用三电极系统评估。石墨电极和Ag/AgCl电极分别用作对电极和参比电极。合成的MnNi2S3 NEs用作工作电极。作为比较,商业Pt/C(HPT020, 20% Pt)催化剂通过滴涂方法负载在NF上(Pt载量:2.0 mg cm−2)。所有测试均以0.1 m PBS为电解质。根据以下公式将电位值从E(Ag/AgCl)转换为E(RHE):E(RHE) = E(Ag/AgCl) + 0.194 + 0.0592 × pH。在进行HER活性测量之前,工作电极经过25个CV循环激活。CV曲线记录范围从−0.6到0.6 V,扫描速率为100 mV s−1。LSV测量从−1.0到0.25 V vs RHE进行,扫描速率为5.0 mV s−1。EIS光谱在开路电压下检测,频率范围从0.01到105 Hz。通过在非Faradaic区域以不同扫描速率(10–100 mV s−1)循环CV曲线来评估催化电极的电化学双层电容(Cdl)。为了研究MnNi2S3 NEs的稳定性,进行了过电位400 mV下的计时安培测量30,000秒。此外,通过多次CV循环进行加速应力测试2000次循环。所有补偿方法基于电化学工作站的自动补偿功能。
DFT模拟计算
所有自旋极化的密度泛函理论(DFT)计算通过Vienna ab initio模拟包(VASP)进行,采用投影缀加波(PAW)方法。电子-离子相互作用通过标准PAW势描述。使用平面波基组扩展波函数的平滑部分,动能截断为400 eV。电子-电子交换和关联相互作用通过Perdew–Burke–Ernzerhof(PBE)形式的广义梯度近似(GGA)描述。范德华相互作用通过DFT-D3BJ方法描述。为了研究表面反应的机制化学,用一个足够大的真空区域(15 Å)的平板模型模拟表面,以确保周期性图像良好分离。Brillouin区的积分通过Monkhorst–Pack网格的特殊点进行,间距为0.06 Å−1。电子自洽循环的收敛标准设置为10−5 eV。原子结构优化直到残余力小于0.03 eV Å−1。DFT模拟基于实验晶体结构进行,MnNi2S3 NEs的晶体结构与未掺杂的Ni2S3 NEs一致,计算采用包含2个Mn、23个Ni和38个S原子的模型(掺杂比例为8.3%,Mn替代Ni的位置)。研究了H2O/OH- 吸附,提供HER性能的理论证据。
体外电催化H2治疗
小鼠结肠癌细胞CT26、人脐静脉内皮细胞(HUVECs)、骨髓衍生树突状细胞(BMDCs)培养在含有10%胎牛血清和1%青霉素链霉素的RPMI-1640培养基中,并在37℃、5% CO2的培养箱中孵育。
对于体外肿瘤细胞杀伤研究,将CT26细胞接种到24孔板中并培养过夜。然后,用MnNi2S3、DC或MnNi2S3加DC处理接种的CT26细胞。电极放置在上层培养基中,不接触贴壁细胞。对DC施加3.0 V电压5分钟。然后,取出电极,继续培养细胞12小时。通过标准MTT方法测量细胞存活率。此外,将CT26细胞接种并用MnNi2S3 NEs加DC在不同施加电压(0–3 V)下处理,以研究细胞存活率。
对于细胞凋亡研究,将CT26细胞接种到24孔板中并用MnNi2S3加DC(3.0 V,5分钟)处理。然后将处理后的细胞用Calcein-AM和PI(Beyotime Biotechnology)在37℃下双重染色30分钟。用PBS洗涤染色细胞,使用共聚焦激光扫描显微镜(CLSM)记录荧光图像。此外,将CT26细胞接种并用MnNi2S3加DC处理,然后用Annexin V FITC和PI(Beyotime Biotechnology)对处理后的细胞进行双重染色30分钟。使用流式细胞仪(C6 plus流式细胞仪)定量评估细胞凋亡率。对照组包括空白对照、MnNi2S3和DC(3.0 V,5分钟)。
对于线粒体膜电位(MMP)变化研究,将CT26细胞接种到24孔板中并培养过夜。然后用MnNi2S3加DC(3.0 V,5分钟)处理细胞并培养6小时。按照提供的协议,用MMP检测试剂盒中的JC-1(Beyotime Biotechnology)在37℃下对处理后的细胞染色30分钟。用PBS洗涤后,使用CLSM观察染色细胞。此外,用MnNi2S3加DC处理CT26细胞,并按照上述协议用JC-1检测试剂盒染色。使用流式细胞术定量研究MMP变化。JC-1聚合物指示高MMP,而JC-1单体指示降低的MMP。对照组包括空白对照、MnNi2S3和DC(3.0 V,5分钟)。
对于ATP合成研究,将CT26细胞接种并用MnNi2S3加DC(3.0 V,5分钟)处理。然后裂解处理后的细胞并进行离心,使用ATP检测试剂盒(Beyotime Biotechnology)根据制造商的协议分析上清液。对照组包括空白对照、MnNi2S3和DC(3.0 V,5分钟)。
为了检测细胞内活性氧(ROS)水平,将CT26细胞接种到24孔板中并孵育过夜。将接种的细胞用MnNi2S3加DC(3.0 V,5分钟)处理并培养6小时。然后用DCFH-DA(20 × 10^-6 M, Beyotime Biotechnology)对处理后的细胞染色30分钟。用PBS多次洗涤后,通过CLSM观察染色细胞。此外,对经处理并用DCFH-DA染色的CT26细胞进行流式细胞术定量分析。对照组包括空白对照、MnNi2S3和DC(3.0 V,5分钟)。
由GSDMD途径诱导的焦亡
为了研究细胞死亡机制,将CT26细胞接种到24孔板中并培养过夜。然后用MnNi2S3加DC(3.0 V,5分钟)处理接种的CT26细胞。然后在培养基中加入抗凋亡剂(ZVAD,10 × 10^-6 M)、抗坏死剂(Nec1,10 × 10^-6 M)和抗焦亡剂(VX765,10 × 10^-6 M),并将细胞孵育12小时。通过标准MTT方法测量细胞存活率。
为了研究焦亡期间的细胞形态,将CT26细胞接种到共聚焦培养板中并培养过夜。将接种的细胞用MnNi2S3加DC(3.0 V,5分钟)处理,并用PI和Annexin V FITC(Beyotime Biotechnology)分别对细胞核和细胞膜进行双重染色,在37℃下染色1小时。用PBS洗涤染色细胞后,通过CLSM观察并记录细胞形态。对照组包括空白对照、MnNi2S3和DC(3.0 V,5分钟)。
为了研究胞外乳酸脱氢酶(LDH)释放,将CT26细胞接种并用MnNi2S3加DC(3.0 V,5分钟)处理。然后收集培养基上清液,离心并使用LDH细胞毒性检测试剂盒(Beyotime Biotechnology)根据制造商的协议进行分析。对照组包括空白对照、MnNi2S3和DC(3.0 V,5分钟)。
为了研究焦亡信号通路,通过蛋白质印迹法(Western blotting)定量评估节点蛋白的表达,包括caspase-1、caspase-3、切割的caspase-1、切割的caspase-3、GSDMD、GSDME、GSDMD-N、GSDME-N和IL-18。首先,将经过各种处理的CT26细胞离心并用PBS洗涤以收集细胞。收集的细胞在4℃下用裂解缓冲液裂解30分钟以获得总蛋白,随后使用BSA Pierce BCA蛋白质检测试剂盒(Thermo Fisher Scientific)对总蛋白进行定量。将相同量的总蛋白转移到聚偏二氟乙烯(PVDF)膜上进行聚丙烯酰胺凝胶电泳(PAGE)。在5% BSA中封闭2小时后,在4℃下与包括β-actin、caspase-1、caspase-3、切割的caspase-1、切割的caspase-3、GSDMD、GSDME、GSDMD-N、GSDME-N和IL-18在内的一抗和相应的二抗孵育过夜,使用增强化学发光(ECL)可视化蛋白质条带。β-actin蛋白用作参考蛋白。对照组包括空白对照、MnNi2S3和DC(3.0 V,5分钟)。
由电氢疗法诱导的免疫原性细胞死亡
为了研究电氢疗法(EHT)诱导的免疫原性细胞死亡(ICD),我们检测了CRT的表达、HMGB1的细胞外释放以及ATP的分泌。CT26细胞被接种在24孔板中,培养过夜。将接种的细胞用MnNi2S3加直流电处理(3.0 V, 5分钟),然后孵育2小时。处理后的细胞用多聚甲醛固定10分钟并用PBS洗涤。固定后的细胞用针对CRT的一抗和相应的Alexa Fluor 488偶联二抗染色。使用共聚焦激光扫描显微镜(CLSM)观察并记录染色的细胞。此外,还使用流式细胞术对染色细胞进行定量分析。采用类似的方法研究HMGB1的表达,只是在荧光染色前用Triton 100渗透细胞膜。对照组包括空白对照、MnNi2S3和直流电(3.0 V, 5分钟)。
对于细胞外ATP释放的研究,CT26细胞被接种并接受MnNi2S3加直流电处理(3.0 V, 5分钟)。孵育8小时后,收集培养基上清液,离心并使用ATP检测试剂盒(Beyotime Biotechnology)根据制造商的方案进行分析。对照组包括空白对照、MnNi2S3和直流电(3.0 V, 5分钟)。
对于体外树突状细胞成熟研究,从C57BL/6小鼠骨髓中获取骨髓衍生树突状细胞(BMDCs),并用IL-4和粒细胞巨噬细胞集落刺激因子(GM-CSF)培养一周。然后将BMDCs接种并用经MnNi2S3加直流电处理(3.0 V, 5分钟)的CT26细胞上清液孵育。用流式细胞术染色检测CD11c+细胞中的CD80+CD86+树突状细胞。
肿瘤模型
动物实验中,从常州卡文斯生物技术有限公司购买体重20克、6-8周龄的雌性Balb/c小鼠。所有动物实验均按照苏州大学实验动物中心批准的协议(No.202406A0460)进行。小鼠在恒温(21±1°C)和相对湿度(40%-70%)的动物房中饲养。所有实验小鼠提供特殊水和食物。
为了进行体内EHT研究,通过在小鼠右后肢皮下注射CT26细胞(50 µL, 2 × 106个细胞溶于PBS)建立肿瘤模型。对于αCTLA-4联合EHIT,CT26细胞分别在右后肢(50 µL, 2 × 106个细胞溶于PBS)和左后肢(50 µL, 0.6 × 106个细胞溶于PBS)皮下注射,以建立原发和远处肿瘤。当最大肿瘤负荷(1500 mm3)超过时,立即处死小鼠。
体内生物安全性评估
为了评估MnNi2S3纳米颗粒(NEs)的体外生物安全性,将人脐静脉内皮细胞(HUVECs)接种并孵育过夜。用MnNi2S3 NEs处理HUVECs不同时间。然后移除MnNi2S3 NEs并继续孵育12小时。通过标准MTT方法测量细胞活力。
对于体内生物安全性研究,将MnNi2S3 NEs植入Balb/c小鼠皮下。在不同天数后,收集靠近MnNi2S3 NEs的皮肤组织进行苏木精&伊红(H&E)染色和毒性检查。此外,收集小鼠血液进行血常规检查,包括红细胞计数(RBCs)、白细胞计数(WBCs)、血红蛋白(HGB)、血小板计数(PLT)和血液生化检查,包括谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)和肌酐(CREA)。
对于EHT的体内生物安全性研究,将体积为150 mm3的荷瘤小鼠随机分为四组(每组n=5),接受以下处理:G1:空白对照组,不进行任何处理;G2:通过微创手术将MnNi2S3 NEs(0.2×0.2 mm2)植入肿瘤;G3:应用直流电(3.0 V)15分钟;G4:通过微创手术将MnNi2S3 NEs(0.2×0.2 mm2)植入肿瘤并应用直流电(3.0 V)15分钟。在第3和第4组中,植入的NEs连接到电源的负极,作为阴极用于生成氢气(H2)。每隔两天测量肿瘤的长度和宽度及小鼠的体重。使用公式计算肿瘤体积:体积 = 长度 × 宽度² / 2。当肿瘤体积超过1500 mm3时,立即处死小鼠。
体内EHT评估
当小鼠的肿瘤体积约为150 mm3时进行体内EHT。将携带CT26肿瘤的小鼠随机分为四组(每组n=5),接受以下处理:第1组:空白对照组,不进行任何处理;第2组:通过微创手术将MnNi2S3 NEs(0.2×0.2 mm2)植入肿瘤;第3组:应用直流电(3.0 V)15分钟;第4组:通过微创手术将MnNi2S3 NEs(0.2×0.2 mm2)植入肿瘤并应用直流电(3.0 V)15分钟。在第3和第4组中,植入的NEs连接到电源的负极,作为阴极用于生成氢气(H2)。每隔两天测量肿瘤的长度和宽度及小鼠的体重。使用公式计算肿瘤体积:体积 = 长度 × 宽度² / 2。当肿瘤体积超过1500 mm3时,立即处死小鼠。
为了评估EHT的效果,上述处理后3天收集处理过的肿瘤并固定于4%多聚甲醛中。将固定的肿瘤组织用冷冻切片机切片并按提供的程序染色,用苏木精&伊红(H&E)、Ki67和TUNEL染色。对于ROS水平研究,将肿瘤切片固定并用DCFH-DA染色30分钟。用Leica显微镜观察H&E和Ki67染色切片,而TUNEL和ROS染色切片则用共聚焦激光扫描显微镜(CLSM)观察。
体内免疫荧光染色
为了研究CRT表达和HMGB1分泌的体内情况,上述处理后的肿瘤被收集用于冷冻切片。肿瘤切片(10 µm)用丙酮固定10分钟,并用FBS(10%)封闭15分钟。然后,将封闭的肿瘤切片与小鼠CRT一抗孵育2小时,并用PBS多次洗涤。最后,用Alex Fluor 488偶联的二抗对肿瘤切片进行染色,通过共聚焦激光扫描显微镜(CLSM)观察。同样地,为了评估HMGB1的分泌,切片用小鼠HMGB1一抗和相应的Alex Fluor 488偶联的二抗染色,除了在免疫荧光染色前用0.1% Triton-X100处理切片以评估细胞膜通透性。
为了研究各种处理后肿瘤中的CD3+ T细胞和CD8+ T细胞,治疗后3天收集肿瘤。然后将肿瘤用4%多聚甲醛固定,用于冷冻切片,并根据提供的协议用αCD3-SpOrange和αCD8-SpGreen荧光抗体对肿瘤切片进行染色。通过CLSM观察并记录染色切片。
体内免疫评估
如上所述各种处理后小鼠的免疫反应在治疗第五天进行评估。收集所有肿瘤和淋巴结,切成小块,并用酶消化。经纱布过滤和离心后,获得单细胞悬液。最后,使用荧光抗体(淋巴树突状细胞:CD11c-FITC、CD80-APC和CD86-PE;细胞毒性T淋巴细胞:CD3-FITC和CD8-APC;辅助T淋巴细胞:CD3-FITC和CD4-PE;M1型巨噬细胞:CD45-FITC、CD80-APC、CD11b-PE和F4/80-Percp;M2型巨噬细胞:CD45-FITC、CD206-APC、CD11b-PE和F4/80-Percp;调节性T细胞:CD3-FITC、CD4-APC、Foxp3-PE和CD45-Percp)根据供应商的说明对获得的细胞进行染色。通过流式细胞术定量检测和分析染色细胞。本工作中使用的所有抗体均购自供应商,未经进一步纯化即使用。
为了研究各种细胞因子(即TNF-α、IFN-γ、IL-1β、IL-6、IL-10和IL-12p70)的分泌水平,使用相应的ELISA试剂盒(Thermo Fisher Co., Ltd.)进行ELISA实验。以TNF-α为例,收集各种处理后的肿瘤,消化,收集上清液供进一步使用。用TNF-α捕获抗体包被96孔板,并在4°C下孵育过夜。用PBST洗涤包被的抗体,并与ELISA POT溶液孵育以封闭未吸附位点并减少非特异性吸附。然后将肿瘤上清样品加入96孔板中,室温孵育2小时。用PBST多次洗涤后,加入TNF-α偶联抗体,并将板孵育1小时。最后,依次加入HRP-链霉亲和素和TMB溶液以诱导显色反应。用H2SO4溶液终止反应后,用微板阅读器测量约450 nm处的吸光度。通过制造商提供的标准TNF-α样品的标准曲线定量分泌的TNF-α水平。同样,使用相应的ELISA试剂盒通过相同的协议检测其他细胞因子的分泌水平。
体内EHIT研究
携带双侧CT26肿瘤的小鼠被随机分为四组,每组五只小鼠,接受以下处理。第1组:空白对照组;第2组:αCTLA-4抗体注射(静脉注射,每次每只小鼠20 µg);第3组:皮下植入MnNi2S3 NEs(0.2 × 0.2 mm²)并施加DC 3.0 V,持续15分钟;第4组:植入MnNi2S3 NEs(0.2 × 0.2 mm²)并施加DC 3.0 V,持续15分钟,以及αCTLA-4抗体注射(静脉注射,每次每只小鼠20 µg)。在第2组和第4组中,αCTLA-4抗体在治疗后的第1、3和5天静脉注射。在第3组和第4组中,植入的MnNi2S3 NEs连接到电源的负极,作为生成H2的阴极。每隔2天测量原发肿瘤和远端肿瘤的长度、宽度及小鼠的体重,直到肿瘤体积超过1500 mm³。肿瘤体积计算公式为:体积 = 长度 × 宽度²/2。当肿瘤体积超过1500 mm³时,立即对小鼠进行安乐死。对经过各种处理后的肿瘤组织进行H&E染色、Ki67染色以及CD3+ T细胞和CD8+ T细胞荧光染色,使用上述类似的程序。
肿瘤再挑战
对于肿瘤再挑战研究,Balb/c雌性小鼠被随机分为三组(n=5),接受以下处理。第1组:未接种肿瘤且未治疗;第2组:接种CT26肿瘤并用EHT治疗;第3组:接种CT26肿瘤并用EHIT治疗。在第3组中,αCTLA-4抗体在治疗后的第1、3和5天静脉注射。治疗后,小鼠的肿瘤被消除。在第60天,对小鼠左后肢进行肿瘤重新接种(对于第1组,在右后肢上)。每隔2天测量肿瘤的长度、宽度及小鼠的体重。肿瘤体积计算公式为:体积 = 长度 × 宽度²/2。当最大肿瘤负荷超过1500 mm³时,立即对小鼠进行安乐死。
为了研究记忆T淋巴细胞,在治疗后的第60天从小鼠眼球收集血液至抗凝管中。收集的血液样本经溶血并以1200 rpm离心15分钟,获得淋巴细胞和血清。然后用αCD3-FITC、αCD8-Percp、αCD44-PE和αCD62L-APC对记忆T细胞进行染色,并使用流式细胞术对染色细胞进行定量分析。效应记忆T细胞为CD3+CD8+CD44+CD62L−细胞。此外,通过制造商提供的IFN-γ ELISA试剂盒定量检测各种处理后血清中的IFN-γ水平。
统计分析
本研究的所有结果均以均值 ± 标准差表示。统计分析通过Origin Pro 2023进行。流式细胞术分析由Flow Jo VX进行。使用单样本Student's t-检验进行两个或多个样本之间的显著性差异分析。生存率的统计差异通过log-rank检验测量。数据变化的显著性如下:****p < 0.0001, ***p < 0.001, **p < 0.01, *p < 0.05 或 n.s.: p > 0.05。
https://blog.sciencenet.cn/blog-41174-1456331.html
上一篇:饮食调节免疫功能的原因
下一篇:鼻窦炎术后鼻腔冲洗用富氢生理盐水的临床观察【上海同济】