博文
氢气预防细胞冻存损伤的研究【赞】
||
氢气提高人脂肪源干细胞增殖和线粒体活性
氢气的细胞学研究不是非常多,研究仍然有一定规模。不过对细胞冻存过程进行研究,则是少之又少。这一研究具有非常重要的价值,因为细胞冻存是细胞生物学技术中重要的过程,但除了经典的细胞防冻物质外,细胞冻存导致的细胞损伤防护研究非常缺乏。氢气用于细胞冻存保护效应的发现,对于细胞生物学技术非常有价值。另外对于血液细胞体外保护问题也提供了重要参考。我们单位附属医院血库曾经考虑将氢气用于血小板冻存保护的研究,也有人考虑用于干细胞保护的研究。这些研究都具有价值,且这些效应能更早更容易应用于临床,这比氢气直接用于人体的安全系数更高。
以上是个人看法,以下是文章内容。
Kimura K, Tabata Y. Hydrogen gas improves proliferation and mitochondrial activity of human adipose-derived stem cells after cryopreservation. Regen Ther. 2024 Aug 14;26:571-577.
本研究的目的是评估氢气对冻存过程中人脂肪来源干细胞(hADSC)生物学功能的影响。在商业细胞保存液中加入氢气后进行hADSC的冻存。在-80°C下冻存后,对冻存细胞的存活率、初始附着形态以及生物参数进行了评估,并与未加氢气冻存的细胞进行了比较。制备后立即,细胞保存液中的氢气浓度为2.0ppm,并随时间逐渐降低。氢气的存在显著增加了细胞的增殖以及初始粘附百分比。与未加氢气冻存的细胞相比,处于铺展状态的细胞数量显著增多。通过流式细胞仪测量细胞周期和测量细胞内活性氧种(ROS)来证明细胞周期增强和ROS产生减少。在细胞周期测定中,有丝分裂阶段的细胞比例增加。氢气的存在在解冻后立即显著降低了羟基自由基的数量。结论是,在冻存过程中添加氢气有望改善细胞解冻后的生物学行为,包括细胞的存活率、增殖或代谢活性。
1. 引言
最轻的氢分子被认为具有高动能。氢的一个主要工业应用广泛地用于“轻电流领域,如半导体、硅晶片和电子元件”。此外,不仅对于太空探索应用,对于氢站点和其他氢能源的需求也日益增加。另一方面,最近这种分子氢因其在生命体中的功能而受到关注。作为一项典型的研究,Osawa等人报告说,分子氢选择性地清除活性氧种(=ROS)。ROS的产生给细胞带来损伤或功能丧失,这通常会导致细胞移植治疗中的一个大问题。氢分子是一种具有强还原活性的试剂。预计氢分子的存在会化学上减少ROS的产生,从而改善细胞的存活率和功能。
本研究旨在调查分子氢对细胞的存活率、增殖活性和代谢活性的影响。在存在或不存在氢气的情况下对hADSC进行冻存后,评价了细胞的行为,并与未加氢气冻存的细胞进行了比较。我们检查了在氢气存在下冻存的细胞产生的ROS。还从细胞形态、细胞周期和应力纤维形成方面评估了细胞的行为。
2. 材料和方法
2.1. 细胞培养
hADSC细胞(ATCC, SCRC-4000™)购自美国模式培养物保藏中心(ATCC Cell Bank)。这些细胞在α最小必需培养基(αMEM, Invitrogen Corp., California, USA)中培养,其中包含10体积%的胎牛血清(FBS, HyClone™, SH30910.03, GE Healthcare Life Sciences, England)和1体积%的青霉素链霉素(09367e34, Nacalai Tesque, Inc., Kyoto, Japan),在37°C下,5% CO2 -95%空气的湿润气氛中以每平方厘米1.3×104个细胞的初始密度培养。孵育后,制备了细胞悬液。用血球计数器确定了细胞悬液中的活细胞数。根据解冻后立即的细胞数计算了细胞存活率。从孵育3小时后的细胞数确定了粘附细胞的数量。
2.2 在氢气存在下的细胞冻存
图1展示了在氢气存在的保存溶液中制备细胞悬液的冻存程序。将细胞保存溶液(CELLBANKER 1, Nippon Zenyaku Kogyo Co., Ltd., Fukushima, Japan)放入铝袋(CCK-1, GL Sciences Inc., Tokyo, Japan)中,并填充氢气。然后摇晃装有细胞保存溶液和氢气的铝袋5分钟。移除饱和氢气的保存溶液并将其与2.1节中准备的细胞悬液混合在一个冷冻管中,立即将其放入铝袋中并再次填充氢气。然后将装有冷冻管的铝袋以每分钟-1°C的速度冷冻至-80°C。从铝袋中取出冷冻管,并在-150°C或更低温度下储存在液氮中。
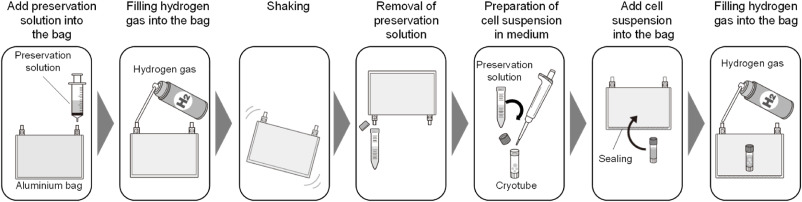
图1. 在氢气存在下准备细胞悬液的示意图。
2.3. 氢气浓度和氧化还原电位的测量
使用气相色谱仪(GC7100TW, J-Science LAB Co., Ltd., Kyoto, Japan),配备MS-5A 60/80目填充柱(3mm内径×2.0m,J-Science LAB Co., Ltd., Kyoto, Japan)和柱温70°C进行细胞保存溶液中氢气浓度的测量。载气为氩气,压力为120kPa,使用热导检测器作为探测器。通过创建已知浓度气体的标准曲线来确定浓度。将1μl细胞保存溶液(按2.2节制备)注入GC/TCD中,并根据校准曲线计算氢气浓度。
在25°C下使用氧化还原电位计(TPX-999Si, Tokokagaku Co., Ltd., Tokyo, Japan)测量细胞保存溶液中的氧化还原电位。除非另有说明,每个样本独立进行4次实验。
2.4. ROS的测定
使用试剂盒(C10444, CellROX™ Green Reagent, Invitrogen, Camarillo, CA)测量细胞中总ROS的量。按照试剂盒手册描述的方法进行测量。解冻后的细胞被接种到96孔板中。去除上清液后,加入100μL培养基并添加CellROX™至最终浓度为5μM,然后在37°C下孵育30分钟。随后用PBS洗涤细胞三次,并使用平板阅读器(SpectraMax i3x, Molecular Devices Japan Co., Ltd., Tokyo, Japan)测量荧光强度。测量波长为485nm/520nm。
使用测量试剂盒(16055, Cell Meter™ Mitochondrial Hydroxyl Radical Detection Kit, COSMO Bio, Tokyo, Japan)测量细胞中的羟基自由基量。按照试剂盒手册描述的方法进行测量。解冻后的细胞被接种到96孔板中。去除上清液后,加入100μL试剂盒的试剂(工作溶液)并在37°C下孵育1小时。然后,用PBS洗涤细胞三次。洗涤后,加入100μL试剂盒的试剂(组分B)并在平板阅读器(SpectraMax i3x, Molecular Devices Japan Co., Ltd., Tokyo, Japan)中测量荧光强度。测量波长为540nm/590nm。
2.5. 细胞形态分析
解冻后的细胞培养0、3和18小时。然后使用光学显微镜(BZ-X700, Keyence Corp., Osaka, Japan)获取图像。使用BZ-X700 Analyzer软件(Keyence Corp., Osaka, Japan)测量细胞的面积和周长。
2.6. 细胞周期测量
使用测量试剂盒(559619, BrdU Flow Kit, Becton Dickinson)进行细胞周期测量。按照试剂盒手册描述的方法进行测量。解冻后的细胞被接种到6孔板中,分别在0、3和18小时孵育后,每孔加入20μL 1mM BrdU并孵育3小时。然后丢弃上清液并按照手册准备细胞悬液。使用流式细胞仪(BD FACSCanto™ II Flow Cytometer, BD Biosciences)分析获得的样本。每个样本独立进行3次实验。
2.7. 肌动蛋白染色
对于肌动蛋白染色,解冻后的细胞被接种到6孔板中,并孵育3和18小时。培养后,用PBS洗涤细胞两次。然后用3.7%甲醛固定细胞,用PBS和Triton X-100洗涤,并在室温下与鬼笔环肽孵育20分钟。之后用PBS洗涤,加入300nM DAPI并在室温下静置5分钟。再用PBS洗涤并用荧光显微镜(BZ-X700, Keyence Corp., Osaka, Japan)观察。
2.8. 统计分析
所有数据均进行统计分析,并以平均值±标准误表示。数据通过学生t检验或Tukey检验进行分析,以确定统计学显著性差异,当p<0.05时认为具有显著性。
3. 结果
3.1. 细胞培养
表1显示了细胞保存溶液中的氢气浓度和氧化还原电位。充入氢气显著增加了溶液中的氢气浓度。另一方面,氧化还原电位从92mV显著降低到-393mV。
表1. 细胞保存溶液的氢气浓度和氧化还原电位。
氢浓度 (ppm) | 氧化还原电位 (mV) | |
有氢气 | 1.2 ± 0.1 a | −393 ± 59a |
无氢气 | 0.0 ± 0.0a | 92 ± 9a |
a均数 ± 标准差
3.2. 在氢气存在下的细胞冷冻保存
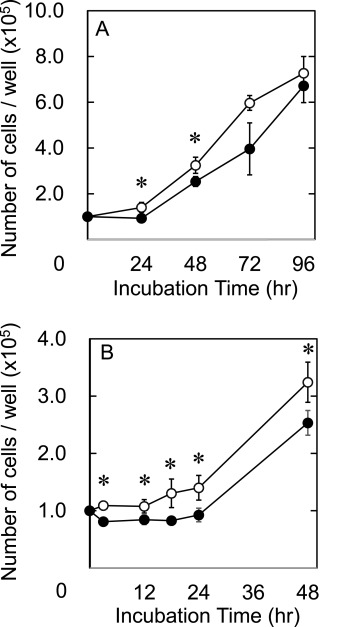
图2显示了在氢气存在下冷冻保存后hADSC增殖的时间过程。与没有氢气的情况相比,用氢气冷冻保存的细胞显示出增强的增殖(图2A)。培养4天后的细胞几乎达到了汇合状态。
图2. 在氢气存在(〇)或不存在(●)的情况下冷冻保存的hADSC增殖曲线,分别在0、24、48、72和96小时(A)以及培养后0、3、12、18、24和48小时(B)。*, p<0.05;两组在相应时间点的显著差异。
对于含氢培养的情况,培养后3小时附着的细胞数量高于无氢冷冻保存的细胞。用氢气冷冻保存的细胞显示出大约18小时的倍增时间,而没有氢气的细胞在24小时后有更长的倍增时间。在培养的最初1天内,细胞增殖没有滞后时间。相反,没有氢气冷冻保存的细胞数量一度减少,然后在一些滞后时间后增加。
3.3. 细胞的存活率和初始附着
图3显示了在含氢细胞保存溶液中冷冻和解冻的细胞存活率。在氢气存在与不存在的情况下冷冻保存的细胞之间的存活百分比没有显著差异。
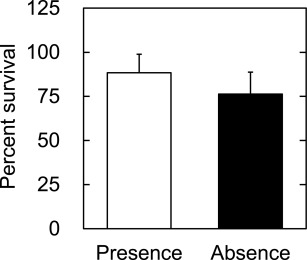
图3. 解冻后立即测定的hADSC在氢气存在(□)或不存在(■)的情况下冷冻保存的存活率百分比。
图4显示了在含氢细胞保存溶液中冷冻和解冻的细胞的初始粘附率。氢气的存在增加了冷冻保存细胞的初始粘附百分比。
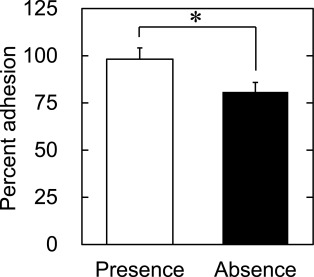
图4. 在氢气存在(□)或不存在(■)的情况下冷冻保存的hADSC在培养后3小时的粘附百分比。*, p<0.05;两组间的显著差异。
3.4. ROS的产生
图5A显示了用氢气冷冻保存的细胞的总ROS量。在没有氢气的情况下培养18小时后,总ROS量增加。另一方面,在氢气存在下培养的细胞的总ROS没有增加。
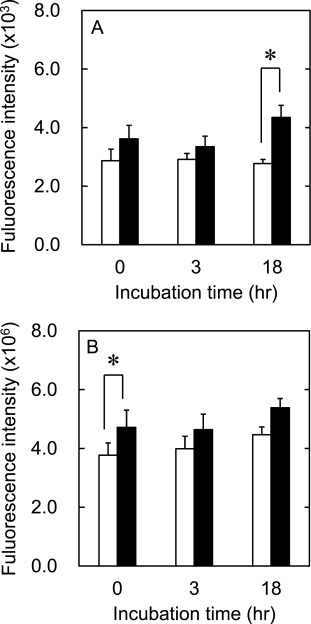
图5. hADSC在氢气存在(□)或不存在(■)的情况下冷冻保存的ROS荧光强度:(A)总ROS和(B)羟基自由基。*, p<0.05;两组在相应时间点的显著差异。
图5B显示了用氢气冷冻保存的细胞的羟基自由基数量。与没有氢气的细胞相比,用氢气冷冻保存的细胞的羟基自由基数量显著减少。
3.5. 细胞形态学
图6显示了在氢气存在下冷冻保存的hADSC的形态百分比。无论培养时间如何,球形细胞的数量在氢气存在下冷冻保存的细胞中显著较低。
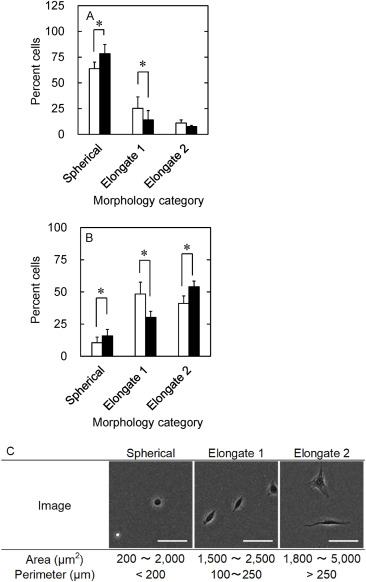
图6. 在氢气存在(□)或不存在(■)的情况下,hADSC冷冻保存后3小时(A)和18小时(B)的形态百分比。*, p<0.05;两组间的显著差异。(C)根据面积和周长分类的细胞形态类别。比例尺为200μm。
3.6. 细胞周期的流式细胞术
图7显示了在含氢细胞保存溶液中冷冻和解冻的细胞的BrdU摄取率百分比。经过18小时培养后,氢气的存在使细胞增加了BrdU摄取的百分比。
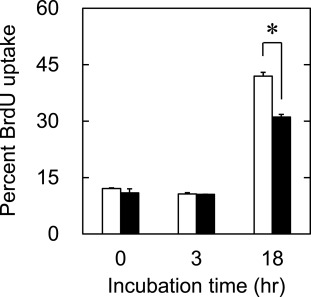
图7. 在氢气存在(□)或不存在(■)的情况下,hADSC在培养后0、3和18小时的BrdU摄取百分比。*, p<0.05;两组间在相应时间点的显著差异。
3.7. 肌动蛋白染色形态
图8显示了细胞的肌动蛋白免疫荧光图像。对于在氢气存在下冷冻保存的细胞,观察到更清晰的肌动蛋白纤维形成。这一结果与图6的结果相符。比较图8B和D,可以看到在氢气存在下冷冻保存的细胞中,用肌动蛋白染色的区域要大得多。
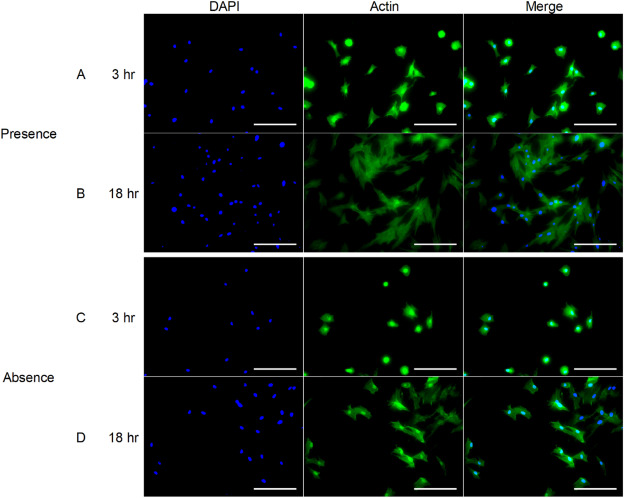
图8. 在氢气存在(A, B)或不存在(C, D)的情况下,hADSC在培养3小时和18小时后的肌动蛋白免疫荧光图像。比例尺=200μm。
4. 讨论
本研究展示了氢气的存在使细胞在冷冻保存期间保持了增殖能力。氢气降低了ROS的水平,这是损害细胞活性的因素之一。与没有氢气的情况相比,在氢气存在下冷冻保存的细胞在细胞增殖前显示出减少了滞后时间。据报道,ROS赋予细胞各种功能,如凋亡诱导、衰老促进以及增强或停滞细胞周期。氢气在冷冻保存中的存在对细胞的存活率没有影响(图3)。然而,氢气有效地增加了初始细胞粘附的百分比(图4)并增强了伸展细胞形态的比例(图5)。
当将含氢气的细胞悬液添加到保存溶液中并在大气压下放置时,保存溶液中的氢气浓度会降低。因此,通过使用阻止氢气渗透的铝袋来维持储存溶液中的氢气浓度。
在用氢气填充的铝袋中冷冻至-80°C的细胞悬液中的氢气浓度为1.2ppm(表1)。此外,铝袋中气相的氢气浓度与细胞悬液中的氢气浓度成正比(数据未显示)。然后将冻存管从铝袋中取出并存储在低于-150°C的条件下。取出的细胞悬液的氢气浓度为0.0ppm。
由于细胞悬液中的细胞增殖以氢气浓度依赖性方式增加(数据未显示),因此后续实验在最高的氢气浓度1.2ppm下进行。
在正常条件下没有氢气冷冻的细胞,播种后初始粘附的细胞数量维持了一段时间(滞后时间)然后转入对数生长期,这是一般的细胞增殖现象。然而,添加氢气不仅改善了解冻后播种细胞的初始粘附,而且逐渐增加了6、12和18小时的细胞数量(图2B)。在氢化过程中细胞无滞后时间增殖被认为是氢气独特的现象。
滞后时间的缺失可能是由于细胞周期活动的增加。滞后时间的缺失可能与增强的细胞周期有关,尽管与细胞周期结果相比有时间延迟(图7)。
据报道,氦气增加了细胞的存活率和初始粘附。这一结果与氢气的结果不同,表明氢气的生物效应与惰性气体不同。
在氢气存在下的细胞存活率为88%,与没有氢气的76%相比没有显著差异(图3)。在没有氢气的情况下细胞存活率更高可能是其中一个可能的原因。
众所周知,冷冻过程常常导致ROS产生的增加。众所周知,当哺乳动物细胞暴露于低温应激时,线粒体呼吸受损,导致细胞中ROS积累,有时会导致细胞损伤。氢分子选择性地清除了解冻后立即产生的羟基自由基(图5B)。众所周知,羟基自由基对细胞具有高度毒性。可以高度推测,羟基自由基的减少影响了培养3小时后的细胞粘附。此外,在18小时培养后,当细胞更活跃增殖时,总ROS量也减少了(图5A)。认为羟基自由基的量(图5B)是氢分子直接减少的结果。另一方面,总ROS的差异(图5A)可能是氢分子间接效应的结果。可以推测,总ROS量变化的时间滞后不是分子氢的直接效应,而是改善线粒体活性的间接效应。
众所周知,氢分子与羟基自由基有特异性反应。从图5B可以看出,与细胞解冻过程后立即进行氢气处理相比,冷冻保存中氢气处理显著减少了羟基自由基的数量。羟基自由基的产生会给细胞带来损伤或功能丧失。值得注意的是,氢分子能特异性地反应以去除羟基自由基。考虑到这些发现,解冻后立即显著减少羟基自由基有助于改善细胞功能,如增强细胞的初始粘附、增加细胞数量、促进细胞周期和增加肌动蛋白含量。
据报道,细胞中的大部分ROS是在线粒体中产生的,而ROS本身会对线粒体造成损伤。氢气减少了ROS的数量,从而减少了对线粒体的损伤。
研究表明,氢气改善了线粒体的生物合成。氢气会减少冷冻解冻过程中的冷应激,导致线粒体负面作用的减少。低水平的ROS通过p53抗氧化功能激活信号传导,从而增强细胞增殖。因此,氢气的存在减少了冻融细胞中的ROS,从而导致细胞增殖增强。
图6显示,在氢气存在下进行冷冻保存的细胞,随时间推移球形细胞的百分比减少。球形细胞减少意味着铺展细胞增加。图6的结果支持粘附细胞数量的增加。这一结果得到了肌动蛋白染色图像(图8)的支持。经过18小时的培养,在含氢条件下冷冻保存的细胞中,伸长1型和2型细胞的总百分比显著更高。据报道,氢气会影响受损细胞的形态。综合考虑,氢气在冷冻保存条件下对细胞形态有影响。这可能是氢气对细胞形态的新效应。
图7明显显示,在氢气存在下冷冻和解冻的细胞在培养18小时后BrdU显著增加。这表明氢气对细胞周期和分裂有影响(如图2、图8所示)。这一发现得到了ROS促进细胞周期的研究结果的支持。
有一些报告评估了氢气对生物体的影响,并且氢气能够减轻对生物体的损伤。然而,关于氢气对细胞生物活性影响的研究报道很少。当氢气被添加到正常细胞培养中时,没有观察到细胞数量的增加或形态的变化(数据未显示)。因此,氢气对细胞的小效应可能是由于损伤减少。氢气的行为与其他气体不同,氢气改善细胞粘附是独特的,即使差异很小,我们相信这项研究实验性地证实了氢气对细胞冷冻保存有益处。
考虑到分子氢的高渗透性,氢气处理将适用于细胞聚集体的冷冻保存,如三维细胞球体和类器官。本研究表明,氢气通过减少细胞中ROS的数量可能改善细胞的生物功能,尽管需要进一步实验来优化氢气处理的条件。
5. 结论
本研究表明,氢气对hADSC在冷冻保存中的生物功能有良好的影响。当hADSC使用商业细胞保存溶液进行冷冻保存时,氢气的存在增加了冷冻保存细胞的初始粘附百分比。细胞周期和细胞内ROS测量显示细胞周期增强和ROS产生减少。总之,在冷冻保存过程中氢气的存在有望改善解冻后细胞的生物行为,包括细胞存活率、增殖或代谢活性方面。
https://blog.sciencenet.cn/blog-41174-1450508.html
上一篇:免疫系统的性别差异
下一篇:大爆炸过后,如何燃烧掉无处不在的氢气?