博文
支架释放镁/氢气对脑缺血神经保护作用  精选
精选
||
血管支架释放镁/氢气对脑缺血神经保护作用
摘要
大多数急性缺血性中风患者,尤其是大血管阻塞的患者,需要支架植入以实现完全再通。然而,由于缺血-再灌注损伤,超过一半的这些患者的预后仍然不佳。因此,神经保护治疗对于缓解缺血性脑损伤至关重要,并且进行了一项“生物可降解神经保护支架”的概念验证研究。这一概念基于这样一个假设:血液中局部释放的来自镁金属的Mg2+/H2可以为远离的脑缺血组织提供协同神经保护,以防止再灌注损伤。研究首先评估了纯镁在氧-葡萄糖剥夺/再氧化(OGD/R)受损神经元细胞中的神经活性潜力。随后,将纯镁丝植入到暂时性大脑中动脉闭塞(MCAO)大鼠模型的颈总动脉中,以模拟人类脑缺血/再灌注损伤。体外分析显示,纯镁提取物帮助小鼠海马神经元细胞(HT-22)防御OGD/R损伤。此外,证实了镁丝对MCAO大鼠的行为异常、神经损伤、血脑屏障破坏和脑血流减少具有保护作用。总之,基于镁的生物可降解神经保护植入物可以作为一个有效的局部Mg2+/H2输送系统,用于治疗远离的脑缺血性疾病。
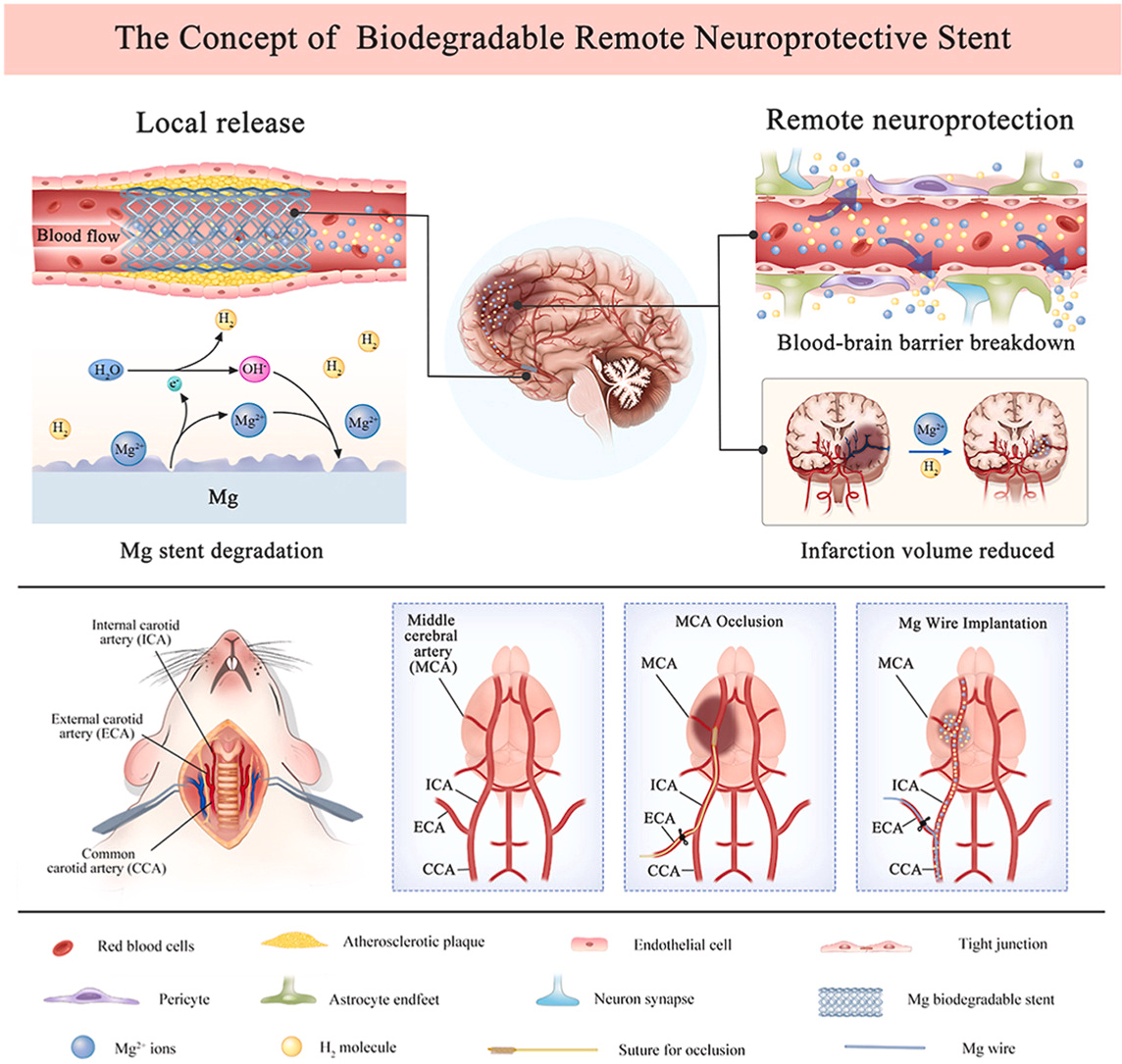
1. 引言
长期以来,急性缺血性中风(AIS)的有效神经保护一直是困扰临床医生的难题。由于缺血/再灌注(I/R)损伤,超过一半的患者在再通治疗后仍然面临不良预后。其中,颅内动脉粥样硬化引起的大血管阻塞占AIS病例的15-35%,大多数患者需要在血栓切除术后植入支架以实现完全再通。因此,将再通治疗与神经保护治疗相结合以减轻I/R损伤至关重要。能够产生和释放镁离子和氢气等神经保护剂的生物可降解镁金属,是制造神经保护性脑支架的有希望的候选材料。
镁离子补充可以通过三个主要机制减少脑缺血:减少细胞内钙超载、增强脑血流以及在脑缺血后维持能量代谢。通过近端动脉直接输注Mg2+到目标器官可以增强其神经保护效果,并最小化血脑屏障损伤。此外,氢气已被确定为一种神经保护治疗剂,可以防止氧化损伤。受2007年大田茂的关键研究影响,通过吸入、注射/输注和摄取给予H2已显示出对各种脑部疾病(包括I/R损伤、创伤性损伤和蛛网膜下腔出血)的显著治疗潜力。分子氢在缺血性中风患者中的安全性和有效性已得到探索。鉴于其高产氢能力(41.7 mmol/g),显著超过富氢饱和水(0.8 μmol/mL),镁可以作为长期的氢源。而且,最近的临床试验表明,Mg2+和氢气的组合治疗对脑部疾病具有协同保护作用。因此,基于镁的脑血管植入物可以作为局部Mg2+和H2输送系统,治疗AIS患者再灌注后的远程神经损伤。
镁及其合金作为生物可降解心血管支架(如DREAMS和DREAMS 2G支架)已被广泛探索,在BIOSOLVE-I和BIOSOLVE-II临床试验中显示出前景。这些发现为镁基合金作为脑血管支架植入物开辟了新的研究方向。然而,关于镁降解产物对神经系统的影响仍存在不确定性。在一项研究中,裸镁钕锌锆支架被植入健康新西兰白兔的颈总动脉20个月,未观察到包括大脑在内的主要器官中Mg2+离子积累。此外,一项体内研究涉及将镁锌合金板植入大鼠皮下以检查24小时内Mg2+平衡,结果显示健康大鼠大脑中的Mg2+水平未升高。尽管如此,鉴于病理条件下血脑屏障受损,血管中镁植入物降解产物对远程缺血性脑组织的潜在影响仍然不确定。
在本研究中,我们引入了“生物可降解神经保护支架”的创新概念,并假设血液中局部释放的Mg2+/H2从镁金属中可以协同保护远程的脑缺血组织。本研究的科学前提和实施方案如图1所示。为了验证这一假设,通过计算建模模拟了颈总动脉(CCA)中镁丝在血流下的腐蚀行为。随后,将健康和氧葡萄糖剥夺/再氧化(OGD/R)损伤的神经元细胞培养在镁提取物中,以评估其体外细胞相容性和神经保护特性。最后,将纯镁丝植入大脑中动脉闭塞(MCAO)大鼠模型的CCA中,以研究潜在的神经保护机制和体内腐蚀行为。评估了镁丝对行为、神经救援、血脑屏障(BBB)完整性和脑血流恢复的影响。此外,还进一步检查了镁丝植入对血液和脑组织中离子和分子浓度的时间依赖性影响。
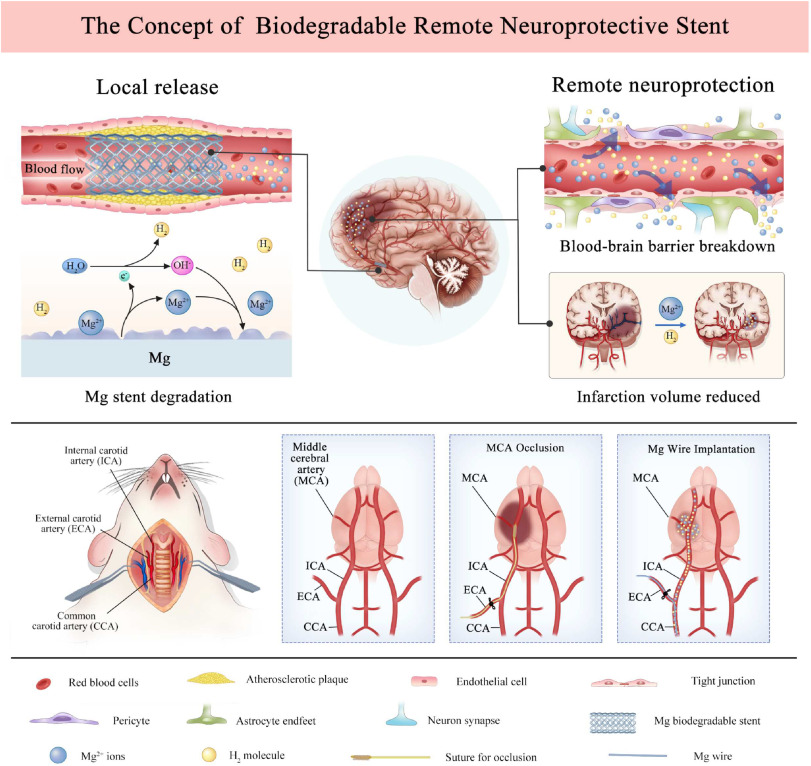
图1. 生物可降解神经保护支架的概念验证及其实施策略。生物可降解神经保护支架指的是在血流中向受损脑组织输送时,能够在支架降解过程中局部产生神经保护物质(如Mg2+/H2)的支架,从而救援远端脑缺血组织。为了验证这一概念,采用了大脑中动脉闭塞大鼠模型,将代表镁支架的镁丝植入到颈总动脉中。
2. 结果
2.1. 镁丝在颈总动脉内腐蚀的计算模型
在任何实验程序之前,评估植入颈总动脉的镁丝的腐蚀行为以及Mg2+和H2随时间释放的情况是必要的。图2A展示了基于颈总动脉模型和材料植入的血管及插入镁丝的建模,以及相关的血流速度分布。植入后,镁丝周围的血流速率降低,但血管仍然保持开放。最快的流速出现在近端,其次是丝表面,远端流速最低,均略低于中心血流速率。图2B揭示了镁丝直径随时间的变化。由于均匀腐蚀,镁丝直径随时间线性减小,显示出约2毫米/年的腐蚀速率。图2B还展示了第7天丝表面上镁离子和氢气的释放浓度。镁丝近端的高流速引发了更高的腐蚀速率,导致Mg2+和H2浓度迅速初始增加。然而,随着丝长度的增加腐蚀速率降低,浓度增加的速度逐渐放缓,受到扩散机制的影响,这减少了镁丝表面上的表面浓度。最终,丝表面上的Mg2+和H2浓度迅速初始增加然后稳定下来。
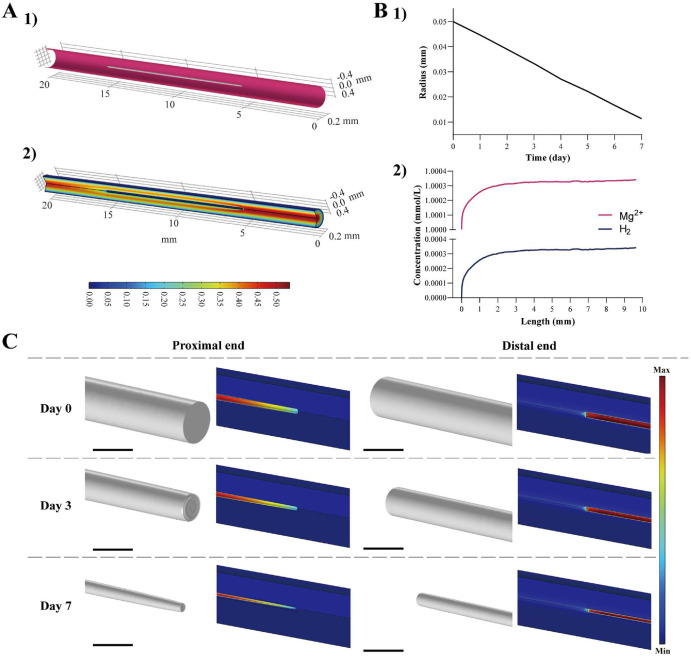
图2. 颈总动脉内镁丝腐蚀的计算模型。(A) 血管和插入镁丝的建模,以及血管内相应的血流速度分布。(B) 计算得到的镁丝直径随时间的变化以及第7天丝表面周围释放的Mg2+和H2浓度。(C) 镁丝随时间的模拟形态特征及Mg2+浓度的轮廓图。
2.2. 体外细胞毒性和神经保护分析
继计算模型之后,对纯镁降解的细胞毒性和神经保护进行了体外评估。使用HUVECs、HASMCs和HT-22评估了对血管细胞和神经元的细胞毒性。首先,进行了CCK-8检测(图S1,A至C),显示不同浓度镁丝提取物对HUVECs、HASMCs和HT-22的体外细胞毒性最小。同时,活/死细胞染色加强了CCK-8的结果(图S1,D和E),表明与对照培养基相比,不同浓度的纯镁提取物并未改变活细胞比率。这些发现表明,镁丝降解过程中产生物质对血管和神经细胞没有毒性作用。
随后,评估了分级Mg2+的体外神经保护作用。采用OGD/R模拟体外I/R损伤。基于CCK-8和乳酸脱氢酶(LDH)释放实验结果,0.4至10 mM浓度的Mg2+似乎提供了神经保护(图S2)。考虑到镁离子的强大神经保护能力,进一步检查了镁提取物对神经元的影响。镁提取物含有高水平的Mg2+和H2,超过对照培养基的含量(图3A和B)。此外,Mg2+浓度处于神经保护范围内(图S2)。虽然Mg2+和H2都提供神经保护,但需要确认镁提取物中的Mg2+和H2的潜在协同神经保护效应。在本研究中,对镁提取物进行了超声波处理以去除H2,从而比较有无超声处理的神经保护效果。我们测量了提取液超声后的氢气含量,并确认氢气被完全去除。实验过程如图3C所示。
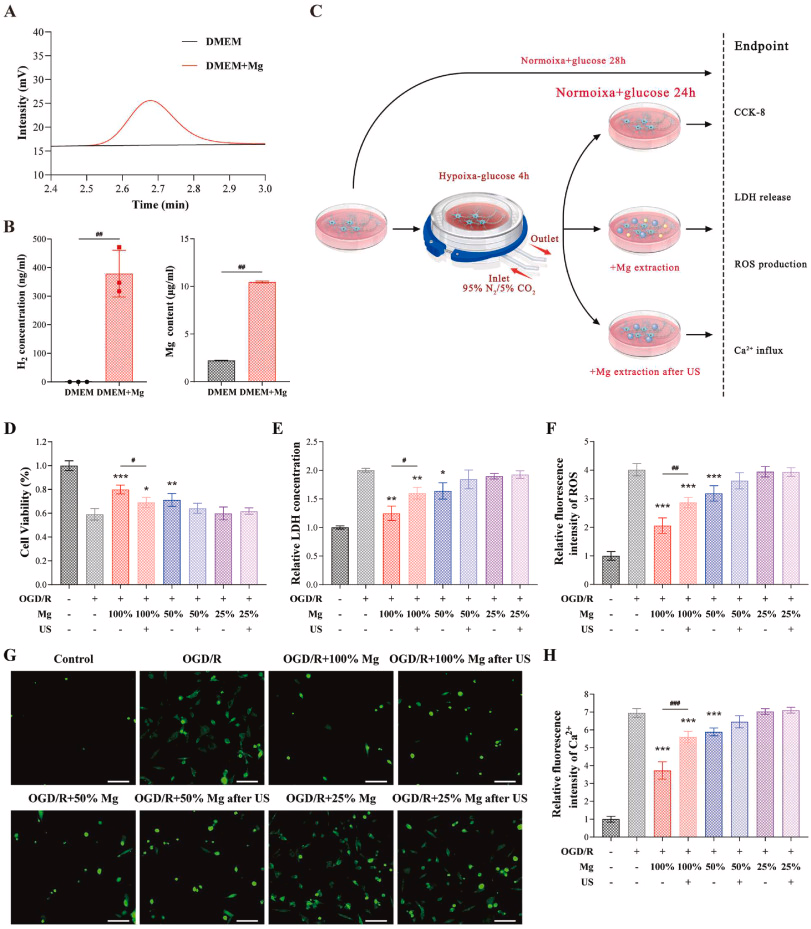
图3. 镁丝提取物对氧-葡萄糖剥夺/再氧化(OGD/R)损伤细胞的体外神经保护作用。(A) 通过气相色谱法检测H2的原始数据。(B) 在正常达尔伯克改良伊格尔培养基(DMEM)和浸泡镁丝的DMEM中H2和Mg2+的定量。(C) OGD/R细胞实验流程图。通过(D)细胞活力、(E)上清液中相对乳酸脱氢酶(LDH)释放浓度、(F)细胞内活性氧物种(ROS)的相对荧光强度以及(G)使用荧光显微镜拍摄的细胞内Ca2+的荧光图像来评估镁丝的神经保护效果,比例尺:20 μm。(H) 根据(G)计算的Ca2+荧光强度的定量。统计学显著性表示为* p < 0.05, **p < 0.01, ***p < 0.001对比OGD/R组;#p < 0.05, ##p < 0.01, ###p < 0.001。
首先,通过CCK-8测试评估神经元活力,通过LDH释放测试评估细胞死亡。经过OGD/R处理后,神经元活力显著降低,细胞死亡增加。这些神经元损伤指标被100%和50%镁提取物减少,但25%镁提取物没有减少。100%镁提取物的逆转效应超过了50%镁提取物。此外,尽管100%镁提取物经过超声处理后仍显示出神经保护作用,但其效果不如未经过超声处理的100%镁提取物。同时,50%和25%镁提取物经过超声处理后未显示出神经保护作用,与其未经过超声处理的对应物相比没有差异(图3D和E)。
由于H2是已知的活性氧物种(ROS)清除剂,而Mg2+是天然的钙拮抗剂,可抑制细胞内Ca2+过载,因此测量了细胞内ROS和Ca2+水平,以评估镁丝提取物的神经保护作用是否源于减少了细胞内ROS产生和Ca2+过载。经过OGD/R处理后,细胞内ROS和Ca2+水平均增加。有趣的是,不同镁丝提取物对细胞内ROS和钙的影响与它们对神经细胞的保护作用相呼应。100%和50%镁提取物,以及经过超声处理后的100%镁提取物显著降低了细胞内ROS和Ca2+。然而,25%镁提取物和经过超声处理的50%及25%镁提取物则没有。此外,100%镁提取物在抑制ROS和Ca2+方面比经过超声处理后的100%镁提取物和50%镁提取物更有效(图3F–H)。
结果表明,镁提取物提供剂量依赖性的神经保护作用,其神经保护效果源于Mg2+和H2对ROS产生和Ca2+过载的协同抑制影响。
2.3. 镁丝的体内神经保护作用
鉴于镁降解产物在体外表现出色神经保护作用,将镁丝植入大鼠CCAs中,在缺血后和再灌注开始时评估其对再灌注损伤的体内神经保护作用。同时,也植入了常用于支架制造的Ni-Ti丝作为对照,以评估外来物质对血流的影响,并将其神经效应与镁丝进行比较。纯镁丝的微观结构表征和机械性能分析如图S3所示。手术后一天,与假手术组相比,MCAO组表现出严重的神经功能缺损,MCAO + Ni-Ti组未见改善。然而,在MCAO + Mg组观察到显著的神经保护作用(图4A–C)。值得注意的是,MCAO + Mg组的Longa评分较低,表明大脑运动区域损伤减少(图4A)。升高身体摆动测试(EBST)评分也显示,与MCAO组和MCAO + Ni-Ti组相比,MCAO + Mg组的身体运动不对称性较低(图4B)。此外,转轮测试显示,植入镁丝的大鼠在MCAO后运动能力恢复改善,表现为跌落潜伏期增加(图4C)。尽管手术后一天未观察到差异,粘附去除测试显示,与MCAO组和MCAO + Ni-Ti组相比,MCAO + Mg组在手术后三天的传感器运动功能显著更好,表现为去除时间减少(图4D)。镁丝植入的神经保护效果持续了14天(图4A–D)。
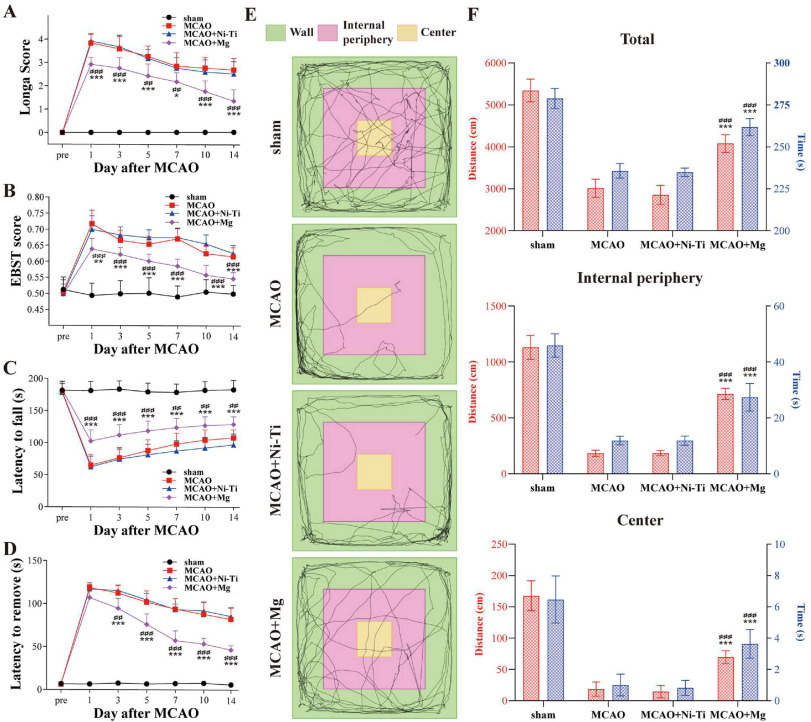
图4. 缺血损伤后镁丝的体内神经保护作用。(A) Longa评分,(B) 升高身体摆动测试(EBST),(C) 转轮测试,和 (D) 粘附去除测试在手术前以及手术后1、3、5、7、10和14天进行。(E) 手术后7天进行了开放场测试。(F) 开放场中的行走距离和时间。每个组的样本量为假手术组n = 6,大脑中动脉闭塞(MCAO)、MCAO + Ni-Ti和MCAO + Mg组每组n = 12。统计学显著性表示为* p < 0.05, **p < 0.01, ***p < 0.001对比MCAO + Mg组与MCAO组;##p < 0.01, ###p < 0.001对比MCAO + Mg组与MCAO + Ni-Ti组。
手术后七天,进行了开放场实验(图4E)。MCAO + Mg组的总移动距离和持续时间超过了MCAO组和MCAO + Ni-Ti组,表明MCAO + Mg组有更大的自发运动参与度(图4F)。此外,MCAO + Mg组的大鼠在内部外围区域和中心区域的穿越次数更多,花费的时间也更长,这表明这些大鼠的卒中后焦虑减少(图4F)。因此,行为测试结果表明镁丝植入可以保留受损的神经功能。
2.4. 镁丝的体内脑部完整性效应
鉴于镁丝在体内具有积极的神经保护效果,手术后7天提取了大鼠的大脑进行体外组织学检查。首先,使用三苯基氯化四氮唑(TTC)染色评估了梗死体积。与假手术组相比,MCAO组显示出显著的梗死,而MCAO + Ni-Ti组对梗死区域没有影响。然而,镁丝植入表现出抑制效果(图5A和B)。接下来,使用了突出神经元中Nissl体的Nissl染色来评估神经细胞完整性。Nissl染色结果显示,在皮层和纹状体中,MCAO + Mg组的神经元完整性优于MCAO组和MCAO + Ni-Ti组(图5C和D)。
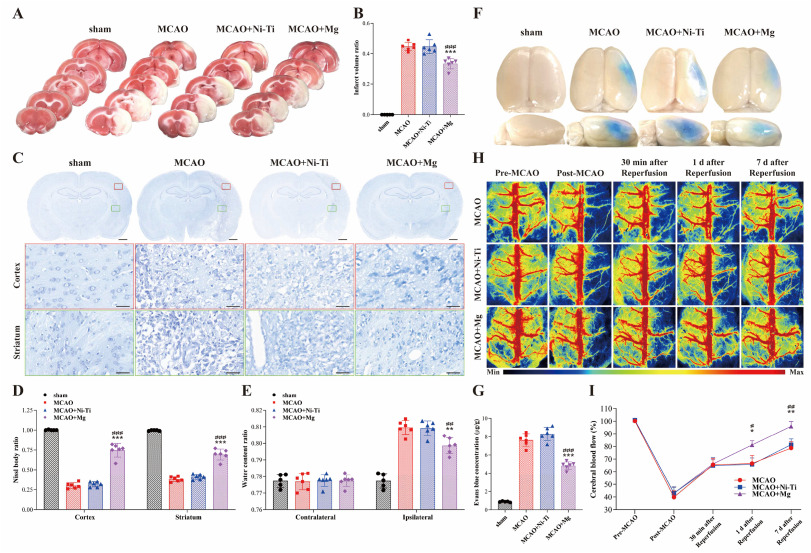
图5. 镁丝在缺血/再灌注损伤后7天内的体内脑部完整性和脑血流(CBF)保护效果。(A) 脑切片的TTC染色图像和(B) 梗死体积的半定量分析。(C) 脑切片的Nissl染色图像和(D) Nissl体的半定量分析;比例尺:1毫米和25微米。(E) 缺血大脑对侧和同侧的水含量比。(F) Evans蓝染料渗入大脑的代表性图像和(G) 梗死侧脑组织中Evans蓝含量的定量。(H) 通过激光散斑成像在指定时间点测量的大鼠CBF图像。(I) 从(H)派生的大鼠时间序列CBF曲线,损伤侧CBF表达为与对侧的比率。样本量对于假手术组为n = 5,对于大脑中动脉闭塞(MCAO)、MCAO + Ni-Ti和MCAO + Mg组为n = 6。统计学显著性表示为* p < 0.05, **p < 0.01, ***p < 0.001对比MCAO + Mg组与MCAO组;#p < 0.05, ##p < 0.01, ###p < 0.001对比MCAO + Mg组与MCAO + Ni-Ti组。
血脑屏障(BBB)破坏是缺血性中风的另一个常见后果,可能会恶化预后。BBB损伤允许水和其他有害大分子渗透到脑组织中。因此,测量了脑水含量和脑白蛋白浓度以评估BBB泄漏。如图5E所示,与MCAO和MCAO + Ni-Ti组相比,MCAO + Mg组在梗死半球的水含量较低。Evans蓝染色显示,通过BBB的白蛋白泄漏在MCAO + Mg组中少于MCAO和MCAO + Ni-Ti组(图5F和G)。这些脑部的组织学发现表明,镁丝可以有效地保存缺血/再灌注损伤后的脑部完整性。
2.5. 镁丝的体内脑血流效应
先前的研究表明,Mg2+和H2都可以在缺血/再灌注损伤后扩张血管。因此,监测了手术前、手术期间以及手术后1天和7天的脑血流(CBF)。最初,MCAO、MCAO + Ni-Ti和MCAO + Mg组的基线CBF一致。启动MCAO模型后,受伤侧的CBF下降到对侧CBF的约40%,并在30分钟再灌注后恢复到大约65%(图5H和I)。假手术程序和金属丝植入不影响CBF(图S4和S5)。再灌注后第一天,MCAO和MCAO + Ni-Ti组的CBF保持在约66%,而在MCAO + Mg组中,CBF显著增加到81.0%。此外,再灌注后7天,接受镁丝治疗的大鼠CBF恢复到95.8%,明显高于MCAO和MCAO + Ni-Ti组(图5H和I)。这些CBF结果表明,镁丝植入可能扩张脑血管,从而在缺血/再灌注损伤后增强CBF。
2.6. 镁丝的体内腐蚀评价
植入大鼠体内的镁丝被仔细提取进行详细分析。图6A揭示了CCA中剩余镁丝的3D重建。植入后一天,电线表面形成了一层明显的氧化层(红色),该层均匀且没有微小的腐蚀坑。随着时间的推移,氧化层的厚度增加,镁丝基质上出现了一些坑,表明随着时间的推移,从均匀腐蚀转变为局部腐蚀,可能是由于氧化层的降解。随着时间的流逝,镁丝的残留体积逐渐减少,从第一天的80.55±1.65%降至第28天的66.64±0.91%,表明大鼠中的腐蚀速率降低。尽管如此,一个月后镁丝仍保持结构完整性。图6B和C显示了镁丝腐蚀过程中的残留体积以及释放到生理环境中的氢气和镁离子。氢气和镁离子的释放速率与镁丝腐蚀相对应,随时间逐渐降低。除了释放到生理环境中的镁外,镁还残留在腐蚀层中。因此,释放到血液中的镁离子量(图6C中的红线)是基于腐蚀层中的镁含量(图6A)来估算的。估算表明,植入后第一天,大约有1.00±0.085μmol的镁和1.11±0.094μmol的氢气被释放到血液中。在一个月的植入期内,约有1.7μmol的镁和1.9μmol的氢气被释放,突显出释放集中在植入的早期阶段。图5D显示了镁丝的表面形态和相应的能量散射光谱仪(EDS)元素映射,揭示了镁丝上由Ca、P、O和Mg组成的薄降解产物层。该层中的Mg含量随着腐蚀时间的增加而减少(图6E),与先前的研究一致[21]。总的来说,CCA中的镁丝在体内表现出均匀腐蚀,最快的腐蚀速率出现在第一天,随后在植入期间逐渐减慢。
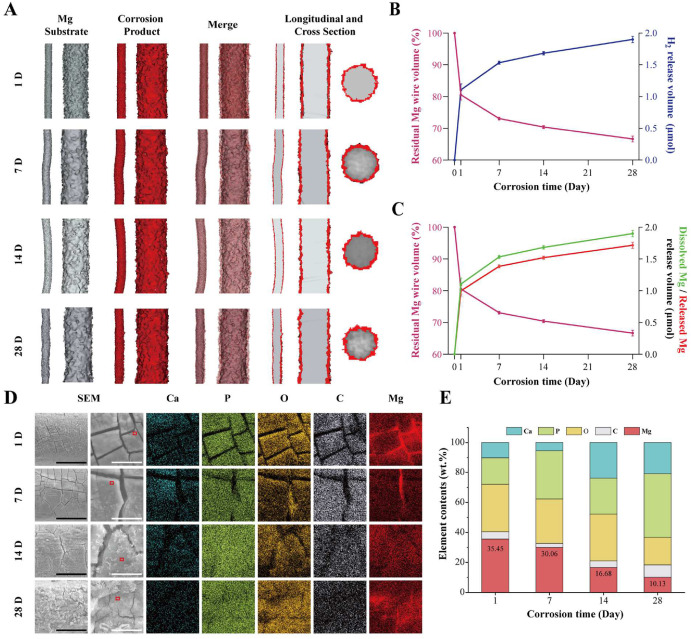
图6. 镁丝的体内腐蚀评价。(A) 根据微计算机断层扫描分析,植入后1、7、14和28天残留镁丝和腐蚀产物的3D重建。(B) 随时间变化的残留镁丝体积和释放氢气的体积。残留镁丝体积来源于模拟结果,而释放氢气的体积是基于此残留体积计算得出。(C) 植入过程中残留镁丝体积和溶解/释放到生理环境中的镁。(D) 植入后1、7、14和28天镁丝的扫描电子显微镜图像和能量散射光谱仪(EDS)元素映射。黑白比例尺分别代表50和10微米。(E) 镁丝表面降解产物的EDS点分析结果。
2.7. 体内Mg2+、H2、ROS和Ca2+浓度及生物安全性测试
在手术后1天和7天,测量了不同大鼠组血液中以及心脏、肝脏、脾脏、肺、肾脏、梗死对侧脑(ICB)和梗死同侧脑(IIB)等不同器官中的Mg2+浓度。手术后第1天,MCAO + Mg组血液中的Mg2+浓度高于假手术组、MCAO组和MCAO + Ni-Ti组,且在第7天时该浓度有所下降(图7A)。测量到大鼠颈总动脉血和梗死脑中的Mg2+浓度增加了约18微克/克,这与体外实验处于同一数量级。除了第1天的IIB外,所有测试器官中的Mg2+水平没有显著差异(图7B及图S6)。此外,手术后第1天在血液中发现了少量但可检测到的H2(图7C和D)。取出大鼠大脑后也测量了大脑中的氢气,但没有检测到H2。将来,可能会使用氢-1磁共振波谱技术在体内水平进行检测。
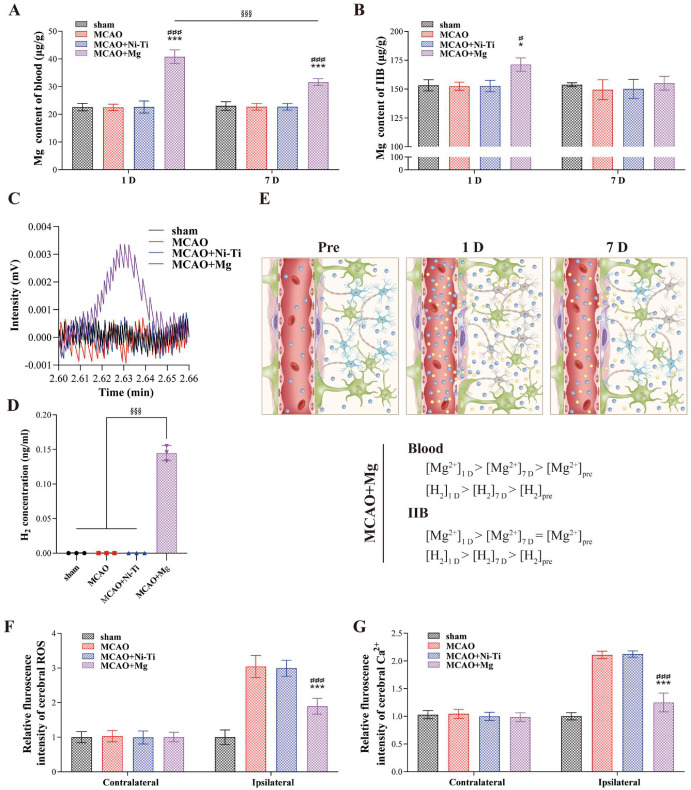
图7. 体内Mg2+、H2、活性氧物种(ROS)和Ca2+在血液和大脑中的浓度。(A) 植入镁丝后1天和7天大鼠血液中的镁浓度;(B) 同侧脑梗死大脑(IIB)中的镁浓度(n = 3)。(C) 通过气相色谱法测试的大鼠血液中H2的原始数据和(D)定量。(E) 血液中和大脑组织中Mg2+和H2分布的图谱和推断。还描述了大脑(F) ROS和(G) Ca2+的相对荧光强度。每组样本量为假手术组n = 5,中脑动脉闭塞(MCAO)、MCAO + Ni-Ti和MCAO + Mg组各为n = 6。统计显著性表示为**p < 0.01, ***p < 0.001对于MCAO + Mg组vs. MCAO组;##p < 0.01, ###p < 0.001对于MCAO + Mg组vs. MCAO + Ni-Ti组。
根据这些结果,可以推断出镁丝的植入导致了镁丝降解过程中血液中Mg2+和H2的释放,尤其是在第一天最为明显。尽管这种释放随时间减慢,但在第7天时血液中仍然有大量的Mg2+和H2。关于受损区域的大脑组织,第一天严重的BBB破坏允许大量血液中的Mg2+进入大脑实质。到了第7天,BBB有所恢复,减少了Mg2+进入IIB的流入,从而与Mg2+的消除达到平衡。由于BBB不阻碍氢气,IIB中的氢气水平可能与血液中的水平成比例(图7E)。
除了Mg2+和H2之外,还测量了大脑ROS和Ca2+的浓度。与体外发现一致,ICB中的ROS和Ca2+水平在四组之间没有差异。然而,在IIB中,MCAO和MCAO + Ni-Ti组的ROS和Ca2+水平升高,而镁丝植入显著抑制了这种增加(图7F和G)。此外,在镁丝植入后1、7、14和28天对大鼠实施了安乐死,进行了组织学分析。主要器官被切除并用H&E染色,显示无论是对照组还是治疗组均无明显急慢性病理毒性或不良影响(图S7)。此外,植入后第七天大脑中的镁含量已恢复到正常范围,这可能是由于BBB的恢复和Mg2+的快速代谢,在我们的观察中,术后14天的大鼠仍保持神经功能恢复状态,因此我们推测大脑中Mg2+的暂时增加不太可能对神经功能产生长期不良影响。
3. 讨论
本研究探讨了使用OGD/R诱导的HT-22细胞和MCAO大鼠模型模拟人脑缺血情况下镁植入物的神经保护作用。发现纯镁提取物在帮助HT-22细胞防御OGD/R损伤方面起到保护作用。此外,将纯镁丝植入MCAO大鼠的CCA中,类似于将生物可降解的神经保护镁支架插入脑血管中。观察结果显示,纯镁丝植入带来了多种益处,包括神经救援、BBB保护和CBF改善(图8)。基于本研究的发现,“生物可降解的神经保护支架”的创新概念看起来很有前景,并值得在未来的研究工作中进一步探索。
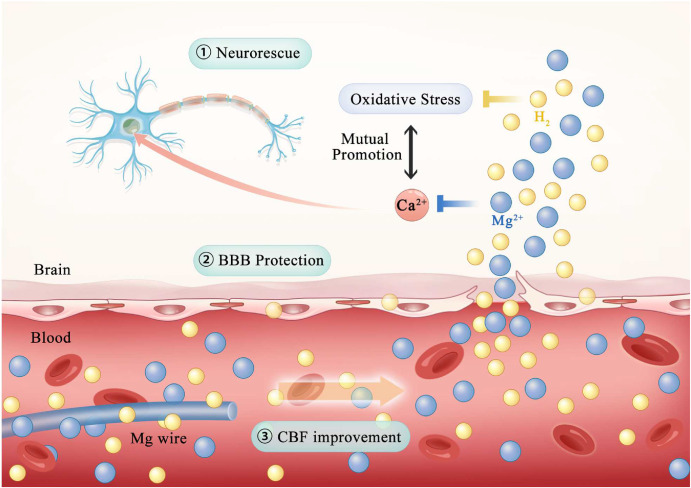
图8. 缺血性大脑中镁丝作用的示意图。镁丝降解产生的Mg2+和氢气迁移到损伤部位,并穿越血脑屏障进入大脑。Mg2+和氢气主要分别抑制Ca2+的内流和ROS的产生,并且表现出协同关系,最终导致神经元救援、BBB保护和CBF增强。
3.1. 镁合金在神经科学中的应用
由于其可调的机械强度和生物可降解性,镁及其合金正被认为是永久性生物医用材料有希望的替代品。然而,基于镁的生物医学装置在神经科学中的应用仍处于初期阶段。潜在的应用包括神经引导导管、用于神经记录或监测的神经电极的主要组成部分、脑动脉瘤线圈辅助支架和颈总动脉支架。
一种名为Magmaris(DREAMS 2G)的生物可降解镁合金心血管支架于2016年获得了CE标志,证明了其临床安全性和有效性。与心血管血管相比,脑血管系统因其曲折且缺乏血管周围组织支撑而更容易在血流动力学压力下破裂。支架部署位置的流体动力学特性也显著影响镁合金降解行为。人体不同血管中观察到不同的壁面剪切应力,如冠状动脉中的0.68±0.03 Pa,颈动脉中的1.23±0.21 Pa,以及脑动脉中的1.62-2.29 Pa。因此,确保镁合金支架的机械兼容性和均匀腐蚀对于其在脑场景中的潜在应用至关重要。此外,我们的研究旨在调查镁金属降解产物的神经保护效应,为开发具有神经保护功能的镁合金支架提供理论支持,并为基于镁的神经植入装置(可降解神经电极、线圈)提供新思路。镁合金的腐蚀速率与其表面积和局部流体环境有关。因此,有必要根据具体情况重新计算镁合金支架、神经电极和线圈的镁释放浓度。
3.2. 颅内支架置入术和再灌注损伤
颅内动脉粥样硬化性狭窄是全球范围内中风的主要原因之一。SAMMPRIS和VISSIT随机对照试验显示,颅内支架置入术的效果不如药物治疗,主要原因是与支架相关的高并发症率。此外,与单独药物治疗相比,结合支架和医疗疗法并没有显著降低症状性颅内狭窄患者的中风或死亡风险。
这些不理想的支架结果的可能解释可能与脑缺血再灌注损伤或脑过度灌注综合征有关。在缺血性中风中重新开通闭塞血管并恢复血液供应常常触发各种分子和细胞反应。其中,Ca2+超载和ROS产生是再灌注神经损伤发展的关键因素。由内皮细胞、基底膜、周细胞和星形胶质细胞足突组成的血脑屏障在维持大脑稳态中起着关键作用。内皮细胞内的Ca2+和ROS是影响BBB通透性的关键介质。BBB的破坏增加了血管通透性,导致进一步的大脑损伤。因此,神经保护策略对于解决再通后的缺血性脑损伤至关重要。尽管在临床前研究中有超过1000种潜在神经保护剂显示出前景,但它们在临床试验中往往失败,这强调了对新治疗方法的需求。
3.3. Mg2+和H2的神经保护作用
在脑缺血性疾病中,镁离子补充提供了多种神经保护机制。Mg2+通过减少N-甲基-D-天门冬氨酸受体介导的细胞内钙超载并作为天然钙拮抗剂起作用。它还扩张脑血管,增加脑缺血后的血流,稳定线粒体功能,并调节脑缺血后能量代谢关键酶。Mg2+可以通过腹膜内、静脉内、动脉内和颅腔内给药。特别是,颈动脉注射可以快速增加目标部位的药浓度,所需剂量更低。
此外,分子氢作为一种治疗性医用气体,在消除细胞毒性氧自由基方面有效,可用于治疗各种脑部疾病。这一点首次在2007年得到证明,当时发现吸入氢气可通过减少神经ROS损伤来减轻I/R损伤大鼠模型中的脑损伤。在全球脑I/R小鼠模型和OGD/R损伤的海马神经元中也观察到氢气的类似神经保护作用,发现氢气通过PINK1/Parkin信号通路促进线粒体自噬,保持线粒体膜电位。氢气的给药方法包括非侵入性的,如吸入氢气气体和饮用富氢水,这些方法便携、安全、简单,但向目标区域输送的剂量有限。相比之下,侵入性的方法如将溶解氢气的盐水注射到腹腔或血管内,可以将足够的氢气输送到受伤区域。
根据这些发现,除了镁和氢各自的效果外,它们的联合使用可能提供增强的神经保护作用。最近的临床试验表明,与单独使用硫酸镁输液或对照治疗相比,脑池内硫酸镁输液结合静脉注射氢疗法更能有效地改善严重动脉瘤性蛛网膜下腔出血患者的康复情况。这些结果提示,与单一疗法相比,联合使用Mg2+和氢可能在治疗缺血性中风时具有协同效应。这一假设与当前研究中的体外实验相一致。此外,虽然H2主要保护免受ROS过量产生的影响,但其从镁丝提取物中的缺失也减少了其对Ca2+超载的抑制作用。这可能是由于ROS与Ca2+信号之间的复杂相互作用,其中一个的异常可能会影响另一个,使两条途径都不稳定。相反,保护一个途径可能会保护另一个途径,从而使两者都稳定下来。
除了直接的神经保护作用外,本研究的体内研究还发现,镁丝植入保护了BBB并促进了脑梗死后CBF的恢复。Ca2+超载和ROS是已知的导致EC损伤的因素,从而导致BBB泄漏增加。关于CBF,Ca2+超载和ROS是周细胞收缩的主要原因,减少了血管直径和CBF。推测这些效果是通过Mg2+和H2在ECs和周细胞中对Ca2+超载和ROS的协同抑制来实现的。然而,需要进一步的研究来确认这一假设。
值得注意的是,我们无法在体内分离Mg2+和H2,目前也很难通过连续注射Mg2+或H2完全模拟体内镁丝降解的过程。如果将来能够实现体内血液中Mg2+或H2的过滤,我们将进一步探索它们各自的作用。同时,目前我们无法确定Mg2+和H2哪个更重要,因为它们的保护作用受到体内多种因素的调节,如浓度、注射方法、干预时机。如果我们能在未来确定,那么用聚合物涂层镁丝/支架以释放更多Mg2+或合金化以释放更多H2来改善植入的镁丝/支架似乎是一个有前景的方向。
3.4. 纯镁金属及镁合金的神经活性
直接研究纯镁金属或镁合金的神经活性相对较少,但是镁离子(通常以MgSO4或MgCl2溶液的形式)的神经保护性质已被广泛研究。我们之前的工作揭示了来源于植入大鼠完整远端股骨的超纯镁针的Mg2+促进了新骨形成,并显著增加了同侧背根神经节(DRG)和股骨外围皮质中的神经元降钙素基因相关肽(CGRP)。此外,分离的大鼠DRG神经元实验表明,升高的细胞外Mg2+可通过特定通道触发Mg2+内流,增强细胞内三磷酸腺苷(ATP)水平,并积累含有CGRP的末端突触小泡。这可能促进骨膜衍生干细胞的成骨分化,表明来自纯镁金属的Mg2+可以增强神经能量代谢。
此外,研究发现稀释的Mg-Zn-Nd-Zr镁合金提取物刺激了星形胶质细胞和神经干细胞的增殖。这种提取物还鼓励神经干细胞向星形胶质细胞和神经元分化。这些效应可能很大程度上归因于提取物中的Mg2+,因为已知Mg2+促进神经干细胞的增殖和分化。
总之,尽管关于纯镁金属及镁合金的神经保护效应的研究有限,但现有研究提供了宝贵的见解。纯镁线材在AIS后对神经的保护作用也可能归因于改善神经细胞的能量代谢和促进神经元再生。
此外,神经毒性方面也值得关注。根据体内的动物研究,大鼠CCA中镁线的完全降解大约需要3-4个月。在此期间,我们没有观察到相关的不良反应,如小血管阻塞或神经活动和行为的变化。推测原因是镁线降解产生的Mg2+和H2可以在体内安全代谢。
3.5. 金属来源的H2的体内活性
金属植入物来源的H2的体内效应是最近研究的一个焦点。例如,Yang等人开发了基于镁的伽伐尼电池(MgG)用于肿瘤植入。他们的研究发现,MgG可以产生H2,诱导肿瘤中的线粒体功能障碍和破坏细胞内氧化还原平衡,从而抑制肿瘤生长。同样,Liu等人利用H2的抗炎特性构建了一个Zn-Fe电池。这种电池口服给药至糖尿病模型小鼠的胃中,增强了Zn水解,产生H2进而减少了全身性炎症。在另一项研究中,Nan等人将镁颗粒掺入微颗粒中注射到膝关节。在镁降解过程中生成的H2被发现可以抑制ROS产生,从而减少关节炎症。这些研究表明了来自镁源的H2在体内的多功能活性,而我们的研究进一步将这一领域扩展到神经保护。此外,血液中产生氢气的安全性值得探索,因为气体可能在血液中形成气栓。然而,由于镁线周围的血液处于流动状态,镁线产生的氢气会随着血流不断流动,不会局部积聚。而且,我们的研究中未发现类似气栓的不良后果,这足以证明镁线的血管安全性。3.6. 具有“远程”神经保护功能的支架
“远程”这一概念在医学中已得到广泛认可。例如,远程缺血性病变指的是发生在颅内出血部位远端的缺血性损伤,可能是由于血肿引起的血管痉挛所致。材料或技术的远程生物活性也正在被探索。彭等人发现,局部植入腹部的聚丙烯和丝素蛋白可以导致远程肝脏脂肪沉积。远程缺血适应,涉及使用血压袖带对肢体进行重复短暂缺血,已被证明可以保护心脏或大脑等远距离器官免受进一步缺血性损伤。这项技术已在多中心随机对照试验(RCTs)中得到验证。借鉴这些原理,我们的研究提出了“生物可降解远程神经保护支架”的概念。这一概念基于从血流中的镁金属局部释放的Mg2+/H2可以为远距离脑缺血组织提供协同神经保护的发现。未来的支架设计可以从这种创新方法中受益,赋予支架神经保护功能。
大鼠的动脉分支很多,这一现象与人类环境一致。然而,我们确实发现了大鼠梗死脑中Mg2+浓度的增加(图7B),这足以证明带有神经保护材料的支架具有针对性治疗潜力。
3.7. 未来发展
本研究为未来开发生物可降解镁合金支架的研究奠定了基础,特别是对于神经血管应用。建议进一步探索几个关键领域:
1)在本研究中,使用了纯镁丝来分离其他金属元素的神经保护效果。然而,纯镁的机械性能不足和腐蚀速率不可控制使其不适合用于支架制造。这些问题可以通过合金化和表面改性来解决。合金化过程涉及添加其他金属元素,这为研究这些附加元素的神经保护效果提供了可能性。此外,通常通过涂层进行的表面改性为结合药物如依达拉奉或丁基苯酞提供了机会,这些药物已被证明有助于脑梗死恢复。
2)中风治疗是时间敏感的,使镁合金的降解速率与治疗窗口对齐至关重要。这种对齐可以通过表面工程技术实现,例如等离子体浸没离子注入和沉积(PIIID)技术,可以创建具有特定时间框架定制腐蚀率的支架。
3)目前,镁合金生物可降解支架仅获批用于冠状动脉疾病。鉴于心血管和脑血管疾病共有的常见病理因素,探究冠状动脉镁合金支架在其降解过程中对脑血管疾病的可能保护作用至关重要。
4)除了脑梗死外,中风还包括蛛网膜下腔出血,通常是由动脉瘤破裂引起的。支架辅助线圈栓塞是治疗破裂动脉瘤的常见方法。因此,镁合金支架可能用于治疗脑动脉瘤,而支架降解对蛛网膜下腔出血后神经功能的影响代表了另一个研究方向。
5)基于本研究,当镁合金支架将来可用于脑血管时,临床医生不仅可以关注与传统支架相比镁支架对原位血管的影响,还可以进行RCT以探索镁合金支架是否具有额外的神经保护效果,为神经保护支架的临床应用提供直接证据。
4. 结论
总之,本研究调查了镁金属作为神经科学中一种内血管装置的使用。发现镁提取物能够保护小鼠海马神经元细胞免受氧-葡萄糖剥夺/再氧化(OGD/R)损伤。在MCAO大鼠模型中植入的镁丝局部释放的Mg2+/H2为远距离脑缺血组织提供了协同神经保护。Mg2+和H2主要分别抑制Ca2+内流和ROS产生,它们的效果相互增强,导致神经元救援、BBB保护和改善脑血流。这些发现引入了一个创新的支架设计理念:“生物可降解神经保护支架”。
5. 材料和方法
https://blog.sciencenet.cn/blog-41174-1449245.html
上一篇:氢气多功能医学效应 2024年英学位论文第一章
下一篇:近红外驱动的氢气释放治疗阿尔茨海默病