博文
氢气减少七氟烷诱导新生儿皮层神经元凋亡,氢气有效浓度1-8%  精选
精选
||
氢气减少七氟烷诱导新生儿皮层神经元凋亡
本研究目的是观察氢气吸入是否能减少麻醉导致的脑神经损伤,发现1-8%氢气吸入3小时能减少麻醉药导致的神经元前体细胞凋亡,这里的前体细胞属于能分化为神经元的祖细胞,就是神经干细胞。然后作者研究了神经元凋亡的信号分子磷酸化,发现氢气能减少这些分子的磷酸化水平。如下图为该研究论文的图形摘要。作者认为氢气吸入通过减少了氧化应激,从而减少了Jun蛋白的磷酸化水平,减少了细胞凋亡。本研究很重要的信息是,通过细胞凋亡保护,证明1-8%的氢气是效果最好的,但16%的效果很一般。这一信息强烈提示,氢气吸入的效果并不是越多越好。这和我们今天流行的做法完全不同,给我们一个非常重要的提醒。
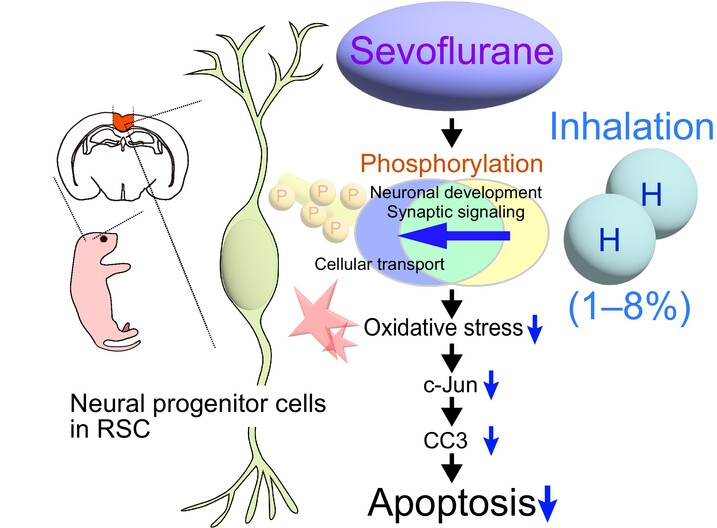
吸入氢气(H2)对脑血管疾病、神经退行性疾病和新生儿大脑障碍,包括由麻醉气体引起的病理状态具有治疗效果。为了理解氢气对大脑保护作用背后的机制,我们研究了在七氟醚诱导的神经元死亡中受到H2影响的分子信号。我们确认,神经前体细胞对七氟醚敏感,并且在幼鼠的后扣带皮层中发生凋亡。将1-8%的H2气体与七氟醚一同给药3小时,可以抑制因氧化应激而升高的caspase-3介导的凋亡性细胞死亡,并同时减少c-Jun磷酸化和c-Jun通路的激活。麻醉引起的脂质过氧化和氧化DNA损伤通过H2吸入得到缓解。磷酸蛋白质组分析揭示,在暴露于七氟醚的新生大脑中,有丰富的差异性磷酸化蛋白簇集,包括参与神经元发育和突触信号传导的蛋白。H2吸入修改了依赖高磷酸化蛋白的细胞运输途径,包括微管相关蛋白家族。这些修改可能涉及H2对抗七氟醚诱导神经元死亡的保护机制中。
该论文通讯作者为大泽郁郎教授,他也是2007年氢气医学奠基性论文的第一作者。
Iketani M, Hatomi M, Fujita Y, Watanabe N, Ito M, Kawaguchi H, Ohsawa I. Inhalation of hydrogen gas mitigates sevoflurane-induced neuronal apoptosis in the neonatal cortex and is associated with changes in protein phosphorylation. J Neurochem. 2024 Jun 7.
全文约12000字。
1 前言
分子氢(H2)作为一种抗氧化和抗炎剂,在动物疾病模型和临床研究中的给药途径大致可以分为两种:吸入氢气和饮用富氢水。氢气吸入对脑部缺血-再灌注损伤具有显著的神经保护作用。最近有报道称,脑缺血后和心脏骤停后的护理期间吸入氢气能增加无神经缺陷存活率。饮用富氢水可能缓解包括帕金森病和阿尔茨海默病在内的神经退行性疾病。它还可以减少视网膜疾病、心血管疾病、肝脏疾病、代谢综合征以及日常生活中的精神疲劳,从而可能提高老年人的生活质量。为了将这些发现进一步转化为临床实践,应阐明氢气功能的分子机制。
在动物模型中预先给予氢气可以预防炎症性疾病,这表明氢气可能间接作用于氧化应激。最近的研究显示,用氢气处理1小时可以抑制由佛波醇12-肉豆蔻酸酯13-乙酸酯诱导的中性粒细胞胞外陷阱的形成,而不会改变基因表达的主要变化。我们发现,将神经母细胞暴露于氢气中1小时,会暂时性且可逆地增加几种磷脂的水平,抑制与能量生产相关的代谢途径,并同时增加微弱的氧化应激。实际上,几乎所有缺血-再灌注损伤模型中都观察到了氢气治疗1-2小时的保护效果。这些来自细胞和动物实验的结果表明,氢气的抗氧化和抗炎功能是其早期细胞调节的结果。
许多气体分子,包括氢气,在脂质中的溶解度比在水中高。溶解在脂质中的气体可能会影响细胞和生理功能。尽管麻醉剂的确切分子机制在很大程度上仍然未知,但Meyer-Overton关联提供了麻醉气体效力与其在类脂非极性介质中溶解度之间的联系。溶解在脂质中的麻醉气体通过疏水相互作用改变细胞膜结构。尽管麻醉气体是非常安全的药物,但它们对未成熟大脑的使用会引起病理变化和长期的行为异常。此外,新生小鼠在吸入七氟醚期间吸入氢气6小时,可以抑制七氟醚引起的氧化应激增加、神经元凋亡以及随后的神经行为缺陷。而且,吸入氢气还能阻止成年后由于新生期暴露于七氟醚而引起的异常母性行为,这表明氢气具有减少麻醉药物引起副作用的巨大潜力。在这项研究中,我们调查了氢气在七氟醚诱导的神经元细胞死亡中影响的分子信号,以更好地理解氢气对大脑保护作用的机制。
2 材料与方法
2.1 动物
所有动物使用和实验方案均遵循《实验室动物护理原则》(NIH出版物编号86-23,1985年修订)。所有研究协议均由东京都老年医学研究所的动物护理委员会审查并批准(批准代码,23027)。在实验过程中,我们尽一切努力减少动物数量及其痛苦。从SLC(东京,日本)购买的C57BL/6N定时怀孕小鼠被安置在22°C的环境中,光照周期为12小时光照/12小时黑暗,自由获取无菌食物和水。出生日被标记为P0。未确定幼崽的性别。研究中未进行随机分配,也未预先确定排除标准。总共使用了18只母鼠和142只幼崽进行实验。该研究未进行预注册。
2.2 暴露于含氢麻醉气体中
在出生后第6天,将小鼠幼崽从母鼠笼中取出,立即放入预热至37°C的湿润丙烯酸室(内部体积6.8升)中。每个室内的幼崽数量为3-6只。关闭并密封盖子后,以1.0升/分钟的流量向室内充入麻醉气体混合物20分钟,然后在正常压力下将其置于37°C的孵化器中3小时(图S1)。随后一些室被打开,立即用空气通风,并在37°C下再保持3小时。根据之前的研究,麻醉气体混合物包含3%七氟醚、30%氧气和0-16%氢气,其余为氮气平衡。来自不同母鼠的幼崽被混合并随意分为五组,分别暴露于以下环境:(1)空气3小时(对照组),(2)不含氢气的混合麻醉气体3小时(七氟醚组),(3)含2%氢气的混合麻醉气体3小时(七氟醚+氢气组),(4)不含氢气的混合麻醉气体3小时,然后空气3小时(七氟醚/空气组),以及(5)含2%氢气的混合麻醉气体3小时,然后空气3小时(七氟醚/空气+氢气组;见图S1)。为了确定展示最强抗凋亡活性的氢气浓度,将幼崽暴露于含有0-16%氢气的混合麻醉气体中3小时,然后再暴露于空气中3小时。之后我们在冷诱导麻醉下将幼崽断头,立即取出大脑,并将左半球的大脑皮层在干冰上速冻。样本储存于-80°C。右半球用4%多聚甲醛在磷酸盐缓冲盐水(PBS)中固定过夜,在4°C下用30%蔗糖/PBS保护,用最佳切割温度(OCT)包埋介质(目录号45833,SAKURA,东京,日本)冷冻,并储存于-80°C。
我们使用GIGA计算器网站的Power & Sample Size Calculator确定了每组的样本量为n=19。实验设计参数:I型错误率(α)= 5%,功效(1−β)= 85%,治疗组数 = 7。数据参数:H0下的均值 = 100,标准差 = 40,最小可检测效应(MDE)= 30,优越性边界 = 0。这些参数基于先前研究(Yonamine等人,2013年)的数据选择。
2.3 免疫染色和末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(TUNEL)测定
OCT包埋的大脑在冷冻切片机上切成20μm厚的冠状切片。每个切片用山羊血清封闭,然后在4°C下与以下针对小鼠抗原的一抗过夜孵育:单克隆兔抗裂解型caspase-3(CC3),用于检测由Asp175附近切割产生的大片段caspase-3;单克隆大鼠抗巢蛋白、抗GFAP、抗NeuN、抗CD31、抗Olig-2、抗F4/80、抗结蛋白;单克隆小鼠抗c-Jun和单克隆小鼠抗磷酸化c-Jun,用于检测Ser63磷酸化的c-Jun p39。然后每个切片在室温(RT)下用以下适当的二抗IgG抗体孵育60分钟:山羊抗小鼠结合Alexa Fluor 594、抗兔结合Alexa Fluor 594、抗兔结合Alexa Fluor 647,以及抗大鼠结合Alexa Fluor 488、抗山羊结合Alexa Fluor 488和抗兔结合CF680R。样本在激光共聚焦显微镜上成像。为了定量免疫组织化学染色CC3,我们使用了生物素化的抗兔IgG和亲和素-辣根过氧化物酶缀合物。免疫染色用3,3'-二氨基联苯胺显色,切片用苏木精复染。在楔前皮质中计数阳性细胞。
对于TUNEL测定,我们使用ApopTag®原位凋亡检测试剂盒按照制造商的协议进行。简而言之,切片在乙醇:醋酸2:1中后固定。在用PBS中的3%过氧化氢淬灭内源性过氧化物酶后,切片在37°C下与末端脱氧核苷酸转移酶孵育,随后与抗地高辛过氧化物酶缀合物孵育。用DAB显色的TUNEL阳性细胞被可视化。每个切片的楔前皮质内的阳性细胞在1-2个视野(每个0.3到0.5 mm²)内手动计数。
2.4 氧化应激标志物的免疫组织化学
4%多聚甲醛固定的OCT包埋大脑的冠状切片(20μm厚)如前所述对氧化应激标志物8-羟基-2'-脱氧鸟苷(8-OHdG)和4-羟基-2-壬烯醛(4-HNE)进行染色。简而言之,切片在柠檬酸缓冲液中加热5分钟以促进抗原恢复,用山羊血清封闭,并在4°C下与针对8-OHdG和4-HNE的一抗单克隆抗体过夜孵育。洗涤后,切片在室温下用生物素化的抗小鼠IgG二抗孵育60分钟,并进一步在室温下用碱性磷酸酶孵育30分钟。使用5-溴-4-氯-3-吲哚磷酸/硝基蓝四唑作为生色底物实现颜色反应。每个切片的楔前皮质内的阳性细胞在1-2个视野(每个0.3–0.5 mm²)内手动计数。
2.5 蛋白质免疫印迹法
将冷冻的大脑皮层在放射性免疫沉淀分析(RIPA)缓冲液中匀浆,该缓冲液含有蛋白酶抑制剂混合物,并在4°C下以15000g离心20分钟。收集上清液并储存于-80°C。解冻后,对于c-Jun,热变性蛋白(每道5μg)在10%丙烯酰胺凝胶上分离并电转移到聚偏氟乙烯(PVDF)膜上。用脱脂牛奶封闭膜,然后在4°C下与抗c-Jun(1:3000)和磷酸化c-Jun(1:3000)的一抗单克隆小鼠抗体过夜孵育。对于CC3,热变性蛋白(每道10μg)在15%丙烯酰胺凝胶上分离并电转移到PVDF膜(0.2μm微孔)上。用脱脂牛奶封闭膜,然后在4°C下与一抗兔抗CC3(1:3000)过夜孵育。洗涤后,膜在室温下用辣根过氧化物酶偶联的抗小鼠IgG孵育1小时。使用增强化学发光试剂盒检测蛋白带,并用CCD成像系统可视化。作为内参,膜被剥离并与多克隆兔抗甘油醛-3-磷酸脱氢酶抗体和辣根过氧化物酶偶联的抗兔IgG孵育。
2.6 定量PCR
使用RNeasy Plus Mini试剂盒从冷冻的大脑皮层中提取总RNA,并按照制造商的协议使用第一链合成系统进行逆转录。通过使用基于SYBR Green I的qPCR混合液和StepOne Plus实时PCR系统,以三重复测定转录水平。用于扩增的引物列于表1。基因表达量归一化至每个样本中的Rpl4表达量。
TABLE 1. List of primers used for quantitative real-time PCR.
Gene | Fwd/rev | Primer sequence (5′–3′) |
Fas | Forward | GAGAATTGCTGAAGACATGACAATCC |
Reverse | GTAGTTTTCACTCCAGACATTGTCC | |
Fasl | Forward | CAGCCCATGAATTACCCATGT |
Reverse | ATTTGTGTTGTGGTCCTTCTTCT | |
Bcl2 | Forward | TAAGCTGTCACAGAGGGGCT |
Reverse | TGAAGAGTTCCTCCACCACC | |
Jun | Forward | ACGACCTTCTACGACGATGC |
Reverse | CCAGGTTCAAGGTCATGCTC | |
Fos | Forward | GAATGGTGAAGACCGTGTCAG |
Reverse | CTGCAACGCAGACTTCTCATC | |
Egr1 | Forward | CTGCTTCATCGTCTTCCTCT |
Reverse | CCTGTTGTTGTGGAAACAGA | |
Ddit3 | Forward | CTGCCTTTCACCTTGGAGAC |
Reverse | CGTTTCCTGGGGATGAGATA | |
Ppp1r15a | Forward | GGTGGTCCAGCTGAGAATGA |
Reverse | TCTTCCGTGGCTTGATGTTC | |
Hmox1 | Forward | TGCTAGCCTGGTGCAAGATA |
Reverse | GCCAACAGGAAGCTGAGAGT | |
Rpl4 (internal control) | Forward | GCCAAGACTATGCGCAGGAAT |
Reverse | GTAGCTGCTGCTTCCAGCTT |
2.7 血流和氧气水平测量
使用激光散斑对比成像仪测量血流,该设备由一个红外半导体激光器(波长785 nm)和一个电荷耦合器件相机(moor FLIP2)组成。设备设置在小鼠腹部上方,调整缩放以包括整个身体。视野约为3136 mm²(64.0 × 49.0 mm)。一个平面图像由752 × 580像素组成,像素大小约为85 μm。为了量化区域血流,从腹股沟区域的感兴趣区域约16.4 mm²(4.0 × 4.1 mm)提取数据。使用非侵入式脉搏血氧仪测量血氧水平。
2.8 磷酸蛋白质组学分析
通过纳米液相色谱-串联质谱(LC-MS/MS)进行的磷酸蛋白质组学分析和数据处理在Proteobiologics进行。
2.8.1 LC-MS/MS分析的样品制备
将冷冻的楔前皮质在含有蛋白酶抑制剂混合物和磷酸酶抑制剂混合物的相转移表面活性剂缓冲液中匀浆,95°C孵育7分钟,超声处理并离心。然后将上清液转移到新的管子中。每个样品用相转移表面活性剂缓冲液溶解。每个样品共200 μg转移到1.5 mL管中,95°C煮沸5分钟。使用Bioruptor超声器对裂解液进行超声处理。然后,用10 mM2-羧乙基三膦还原样品,用20 mM碘乙酰胺烷基化,并使用SP3协议纯化蛋白质。纯化的蛋白质用胰蛋白酶(蛋白质重量:1/50)和质量光谱级的赖氨酰内肽酶在37°C下消化16小时。
2.8.2 去盐、富集磷酸肽、串联质量标签(TMT)标记
根据先前描述的协议,使用OASIS亲水-疏水平衡对肽段进行去盐,并用Fe3+固定化金属亲和层析(Fe-IMAC)树脂富集磷酸肽。在本研究中,我们在阶段尖端用Fe-IMAC树脂富集了磷酸肽。简而言之,将C18盘设置在200 μL一次性尖端中,并在C18盘上设置Fe-IMAC树脂。去盐的肽段通过Fe-IMAC/C18阶段尖端。用60%乙腈加0.1%三氟乙酸洗脱磷酸肽,并在下部C18盘上纯化。为了定量每个样品中的磷酸位点,根据制造商的协议对每个富集磷酸肽的样品进行TMT标记。样品随后被真空离心至近干。每个组分在2%乙腈,0.1%三氟乙酸中重构,用于LC-MS/MS处理。
2.8.3 LC-MS/MS分析
LC-MS/MS分析使用与Ultimate 3000和HTC-PAL耦合的Q Exactive Plus进行。纳米液相色谱梯度由缓冲液A(0.1%甲酸)与5-30%缓冲液B(0.1%甲酸和99.9%乙腈)在85分钟内形成;流速为280 nL/min。Q Exactive仪器以数据依赖模式操作。在离子累积至3×10^6目标值后,在Orbitrap中以70,000分辨率获取调查全扫描质谱(m/z 350–1800)。动态排除设置为30秒。最强烈的12个多电荷离子(z≥2)被顺序累积至1×10^5目标值,并在碰撞池中通过高能量碰撞解离(HCD)进行碎片化,最大注射时间为120毫秒,分辨率为35,000。典型的质谱条件如下:喷雾电压,2 kV;加热毛细管温度,250°C;标准化HCD碰撞能量,30%。LC-MS/MS离子选择阈值设置为2.5×10^4计数。选择了0.7 Da的隔离宽度。
2.8.4 磷酸肽的鉴定和定量
使用MaxQuant1.6.14.0进行磷酸肽的鉴定。结合了253种常见污染物的人类蛋白质UniProt数据库(2017_01版本)用于分析LC-MS/MS光谱。酶特异性设置为胰蛋白酶/P。允许最多两个位点的不正确切割。假设半胱氨酸残基的固定修饰为羧甲基化,而蛋氨酸氧化和丝氨酸、苏氨酸、酪氨酸的磷酸化被设定为可变修饰。蛋白质组、肽段和磷酸位点的假发现率(FDR)小于0.01。TMT报告离子强度的定量值由MaxQuant总结。被识别为反向或潜在污染物的肽段不用于后续分析。每个磷酸位点的定位概率的截断标准超过0.75。
2.8.5 数据处理
使用Perseus 1.6.14.0进行数据处理。定量TMT报告离子强度经过log2转换并通过每个TMT通道中的值的中位数中心化进行归一化。
2.9 使用Phos-tag技术富集和蛋白质免疫印迹分析磷酸蛋白
冰冻的楔前皮质在不含SDS的RIPA缓冲液中匀浆,该缓冲液含有蛋白酶抑制剂混合物和磷酸酶抑制剂混合物。匀浆样本在4°C下以15000×g离心20分钟。收集上清液并储存于-80°C。使用Phos-tag琼脂糖从解冻样本中提取磷酸化蛋白质。Phos-tag协议首先通过用21G针头刺穿0.5 mL管底部创建一个小孔,并将此管置于1.5 mL管内开始。然后,向0.5 mL管中加入40 μL的50% (v/v) Phos-tag琼脂糖悬浮液,将单元离心(2000 g)20秒后丢弃滤液。接着,加入40 μL平衡缓冲液,再次离心并在5分钟后丢弃滤液。凝胶用40 μL结合/洗涤缓冲液(0.1 M Tris-CH3COOH (pH 7.5) 和 1 M CH3COONa)洗涤三次,伴随离心。随后,向每个含有20 μg蛋白质的匀浆样本中加入10 μL,平衡5分钟,然后离心以收集流过物。然后将与磷酸蛋白结合的凝胶用0.1 mL结合/洗涤缓冲液洗涤并离心。向凝胶中加入至少40 μL蒸馏水后,将混合物转移到新管中并离心以丢弃上清液。最后,向凝胶中加入10 μL样品上样染料,然后在95°C加热5分钟。热变性样本在3%丙烯酰胺/0.5%琼脂糖凝胶上分离,并在4°C下湿转到PVDF膜上16小时。膜用脱脂牛奶封闭,并在4°C下与MAP1A和MAP1B的一抗过夜孵育。洗涤后,膜在室温下与辣根过氧化物酶偶联的抗小鼠IgG(1:10000)和抗兔IgG(1:10000)孵育1小时。蛋白质带用增强化学发光试剂盒检测,并用CCD成像系统可视化。
2.10 统计分析
使用Prism 8进行统计分析。所有值表示为平均值±标准偏差(SD)。通过Shapiro-Wilk和Kolmogorov-Smirnov测试确认数据的正态性。通过带有Tukey测试的单因素方差分析(ANOVA)确定显著性。p<0.05视为显著。数据未进行离群值测试。我们收集了包括F值和p值在内的所有统计数据,用于我们的ANOVA和t检验分析(数据S1)。对于LC-MS/MS分析,使用Welch的t检验确定感兴趣条件之间的统计显著性。p值通过Benjamini-Hochberg方法进行FDR校正。
3 结果
3.1 七氟醚诱导的新生鼠大脑神经祖细胞凋亡
我们首先在暴露于七氟醚的新生小鼠大脑中识别出凋亡细胞。我们在6天大的小鼠暴露于3%七氟醚3小时后,主要在发育缓慢的楔前皮质(随着动物学会在环境中导航而发育)观察到抗CC3抗体染色或TUNEL阳性的凋亡细胞(图1)。凋亡由内在或外在途径介导,导致caspase-3的切割。CC3阳性细胞与抗巢蛋白抗体共染(图1c),但不与NeuN(成熟神经元的标志物;图1a)、胶质纤维酸性蛋白(GFAP;星形胶质细胞的标志物;图1b)、CD31(内皮细胞的标志物;图1d)、抗Olig2(少突胶质细胞的标志物;图1e)、抗F4/80(微胶质细胞和巨噬细胞的标志物;图1f)或抗结蛋白(周细胞的标志物;图1g)共染。由于存在巢蛋白阳性的周细胞,CC3阳性细胞同时用抗巢蛋白和抗结蛋白抗体共染。我们发现双阳性细胞不是CC3阳性。这些结果表明,七氟醚暴露可诱导凋亡的细胞是神经祖细胞。
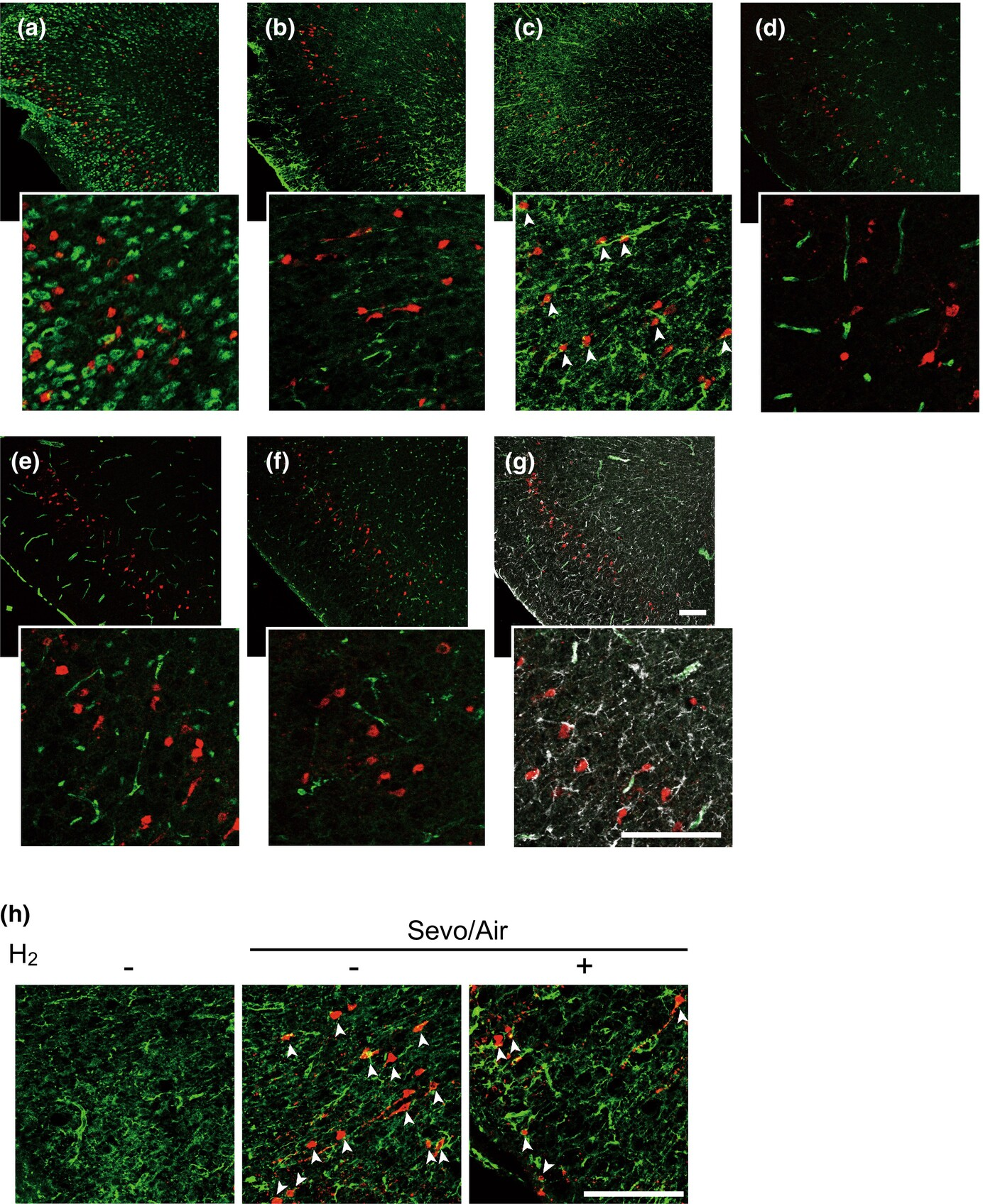
图1七氟醚诱导楔前皮质神经祖细胞凋亡。(a–g) 代表性共聚焦显微镜图像显示,七氟醚诱导的CC3阳性细胞(红色),与抗NeuN (a)、抗GFAP (b)、抗巢蛋白 (c)、抗CD31 (d)、抗Olig2 (e)、抗F4/80(绿色;f)或抗结蛋白(绿色)和抗巢蛋白(白色;g)共染。幼鼠暴露于混合麻醉气体3小时,然后暴露于空气3小时。(h)从暴露于含或不含2%氢气的混合麻醉气体3小时及随后暴露于空气3小时(Sevo/Air)的幼鼠中提取的楔前皮质,用抗CC3(红色)和抗巢蛋白(绿色)抗体共染。箭头指示巢蛋白和CC3双阳性细胞。比例尺:100μm。
3.2 氢气对七氟醚诱导凋亡的神经保护作用
为了评估氢气对七氟醚诱导凋亡的保护作用,新生小鼠被同时给予3%七氟醚,有或无2%氢气共处理3小时(分别为Sevo组和Sevo+H2组)。先前的研究表明,在脑缺血再灌注期间吸入的氢气最有效的浓度是2%。免疫染色和TUNEL检测显示,氢气倾向于减少七氟醚诱导的CC3和TUNEL阳性细胞增加(图2a-c)。为了便于区分凋亡细胞,将小鼠进一步置于正常空气中3小时,以使大脑中的凋亡得以发展(Sevo/Air和Sevo+H2/Air组)。我们观察到,与Sevo组相比,Sevo/Air组中七氟醚诱导的CC3和TUNEL阳性细胞约增加了两倍(图2a-c)。在这些实验条件下,2%氢气导致Sevo+H2/Air组的CC3和TUNEL阳性细胞数量显著低于Sevo/Air组(图2a-c)。西方印迹分析揭示,氢气抑制了七氟醚在楔前皮质中诱导的CC3片段增加(图S2)。我们进一步确认,随着2%氢气的使用,楔前皮质中凋亡神经祖细胞的数量减少(图1d)。
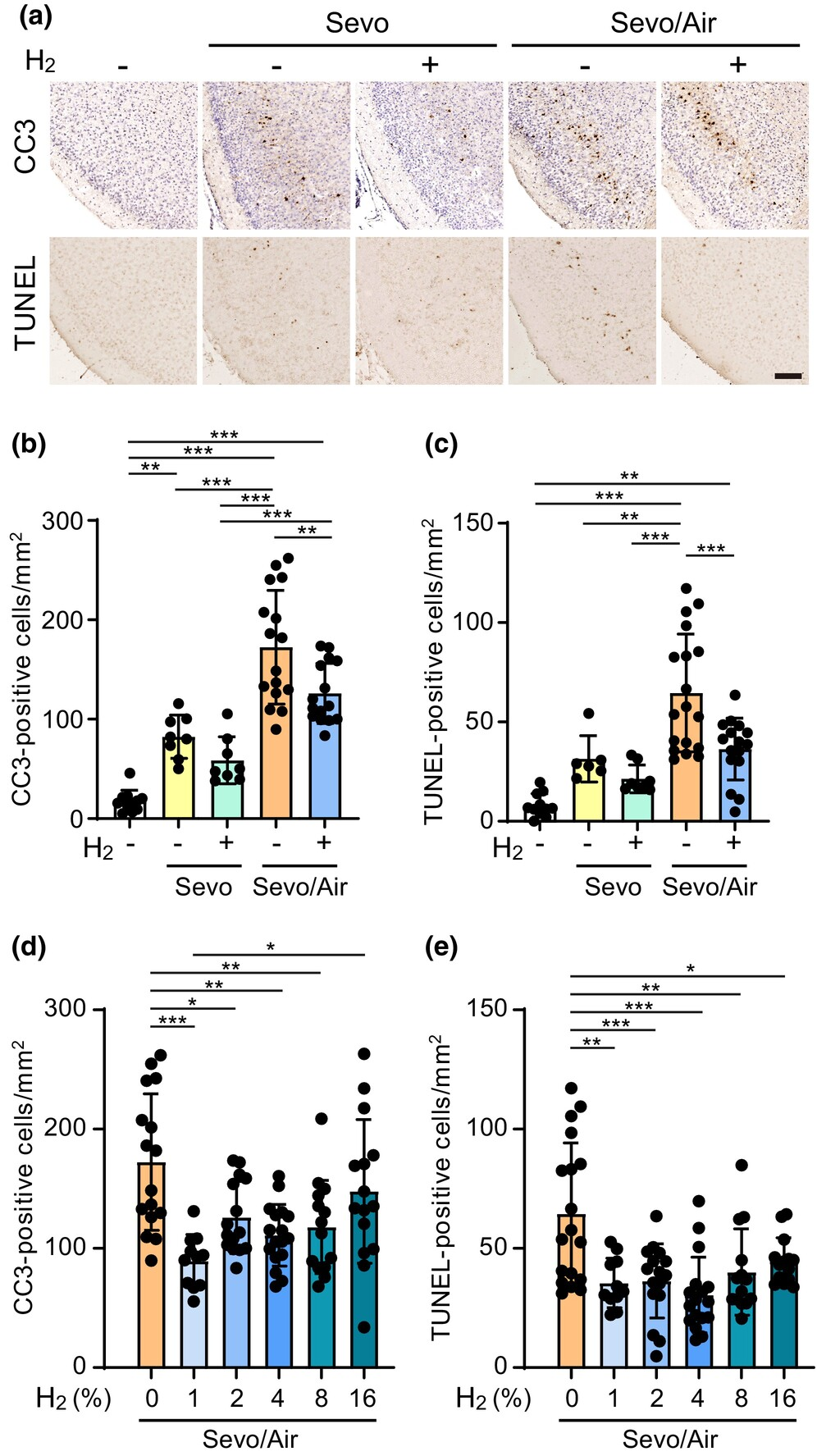
图2氢气在楔前皮质对抗七氟醚诱导的凋亡中发挥神经保护作用。幼鼠暴露于混合麻醉气体(Sevo)3小时,有或无氢气。其中一些幼鼠进一步被放置在正常空气中3小时,以使凋亡得以发展(Sevo/Air)。(a)代表性显微镜图像显示,幼鼠暴露于含或不含2%氢气的混合麻醉气体后,楔前皮质中七氟醚诱导的CC3阳性细胞与核染色素复染(上方)和TUNEL阳性细胞(下方)。比例尺:100μm。(b-e)对暴露于含或不含2%氢气(b, c)或含0–16%氢气(d, e)的混合麻醉气体的幼鼠中CC3阳性细胞(b, d)和TUNEL阳性细胞(c, e)的数量进行定量分析。计算每个幼鼠的冠状切面中楔前皮质的阳性细胞数量。各组“对照”、“不含2%氢气的Sevo”、“含2%氢气的Sevo”、“不含2%氢气的Sevo/Air”、“含2%氢气的Sevo/Air”的样本量分别为:CC3 n=11, 8, 8, 16, 和15只幼鼠;TUNEL n=11, 6, 8, 18, 和16只幼鼠(b, c)。各组“不含氢气的Sevo/Air”、“含1%氢气的Sevo/Air”、“含2%氢气的Sevo/Air”、“含4%氢气的Sevo/Air”、“含8%氢气的Sevo/Air”、“含16%氢气的Sevo/Air”的样本量分别为:CC3 n=16, 11, 15, 17, 14, 和15只幼鼠;TUNEL n=18, 11, 16, 17, 14, 和14只幼鼠(d, e)。数据表示为平均值±标准差。*p<0.05, **p<0.01, ***p<0.001;单因素方差分析与Tukey检验。
接下来,我们研究了在Sevo/Air组中,哪种浓度的氢气最能保护神经祖细胞免受七氟醚诱导的凋亡。氢气的使用显示出氢气浓度与凋亡细胞数量之间存在非线性的U型关联。(这个结果提示,氢气的作用并不是越多越好!!!)抗CC3抗体染色显示,1–8%的氢气显著减少了CC3阳性细胞的数量,而16%的氢气则没有(图2d)。(假如这个浓度在人类也是如此,则是氢气浓度最合理的浓度是低于10%,按照图中所表示,理想浓度1-4%,大约每分钟300毫升,而不是更高摄取氢气。虽然这只是其中一个指标,没有更多的信息,尚不能作为应用的参考。但氢健康产业过于追求高流量的做法并不是合理的做法。)
TUNEL染色揭示,1–16%的氢气显著减少了TUNEL阳性细胞的数量,而16%的氢气效果略差(图2e)。这些结果表明,在七氟醚诱导的大脑损伤和缺血再灌注实验中,1–8%的氢气具有最强的神经保护作用。
3.3 氢气吸收途径及其对血流和血氧水平的影响
将新生小鼠置于充满氢气和七氟醚的腔室中。氢气极具渗透性,因此不仅通过呼吸吸收,还通过体表吸收。为了证明氢气是通过呼吸摄入的,我们还仅将小鼠的身体或头部置于腔室中,然后用针型氢气微传感器测量肝脏中的氢气浓度(图3a)。仅头部或全身暴露于2%氢气的小鼠中,氢气浓度相似(图3b)。测得的浓度约为15mM,这与2%氢气在水中溶解的浓度非常相似,即15.6mM。相反,仅从颈部以下暴露于2%氢气的小鼠体内氢气浓度要低得多:约3mM。这些结果表明,几乎所有氢气都是通过肺呼吸摄入的。吸入气体中氢气浓度归零后,体内氢气浓度迅速降低(图3c)。
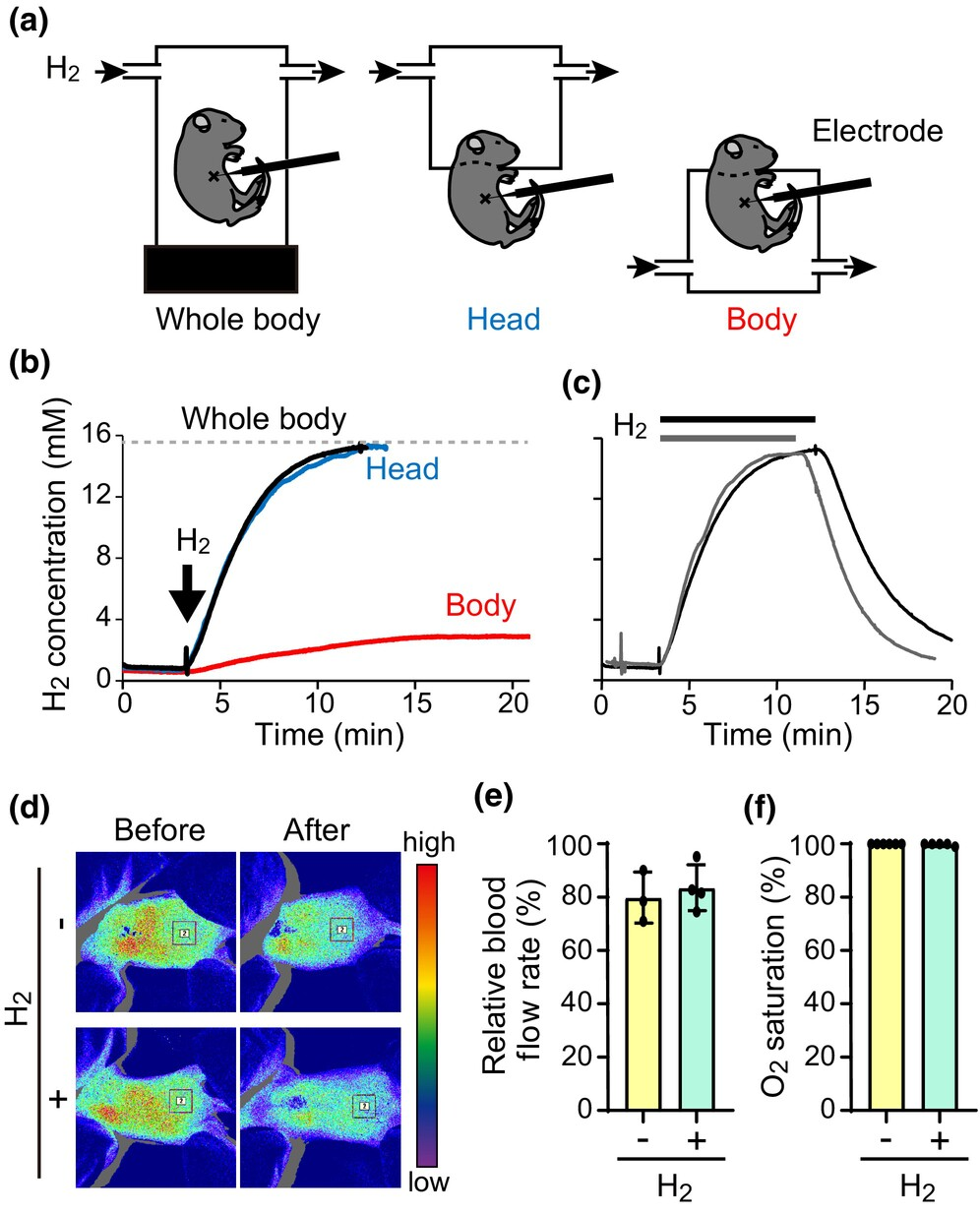
图3氢气吸入对血流和氧气水平的影响。(a-c) 大部分氢气是通过呼吸而不是通过体表吸收的。(a) 暴露舱的示意图,舱内充满气体流,覆盖整个身体、仅头部或仅身体。(b) 在每个舱中开始暴露于2%氢气(箭头所示)后,肝脏中氢气浓度的时间变化。虚线表示充满2%氢气的水中氢气浓度。注意,通过体表吸收的氢气浓度增加缓慢。(c) 停止供应氢气(粗线所示)后,肝脏中的氢气浓度迅速降低。显示了两次重复测量的结果。(d, e) 在麻醉暴露期间,血流量不受2%氢气的影响。吸入七氟醚前后,全身的激光散斑对比图像,无论是否含有氢气。从每张图像的兴趣区域框中提取血流量定量分析数据(d)。吸入七氟醚后血流量的定量分析,无论是否含有2%氢气。样本量如下:“不含2%氢气的七氟醚”n=3只幼鼠,“含2%氢气的七氟醚”n=4只幼鼠(e)。(f) 在麻醉期间,氧气水平不受2%氢气的影响。样本量如下:“不含2%氢气的七氟醚”n=6只幼鼠,“含2%氢气的七氟醚”n=5只幼鼠。数据表示为平均值±标准差。
脑细胞的存活可能受到某些参数的影响,包括血流和血液氧气水平。为了排除吸入氢气影响这些参数的可能性,我们测量了吸入2%氢气和七氟醚的小鼠的血流量(图3d,e)和血液氧气水平(图3f)。这些参数均未受到吸入2%氢气的影响。
3.4 氢气对七氟醚激活的c-Jun通路具有抑制作用
为了阐明氢气对七氟醚诱导凋亡保护作用的分子机制,我们首先通过qPCR检查了皮层中基因表达的变化。加入七氟醚后,Fas、Fasl、Ddit3、Ppp1r15a、Hmox1和Jun的转录显著增加,而Bcl2和Egr1的转录显著减少(图4a;图S3)。在Sevo/Air组中,氢气显著抑制了Fas、Ddit3、Hmox1和Jun的增加转录以及Bcl2的减少转录(图4a)。这些基因受c-Jun的调控,c-Jun与c-Fos结合形成AP-1早期反应转录因子。c-Jun的激活进一步诱导c-Jun本身的表达。实际上,加入七氟醚后,巢蛋白阳性的神经祖细胞部分呈现c-Jun阳性,而这种蛋白表达被氢气所抑制(图4b)。我们进一步检查了c-Jun的磷酸化。免疫印迹显示,氢气倾向于减少皮层中七氟醚诱导的c-Jun磷酸化和蛋白质丰度的增加(图4c)。
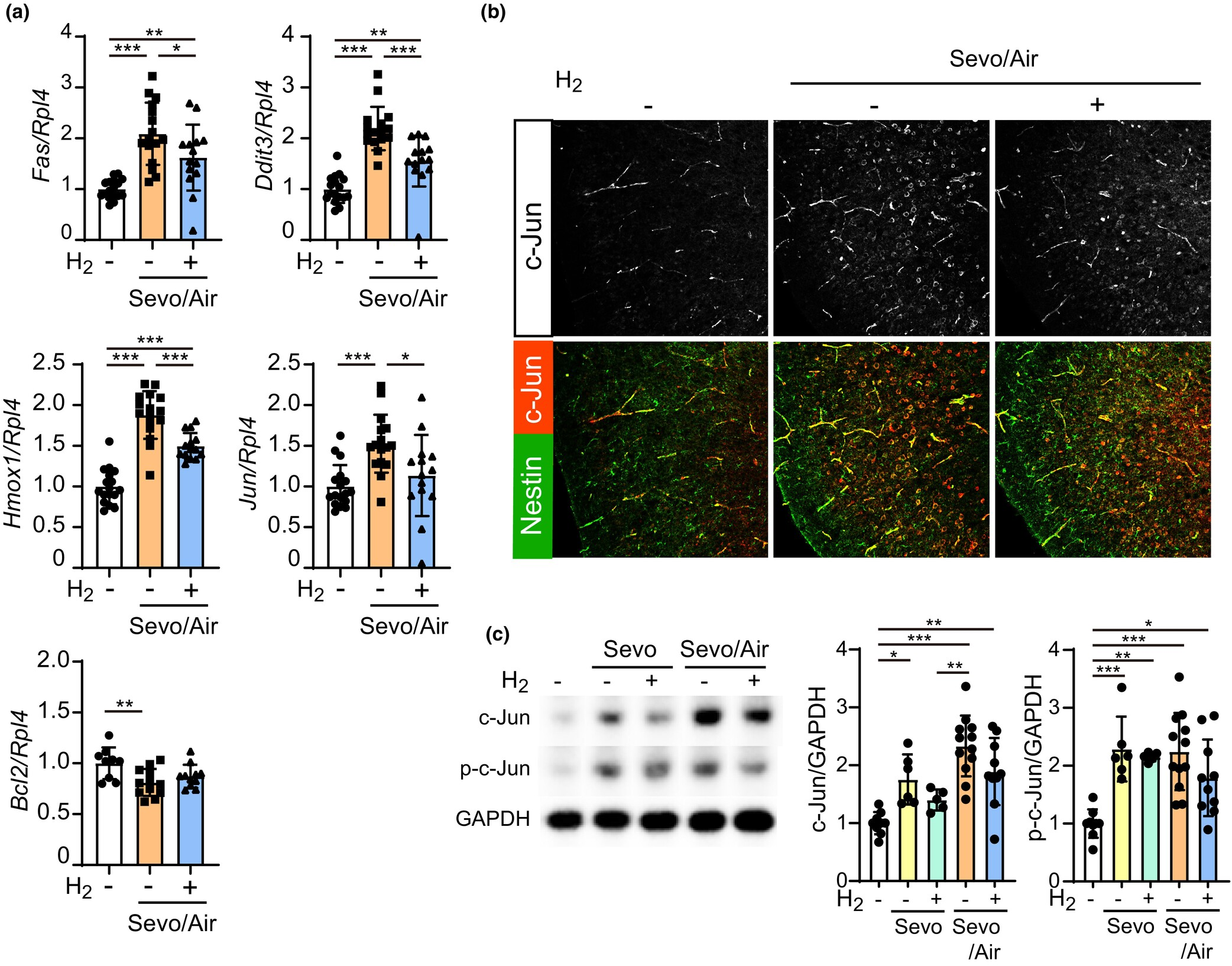
图4氢气对七氟醚激活的c-Jun通路的影响。幼鼠暴露于含有或不含有2%氢气的混合麻醉气体(Sevo)3小时,然后暴露于空气中另外3小时(Sevo/Air)。(a) 氢气抑制了七氟醚诱导的Fas、Ddit3、Hmox1和Jun转录增加以及Bcl2转录减少。从楔前皮层分离的总RNA进行了qPCR分析。Rpl4用作内参。各目标基因在“对照组”、“不含2%氢气的Sevo/Air”和“含2%氢气的Sevo/Air”组中的样本量如下:Fas n=17, 16, 和14只幼鼠;Ddit3 n=17, 16, 和14只幼鼠;Hmox1 n=17, 16, 和14只幼鼠;Jun n=17, 16, 和14只幼鼠;Bcl2 n=9, 12, 和11只幼鼠。(b) 共聚焦显微镜下的代表性图像,显示楔前皮层中与抗巢蛋白共染色的c-Jun阳性细胞。氢气抑制了神经祖细胞中七氟醚诱导的c-Jun表达增加。(c) 氢气对c-Jun表达和磷酸化(p-c-Jun)的影响。使用楔前皮层的裂解液进行西方印迹分析。图表(右侧)显示了每个条带的定量水平。甘油醛-3-磷酸脱氢酶(GAPDH)用作内参。c-Jun和p-c-Jun的样本量如下:“对照组”n=9,“不含2%氢气的Sevo”n=6,“含2%氢气的Sevo”n=5,“不含2%氢气的Sevo/Air”n=12,“含2%氢气的Sevo/Air”n=10只幼鼠。数据表示为平均值±标准差。*p<0.05, **p<0.01, ***p<0.001;采用Tukey检验的单因素方差分析。
3.5 氢气抑制七氟醚诱导的氧化应激
c-Jun N端激酶(JNK)模块在凋亡中起着重要作用,并且由氧化应激激活。此外,七氟醚的神经毒性部分是由氧化应激增加引起的。我们观察到,七氟醚暴露(3小时)增加了新生大脑中的脂质过氧化(4-HNE)和氧化DNA损伤(8-OHdG)(图5)。4-HNE和8-OHdG阳性细胞数量的增加被氢气显著降低,表明氢气诱导的c-Jun通路激活抑制至少部分可以通过减少氧化应激来解释。
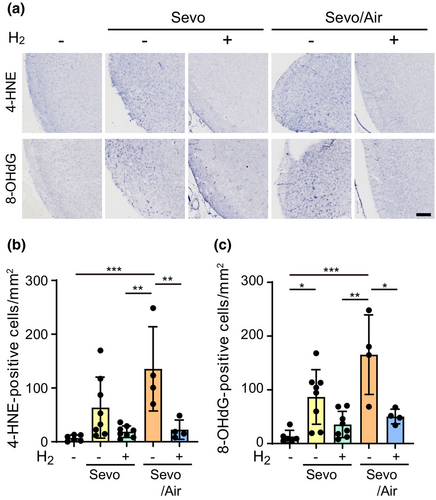
图5
氢气抑制七氟醚诱导的氧化应激。幼鼠暴露于含有或不含有2%氢气的混合麻醉气体(Sevo)3小时,然后暴露于空气中另外3小时(Sevo/Air)。用针对氧化应激标记物4-HNE和8-OHdG的抗体对楔前皮层进行免疫组织化学染色。(a)代表性显微镜图像显示了用苏木精核复染的4-HNE和8-OHdG阳性细胞。比例尺:100μm。(b, c)对暴露于含或不含氢气的混合麻醉气体的幼鼠中4-HNE(b)和8-OHdG(c)阳性细胞的定量分析。计算每个幼鼠的楔前皮层冠状切面中阳性细胞的数量。4-HNE和8-OHdG的样本量如下:“对照组”n=6,“不含2%氢气的Sevo”n=8,“含2%氢气的Sevo”n=8,“不含2%氢气的Sevo/Air”n=4,“含2%氢气的Sevo/Air”n=4只幼鼠。数据表示为平均值±标准差。*p<0.05, **p<0.01, ***p<0.001;单因素方差分析与Tukey检验。
3.6 氢气改变由七氟醚修饰的磷酸蛋白质组
鉴于全身麻醉导致大脑中许多蛋白质迅速磷酸化,蛋白质磷酸化可能是新生儿小鼠大脑中麻醉和细胞凋亡机制的基础。如图2和图5所示,3小时的七氟醚暴露倾向于诱导凋亡和氧化应激,这些通过给予氢气部分受到抑制。为了揭示氢气对导致凋亡的磷酸化变化的影响,我们随后研究了与暴露于3%七氟醚(含或不含2%氢气)3小时相关的磷酸化事件,并与未经处理的对照大脑进行了比较。从皮层提取蛋白质并进行处理用于纳米液相色谱-质谱联用分析(nano-LC-MS/MS)。在进行统计分析之前,对包含5808个磷酸肽的数据进行了过滤,以便仅包括在所有样本中发现的肽。我们鉴定了5789个磷酸修饰位点,对应于1962个蛋白质。所有数据的完整目录可在Data S2中获得,并通过JPOST合作存储库在ProteomeXchange联盟上存档,数据集标识符为JPST002368。
在Sevo组中,有318个蛋白响应七氟醚发生了磷酸化变化,总共有498个差异磷酸化事件,包括257个超磷酸化和241个低磷酸化事件(图6a,FDR<0.2)。在Sevo + H2组中,有353个蛋白响应七氟醚发生了磷酸化变化,总共有588个差异磷酸化事件,包括301个超磷酸化和287个低磷酸化事件(图6a,FDR<0.2)。此外,分别有131和166个蛋白在Sevo组和Sevo + H2组中特异性地发生差异磷酸化,而187个蛋白在两组中都发生了差异磷酸化(图6b)。使用Metascape对这些差异磷酸化蛋白进行注释以进一步调查它们的功能(见图S4,数据S3)。两组共有的差异磷酸化蛋白最丰富的富集簇包括神经发育、突触信号和细胞极性(图6c)。这些结果与成年大鼠大脑中异氟醚诱导麻醉期间蛋白质磷酸化的报道相似。对仅在Sevo组和Sevo + H2组中的差异磷酸化蛋白进一步注释显示,最丰富的富集簇包括细胞运输和质膜调节(图6d,e)。
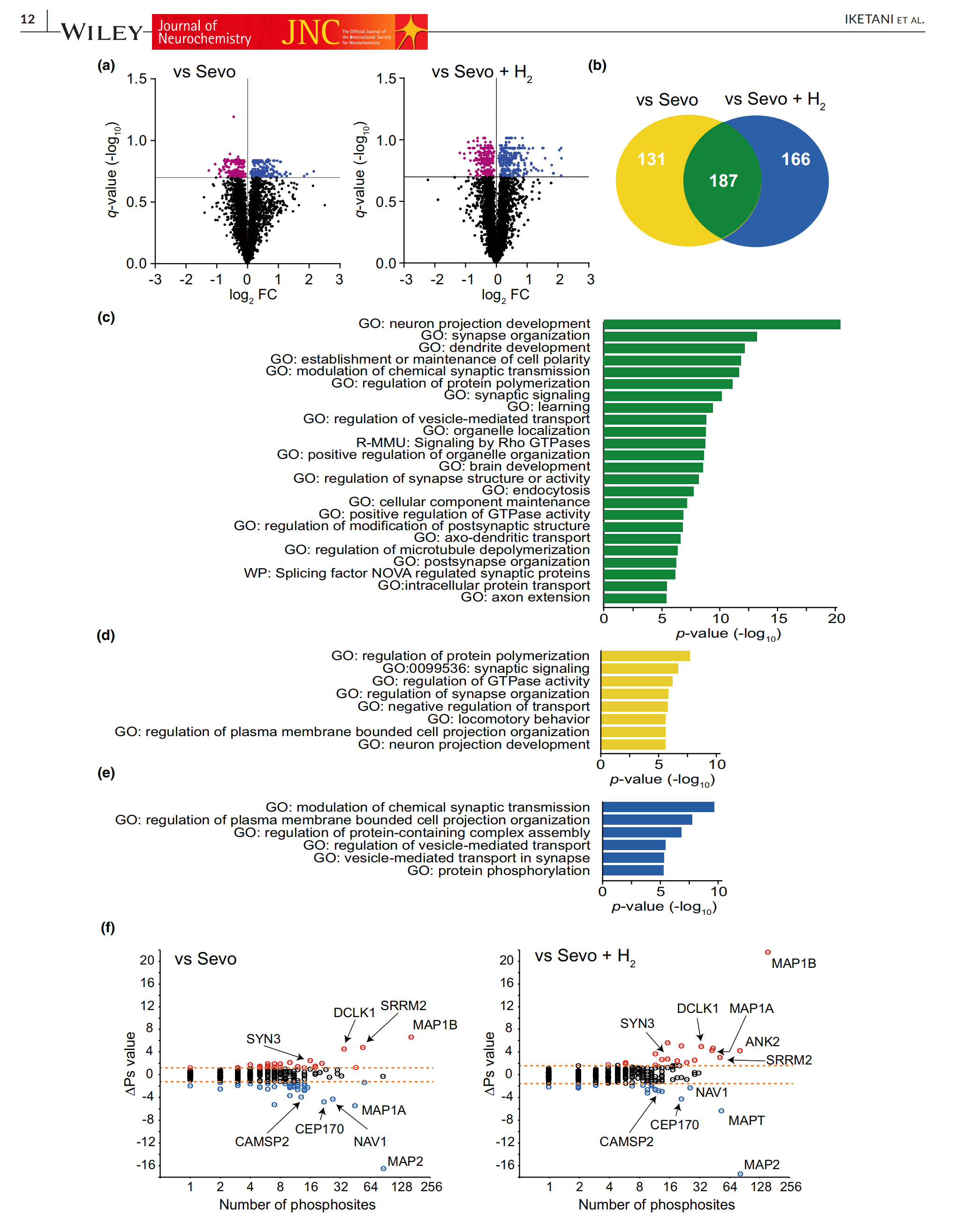
图6楔前皮层响应七氟醚的定量磷酸蛋白质组,无论是否含有氢气。幼鼠(n=24)分为三组:对照组(n=6)以及暴露于含2%氢气(n=9)或不含2%氢气(n=9)的七氟醚3小时。楔前皮层被解剖并在每组中分为三个样本。从样本中提取蛋白质并处理用于纳米液相色谱-质谱联用(nano-LC-MS/MS)以定量磷酸化肽段。(a)总共绘制了5789个磷酸化修饰位点。火山图显示了对照组与不含2%氢气的七氟醚组(vs. Sevo)的磷酸蛋白质组,显示了257个超磷酸化(蓝色)和241个低磷酸化(紫色)事件,以及对照组与含2%氢气的七氟醚组(vs. Sevo + H2)的磷酸蛋白质组,显示了301个超磷酸化(蓝色)和287个低磷酸化(紫色)事件(FDR < 0.2)。(b)Venn图显示,在Sevo和Sevo + H2组中,有187个蛋白质在磷酸蛋白质组水平上发生了变化,而131和166个蛋白质分别只在Sevo和Sevo + H2组中发生了差异磷酸化。(c–e)使用Metascape对差异磷酸化蛋白进行基因注释(p值(−log10)> 5)。(c)在Sevo和Sevo + H2组中都发生磷酸化的选定经典通路。(d, e)仅在Sevo(d)和Sevo + H2(e)组中差异磷酸化的选定经典通路。(f)对照组与Sevo组之间(vs. Sevo;虚线,ΔPs = 1.23)以及对照组与Sevo + H2组之间(vs. Sevo + H2;虚线,ΔPs = 1.62)磷酸蛋白的整体磷酸化状态变化(ΔPs)分析。
此外,我们全面量化了磷酸化的变化,这使得能够计算单个蛋白质整体磷酸化状态变化的单一值(ΔPs;见数据S4)。在Sevo和Sevo + H2组中,分别有26和18个蛋白质显著超磷酸化,以及37和23个蛋白质显著低磷酸化(|ΔPs| < 1.23和1.62)(图6f;图S5)。两组中超磷酸化最多的蛋白质包括微管相关蛋白(MAP)1B、丝氨酸/精氨酸重复基质2、双皮质素样激酶1和突触蛋白III。低磷酸化蛋白包括MAP2、中心体蛋白170、神经元导航蛋白1和钙调蛋白调节的光谱蛋白家族成员2。其中一些蛋白参与细胞骨架蛋白结合和突触事件。有趣的是,MAP1A在Sevo组中低磷酸化,在Sevo + H2组中超磷酸化。此外,MAP1B在Sevo + H2组中的磷酸化程度远高于Sevo组。通过Phos-tag技术进一步确认了MAP1A和MAP1B在H2作用下的增强磷酸化。在使用Phos-tag琼脂糖选择性富集楔前皮层中的磷酸蛋白后,通过西方印迹法确定了磷酸化的MAP1A和MAP1B蛋白(图S6)。相反,MAP Tau蛋白只在Sevo + H2组中特异性低磷酸化(图6f;图S5)。
4 讨论
许多研究表明,吸入氢气对治疗脑血管疾病、神经退行性疾病以及包括麻醉气体引起的病理变化在内的新生儿脑部疾病有效。氢气的作用可能直接抑制任何脑损伤,因为治疗效果在受伤后几小时内就已经显现。然而,氢气的抗炎和其他治疗效果不能通过直接清除活性氧物种(ROS)的能力来解释,因为氢气显示出非常弱的反应性(Buxton等,1988年)。
我们确认,在新生小鼠大脑中,经历七氟醚诱导凋亡的细胞是楔前皮层中的巢蛋白阳性神经前体细胞,这在大鼠模型中被报道特别受到缺氧缺血的影响。新生期的七氟醚暴露会导致长期发展的神经心理功能障碍,包括记忆障碍。吸入氢气阻止了这些未成熟神经元的细胞死亡。以前的研究发现,包括七氟醚在内的全身麻醉药可能会在几种细胞类型中,特别是在发育中的大脑中引起永久性损伤。Hofacer等人报告说,通过将幼年和年轻成年小鼠暴露于异氟醚,诱导了亚颗粒区包括晚期前体细胞和未成熟颗粒细胞在内的未成熟神经元的选择性凋亡。将培养的小鼠新皮层神经元和切片暴露于异氟醚,抑制了由netrin诱导的生长锥塌陷,并破坏了轴突导向。Netrin及其受体DCC和Unc5参与神经元导向和凋亡。麻醉药可能通过干扰神经元成熟的关键环节来诱导神经元凋亡。我们假设氢气改善了这些效应并保护了神经前体细胞。
氢气给药显示了氢气浓度与脑细胞凋亡数量之间的非线性U型关联;最有效的氢气浓度为1-8%。之前有报道称,氢气对七氟醚诱导的神经元凋亡的保护作用是浓度依赖性的,从0到1.3%。相比之下,氢气对大脑和心脏缺血再灌注损伤的保护作用显示出U型关联,最有效的氢气浓度约为2%,与我们目前的结果相似。然而,更高浓度的氢气并没有阻止凋亡;为什么没有观察到保护效果尚不清楚。因此,应该进一步研究氢气神经保护作用的潜在机制。有趣的是,有报道称,每天吸入两次氢气,持续4周,增加了帕金森病患者尿液中8-OHdG的水平。
氢气(H2),一种高渗透性气体,可以通过体表吸收。然而,我们当前的研究表明,通过吸入氢气使体内H2浓度增加的速率,比通过体表吸收要快得多。当吸入气体中的H2浓度降至零后,体内的H2浓度也迅速下降。这些结果提示,在实验箱内的H2气体主要是与七氟醚一起被吸入,并由肺部吸收。
在这项实验中,为了帮助确认吸入H2气体不影响体温,我们将实验箱内部保持在37°C。有报道称,在大鼠心肺骤停模型中,吸入H2气体产生的脑保护效果与低体温相当。之前的一项研究评估了麻醉前后动脉血的情况,并证明与七氟醚同时给予1.3% H2对pH值、氧气分压或二氧化碳分压没有显著不良影响。此外,H2的同时给药在麻醉后未引起任何行为异常。我们还观察到,与仅用七氟醚麻醉的小鼠相比,用2% H2和七氟醚麻醉的小鼠在血流速率或血氧水平上没有明显变化。这些结果表明,吸入H2不影响七氟醚的麻醉效果,且上述生理参数不涉及H2诱导的神经保护机制。
我们展示了七氟醚麻醉诱导了皮层中c-Jun控制下的基因表达,其中一些基因通过同时吸入H2而被下调。在新生大鼠海马中,JNK/c-Jun/AP-1通路可以被七氟醚激活,随后诱导连接蛋白43的表达。因此,我们检查了c-Jun的磷酸化情况,发现H2减少了七氟醚诱导的磷酸化增加。c-Jun的激活诱导了c-Jun本身的表达。此外,七氟醚增加了c-Jun mRNA和蛋白质水平,而这种增加被H2显著降低。这些结果表明,抑制与c-Jun激活相关的信号通路可能参与了H2的抗凋亡活性。应进一步调查以阐明包括JNK和AP-1在内的c-Jun上下游是否受到H2的影响。
JNK/c-Jun/AP-1通路的激活对于由多种伤害引起的神经元凋亡至关重要,包括氧化应激。然而,关于吸入性麻醉药引起的氧化应激的研究结果是有争议的。一项研究报告称,七氟醚增加了成年大鼠肺部的丙二醛,但减少了肾脏和大脑中的丙二醛。相反,另一项研究报告称,七氟醚增加了新生大鼠海马中的ROS水平和氧化DNA损伤。此外,一项对接受尿道下裂修复手术的幼儿(12-36个月大)的研究发现,手术2小时后七氟醚增加了抗氧化酶的mRNA水平,表明七氟醚暂时增加了儿童的氧化应激。我们的数据显示,暴露于七氟醚3小时增加了新生大脑中的脂质过氧化和氧化DNA损伤。有人提出,由于七氟醚导致的神经元放电爆发增加了代谢需求,这可以迅速耗尽局部可用的氧气,因为全身麻醉干扰了正常的神经血管耦合并诱发了氧化应激。如后所述,麻醉引起的微管调节导致凋亡,也可能增强了触发JNK和凋亡信号反应的ROS产生。值得注意的是,氧化应激的增加被H2吸入缓解了。然而,H2对ROS的还原活性太低,无法直接抑制氧化应激。
蛋白质磷酸化是一种重要、快速且瞬时的翻译后修饰,它调节着许多生物学过程,而定量磷酸蛋白组学正成为研究全局信号水平变化的非常有效的工具。有研究表明,蛋白质磷酸化可能是麻醉剂及其随后在大脑中引起的神经元损伤的快速机制的基础。对暴露于异氟醚的成年小鼠大脑进行的磷酸蛋白组学研究,确定了麻醉剂的主要药理学靶点以及与神经元兴奋性、大脑能量稳态、突触可塑性和传递及微管功能相关的其他几种蛋白质作为麻醉剂的次要假定靶点。细胞骨架重塑和突触信号事件中涉及的蛋白质的快速翻译后修饰可能介导全身麻醉剂的中心机制。
在我们的研究中,暴露于七氟醚的新生小鼠大脑中差异磷酸化蛋白质的最丰富集群包括神经发展和突触信号传导,这表明麻醉剂通过改变神经元结构和功能发挥作用。突触形成是未成熟神经元存活的关键步骤,因为来自目标的因子从突触运输到胞体,影响凋亡信号。在Sevo或Sevo + H2组中的差异磷酸化蛋白质显示,最丰富的集群包括细胞运输和细胞突出组织。实际上,在体外暴露于H2的神经母细胞瘤中,内体运输到回收内体的延迟已被观察到。加速的细胞内运输对于凋亡至关重要,当细胞内运输被调节回正常水平时,凋亡会被延迟。因此,我们推测H2通过调节细胞运输来减轻七氟醚诱导的凋亡。
细胞内运输依赖于一个高度组织化的系统,包括微管和微管相关分子马达蛋白。许多发现表明,微管网络在凋亡过程中会重新形成,并协助核和细胞碎片的分散。维持凋亡微管网络依赖于高ATP水平和活跃的线粒体,线粒体膜电位的消散导致超氧化物阴离子的过度产生和ROS水平的增加。在我们的实验中,全面定量的磷酸化变化揭示,几个七氟醚诱导的过度和低磷酸化蛋白与微管网络和细胞骨架重塑有关,这可能是麻醉剂和未成熟神经元凋亡效应的基础。我们发现,H2吸入进一步增加了MAP1A和MAP1B的磷酸化。MAP1家族成员根据其磷酸化状态和在神经发育及整体维护中的功能,可能在调节微管细胞骨架中发挥多重作用。双特异性酪氨酸磷酸化调节激酶-1a(DYRK1a)可以磷酸化MAP1A和MAP1B,酪蛋白激酶2可以磷酸化MAP1A、MAP1B和锚蛋白-2。有趣的是,DYRK1a已被证明在发育中的视网膜和几种人类癌细胞系中抑制内在凋亡途径。酪蛋白激酶2的过表达促进星形胶质细胞增殖,抑制神经元凋亡,并减少大鼠大脑中的星形胶质细胞介导的炎症。这些激酶的激活和MAP1家族成员的磷酸化可能参与了麻醉期间H2的抗凋亡活性。
5 结论
我们的数据表明,在麻醉期间给予H2可通过微管的过度磷酸化来调节细胞运输。这可能抑制ROS的产生并减轻神经前体细胞的凋亡。我们必须考虑到,较高浓度(> 4%)的H2是易燃的,其主要靶分子仍然未知。然而,给予1-4%的H2气体可以容易且安全地减轻大脑中麻醉诱导的凋亡。此外,在儿科麻醉中使用H2可能会提高当前全身麻醉方案的安全性。
https://blog.sciencenet.cn/blog-41174-1437488.html
上一篇:2型糖尿病患者内源性产氢气下降
下一篇:鸟眼仿生人工视觉系统