博文
氚有毒,富氢水克服!?
|
氚有毒,富氢水克服!?
氚是氢的放射性同位素,会发射β射线。摄入大剂量的氚可能会导致组织和器官受到严重的内照射损伤,引起染色体损伤、基因组不稳定,甚至癌症。因此,由于氚的广泛使用,有效促进氚的排泄和解毒已成为一个关键问题。传统方法包括使用利尿剂和增加水的摄入量,这可以将氚的有效半排泄期缩短4至6天。然而,利尿剂的使用可能会导致不良反应。近年来,像排川片和茶黄精这样的传统中药因其在动物实验中显示出的低毒性而在氚排除方面引起了关注。尽管如此,鉴于涉及氚内污染的临床病例数量有限,关于它们的临床效果和毒性水平仍存在不确定性。富氢水提供了一种简单、安全、无毒的解决方案,已在抗辐射治疗和各种疾病的治疗中显示出有希望的结果。实验证据表明,富氢水还可以在暴露于内部氚的动物模型中增强排泄和解毒过程,同时提供抗氧化益处。因此,它作为促进氚排泄和解毒的创新方法具有潜力。本文旨在比较不同措施和药物的优缺点,为专门用于促进氚排泄的药物的开发和增强提供见解。
氚是一种放射性氢同位素,会衰变成氦同时放出β射线。其物理半衰期为12.3年,比活度为2.62×10^8Bq/μg。由氚发射的β射线平均能量为5.7 keV,最大能量为18.6 keV。β射线在空气中的最大射程为5毫米,在水中约为0.56微米,显著小于细胞的平均直径(10-20微米)。由氚发射的β射线可被塑料、玻璃或金属片有效屏蔽,防止任何外部辐射对人体的影响。然而,氚可通过皮肤轻易穿透人体。吸收进入血液后,氚在1至2小时内均匀分布在各种组织和器官中,显示出与水相似的滞留特性。氚的生物半衰期约为8-10天,生物效应主要是由进入体内后的内部辐射引起的。氚主要以氚氧化物(HTO,T2O)的形式存在于体内。空气中的氚气通过氧化反应和同位素交换反应生成氚水,后者通常比前者快。氚气转化为氚水的速率随氚浓度的增加而增加。环境中和食物中的天然氚主要以三种化学形式存在:氚气(HT)、氚水(HTO)和有机结合氚(OBT)。这些形式可能通过吸入、皮肤渗透或摄入进入人体。值得重视的是,核电站、核爆炸和核反应堆的运行可以向环境中释放大量的氚,其水平明显超过天然氚。
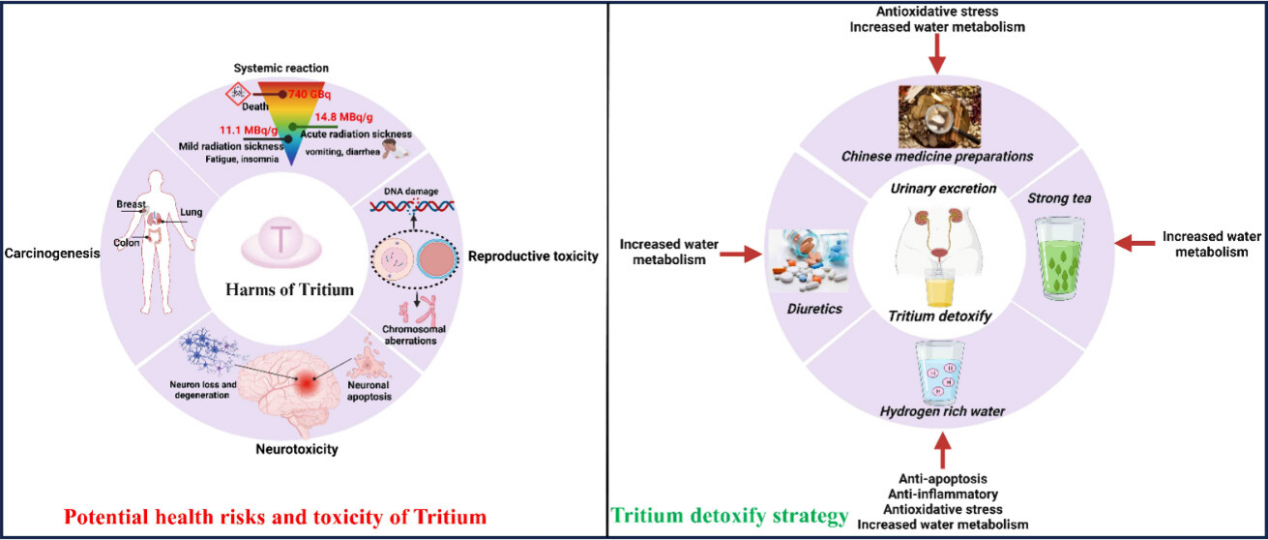
2. 氚污染的危害
由于氚的半衰期较长,以及其同位素交换和氢氧化的高速率,当大量氚通过摄入、吸入或皮肤接触进入人体时,可以预期会对组织和器官造成显著的内部辐射损伤。作为氢的同位素,氚可以轻易地替代稳定的氢原子,形成水分子,并可能与有机分子结合。
HTO(氚水)在体表的污染通过浸泡和扩散渗透进入体内。无论是HTO还是HT(氚气),氚在体内的吸收显示出相对均匀的分布,表明其在整个身体中的普遍性。
2.1. HTO中毒的系统反应
急性HTO(氚水)中毒的表现反映了通常在外照射下急性辐射病中所观察到的症状。在实验动物中,口服摄入相当于每克体重11.1 MBq的氚可以诱发轻度辐射病。单次摄入每克体重14.8 MBq的氚可引起严重的急性辐射病,并在33至45天内导致死亡。据报道,人类在HTO暴露下的急性致死剂量约为740 GBq。
2.2. HTO神经系统中毒作用
研究表明,氚的内部辐射可能会对神经系统造成损害。姚等人(7)进行了一项研究,探讨了氚水辐射对后代大鼠大脑发育的影响,该研究涉及向十天大的雌性SD大鼠腹腔注射HTO,剂量为3.7×10^6 Bq/g。结果表明,子宫内HTO辐射可以下调后代小鼠大脑中神经元迁移相关的粘附分子NCAM、L1和细胞表面受体分子整合素α5β1的表达,阻碍神经元的正常迁移。这导致大脑中神经元与神经胶质细胞的相对比例发生变化,诱导后代大鼠的大脑功能受损,并显著损害其空间学习和记忆能力。此外,内部氚暴露被发现会对中枢神经系统造成损害,其特征是大脑活性物质的变化,海马神经元中Ca2+电流幅度减小,脑细胞凋亡增加,以及p53蛋白表达不规则。(8)在邱等人(9)的研究中,发现氚β辐射可能会损害神经元的迁移能力。这种效应被认为是通过增加细胞内游离钙离子和下调β-微管蛋白和NCAM蛋白来实现的。
2.3. HTO中毒对生殖遗传系统的损害
氚对身体的遗传影响可以分为生殖细胞的遗传突变和染色体畸变,因为氚有倾向于融入携带遗传信息的DNA分子。生殖细胞对氚高度敏感,精原细胞中染色体易位的发生率成为评估HTO遗传影响的重要生物标志物。Satow等人(10)使用未成熟的小鼠卵母细胞研究了HTO的相对生物效应(RBE)。研究发现,当HTO的活性超过3.4 × 10^5 Bq/10 g体重(相当于累积剂量77 mGy)时,它可以有效杀死未成熟的卵母细胞。与^137Cs γ辐射相比,HTO的RBE范围在1.1到3.5之间。 氚对动物体内的影响包括通过氚β辐射诱导生物分子电离、染色体畸变、DNA单链和双链断裂,以及基因突变。(11)陈等人(12)已经确定,氚释放的β粒子可以对动物DNA造成严重损害,如双链断裂(DSBs)和单链断裂(SSBs)。未修复或修复不当的DNA损伤可能导致染色体畸变、基因组不稳定和癌症。(13,14)现有研究表明,进入动物体内的HTO可以与细胞DNA和RNA结合,产生辐射效应,或因^3H衰变留下^3He原子,导致染色体和染色单体畸变。(3)Brooks等人(15)将小鼠暴露于氚水(3 × 3.7 × 10^4 Bq/mL)中90、330、500、560和700天。随后,取出部分肝脏以诱导肝细胞分裂,并在不同时间点获取肝组织切片,以检查肝中期细胞的染色体畸变率。结果显示,小鼠肝细胞的染色体损伤在330、500和560天显著增加。Ikushima等人(16)研究了氚诱导雄性Hale-Stoner-Brookhaven品系小鼠姐妹染色单体交换(SCEs)的能力,这些小鼠饮用含有3.0 μCi/mL HTO的水。使用5-溴脱氧尿苷标记方法,测量了骨髓细胞在选定间隔(28-261天)的SCE频率和细胞增殖动力学,同时对HTO处理的动物和同龄对照组进行了比较。在HTO摄入后81、163、192、247和261天观察到SCE显著增加(1%水平)。诱导的SCE频率与摄入时间呈线性增加。张等人(17)通过体外研究,用浓度为1.85 × 10^5 Bq/mL的HTO照射处于G0期的人类淋巴细胞,以确定氚β辐射与淋巴细胞染色体畸变率之间的剂量-效应关系。同时进行了^60Co γ射线平行实验。结果显示,氚β辐射和^60Co γ射线主要诱导淋巴细胞的染色体畸变,其剂量-效应关系符合Y = a + bD模型,相关系数分别为0.9918和0.9257。当使用淋巴细胞染色体畸变作为生物终点,以^60Co γ射线为参考辐射时,测得氚的相对生物有效性(RBE)值约为2。Snigireva等人(18)通过检查外周血淋巴细胞的染色体畸变,评估了氚β辐射的相对生物有效性(RBE)。他们发现,与^60Co γ辐射相比,氚β辐射的RBE在最低剂量时为2.2,随着剂量的增加降低到1.25。
2.4. HTO中毒增加癌症发病率
HTO(氚水)和OBT(有机结合氚)的致癌效应在动物实验的各种组织中广泛观察到,包括生殖系统和神经系统;然而,白血病似乎是个例外。有趣的是,HTO诱导的致癌作用的特定靶组织仍然不清楚。Seyama等人(19)通过将不同浓度的HTO(分别为1.4、2.8、5.6和7.4 × 10^5 Bq/动物)腹腔注射到雌性F1小鼠的腹腔中,建立了4组氚内污染动物模型。研究发现,与对照组不到5%的肿瘤发病率相比,一生中接受单次HTO腹腔注射的小鼠的肿瘤发病率范围为80%至90%。在HTO注射后400天,累积肿瘤发病率分别为4%、8%、18%和24%,分别对应于1.4 × 10^8 Bq、2.8 × 10^8 Bq、5.6 × 10^8 Bq和7.4 × 10^8 Bq剂量的给药组。
遗憾的是,没有流行病学研究直接评估单独暴露于氚的影响。(20)然而,有迹象表明,暴露于氚及其他形式辐射的人群中儿童白血病和先天性畸形的发病率增加。实际上,在德国核电站附近白血病发病率增加的重要新流行病学证据(KiKK研究);(21)这些反应堆排放相对大量的氚。Martin等人(22)调查了氚暴露对一组工人死亡率的影响,随后进行了放射毒理学监测。他们的分析显示,喉、气管、支气管和肺部肿瘤的最高风险与较高剂量类别相关,尽管不显著。值得注意的是,尽管基于有限数量的案例,但在较高剂量下观察到胰腺和膀胱肿瘤的显著风险。
3. 促进氚排泄的措施和药物
进入人体并被吸收后,HTO通过循环系统迅速进行全身分布。这不仅使其积极参与新陈代谢过程,还导致所有器官均匀的内部辐射。因此,在摄入氚后立即采取措施增强排泄至关重要。一旦进入体内,氚主要以体液中的自由HTO形式存在,其生物学半排泄期与水代谢密切相关。因此,任何影响水代谢的因素都会影响人体内氚的生物学半排泄期。常见的氚摄入治疗措施通常涉及大量饮水和使用利尿剂。此外,一些中药制剂,如排川片和茶黄精,已显示出在促进氚排泄的同时避免利尿剂使用可能带来的不良反应的潜力。近年来,关于富氢水(HRW)的研究揭示了HRW中高浓度的氢分子可以与氚竞争性结合,从而促进HTO的排泄,并选择性中和羟基自由基(•OH)。这一过程表现出抗氧化和抗凋亡效果,最终有助于减少DNA和染色体损伤,保护小鼠和细胞免受HTO引起的伤害。
3.1. 氚去除的常规方法
通过增加饮水量和使用利尿剂,HTO(氚水)的内部污染有可能将人体内氚的有效半衰期缩短至4到6天。(23) 在Chen等人进行的一项研究中,(24) 报告了一例患者因HTO溅到身体表面而遭受内部氚污染的案例,这导致了初始累积有效剂量为45.6 mSv。患者接受了全身清洗,并被指示在8天内每天摄入大量的浓茶水,具体为每24小时5到10升。同时,患者还补充了维生素和电解质以及其他补水疗法以缓解疲劳症状。为了提高睡眠质量,还进行了舒拉西泮的辅助治疗。因此,这种综合方法整合了补水、电解质管理和支持疗法以促进氚排泄,不仅展示了有效减少内部污染的效果,还管理了伴随症状。这强调了对氚摄入进行全面和迅速处理的重要性,帮助减轻其潜在的不良影响。此外,每天注射40毫克的呋塞米用于利尿。患者的尿量在24小时内范围为10到13升,平均尿量为12.2升。大量饮用水和利尿剂的利用显著加快了身体的水代谢速率,从而增强了氚的消除。然而,重要的是要认识到由于严重的液体丢失和水代谢失衡而导致的脱水和电解质紊乱的风险。应特别注意监测电解质变化和肾功能,特别是对于肾功能不全的患者。对于这样的个体实施排泄促进计划时应谨慎。此外,过量饮用浓茶可能会刺激患者并扰乱他们的睡眠和饮食模式。尽管啤酒消费可能具有利尿和排泄效果,但过量饮酒可能对人体有害,特别是对于酒精过敏的个体。不应低估啤酒饮用可能导致的潜在副作用,如嗜睡,因为它们也可能影响后续的患者程序。
除了充足的水分外,使用利尿剂是增强氚排泄的主要方法。利尿剂可以根据其独特的作用机制和临床效果分为碳酸酐酶抑制剂、袢利尿剂、噻嗪类利尿剂、保钾利尿剂和渗透性利尿剂等类别。噻嗪类药物,如氢氯噻嗪,是最常开的利尿剂,主要作用于远端肾小管以抑制钠和水的重吸收。然而,承认利尿剂使用相关的潜在不良反应至关重要。例如,噻嗪类利尿剂可能增加肾脏损伤、低钾血症、低钠血症、低血压和血液学紊乱的风险。袢利尿剂也可能导致耳毒性,以及低钠血症和低钾血症等副作用。此外,保钾利尿剂存在高钾血症和血液学抑制的风险;因此,在使用它们时需要注意膳食钾的摄入。(25) 鉴于利尿剂的不良影响,确定高效无毒的辐射防护剂对于HTO暴露至关重要。
3.2 中药制剂促进氚排泄
由于过量饮水、频繁排尿和利尿剂使用相关的潜在不良反应,中药制剂如排川片和茶黄晶因其促进氚排泄和解毒的能力而受到关注。动物实验表明,这些制剂在消除氚方面显示出更高的效率,同时毒性风险较低,因此在核紧急情况下提供了更方便和适当的氚去除替代方案。3.2.1. Paichuanpian
中药制剂排川片具有悠久的历史,并在临床实践中被广泛使用。它由多种中草药混合而成,包括黄芪、茯苓、肉桂、白术、泽泻、猪苓和桔梗等。这些成分的主要功能是通过它们的利尿效果促进氚排泄。(26)
辛等人(27) 通过单次腹腔注射HTO在ICR雄性小鼠中建立了氚内部污染模型,以评估排川片在动物中促进氚排泄的效果。共有120只小鼠随机分为六组:低剂量、中剂量和高剂量的氚排出片;一个空白对照组;一个阴性对照组(等体积的生理盐水);以及一个用氢氯噻嗪10 mg/kg治疗的阳性对照组。给药方式为连续10天每天一次口服灌胃。初次给药后,将HTO以5 × 3.7 × 10^4 Bq/10 g体重的剂量腹腔注射到对照组。结果表明,与阴性对照组相比,所有剂量的氚排泄片都显著增强了氚的排泄。其中,中剂量组(生药13.0 g/kg)在所有时间尺度上对氚排泄的综合效果最为显著,其次是低剂量组和高剂量组。考虑到整体的氚代谢周期,与作为标准参考的氢氯噻嗪相比,中剂量组在氚排泄方面显示出更好的效果。
马等人(26−28) 独立进行了关于排川片的利尿效果、急性毒性和慢性毒性的研究。他们建立了三个剂量组:低、中和高剂量组分别通过灌胃接受4.8、9.6和19.2 g生药·kg^-1。研究显示,在给药后1-2小时和2-3小时,中剂量和高剂量组的大鼠尿量显著增加,与空白对照组相比。此外,在给药后1至3小时内观察到利尿效果,低、中和高剂量组分别增加了130.0%、140.0%和155.7%。这些发现证实了排川片对大鼠的利尿效果,有效剂量为9.6 g生药·kg^-1。小鼠在4小时间隔内两次口服给药,并连续监测给药后2周。排川片在小鼠中的最大耐受剂量(MTD),在4小时间隔内给予两剂,超过333.8 g生药·kg^-1。这个剂量相当于预期日常临床剂量的521.6倍。这证实排川片在最大剂量水平下对大鼠没有急性毒性。为了进一步验证排川片的长期毒性,建立了一个连续胃肠给药排川片的大鼠模型。共有96只大鼠随机分为四组:空白对照组和低、中、高剂量组,分别接受0、32、64和128 g生药·kg^-1的剂量。对照组接受等体积的饮用水,而高剂量组每天上午和下午两次通过灌胃给药,其余组每天上午一次给药,连续三个月。研究显示,在药物给药和停药期间,所有组均未出现死亡、行为变化、食物摄入偏差、粪便不一致或异常体重波动。此外,在凝血时间、血象、血液生化指标或器官重量系数的测量中,也没有发现药物引起的伤害,在病理检查中也没有迹象。这些发现表明,口服排川片在建议的日常临床剂量的50倍、100倍甚至200倍连续三个月不会导致大鼠出现可检测的毒性效应,从而证实了它在大鼠中的相对较低的长期毒性。然而,由于目前可用的氚内部污染的临床病例有限,需要进一步研究以确认其在人体中的临床效果和潜在的毒性副作用。
3.2.2. 茶皇晶
除了排川片,茶皇晶在消除氚方面也显示出效果。左等人(29) 评估了茶皇晶这种中药复方的效果,它由茶多酚和黄芪提取物(如黄芪多糖)组成,对利尿、氚排泄和自由基清除的作用进行了研究。本研究中使用的黄芪提取物是通过水提取和随后的乙醇沉淀过程从黄芪膜荚根中获取的。茶多酚是从多种茶叶芽尖中提取的,包括中国红茶和绿茶。从黄芪膜荚和茶多酚提取物(以2:1的比例)中衍生出的化合物被溶解成50 mg/mL和25 mg/mL的浓度,分别用于小鼠的灌胃给药。在动物试验中,共有60只C57BL/6J小鼠随机分为12组:四个对照组接受无菌水的腹腔注射,四组接受剂量为11.1 × 10^5 Bq/g的HTO注射,其余四组在接受HTO的同时给予茶皇晶化合物(每天0.2 mL)。在1、7、14和21天后,小鼠被处死,并收集样本。结果表明,茶皇晶没有显示出毒性或不良反应,同时显著增强了小鼠肝脏中氚的排泄率,并有效缩短了氚排泄的半衰期。此外,它还表现出强大的自由基清除活性,缓解了外周血白细胞数量的下降,促进了红细胞的增殖,并减轻了HTO诱导的肝脏组织中超氧化物歧化酶(SOD)活性的抑制和丙二醛(MDA)含量的升高。因此,这种氧化应激损伤的减轻与内部氚辐射有关。在HTO暴露7天或14天后,小鼠的白细胞计数显著减少,而茶皇晶给药增加了白细胞和红细胞的计数。由于缺乏临床应用数据和与传统利尿剂的比较,需要进一步的研究来评估茶皇晶在人体内的氚排泄效率和抗氧化应激能力。
3.3. 富氢水
近年来,关于富氢水的研究表明其作为有效的氚解毒剂具有潜力。氢被认为是已知最轻的气体。自从大泽等人(30) 发现氢气可以通过选择性清除羟基自由基来发挥抗氧化和抗凋亡作用,并显著改善动物脑缺血再灌注(I/R)损伤以来,其治疗潜力受到了广泛关注。许多临床和实验研究一致证明,氧化应激是各种疾病的普遍病理机制。氢气选择性地清除细胞内活性氧(ROS)自由基,因此在治疗多种疾病中扮演抗氧化剂的角色,并逐渐在临床环境中找到应用。富氢溶液是通过在0.4 mPa的压力下将氢气溶解在生理盐水或PBS中制备的,从而使得氢气达到0.6 mmol/L的饱和浓度甚至超过过饱和水平。还有人提出,宇航员吸入氢气或饮用富氢水可能有助于减轻太空旅行中辐射引起的氧化损伤风险。这一迹象表明,氢气可能既是预防性又是治疗性的空间飞行药物。(31)
3.3.1. 富氢水在疾病治疗和潜在抗辐射性中的应用
目前认为,氢气的选择性抗氧化能力主要归因于其与活性氧物种直接反应,能够针对性地清除羟基自由基和亚硝酸阴离子(ONOO–)。因此,这一过程有效地减轻了这些自由基引起的DNA核酸断裂、脂质过氧化和蛋白质失活。氢气可以增加细胞内抗氧化酶,如过氧化氢酶、超氧化物歧化酶(SOD)和血红素加氧酶-1,从而对细胞起到保护作用。氢气可以通过抑制凋亡蛋白Caspase-3的表达来发挥抗凋亡作用。它还通过下调诸如IL-1β、IL-6、CC基序配体和TNF-α等因子表现出抗炎特性,从而缓解炎症并减轻氧化应激引起的炎症组织损伤。越来越多的证据表明,氢气可以调节多种信号传导途径,并有可能成为继NO、CO和H2S气体之后的第四种气体信号分子。
作为一种安全有效的治疗性气体,氢气具有以下几个优点:首先,它进入体内后展现出极佳的分散性。由于其低分子量,它能迅速扩散到整个生物体,并容易穿透细胞膜以进入线粒体和细胞核等细胞器。其次,氢气在体内选择性地清除羟基自由基和亚硝酸阴离子,同时保留O2•和H2O2等对巨噬细胞和中性粒细胞执行吞噬作用和消灭细菌至关重要的活性氧物种。第三,氢气的安全性和无毒性使其成为一种可靠的物质。人类结肠细菌每天能够产生12升氢气,其中大部分通过呼吸从体内排出。最后,氢气与•OH和ONOO–反应生成水。在潜水医学领域的广泛研究表明,长时间吸入高压氢气对人体健康没有显著的不良影响。基于在疾病治疗中的各种优势,氢气的治疗能力已在缺血再灌注损伤、炎症、感染、代谢性疾病、神经退行性疾病、肿瘤、过敏性疾病、听力损伤、器官移植反应、阻塞性黄疸、动脉粥样硬化等方面得到了证实。辐射导致体内水分发生辐射分解,产生大量的•OH自由基。这启动了蛋白质、脂质和核酸的过氧化反应。此外,随后形成的次级自由基触发了一系列连锁效应,损害脆弱的组织和细胞。因此,及时清除自由基是减轻辐射引起的伤害的关键措施。
在细胞水平上的研究已经证实了富氢水的辐射防护效果。钱等人(51)表明,在照射前用特定浓度的富氢水预处理培养基可以显著提高人类淋巴细胞AHH-1的存活率,减少细胞凋亡,并降低细胞内乳酸脱氢酶(LDH)的渗出。利用分子探针和荧光显微镜共焦技术,观察到富氢水在辐射暴露后有效减轻了细胞内的•OH水平。动物研究表明,富氢水可以缓解辐射引起的多器官系统损伤,包括肠道、造血和生殖系统、肺、神经系统和皮肤。已经观察到HRW对辐射引起的认知功能障碍具有保护作用,主要是通过参与抗氧化和抗炎反应。HRW通过调节BDNF-TrkB信号通路在保护新生神经元方面发挥关键作用。其浓度依赖性的抗氧化和抗炎作用显著加快了皮肤放射损伤的愈合过程。临床研究已经证明,HRW在提高接受放疗的肝癌患者的生活质量和抗氧化活性方面显示出显著潜力。康等人(56)通过将镁棒与水反应生成弱碱性富氢水,并在49名接受放疗的肝癌患者中进行了安慰剂对照研究。经过6周的放疗,HRW治疗组的生活质量与安慰剂组相比显著改善。该组血清过氧化物显著减少,抗氧化活性相应增加。然而,肿瘤对辐射的敏感性、肝功能和血常规检查似乎未受影响。
作为新兴的研究领域,治疗性氢气在辐射防护效果及其机制方面的报道还很少。尽管人类大肠产生大量氢气,但关于内源性氢气的研究仍然很少。此外,直接吸入氢气或摄入富氢水的安全性尚未精确确定。
3.3.2. 富氢水对促进氚中毒排泄和解毒的效果
在氚暴露的初期阶段,早期促进排泄和实施有效的抗氧化治疗至关重要。鉴于氚和氢的物理性质相似,人们推测高浓度的氢可能与氚竞争并在暴露后促进交换。大泽等人(30)发现,氢分子选择性地中和羟基自由基(•OH)和过氧亚硝酸阴离子(ONOO–),由于其抗氧化和抗凋亡特性,使其成为医疗气体研究的前沿。然而,有限的研究调查了氢分子对内部辐射损伤的影响,例如氚引起的效应。因此,李等人研究了HRW对氚中毒小鼠的排泄促进效果及其机制。(57)HRW已被用作辐射防护剂,以保护人类淋巴细胞AHH-1细胞和小鼠免受氚暴露。研究表明,口服HRW可以提高HTO内暴露小鼠的氚排泄,减少血液中的放射性残留,并有效降低组织中的有机氚(OBT)。氢气处理显示出能够保护培养的淋巴细胞和小鼠免受氧化和凋亡的能力,从而对抗β辐射引起的基因毒性。
3.3.2.1. 富氢水促进HTO的排泄
给予H2O和HRW增加了尿HTO的排泄,与H2O组相比,HRW组观察到尿液放射性活性显著更高。这些发现表明,HRW有效地促进了小鼠体内HTO的排除,从而降低了血液放射活性水平并减少了体内残留的HTO。经过7天两种水处理后,观察到暴露于HTO的组织放射性活性显著降低。值得注意的是,HRW在减少器官结合氚方面显示出更大的潜力,表明其增强HTO排泄、最小化体内残留放射活性的能力,并且比普通水更有效。
3.3.2.2. HRW有效缓解HTO引起的小鼠血常规变化
通过灌胃给予H2O和HRW显著增强了降低由HTO引起的外周血白细胞(WBC)和血小板(PLT)水平。重要的是,HRW比普通H2O显示出更强的效果。
3.3.2.3. HRW预防DNA氧化损伤并减少β射线引起的染色体损伤
与H2O组相比,彗星实验显示HRW处理组在减少由β辐射引起的DNA损伤水平方面表现出更显著的降低,表明HRW在保护细胞免受HTO引起的DNA氧化损伤方面表现出更好的效果。此外,HRW处理在减轻β辐射引起的染色体损伤方面比H2O显示出增强的效果。这些发现表明,HRW可能提供更强大的保护,防止HTO引起的染色体损伤。
3.3.3. 富氢水促进排泄和解毒氚中毒的机制
3.3.3.1. HRW减少了HTO暴露引起的AHH-1中ROS产生的增加
已经提出HRW减轻HTO暴露对AHH-1细胞有害影响的可能性,主要归功于其抗氧化特性和清除细胞内ROS(包括HTO暴露产生的•OH)的能力。
3.3.3.2. HRW减少了HTO对AHH-1细胞的遗传毒性
彗星实验揭示了48小时HTO暴露后细胞尾部荧光强度的剂量依赖性增加,表明细胞尾部DNA逐渐积累。HRW在高剂量HTO(100μCi/mL)组中显著降低了细胞尾部DNA的百分比含量,表明其有潜力减轻HTO引起的细胞DNA辐射损伤。
3.3.3.3. HRW减少了HTO诱导的AHH-1凋亡
流式细胞术分析揭示了AHH-1细胞整体凋亡率在HTO暴露下的剂量依赖性增加,在100μCi/mL浓度时达到约20%。值得注意的是,用富氢介质处理显著减弱了HTO诱导的AHH-1细胞凋亡,凸显了HRW的有效细胞保护作用。
李等人(57)探讨了HRW作为关键的促排泄和保护剂对抗HTO暴露的影响和机制。结果显示,含有高浓度氢分子的HRW可以促进HTO的排除并减少残留放射活性,这可能归因于氢气交换EOT后的竞争效应。HRW还可以选择性中和•OH,从而减少DNA和染色体损伤,保护小鼠和细胞免受HTO引起的损伤,如图1所示。
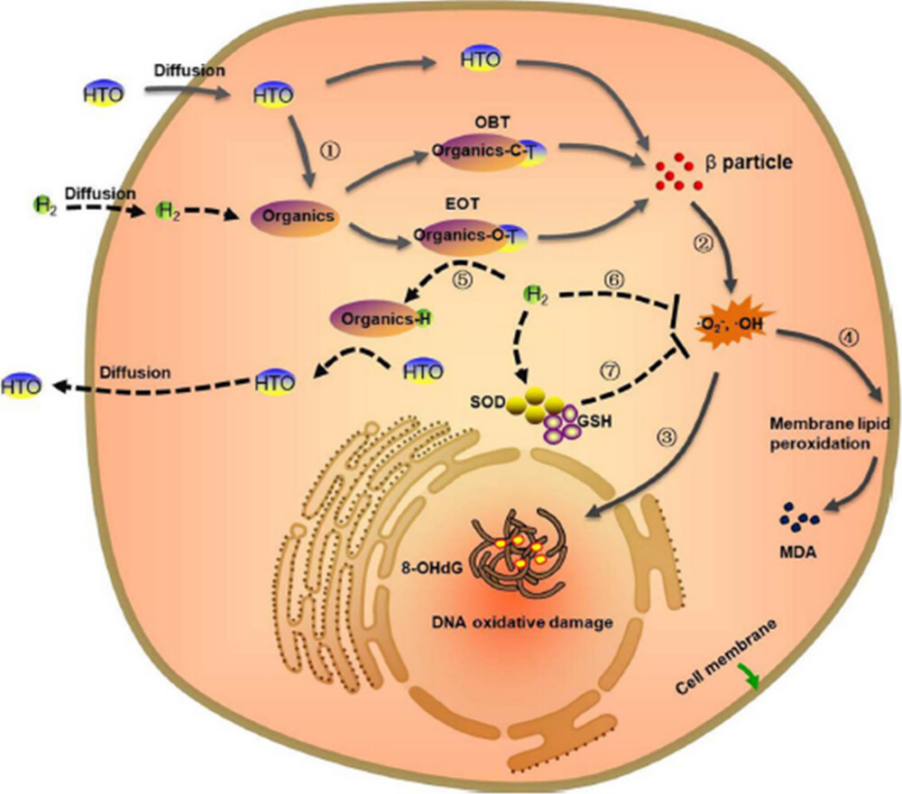
图1. HRW减弱氚暴露引起的辐射毒性的机制。实线箭头表示氚对细胞的损伤机制。虚线箭头表示HRW促进氚排泄和治疗的机制。① HTO进入生物体并与有机分子结合形成OBT和EOT。② OBT、EOT和游离HTO发射的β粒子通过水辐射分解和生物分子氧化诱导细胞内ROS(如•OH和O2•–)增加。③ 过量的ROS导致DNA氧化损伤和产生8-OHdG。④ 自由基还会导致膜脂过氧化,破坏生物膜结构并产生MDA。⑤ 高浓度氢气的HRW与有机物中氚的结合位点竞争性结合,通过同位素交换促进自由或弱结合氚从细胞内扩散出来。⑥ HRW的抗氧化活性可以中和过量的自由基(•OH,O2•–)。⑦ ROS刺激下耗尽的细胞内源性抗氧化剂(GSH和SOD)也可以被HRW逆转,从而缓解氧化应激损伤。
结论
随着氚的使用和环境浓度的增加,增强其排泄和解毒的兴趣日益增长。传统的加速氚排泄策略涉及高水摄入量与利尿剂给药相结合,这可能将氚的有效半衰期缩短4至6天。然而,过量饮水、频繁排尿和利尿剂应用可能导致流体和电解质损失、流体和电解质水平失衡,甚至肾脏损伤。传统中药制剂如排川片和茶黄精已证明具有更优的氚去除效率且毒性较低,使其成为紧急操作的更方便选择。然而,由于氚内污染病例数量有限,关于它们的临床效果和有毒副作用还需要进一步验证。另一方面,HRW作为一种简单、安全、无毒的替代品,在各种疾病中显示出治疗潜力,并且已被证明可以增强辐射抗性。实验已经证实了其在氚内污染模型中促进排泄和解毒、提供抗氧化益处以及预防染色体畸变的能力。由于对氚排泄和解毒的研究有限,尤其是在临床病例中,许多促进排泄方法和药物的有效性仍需进一步确认。与传统方法相比,新型解毒药物的优势并不足够明显,潜在风险也尚未得到彻底评估和评价。在未来的研究中,应努力研究促进排泄的机制,并确认其有效性和副作用。还应探索多手段协同解毒和其他新型解毒药物促进排泄的效果。 总之,本文全面概述了增强氚排泄的传统措施、中药制剂在增强氚排泄方面的疗效,以及HRW对氚的解毒和排泄效果。它进一步对比了各种方法和药物的优势和劣势,旨在为促进氚排泄药物的进步和完善提供有价值的视角。
Lu B, Yang X, Liu J, et al. Progress on Tritium Toxicity and Detoxification Strategies[J]. ACS Chemical Health & Safety, 2024.
作者单位State Key Laboratory of Trauma and Chemical Poisoning, Military Key Laboratory of nanomedicine, College of Preventive Medicine, Army Medical University,
https://blog.sciencenet.cn/blog-41174-1424323.html
上一篇:氢水的健康价值:抗炎症抗氧化【综述】
下一篇:科学家过分相信AI的危害