博文
MTHFR C677T基因突变型中国人群的代谢饮食干预与疾病预防关联
||
MTHFR C677T基因突变型中国人群(高频)的代谢饮食干预与疾病预防关联
摘要:中国人群MTHFR C677T突变携带率高达25-40%(这一比率远高于欧美白种人群(约 5-12%)的 TT 频率。),该突变通过降低5,10-亚甲基四氢叶酸还原酶活性(TT型酶活性仅30%),引发同型半胱氨酸(Hcy)蓄积(血浆浓度>15μmol/L)、叶酸代谢障碍及DNA甲基化异常,使心脑血管疾病风险增加42%、糖尿病风险提升1.9倍、阿尔茨海默病发病率升高2.3倍。饮食干预模式构建:"防病优先"四维饮食架构:热量控制(每日摄入≤1800kcal),低蛋氨酸食物蛋白(蛋氨酸限制性饮食、限制红肉/乳制品,蛋氨酸<800mg/日),低碳水化合物(碳水供能比≤40%,GI值<55),强化营养素(叶酸800μg/日、VB12 10μg/日、VB6 5mg/日,辅酶Q10 100mg/日)。"精准营养干预+传统饮食改良"双轨模式,具有破解MTHFR突变人群慢性病防控难题的潜能。
引言
叶酸(维生素 B9)与一系列B族维生素在人体中担负核心代谢角色,尤其是参与一碳(one-carbon)代谢网络。一碳代谢对于DNA合成与修复、同型半胱氨酸(homocysteine, Hcy)清除、甲基化反应和神经递质代谢等至关重要。5,10-亚甲基四氢叶酸还原酶(MTHFR)是这一网络中枢功能的关键限速酶,转化5,10-亚甲基四氢叶酸为 5-甲基四氢叶酸(5-MTHF),是完成 Hcy 再甲基化成甲硫氨酸的前提步骤。
MTHFR基因常见的 C677T 单核苷酸多态性(SNP,rs1801133)改变了酶的稳定性与活性,导致载有 677TT 基因型的人群 MTHFR 酶活性显著下降,从而直接影响单碳代谢与甲基化反应。这一多态性在人类群体中的分布差异极大,与营养、疾病风险和公众健康策略密切相关。
现代年轻人当前膳食模式存在显著的微量营养素摄入不足问题,特别是B族维生素。这与高油、高盐、精制主食摄入以及不健康烹饪方式相关。B族维生素缺乏与代谢紊乱、心血管风险增加、慢性病负担上升密切联系。针对这一问题,需要从政策制定、膳食结构改善、烹饪方式优化、公众教育、营养强化策略与临床监测多层次开展综合干预。酵母提取物含有丰富的B族维生素辅酶和微量元素,对于纠正代谢必须物的缺乏,以期降低疾病风险、改善健康水平有重要意义。
I,叶酸的生理功能
叶酸(维生素 B9)与其他 B 族维生素长期被视为独立的营养因子,用于防治贫血、神经管缺陷或能量代谢障碍。然而,随着分子营养学与代谢组学的发展,人们逐渐认识到B族维生素并非孤立发挥作用,而是共同构成一个高度耦合的代谢网络。其中,叶酸居于网络的核心节点,通过一碳代谢(one-carbon metabolism)连接DNA合成、甲基化调控、能量代谢及神经系统功能 (Montserrat et.al., 2006)。
膳食中的天然叶酸主要以多谷氨酸形式存在,而补充剂中的叶酸多为合成叶酸(folic acid)。无论来源如何,叶酸在体内均需经过二氢叶酸还原酶(DHFR)的作用,由二氢叶酸还原为四氢叶酸(THF),这一过程依赖维生素B2(核黄素)衍生的辅酶FAD。THF是叶酸代谢的基础骨架,能够结合并转运不同氧化态的一碳单位,从而进入一碳代谢网络。
一碳单位主要来源于丝氨酸、甘氨酸等氨基酸代谢,在维生素B6(吡哆醛磷酸)参与下生成 5,10-亚甲基-THF。该中间体是叶酸代谢的关键分叉点,具有两条主要命运,一是用于胸苷酸(dTMP)合成,直接参与 DNA 复制与细胞增殖,第二,在 MTHFR(5,10-亚甲基四氢叶酸还原酶) 催化下还原为 5-甲基-THF,这是参与甲基化反应的唯一叶酸形式。
5-甲基-THF 的甲基需要通过维生素B12依赖的甲硫氨酸合成酶转移给同型半胱氨酸,从而生成甲硫氨酸。该反应不仅是叶酸代谢的出口,也是甲硫氨酸循环的起点。若维生素B12 缺乏,即便体内叶酸水平充足,5-甲基-THF 也会积聚,无法回流为THF,形成所谓的甲基陷阱。因此,叶酸功能的实现必须依赖 B12 的充分供给。
生成的甲硫氨酸进一步转化为S-腺苷甲硫氨酸(SAM),这是体内最重要的通用甲基供体。SAM 参与多种甲基化反应,包括组蛋白修饰,神经递质代谢,磷脂和肌酸合成。甲基化反应完成后,SAM转化为 S-腺苷同型半胱氨酸(SAH),继而水解为同型半胱氨酸,重新进入叶酸/B12 或B6依赖的代谢路径(Sharma et.al., 2017)。
同型半胱氨酸并非只能进入甲基化循环,在维生素B6参与下,它还可通过转硫途径生成半胱氨酸和谷胱甘肽。该途径在抗氧化、防御氧化应激中至关重要。因此,维生素B6决定了同型半胱氨酸在甲基化调控与抗氧化防御之间的代谢分配,对心血管、神经系统和衰老过程具有重要影响。
叶酸依赖的 dTMP 合成是DNA复制不可替代的步骤。叶酸缺乏会导致 DNA 合成受阻,出现巨幼红细胞性贫血,并在胚胎期造成神经管缺陷。通过SAM介导的甲基化反应,叶酸和B 族维生素参与基因表达调控、细胞分化及发育命运决定,对胚胎发育、神经系统成熟及跨代遗传具有深远影响。
B6、B9、B12 参与神经递质合成、髓鞘形成与神经元稳态维持,其缺乏与抑郁、认知障碍及神经退行性疾病风险增加密切相关。同型半胱氨酸水平受叶酸、B6 和 B12 协同调控,其升高与动脉粥样硬化、脑卒中和代谢综合征相关。综合来看,叶酸并非孤立发挥生理作用,而是嵌入在一个由多种 B 族维生素共同支撑的代谢网络中。该网络通过一碳代谢将营养状态与基因稳定性、表观遗传调控、能量代谢及神经功能紧密连接 (图1)。
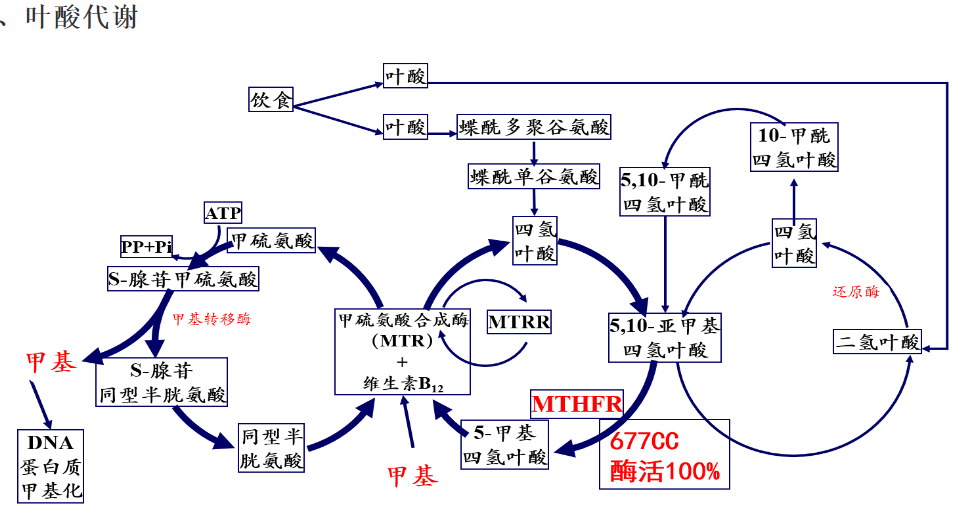
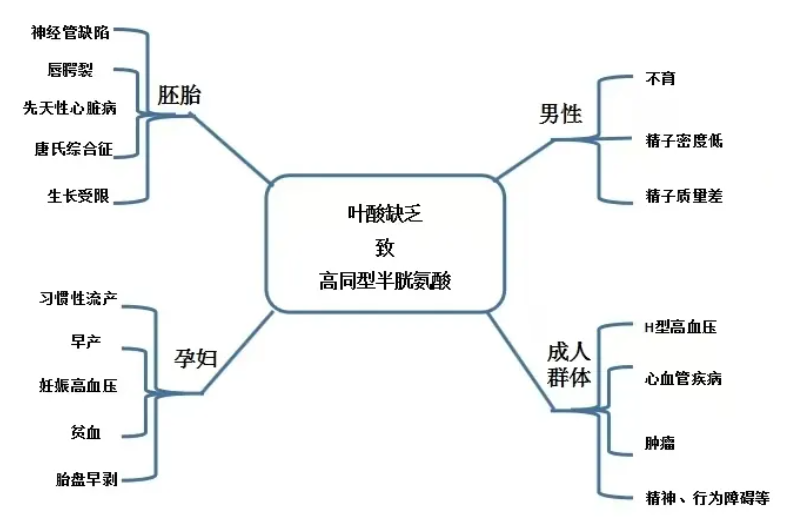
图1. 叶酸和B族维生素代谢图 from .Lionaki E, Ploumi C, Tavernarakis N. One-Carbon Metabolism: Pulling the Strings behind Aging and Neurodegeneration. Cells. 2022 Jan 9;11(2):214.
II,叶酸代谢突变-亚甲基四氢叶酸还原酶(MTHFR)
在过去几十年中,营养学与临床医学对叶酸的关注主要集中在摄入是否充足以及是否预防神经管缺陷这一相对狭窄的领域。然而,随着分子生物学、代谢组学和表观遗传学的发展,人们逐渐认识到:叶酸并不是一种摄入即可发挥作用的普通维生素,而是一个高度依赖酶促转化、并深度嵌入全身代谢调控网络的功能性分子。在这一网络中,5,10-亚甲基四氢叶酸还原酶(methylenetetrahydrofolate reductase,MTHFR)处于一个几乎不可替代的位置。它并不直接参与DNA合成,也不直接提供甲基,但它决定了叶酸能否从结构性代谢转化为调控性代谢。换言之,MTHFR决定了叶酸是否能够真正进入甲基化体系,进而影响基因表达、神经递质合成、内皮功能、炎症反应与能量代谢。
所谓一碳代谢(one-carbon metabolism),并不是单一的线性反应通路,而是由多个相互耦合的循环组成的动态网络,主要包括:叶酸循环(folate cycle),甲硫氨酸循环(methionine cycle),转硫途径(transsulfuration pathway)。这三个模块在细胞内并行运行,通过关键中间体(5-MTHF、SAM、SAH、Hcy)实现物质与信息的交换。这一网络承担的功能极其基础,嘌呤与胸苷酸的合成,DNA与RNA的甲基化修饰,蛋白质、磷脂、小分子的甲基化,神经递质(多巴胺、去甲肾上腺素、5-HT)的合成与降解,抗氧化系统(谷胱甘肽)的维持,任何一个关键节点效率下降,都会导致网络级失衡,而非单一反应受阻。
MTHFR 催化的核心反应为:5,10-亚甲基四氢叶酸 → 5-甲基四氢叶酸(5-MTHF),这一反应具有两个极其重要的特征:一,它是不可逆反应,第二,它是叶酸进入甲硫氨酸循环的唯一通路。这意味着,一旦5,10-亚甲基四氢叶酸被转化为 5-MTHF,它就不再参与DNA 合成,定向输出甲基供体。MTHFR 因此叶酸在生物合成与表观调控之间的分流开关(Frosst et.al., 1995)。
5-MTHF是人体内唯一可以用于同型半胱氨酸再甲基化的叶酸形式。这一反应由甲硫氨酸合成酶(MS)催化,并严格依赖维生素 B12 作为辅因子。因此,在生理层面上可以说,没有 MTHFR,就没有5-MTHF,同型半胱氨酸无法被清除,导致甲基循环崩塌。同型半胱氨酸(homocysteine,Hcy)并非外源毒素,而是甲硫氨酸代谢的必然中间产物:甲硫氨酸 → SAM → SAH → Hcy,在健康状态下,Hcy不会显著积累,因为它会迅速通过以下途径被清除,再甲基化为甲硫氨酸(为主要途径),经转硫途径转化为半胱氨酸和谷胱甘肽,其中,再甲基化途径对 MTHFR 依赖度最高。
Hcy 升高的危害并不局限于其本身的化学毒性,更重要的是它在代谢网络中的放大效应。一方面,Hcy 可直接诱导内皮细胞氧化应激,抑制一氧化氮合成,激活NF-κB等炎症通路。另一方面,更为致命的是Hcy升高通常伴随 S-腺苷同型半胱氨酸(SAH)蓄积。而 SAH 是几乎所有甲基转移酶的强抑制剂(Refsum et. al., 1998)。
长期以来,人们习惯用 SAM 水平来评估甲基化能力,但现代研究表明,SAM/SAH 比值才是真正决定甲基化反应通量的关键指标。当 MTHFR 活性下降时,5-MTHF减少,Hcy再甲基化受阻,SAH积累和SAM/SAH比值下降,即使 SAM 绝对量尚可,甲基转移反应仍然会被 SAH锁死。甲基化水平下降并不会立即致死,但它会在多个层面产生深远影响, 表现DNA甲基化异常:基因表达程序紊乱,神经递质代谢异常:情绪、认知与行为改变,磷脂甲基化受损:细胞膜流动性下降,激素与毒物代谢受阻:内分泌与解毒功能下降,这些改变并非疾病本身,而是疾病发生的土壤。
III. MTHFR C677T突变和人群分布
1.MTHFR C677T的基因型分布
多项基于大样本人群的流行病学研究表明,中国汉族人群中 MTHFR C677T 基因多态性具有显著的地域差异性(Yang et.al., 2013; Lin et.al., 2023)。根据一项涵盖 15,357 名健康汉族成年人的研究,中国大陆不同地区 677T 等位基因的频率(图2)大约为 45.2%,而 677TT 同型合子基因型的总体频率约为 23.2%。这一比率远高于欧美白种人群(约 5-12%)的 TT 频率,且在中国不同省区之间存在明显差异。具体来看,这种遗传多态性表现出明显的地理梯度,在南方省份(例如海南),677TT 基因型的频率较低,约为 6.4%;中部省份(如江苏、湖北等)呈现中等水平,约 8.3–19.7%;北方省份(如山东、河南、陕西)则显著偏高,部分地区 TT 频率达到 30–40% 以上。
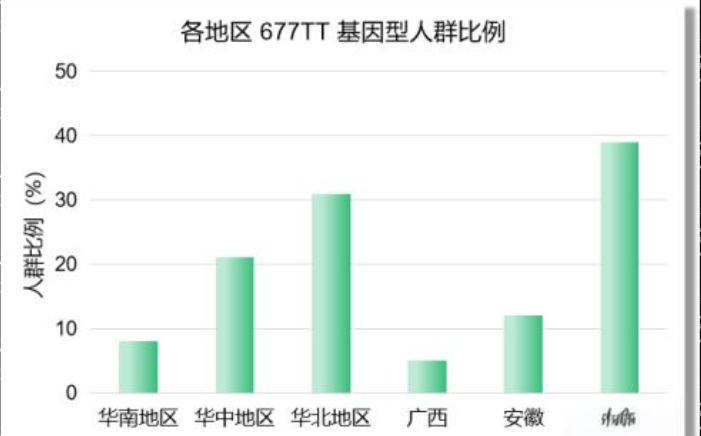
图2:中国大陆不同地区 677T 等位基因的频率
这种南低北高的空间分布模式不仅在整体汉族群体中存在,而且在女性(尤其育龄女性)中也呈现类似趋势,与北方地区神经管缺陷和高血压等疾病的高发率重叠。
在中国除汉族之外的其他少数民族中,MTHFR C677T 基因多态性频率也表现出差异。例如某研究报告指出,部分少数民族的 T 等位基因频率与表现出的 TT 型比例低于或高于汉族平均值,但整体仍呈现地域结构性分布。此外,TT 基因型在男性与女性中的基础分布差异不显著,但在某些特定女性群体中(如孕期人群)其与妊娠结局的关联性更显著,提示该多态性对生殖健康具有潜在影响 (Lin et. al., 2023)。
相比其他人种(如非洲人群中T等位基因频率较低,欧美人群中T等位基因频率中等),中国人群中 MTHFR C677T TT 型非常普遍,这一特点使得中国在无叶酸强制强化政策背景下的同型半胱氨酸水平普遍偏高,疾病风险因子显著。
2. MTHFR C677T 与B族维生素代谢的生化通路与障碍机制
5,10-亚甲基四氢叶酸还原酶(MTHFR)作为上述网络的枢纽门控酶,连接了叶酸循环与甲硫氨酸循环。MTHFR 的催化产物 5-甲基四氢叶酸(5-MTHF)是唯一可用于 Hcy 再甲基化的叶酸形式。C677T 突变导致 MTHFR 蛋白的热稳定性降低,从而显著减少 MTHFR 的酶活性,TT 型个体的 MTHFR 活性通常只有野生型 CC 个体的 25-30% 左右。缺乏稳定有效的 MTHFR 活性意味着 5-MTHF 生成减少,从而限制了 Hcy 再甲基化成甲硫氨酸的能力。这种酶促功能下降的结果包括,5-MTHF 可用性下降,Hcy 再甲基化效率降低,Hcy 在血浆和组织中积累,甲基供体 SAM(S-腺苷甲硫氨酸)生成减少,DNA、蛋白与神经递质合成等甲基化过程受阻 (Crider et. al., 2011)。这种代谢阵痛不仅取决于基因型,还深受营养状态(如叶酸、B12、B2 的摄入与体内水平)影响。
研究发现,即使在营养状况相对一般的中国成人中,TT 型个体在叶酸和 B12 水平均在低至适中状态下表现出更显著的同型半胱氨酸升高,而当叶酸或 B12 摄入充足时,TT 型同样能显著改善 Hcy 水平,这表明营养干预对改善该基因型相关代谢障碍具有重要意义(Selhub et.al., 2022)。此外,中国一些区域总体叶酸水平较低,在无强制叶酸强化的条件下,TT 基因型与高 Hcy 水平的关联更为明显,这与中国南北方在心血管疾病发生率上的南低北高趋势一致。
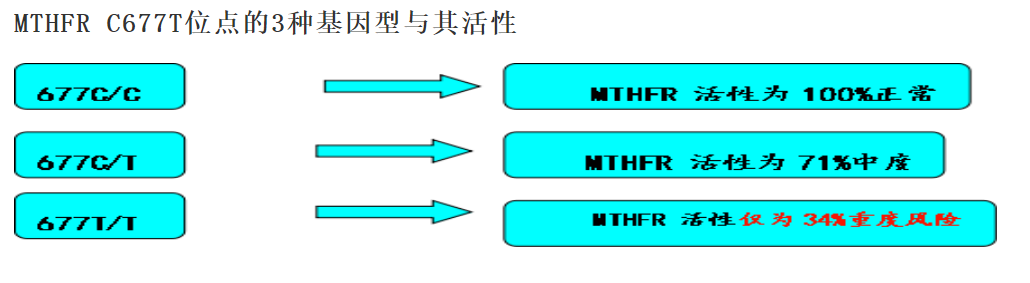
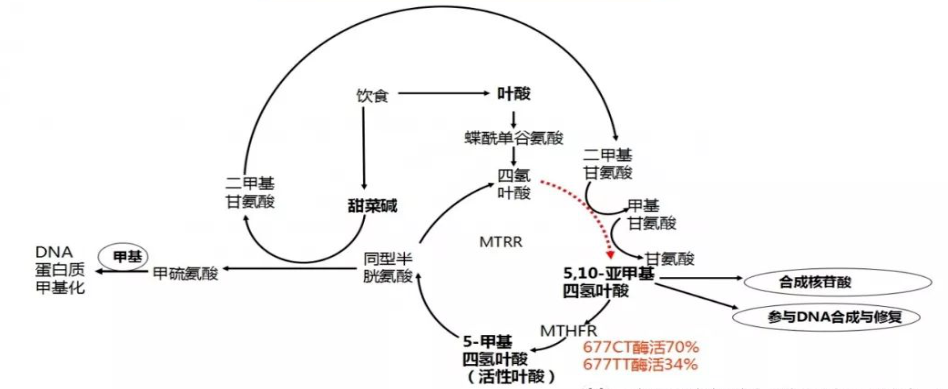
图3:MTHFR C677C/C、C677C/T C677T/T 基因型对应酶活力对比
3.TT 基因型与B族维生素缺乏的交互作用
C677T 突变导致 MTHFR 蛋白第 222 位氨基酸由丙氨酸变为缬氨酸。这一改变降低了酶与 FAD 辅因子的结合稳定性,使其对温度、氧化应激和营养状态更加敏感。TT型个体在叶酸摄入不足或压力状态下,极易发生功能性叶酸缺乏,即血叶酸正常但细胞内 5-MTHF 严重不足。升高的同型半胱氨酸具有以下直接作用损伤血管内皮,促进氧化应激,激活炎症通路,干扰一氧化氮(NO)信号,这是其与心血管疾病高度相关的基础。在生理温度和压力条件下,该酶更容易发生构象不稳定和活性下降。TT 型个体在静息状态下尚可维持基本代谢,但在以下情况下加速代谢障碍,叶酸或 B12 摄入不足,高蛋白或高甲硫氨酸饮食,慢性炎症或氧化应激,妊娠、生长或心理压力状态,因此,C677T 突变并非疾病基因,而是代谢韧性下降的遗传基础。MTHFR 活性下降直接阻碍了再甲基化途径,导致Hcy积累。Hcy蓄积本身有多个负面影响(Shane et. al., 2018)。
血管内皮损伤与心血管风险,高Hcy可引发氧化应激、损害血管内皮细胞功能并增加血栓形成的倾向,是心血管及脑血管事件(如中风、缺血性疾病)的独立危险因素。Meta 分析显示,C677T,特别是 TT 型,与脑血管病风险显著相关,其病死率与发病率在 TT 个体中高于 CC 个体。
神经精神与认知影响,Hcy升高减少了可用的SAM甲基供体,用于DNA和神经递质代谢的甲基化过程被抑制,可能促使神经递质失衡、DNA甲基化异常及慢性炎症,从而与抑郁、认知功能下降乃至神经退行性疾病风险增加相关。
生殖与早期发育障碍,TT 型人群在孕期如叶酸状态不足,与神经管缺陷、早产及妊娠期并发症如妊娠期高血压、妊娠期糖尿病风险增加有关。中国研究显示,妊娠期糖尿病风险与 MTHFR C677T 多态性有关,TT 型可显著升高风险。
癌症与慢性病,长期低甲基化状态可能导致基因表达异常、抑癌基因沉默与染色体不稳定,增加某些癌症风险。全基因组低甲基化使基因组不稳定,局部高甲基化导致抑癌基因沉默,不同癌种呈现不同方向风险变化。
此外,系统性慢性炎症及代谢异常也与代谢综合征、脂质代谢紊乱相关。国人TT人群若叶酸或 B12 全身水平不足,将使 Hcy 升高更明显。研究表明,B12 和叶酸双重缺乏者 Hcy 水平显著高于单独缺乏者或无缺乏者。代谢性疾病(如 2 型糖尿病、肥胖)与膳食不均衡密切相关。B族维生素缺乏通过影响能量代谢效率、胰岛素敏感性等途径参与其病理机制。虽然直接针对年轻人群的中国人群数据仍有限,但全球营养学研究普遍认为膳食质量低下是代谢综合征的重要危险因素。
MTHFR C677T 突变并非决定命运的疾病基因,而是一个揭示现代人群代谢脆弱性的窗口。在高精制饮食、B 族维生素不足、慢性压力和炎症背景下,这一突变被不断放大,最终表现为系统性疾病风险上升。
IV,叶酸和B族维生素缺乏纠正方法
目前尚未实施全国性粮食叶酸强化政策,推广叶酸强化食品与公共健康教育可降低总体 Hcy 水平与相关疾病风险,尤其在高 TT 基因频率的北方地区潜在收益更大。中国人群中 MTHFR C677T TT 基因型具有较高频率,并呈现明显的南低北高地域梯度。这一基因多态性显著影响 B 族维生素代谢、同型半胱氨酸清除与整体甲基化状态,从而增加心血管疾病、神经精神异常、妊娠相关并发症等多系统风险。改善策略不仅需要针对个体的营养补充(尤其是活性叶酸与 B12)和饮食模式优化,还需要更大的公共健康层面的营养强化政策与风险筛查机制。
B12 是甲硫氨酸合成酶(MS)的关键辅因子,B2是 MTHFR 的辅因子,可提高其稳定性与辅因子依赖性,强化这两者可在底层提高 Hcy 再甲基化效率。在基础代谢网络之外,理论上可以设计一种替代同型半胱氨酸清除的旁路,利用胆碱/甜菜碱通路,胆碱和甜菜碱均可作为 甲基供体,参与甜菜碱 + 同型半胱氨酸 → 甲硫氨酸 + 蜂窝格代谢,这一途径独立于 MTHFR,是 SSRP(Sarcosine Synthase)和 DMGDH (Dimethylglycine Dehydrogenase)等酶参与的旁路。通过提高胆碱、甜菜碱摄入,可以从另一个通路增强 Hcy 清除能力,尤其在 MTHFR 功能受损时更有价值。
除了旁路激活,理论上可以通过以下方式改变代谢通量,小分子伴侣(Chemical Chaperones)增强突变 MTHFR 的稳定性,TT 型 MTHFR 蛋白易发生构象变性或与辅因子脱离。一类称为小分子伴侣化合物理论上可以通过结合酶蛋白促进其稳定,实现活性部分恢复。例如某些黄酮类、辅酶 Q10 级别的化合物被研究用于增强弱活性氧化还原酶的稳定性。这类方向需要深入分子动力学分析,但从遗传学角度属于“恢复突变体部分功能”的可行策略。
1. 经典基因治疗的可行性与限制
基因编辑(如 CRISPR/Cas9)理论上可以直接纠正 C677T 突变,但在人类体细胞层面存在重大伦理、技术与安全问题:充分避免脱靶效应,避免影响胚系遗传,动态调控表达水平而不引入过量 MTHFR,精准递送到关键组织(肝、肾、脑)。尽管技术上前景可期,但目前在人体常规实现仍不可行。虽然 CRISPR 编辑动物模型已部分恢复甲基代谢,但在成人滤过基因的临床应用仍远未成熟。RNA干扰与调控:不是删掉,而是优化表达,另一种遗传层面策略是利用小分子 RNA 结合物增强 MTHFR mRNA 的稳定性,利用反义 RNA 或 miRNA 的抑制作用调整代谢通路的节点表达,此策略强调的是调节网络表达,而不是简单修复突变,是一种网络层面的遗传功能优化。
未来更远景但系统性更强的策略是重新编程微生物(肠道菌群)表达活性 5-MTHF 合成途径可利用工程菌在肠道内高效生成功能性叶酸形式,终生持续供给,不受 MTHFR 限制,在肝细胞或肠上皮细胞中构建“替代通路”,例如导入能将任意叶酸形式直接转换为 5-MTHF 的人工基因模块,这类策略属于合成生物学与系统生物学交叉,是从根本上重塑代谢通路的方向。
甲基化反馈与代谢重塑机制,TT型 MTHFR 导致的 SAM/SAH 比率下降,其结果是DNA 低甲基化,基因表达异常,抗氧化系统失衡,表观遗传修饰本身也可通过营养干预、药物改变其状态。例如S-腺苷甲硫氨酸(SAMe)补充 可直接提升甲基供体,组蛋白去甲基化酶抑制剂 可间接调整基因表达营养表观遗传调控分子(如EGCG、硫辛酸等) 调整甲基化动力学。这些策略不是针对 MTHFR 本体,而是改变整个网络对突变的反应,使系统整体更具韧性。除了DNA 甲基化外,RNA 甲基化(如 m6A)也是单碳代谢的受益者。通过调整 m6A 调控酶表达,可在翻译层面 部分补偿 TT 型 MTHFR 的影响,从而部分恢复蛋白合成与细胞功能。
未来的研究可能:利用肠道工程菌持续供应 5-MTHF,在体内构建新的 5-MTHF 生成途径,利用病毒载体在关键组织中表达非 MTHFR 依赖的酶组,利用 CRISPR 直接修复或替换部分 MTHFR 基因片段,这些策略代表了从根本上改变遗传背景影响的可能路径,而不是单纯补充营养。MTHFR C677T 作为单碳代谢的核心节点,其突变对全身代谢造成的影响极其深远。仅靠传统营养补充只能缓解表面症状,其代谢网络的核心瓶颈仍未解决。新时代的遗传学与代谢工程为我们提供了系统性的解决路径,旁路激活与替代通路构建,基因表达与表观遗传调控优化,合成生物学与肠道工程供源策略多组学监测与个体化精准干预,这些策略共同构成一个从基因到系统、从分子到整体的多层次干预框架。
2, 饮食成分改变
叶酸与 5-MTHF(活性叶酸)补充,对于 MTHFR C677T TT 型人群,普通的合成叶酸(folic acid)需要依赖 MTHFR 转化成活性 5-MTHF,而其转化效率低,因此直接补充 5-MTHF(即甲基叶酸)比单纯叶酸更有效。临床研究显示,5-MTHF 能更有效提高血清叶酸水平,降低 Hcy 水平,尤其是在 TT 型人群中更有优势。维生素 B12 是甲硫氨酸合成酶的辅因子,B2(核黄素)作为 MTHFR 的辅因子,优化这两种维生素有助于提升整个单碳代谢网络效率。临床干预表明,B12 足量能够显著缓解 TT 型个体的高 Hcy 表现。
TT 型人群尤需增加富含活性叶酸(深绿色蔬菜、豆类)和 B12(动物肝脏、鱼类、蛋类、强化食品)食物,同时避免过多高蛋白质高蛋黄摄入因可能增加 Hcy 负担。整体膳食模式如地中海式饮食也有利于 Hcy 降低与心血管风险控制。定期监测血浆 Hcy、叶酸与 B12 水平,可动态评估干预效果与调整补充方案。公共健康策略:叶酸强化与预防筛查。
全国膳食调查显示,中国居民 B1 和 B2 的平均摄入量长期低于推荐摄入量。例如维生素 B2 的平均摄入量约为推荐量的一半。此外,国际研究也表明中国成年人口中存在 B12 和叶酸水平不足的问题,尤其是在植物性食物摄入多、动物性食品摄入少的北方地区。总体来看,中国人群特别是年轻群体存在B 族维生素摄入不足与营养缺口问题,这与膳食结构不合理、加工精细食品流行密切相关。
全谷物与杂豆类:保留米面胚芽和麸皮,可显著提高 B1 和 B2 摄入。绿叶蔬菜和豆类:富含 B2 和叶酸。动物性食物:如瘦肉、肝脏、蛋类、奶制品提供 B12 和 B6。坚果与种子:提供泛酸和烟酸等 B 族维生素。鼓励用糙米、全麦面包、燕麦、玉米等替代精制米面。三餐保证多样性,结合粗细粮、五大类食物。烹饪方式与营养保存,高温、长时间烹饪、碱性环境均可破坏水溶性维生素,改进烹饪方法:尽量采用蒸、煮、焯水而非油炸、煎炒。缩短加热时间:减少维生素流失,尤其是叶酸和 B1。避免过度加工:尽可能少用精制食品与预包装高盐食品。
对目标群体,膳食不足、胃肠吸收不良者、素食者及育龄女性,遵循医学或专业营养师建议,避免过量。叶酸对孕妇尤为重要,其不足与神经管缺陷相关。社区卫生服务中心应增加营养评估,例如血浆叶酸、B12 测定,以筛查缺乏风险并提供针对性干预。公众教育与行为改变。
V.酵母提取物有效补充叶酸和B族维生素
随着现代饮食结构的快速变化,不健康膳食模式导致 B 族维生素缺乏及代谢性慢性疾病发病率上升已成为公共健康问题。酵母提取物(Yeast extract)富含 B 族维生素(B1、B2、B3、B6、叶酸 B9 以及 B12 等)及多种辅酶、小分子肽和矿物质,是一种具有潜力的功能性食品成分。相比传统食物来源,酵母提取物中的 B 族维生素多以辅酶形式存在,更易于稳定保存和人体吸收,同时在低温提取条件下能最大限度保持其营养活性。然而,原料中天然核酸尤其是嘌呤含量较高,需通过工艺优化(如低温处理、选用特定核酸酶分解)降低核酸负担,以提升食品安全性与消费体验。本综述从酵母提取工艺、生物化学特点、核酸控制策略、营养学作用、功能性食品开发、安全性与法规、市场前景等多角度展开论述,为该类产品的研发与产业化提供系统参考。
酵母提取物是以酿酒酵母(Saccharomyces cerevisiae)等菌株为原料,通过细胞破壁、提取、酶解、浓缩等工艺制得的细胞质提取物,富含游离氨基酸、小分子肽、核苷酸、多种 B 族维生素及矿物质等营养因子。其在食品工业中被广泛用作调味剂、营养强化剂及微生物培养基成分。酵母提取物具有高营养密度、B 族维生素含量丰富的特点,是开发功能性食品和营养补充剂的优质原料。
传统酵母提取物生产中常见自溶或热水提取方法会导致部分热敏性维生素降解。采用低温提取技术(如低温酶解、自溶于低温条件)可以最大限度保持酵母细胞内 B 族维生素及其辅酶形式的活性。低温处理可减少高温引发的营养物质降解与不良味觉反应的生成,同时保护敏感分子结构,提升产品的营养价值与口味体验。
酵母细胞内核酸含量较高,特别是核苷酸和嘌呤类物质,高核酸水平会在某些人群中转化为高尿酸并导致痛风等风险。要将酵母提取物作为食品级营养补充品,其降低核酸含量至关重要。有效的策略包括,选用特定酵母菌株:筛选低核酸天然菌株作为原料。核酸酶水解:在提取过程中加入核酸酶(如核糖核酸酶)促使核酸分解为无营养风险的低分子核苷酸或碱基,从而减少嘌呤释放。分离纯化步骤:结合膜过滤、离心等工艺去除或降低核酸,同时保留维生素和肽类活性成分。温和处理条件:控制温度和 pH 条件,在避免维生素降解的同时优化核酸分解效率。通过以上办法,可显著降低产品中的嘌呤负担,使其更适合作为日常营养补充食品。
与某些补充剂中合成的单一维生素相比,酵母提取物中的 B 族维生素多以辅酶形式或与小分子肽结合存在,这可能提升其吸收率与生物利用度。辅酶形式往往是维生素的活性形式,可以直接参与代谢反应,无需在体内复杂转化,以增强生理效益。酵母提取物作为功能性食品原料,可应用于膳食补充剂:以片剂、粉末、饮品添加剂形式,针对缺乏风险人群,如素食者、体力消耗大者、应激状态人群。营养强化食品:在早餐谷物、代餐粉及运动营养品中强化 B 族维生素。健康配方食品:如心血管健康产品、孕期营养补充食品中作为天然来源的维生素成分。
酵母提取物被国际食品安全机构(如 JECFA、FDA)认为是 GRAS(一般认为安全)的食品成分,允许在食品中按标准使用。常规摄入水平下酵母提取物安全性高,但核酸含量需标准化控制以满足低嘌呤食品的要求。
通过基因工程或发酵条件优化提高目标维生素(如 B12、叶酸)的积累,同时降低核酸积累,为产品开发提供更优原料。建立工业化低温提取、核酸去除与维生素稳定化的标准流程,并评估批间一致性、营养保留率等关键指标。功能评价与临床验证,开展针对不同人群(如心血管风险高、素食者)的营养干预临床研究,验证酵母提取物对血浆维生素水平、代谢健康指标的改善效果。
酵母提取物作为一种富含B族维生素(包括 B12、叶酸)及辅酶形式营养素的功能性食品成分,具有显著的营养优势。通过低温提取与核酸控制方法,可获得更高品质的产品,减少嘌呤风险,适用于营养强化食品与膳食补充剂领域。在现代膳食结构偏向不健康的大背景下,这类原料为改善微量营养素缺乏、支持代谢健康提供了新的解决方案。
VI.食物结构和烹饪方法的改进
中国菜是中华文明的重要组成部分,也是中国人最具文化认同感的生活实践之一。八大菜系、千变万化的烹饪手法、复杂精细的调味体系,使中国菜在全球范围内享有盛誉。然而,饮食的成功并不等同于健康的最优解。随着现代社会慢性病负担的显著上升,特别是心血管疾病、糖尿病、肥胖和肿瘤的高发,饮食体系若脱离其原有的生活方式、体力活动水平和食物环境,都可能从适应性方案转变为健康风险因素。当前社会经历了剧烈的营养转型,高能量、低营养密度、高盐高脂、红肉比例上升的饮食模式,与一些菜的某些烹饪与选材传统发生了叠加效应,值得严肃审视.传统农业社会中,中国饮食具有几个显著优势:第一,以谷物为主,辅以蔬菜和豆类;第二,肉类并非每日大量摄入,而是作为改善口感与能量补充的配角;第三,体力活动水平高,能量消耗大;第四,食材多为本地、季节性食物,加工度低。
在这样的背景下,即便采用较多的炒、煎、炖等方式,人体也能够在能量平衡和代谢层面维持相对稳定。然而,问题不在于菜系本身,而在于菜系已经脱离了这些前提条件:体力活动显著下降、加工食品大量进入餐桌、动物性食物和油脂成为日常主角,而传统饮食结构却没有同步调整。
目前饮食菜系中最常见健康缺陷包括,
1.高盐是最普遍、最被低估的风险因素
盐不仅是一种调味品,更是一种结构性存在。酱油、豆瓣酱、酱、腌制品、火锅底料、预制调料等,都构成了隐性盐的主要来源。大量研究表明,居民平均盐摄入量长期显著高于世界卫生组织推荐水平,高盐摄入是高血压患病率居高不下的核心饮食因素之一。高盐饮食不仅直接升高血压,还通过损伤血管内皮、加重肾脏负担、促进左心室肥厚,间接提高心血管事件风险。值得注意的是,高盐问题并非个体选择,而是烹饪文化、餐饮工业和口味驯化共同塑造的结果。
2. 高油与高温烹饪,能量密度与氧化负担
某些菜系高度依赖油脂来传递风味,爆炒、油炸、干煸、回锅等手法在多地菜系中极为常见。油不仅增加能量密度,也在高温下发生氧化、裂解,生成过氧化脂质、醛类和多环芳烃等物质。这些化合物与慢性炎症、胰岛素抵抗及肿瘤发生存在关联。更重要的是,高油烹饪往往伴随高盐和高精制碳水,形成代谢压力组合:高血糖负荷,高脂肪供能,高钠潴留,极易诱发代谢综合征。
3. 精制主食占比过高,膳食纤维与微量营养素不足
白米饭、白面条、馒头等精制主食仍然是多数家庭与餐馆的核心能量来源。精制过程中,谷物的麸皮和胚芽被去除,导致膳食纤维、B族维生素、矿物质大量流失。长期以精制碳水为主,会导致血糖波动加大、肠道微生态多样性下降,并放大红肉和油脂的不利效应。
4.红肉摄取过量
在传统社会,红肉并非每日可得,其摄入频率与总量都受到经济条件限制。现代社会中,红肉尤其是猪肉,已成为几乎每天都出现的主菜甚至主食替代品。火锅、烧烤、卤味、快餐、外卖体系进一步放大了红肉的消费频率。红肉提供优质蛋白、铁、锌和维生素B12。然而,问题在于剂量、频率与加工方式。当红肉从营养补充变成结构性主食,其潜在风险开始显现。红肉中通常含有较高比例的饱和脂肪酸。长期高摄入会升高低密度脂蛋白胆固醇,促进动脉粥样硬化形成。此外,红肉中的血红素铁可催化自由基反应,增强氧化应激,激活慢性低度炎症通路。这些机制共同作用,增加冠心病和卒中的发生风险(Wang et. al., 2024)。
多项队列研究发现,红肉摄入与2型糖尿病风险呈正相关。其潜在机制包括:血红素铁过量促进胰岛β细胞氧化损伤;饱和脂肪干扰胰岛素信号通路以及红肉相关饮食模式往往伴随膳食纤维不足。国际癌症研究机构已将加工肉类列为Ⅰ类致癌物。血红素铁在肠道中可促进N-亚硝基化合物生成,高温烹饪产生的杂环胺和多环芳烃亦具有致突变性。同时,红肉可通过改变肠道菌群代谢,增加有害代谢产物生成,进一步提高肿瘤风险。高红肉饮食增加嘌呤摄入,加重尿酸生成,对痛风和慢性肾病人群尤为不利。同时高蛋白、高盐组合进一步加重肾小球滤过压力。
因此传统饮食必须进行结构性现代化调整,
第一,控制红肉摄入总量,提倡少而优,用鱼类、禽类、豆类部分替代。
第二,降低盐和油的使用强度,恢复食材本味。
第三,增加全谷物、杂豆和蔬菜比例,提高膳食纤维与微量营养素密度。
第四,推广低温、短时、少油的烹饪方式。
中国菜作为中华文化瑰宝,在营养和味觉层面都有其闪光之处,但现代版中国饮食结构存在一些不健康趋势——尤其是高盐、高油、精制主食与过量红肉摄入等,这些因素与心血管疾病、糖尿病、肠癌及死亡风险相关。透过科学证据分析,我们应坚持平衡饮食、多样膳食、适量肉类摄入并强调植物性与全谷物来源,以实现健康饮食与疾病预防的长期目标(中国居民膳食指南,2025)。
VII,展望和总结
改善食物中B族维生素摄取的问题,正在从一个是否摄入充足的传统营养学议题,逐渐转变为一个涉及代谢效率、遗传差异、食物结构与社会系统的综合性问题。即便在总体能量和蛋白质供应充足的现代社会,B族维生素的功能性不足仍然普遍存在,其根本原因并不只是摄入量偏低,而是“摄入—吸收—转化—利用”这一整条代谢链条中的多点受限。
在饮食结构层面,现代饮食对高度加工食品的依赖显著削弱了B 族维生素的天然来源。精制谷物去除了富含硫胺素、烟酸和维生素B6的胚芽与麸皮,植物性饮食比例上升又使维生素 B12 的膳食来源更加有限。同时,B族维生素普遍具有水溶性和热不稳定性,传统的长时间高温烹饪方式会造成显著损失,使得名义上的摄入量与真实可利用量之间出现偏差。因此,未来改善摄取的第一步并非依赖补充剂,而是重新重视完整食物形态和食物结构本身,通过全谷物、豆类、坚果、蛋类、乳制品及深绿色蔬菜等食物矩阵,提高多种 B 族维生素在同一餐食中的协同存在和吸收效率。
在此基础上,发酵食品的重要性正在被重新评估。微生物不仅可以降低植酸等抗营养因子,提高矿物质与维生素的吸收,还能够直接合成核黄素、叶酸甚至部分形式的维生素 B12。随着菌株筛选与定向发酵技术的发展,未来食品中 B 族维生素的供给将不再完全依赖原料本身,而是由原料和微生物共同决定。这种以肠道微生态和食品发酵为桥梁的路径,使 B 族维生素摄取问题从单纯的膳食选择,拓展到饮食模式和肠道功能的整体调控。
在食品工业层面,营养强化的理念也正在发生转变。传统强化策略强调数量补足,例如在面粉中添加叶酸或在谷物中添加多种 B族维生素,但越来越多的证据表明,强化形式与生物可利用性同样关键。部分人群由于遗传变异或代谢能力受限,无法有效将合成形式转化为活性辅酶,从而导致摄入充足但功能不足。未来的强化食品更可能采用活性形式的维生素,并结合微胶囊、缓释和靶向释放技术,减少加工和烹饪过程中的损失,提高在小肠特定部位的吸收效率。酵母提取物是有效的B族维生素补充物,营养充分全面,不仅能补充维生素,也能提供辅酶和微量元素,蛋白质和必需氨基酸,对于体弱,素食,病后恢复人群,使食品与功能性营养干预之间的界限逐渐模糊,此类食品在一定程度上承担起维护代谢稳态的角色。
总体而言,B 族维生素正在从基础营养素转变为调控代谢和维持生理弹性的关键因子。改善其摄取的未来方向,不在于简单增加数量,而在于通过优化食物结构、利用微生物发酵、提升强化形式的生物可利用性,并结合个体化代谢特征,实现真正有效的供给。这一转变不仅有助于预防经典的营养缺乏,更可能在慢性病、衰老及神经代谢健康中发挥更为深远的作用。
注释:本文由靳海宁博士和徐斌博士完成,鉴于水平有限,请批评指正。
谢谢科学网大力支持!
参考文献
Boyi Yang, Yuyan Liu, Yongfang Li, Shujun Fan, Xueyuan Zhi, Xiangxiang Lu, Da Wang, Quanmei Zheng, Yinuo Wang, Yanxun Wang, Guifan Sun. Geographical Distribution of MTHFR C677T, A1298C and MTRR A66G Gene Polymorphisms in China: Findings from 15357 Adults of Han Nationality. PLoS One. 2013 Mar 5;8(3):e57917.
Hua Lin, Changxi Liao, Rujing Zhang. Regional distribution of the MTHFR C677T polymorphism in Chinese females.Front Genet. 2023 Apr 21:14:1139124.
P Frosst, H J Blom, R Milos, P Goyette, C A Sheppard, R G Matthews, G J Boers, M den Heijer, L A Kluijtmans, L P van den Heuvel, et al. A candidate genetic risk factor for vascular disease: a common mutation in methylenetetrahydrofolate reductase. Nat Genet. 1995 May;10(1):111-3.
Jacob Selhub, Joshua W Miller, Aron M Troen, Joel B Mason, Paul F Jacques. Perspective: The High-Folate-Low-Vitamin B-12 Interaction Is a Novel Cause of Vitamin B-12 Depletion with a Specific Etiology-A Hypothesis. Adv Nutr. 2022 Feb 1;13(1):16-33.
Shane B, Pangilinan F, Mills JL, Fan R, Gong T, Cropp CD, Kim Y, Ueland PM, Bailey-Wilson JE, Wilson AF, Brody LC, Molloy AM.. The 677CT variant of MTHFR is the major genetic modifier of biomarkers of folate status in a young, healthy Irish population.Am J Clin Nutr. 2018 Dec 1;108(6):1334-1341.
Krista S Crider, Jiang-Hui Zhu, Ling Hao, Quan-He Yang, Thomas P Yang, Jacqueline Gindler, David R Maneval, Eoin P Quinlivan, Zhu Li, Lynn B Bailey, Robert J Berry. MTHFR 677C->T genotype is associated with folate and homocysteine concentrations in a large, population-based, double-blind trial of folic acid supplementation. Am J Clin Nutr. 2011 Jun;93(6):1365-72.
Anup Sharma, Patricia Gerbarg, Teodoro Bottiglieri, Lila Massoumi, Linda L Carpenter, Helen Lavretsky, Philip R Muskin 8, Richard P Brown, David Mischoulon. S-Adenosylmethionine (SAMe) for Neuropsychiatric Disorders: A Clinician-Oriented Review of Research. J Clin Psychiatry. 2017 Jun;78(6):e656-e667.
Montserrat C Anguera, Martha S Field, Cheryll Perry, Haifa Ghandour, En-Pei Chiang, Jacob Selhub, Barry Shane, Patrick J Stover. Regulation of folate-mediated one-carbon metabolism by 10-formyltetrahydrofolate dehydrogenase. J Biol Chem. 2006 Jul 7;281(27):18335-42.
Refsum, P M Ueland, O Nygård, S E Vollset. Homocysteine and cardiovascular disease. Annu Rev Med. 1998:49:31-62.
Dong D Wang, Yanping Li, Xuan-Mai Nguyen, Yuk-Lam Ho, Frank B Hu, Walter C Willett, Peter Wf Wilson, Kelly Cho, J Michael Gaziano, Luc Djoussé. Red Meat Intake and the Risk of Cardiovascular Diseases: A Prospective Cohort Study in the Million Veteran Program. J Nutr. 2024 Mar;154(3):886-895.
中国居民膳食指南(2025,最新版)
https://blog.sciencenet.cn/blog-3569163-1516153.html
上一篇:蛋氨酸限制性饮食疗法的深度研究:从分子机制到临床应用的系统性分析
下一篇:面向代谢性疾病防控的食品产业发展的思考