博文
FMH | 河南省科学院李晓副研究员团队:艾叶多糖改善LPS诱导的小鼠肠道炎症和肠道菌群失调
||

Introduction
近年来,肠道炎症类疾病的发病率呈不断上升趋势,严重威胁人类健康。肠道黏膜为一种选择性屏障,是人体免疫的主要组成部分,也是机体最大的免疫器官。肠道黏膜炎症会造成肠道屏障损伤,同时肠道屏障损伤又参与多种肠道疾病的发生,与肠道炎症疾病、细菌性肠炎等关系密切。目前,治疗肠道炎症主要依赖抗生素,虽然治疗效果明显,但是会产生一系列的临床并发症,如抗生素耐药、抗生素相关性腹泻、重复感染和肠道菌群代谢紊乱等。越来越多的证据表明,食物中含有的一些生物活性化合物通过影响炎症、屏障完整性和肠道菌群组成,在肠道炎症中发挥作用,这些活性成分有望成为肠道炎症类疾病临床治疗的新药物。
艾叶多糖(Artemisia argyi polysaccharide, AAP)是艾叶中重要的活性成分,具有免疫调节、抗肿瘤、抗炎、抗病毒、抗氧化等作用。有研究表明,AAP可显著改善肉仔鸡的生长性能,调节免疫功能,增强抗氧化能力;可调节IL-6、TNF-α等细胞因子的活性并影响T淋巴细胞的增殖,从而发挥免疫调节作用。然而,AAP对缓解肠道炎症,减轻免疫抑制小鼠肠道损伤,调节肠道微生物组成,发挥肠道免疫调节作用及其机制尚未见报道。
LPS是革兰氏阴性菌外膜的主要成分,是引发肠道炎症的致病因素之一。LPS还可通过调节紧密连接蛋白,选择性地增加肠道通透性,使肠道处于促炎状态,模拟轻度肠道炎。研究报道,肠道炎症时,肠道组织中分泌大量炎性细胞因子及趋化因子,多种炎症因子协同作用;肠道炎症性疾病伴随着肠道菌群组成紊乱,并影响机体免疫调节等生理过程。
河南省科学院李晓副研究员团队在本文中探讨了AAP对LPS诱导的小鼠肠道炎症和肠道菌群失调的保护作用,并探讨AAP是否通过调控NF-κB信号通路发挥抗炎作用,为其开发利用提供基础。
Results and Discussion
AAP可降低LPS小鼠肠道组织中TNF-α、IL-6、IL-17、IL-1β的表达。与正常对照组相比,LPS模型组细胞炎性因子TNF-α、IL-17、IL-1β的分泌量均显著升高(P<0.01),回肠组织IL-6显著升高(P<0.05);AAP干预后,小鼠回肠、结肠组织中TNF-α、IL-6、IL-17、IL-1β水平均不同程度降低,说明AAP干预可降低LPS小鼠肠道炎症因子水平(图1A)。
AAP可影响LPS小鼠肠道组织中SOD、CAT、GSH-Px、MDA的水平。与正常对照组相比,LPS模型组SOD、GSH-Px活性显著下降(P<0.01),MDA活性极显著升高(P<0.01),结肠中CAT活性显著下降(P<0.01);SOD、CAT、GSH-Px活性均不同程度升高,MDA活性不同程度降低。说明AAP可抑制LPS小鼠肠道的氧化应激状态,提高机体的抗氧化水平(图1B)。
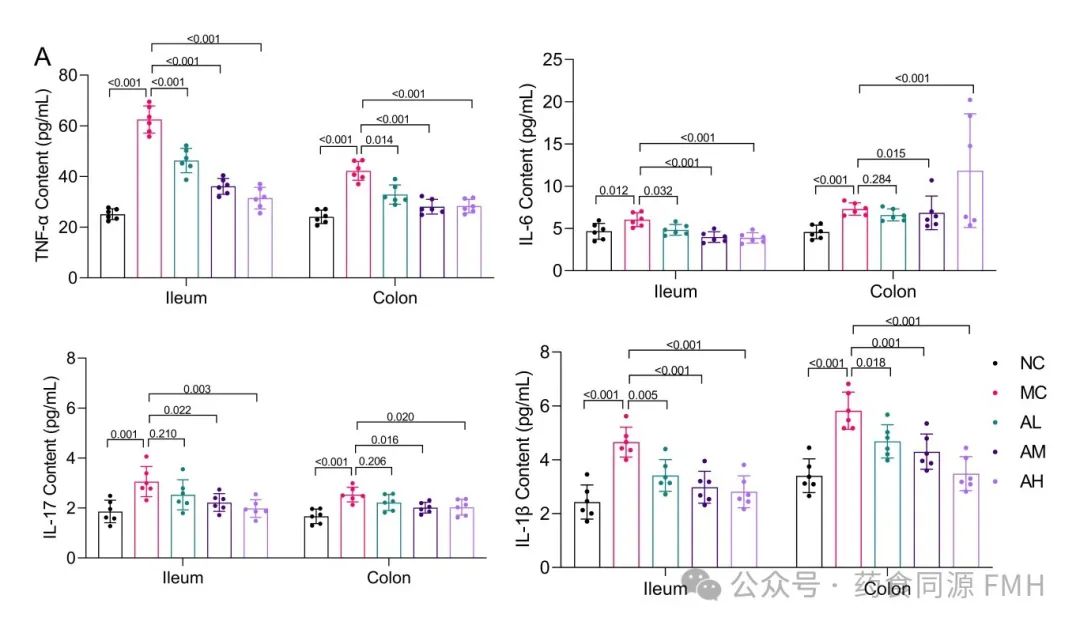
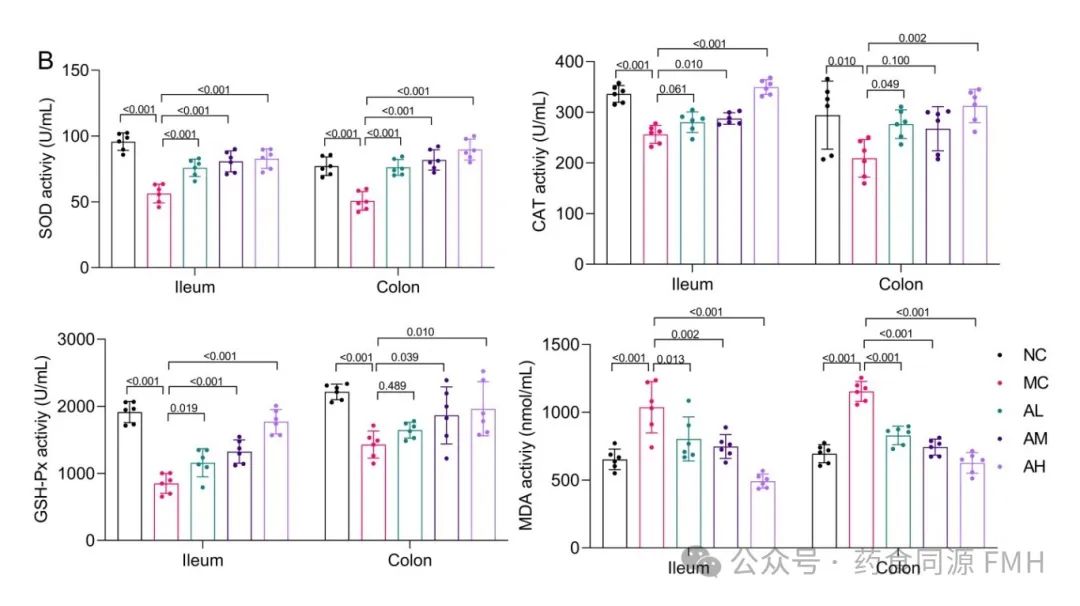
图1. 小鼠肠道炎症因子和氧化指标的变化。
(A)回肠和结肠中TNF-α、IL-6、IL-17和IL-1β的水平。(B)回肠和结肠中的SOD、CAT、GSH-Px和MDA活性。
AAP对炎症模型组IκBα、p65NF-κB的表达也有影响。与正常对照组相比,LPS模型组细胞中 p65NF-κB转录量升高(P <0.01),一定浓度范围的AAP能使p65NF-κB的mRNA转录量降低(P <0.01),IκBα mRNA转录量升高(P <0.01)(图2)。
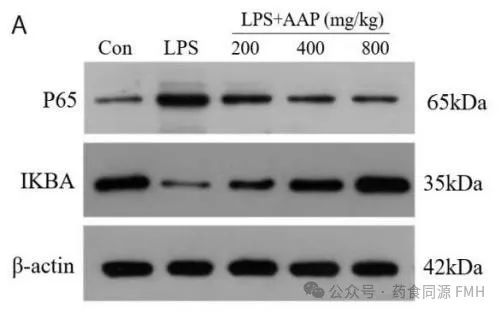
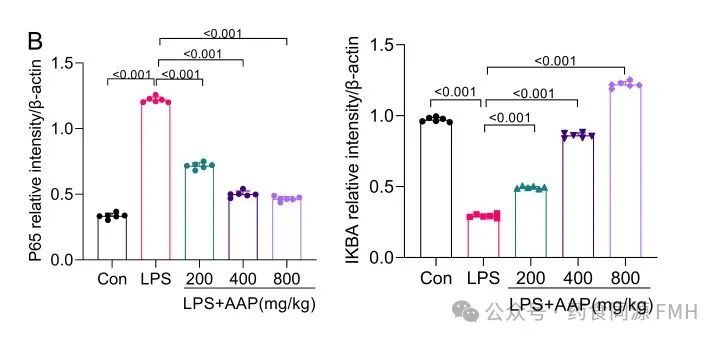
图2. AAP对小鼠结肠细胞中p65 NF-κB和IκBα蛋白表达水平的影响。
(A)蛋白印迹分析p65 NF-κB,IκBα的表达。(B)蛋白质水平的灰度分析。
AAP对炎症模型组肠道菌群多样性和丰度有调节作用。与正常对照组相比,LPS模型组乳酸杆菌和Akkermansia显著减少,Desulfovibrio显著增加(P<0.05)。AAP干预后乳酸菌和Akkermansia丰度均有所提高,Desulfovibrio丰度显著降低(P<0.05)。聚类分析显示,AAP组和NC组肠道菌群的多样性和丰度与MC组不同,AAP组肠道菌群的结构组成要优于MC组(图3)。说明AAP对LPS处理小鼠的肠道菌群平衡有较大的调节作用。
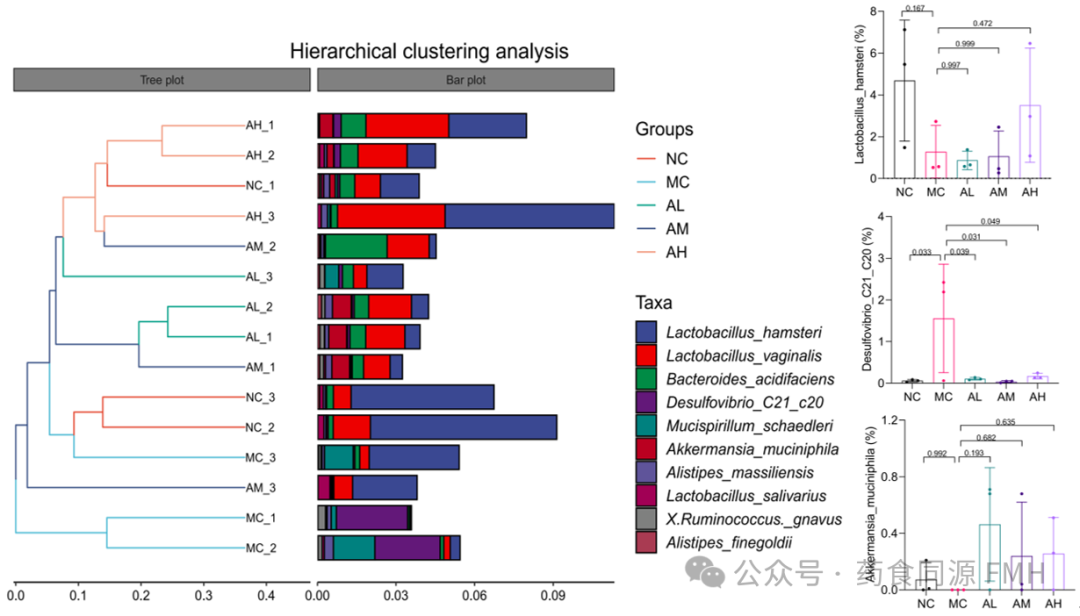
图3. 肠道菌群在物种水平上的聚类分析
相关性分析表明,厚壁菌门、乳酸菌、鼠乳杆菌等肠道有益菌与肠黏膜屏障相关蛋白、SCFAs、SOD、CAT、GSH-PX活性呈正相关,与MDA、炎性因子TNF-α、IL-6、IL-17和IL-1β水平呈负相关;高剂量组各指标变化明显;AAP通过调控NF-κB信号通路在缓解肠道炎症中发挥着重要作用(图4)。
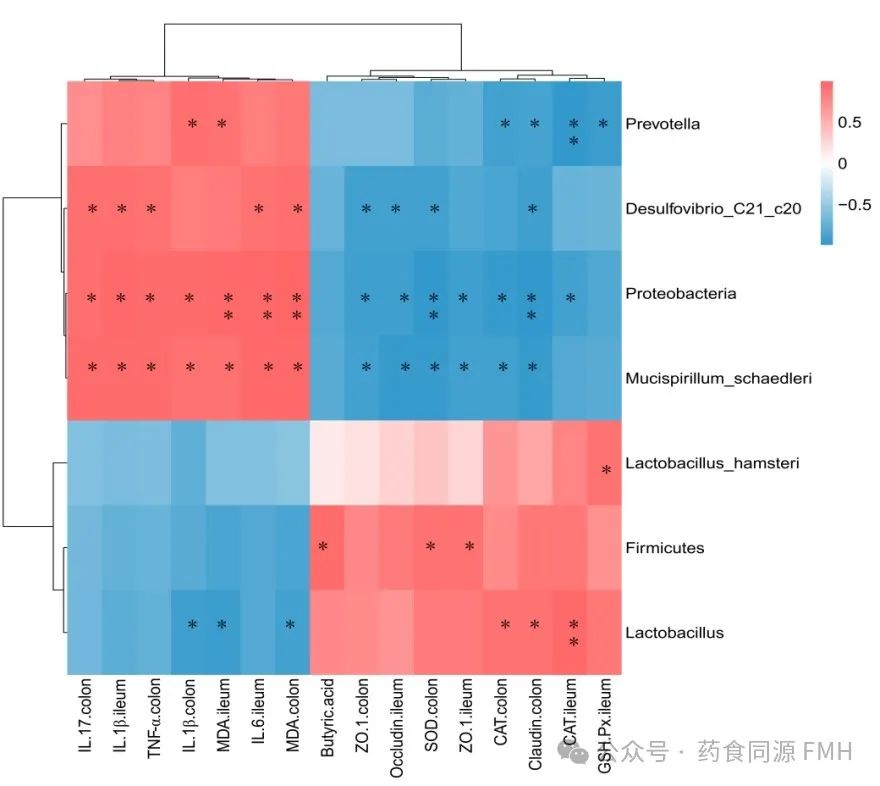
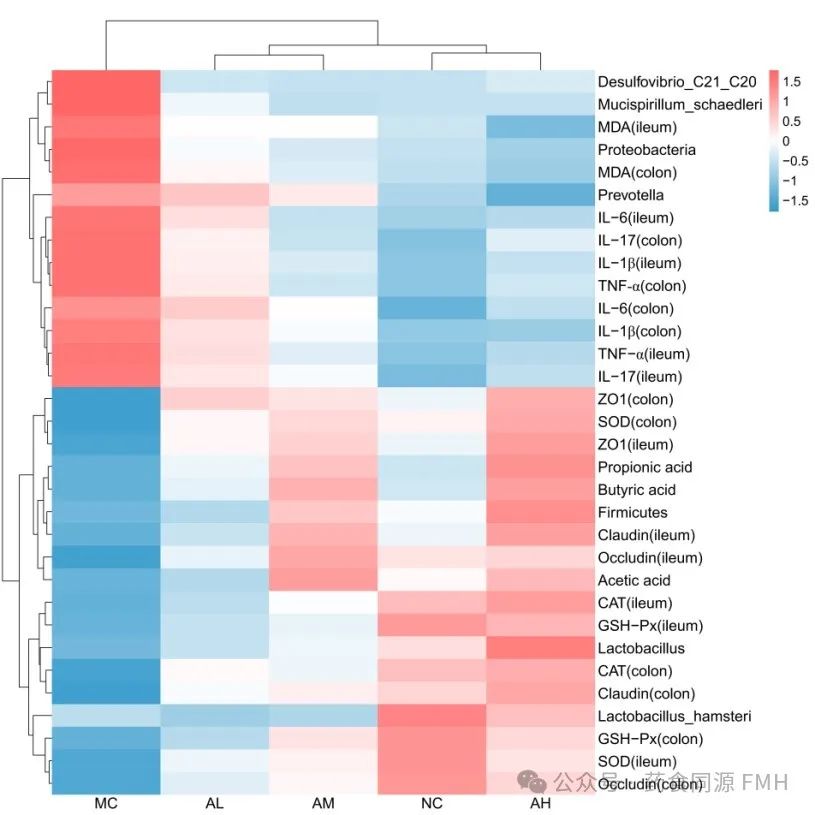
图4.相关性分析。
(A)肠道菌群与炎症氧化指标的相关性分析。(B)试验组间的相关性分析。红色表示正相关,蓝色表示负相关。*P<0.05, ** P<0.01.
Conclusion
本研究表明AAP可调节LPS小鼠肠道菌群组成,增加细菌丰度,改善肠道环境,减轻肠道炎症,修复肠黏膜屏障,恢复肠道功能。这些方面突出了AAP的潜力,并保证其在预防和治疗肠道炎症性疾病方面的发展和应用。
作者简介
第一作者简介
宁二娟,女,河南省科学院助理研究员,主要从事天然植物成分的物质基础研究、功能活性与作用机制评价。参与完成省重大公益专项、省级以上科研项目、中央引导地方项目、市(厅)级科技项目多项,授权国家发明专利10件,发表SCI、中文核心期刊论文30余篇。

通信作者简介
李晓,女,河南省科学院副研究员,硕士研究生导师。近年来主要研究天然植物功效成分、功效评价与新药开发,主持参与省重大项目、省科技攻关项目项目等15项,获国家三类新兽药证书2项,河南省科技进步二等奖1项,完成省级科技成果鉴定7项,授权发明专利20项,以第一作者或通讯作者发表论文30篇。

论文网址
https://www.sciopen.com/article/10.26599/FMH.2024.9420008
END扫码关注我们

https://blog.sciencenet.cn/blog-3563286-1441058.html
上一篇:喜讯|《先进制造科学与技术(英文)》加入SciOpen!
下一篇:FMH | 北京联合大学王锋研究员团队:核桃内种皮的化学成分及其对健康的益处