博文
Phenomics | 复旦大学倪挺教授团队揭示基因内含子多聚腺苷酸化调控细胞衰老新机制
|
文章速递
近日,《表型组学(英文)》(Phenomics)在线发表了复旦大学倪挺教授团队题为“Reduced Usage of GLS Intronic Polyadenylation Promotes Cellular Senescence”的研究论文。
该研究揭示了内含子多聚腺苷酸化在调控细胞衰老中的新作用。研究团队证实,谷氨酰胺酶基因(GLS)内含子多聚腺苷酸化位点的使用减少会降低其较短的线粒体同工型(GAC)的产生,导致活性氧增加、ATP合成减少,最终引发细胞衰老。多聚腺苷酸化因子CPSF6被确认为该过程的关键调控因子。该项工作提供了内含子可变多聚腺苷酸化(APA)与细胞衰老相关联的证据,为衰老及衰老相关疾病的转录后调控提供了新见解。
扫描二维码 | 下载PDF原文
论文DOI链接:
https://doi.org/10.1007/s43657-024-00198-2
论文引用格式:
Li, X., Li, Y., Ding, D. et al. Reduced Usage of GLS Intronic Polyadenylation Promotes Cellular Senescence. Phenomics (2025). https://doi.org/10.1007/s43657-024-0
研究背景
细胞衰老是器官和组织衰老的基础,也是衰老相关疾病产生的直接原因。然而,这个看似简单的生理过程,背后却隐藏着复杂的分子机制。
在生命科学的舞台上,基因序列是剧本,而转录后调控则是决定剧本如何呈现的“剪辑师”。可变多聚腺苷酸化(APA)是一种重要的转录后加工方式,它能让一个基因产生多个不同结尾的mRNA版本,显著增加转录组多样性。内含子多聚腺苷酸化指在基因中间的内含子区域提前加上poly(A)尾巴,形成截短型的蛋白亚型,是APA中一种较少被研究的类型,也是基因表达调控的“隐藏关卡”。
研究团队前期发现3' UTR的APA可调控细胞衰老,然而内含子APA在细胞衰老等基础生物学过程中发挥何种功能尚未可知。该研究聚焦谷氨酰胺酶(GLS)基因,探究线粒体相关基因中的内含子APA是否能够调控衰老进程。该项研究揭示了内含子多聚腺苷酸化在调控细胞衰老中的关键作用,为细胞衰老的研究开辟了新的视角,也为相关疾病的治疗提供了新思路。
研究结果
1. 细胞衰老过程中GLS基因的内含子多聚腺苷酸化显著降低
研究团队通过生物信息学分析及多种人源和小鼠衰老模型的实验验证,观察到GLS基因的内含子多聚腺苷酸化呈现一致性下调。这种下调导致其产生的截短蛋白同工型——谷氨酰胺酶C(GAC)的表达水平下降。
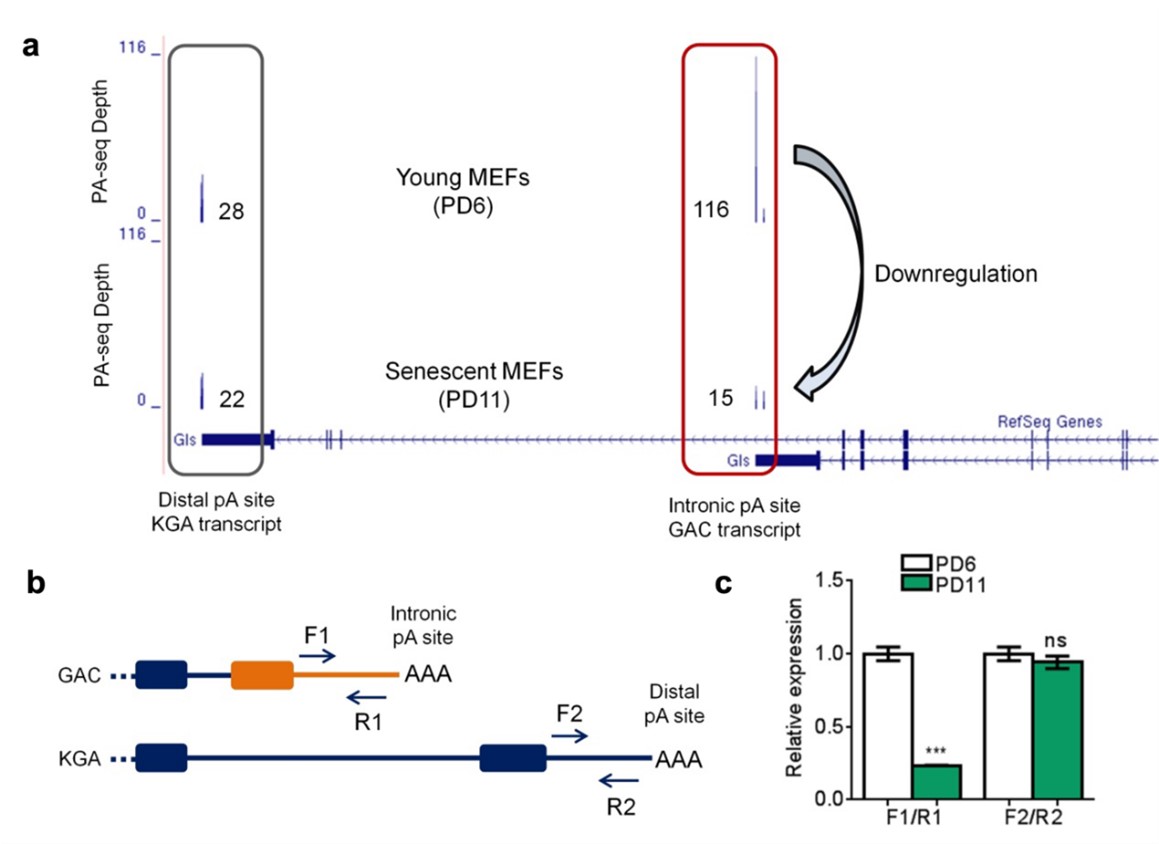 图1
图1
2. GAC的缺乏可诱发细胞衰老
研究者通过shRNA敲低GAC基因,模拟了随年龄增长出现的GAC表达下降现象。结果令人震惊:GAC敲低显著诱导了细胞衰老。在GAC敲低的细胞中观察到多种经典衰老标志:β-半乳糖苷酶活性增强、细胞增殖与DNA复制减少、细胞周期停滞在G1期,以及p21、p53和周期素等关键衰老相关基因表达的显著变化,表明GAC缺失是细胞衰老的驱动因素。
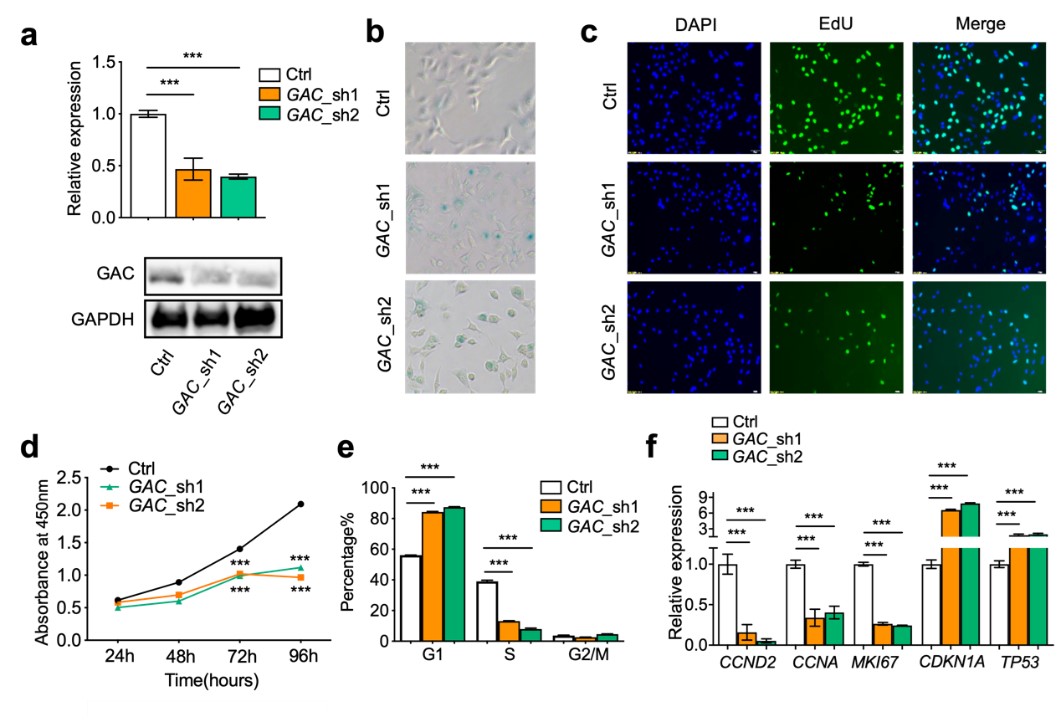
图2
3. GAC的缺乏为何会导致细胞衰老?
鉴于GAC蛋白定位于线粒体,研究团队着重研究了线粒体功能。结果发现GAC耗竭会引发线粒体功能障碍,其特征表现为活性氧(ROS)急剧增加及ATP生成减少。而在使用抗氧化剂NAC清除过量ROS后,细胞衰老表型得到缓解。这证实ROS增加是连接GAC缺失与细胞衰老的关键介导因子。

图3
4. CPSF6是GLS内含子多聚腺苷酸化的关键上游调控因子
多聚腺苷酸化因子CPSF6可直接结合在GAC转录本3' UTR的特定区域,并正向调控其表达。CPSF6在衰老模型中也呈下调趋势。敲低CPSF6可降低GAC表达,并重现与GAC敲低相似的衰老表型及线粒体功能障碍。而在CPSF6敲低的细胞中重新过表达GAC,能够有效逆转衰老表型并降低ROS水平,证实了CPSF6–GAC信号轴在调控细胞衰老中的核心作用。
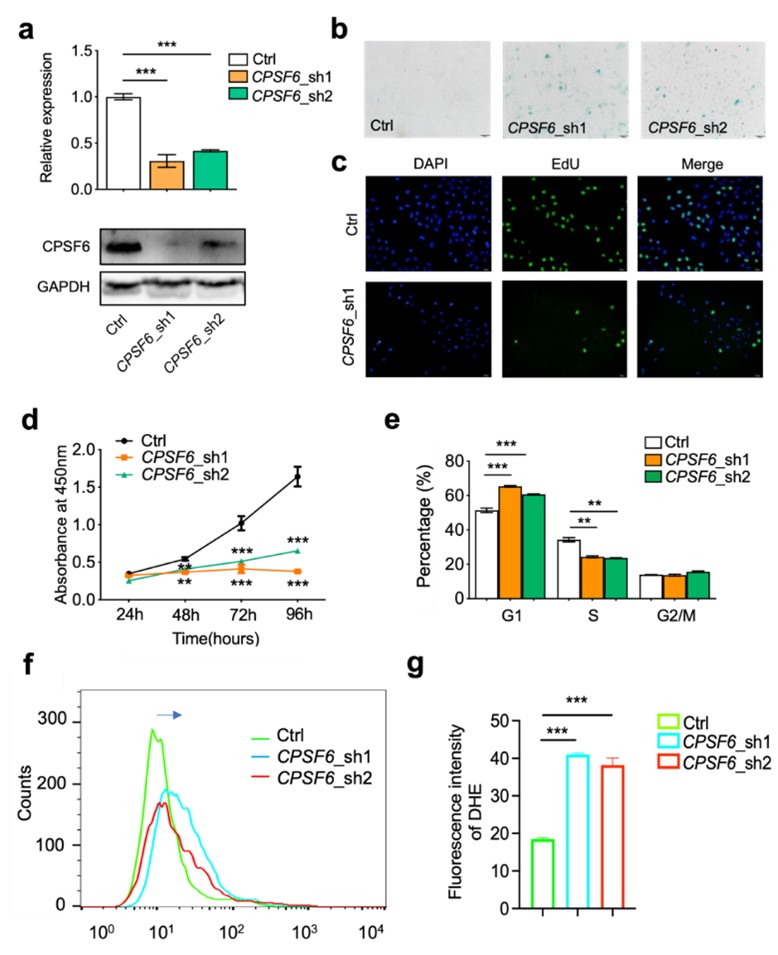
图4
研究结论
综上所述,研究团队发现CPSF6调控的GLS内含子多聚腺苷酸化过程控制着GAC水平,GAC缺乏会损害线粒体功能,导致活性氧增加和ATP减少,最终促进细胞衰老。研究团队据此提出了一条连接内含子APA与细胞衰老的CPSF6-GAC调控轴。本研究的创新性在于证实内含子APA在细胞衰老中的功能作用,为转录后调控、线粒体代谢与衰老之间建立了新的机制联系。
值得注意的是,GAC在癌症中常呈上调表达,而在衰老过程中则呈现下调,表明其功能具有情境依赖性。这为治疗提供了潜在的启示:调控CPSF6-GAC轴或将成为针对衰老相关疾病及癌症的新型治疗策略。
复旦大学生命科学学院倪挺教授与魏刚博士为共同通讯作者,博士研究生李雪萍与硕士研究生李雨欣为共同第一作者。该项目获得国家自然科学基金项目(92249302, 32370592)、国家重点研发计划项目(2023YFC3603300, 2021YFA0909300)、上海市自然科学基金(21ZR1407000)的资助。
Abstract
Alternative polyadenylation (APA) of mRNA is a widespread transcriptomic mechanism which fine-tunes gene expression and plays important roles in diverse biological processes. Of the different APA types, intronic polyadenylation is a prevalent but not well understood one. Although the upstream regulation of intronic polyadenylation is extensively investigated, the understanding of its biological function largely lags behind. Here, we discovered that intronic polyadenylation of glutaminase-encoding gene Glutaminase (GLS) generated an isoform termed Glutaminase C (GAC, encoding glutaminase C), which played regulatory roles in cellular senescence, the basis of individual aging and also an important anti-cancer mechanism. Reduced usage of GLS intronic polyadenylation (pA) site was consistent in both human and mouse senescence models. GAC protein mainly located in mitochondria, and downregulation of GAC induced cellular senescence in both human and mouse cells. Increased reactive oxygen species (ROS) level and decreased ATP synthesis explained the senescence-associated phenotypes in GAC deficient cells. Polyadenylation factor CPSF6 bound to the last exon of GAC to regulate its expression. Rescue experiment confirmed that CPSF6-GAC signal axis did play important roles in regulating cellular senescence. Together, the present study demonstrated for the first time that intronic polyadenylation could regulate cellular senescence, largely extending our understanding of the biological roles of intronic polyadenylation.
作者简介
通讯作者
倪挺,博士,研究员,博士生导师。复旦大学生命科学学院研究员,在Science、Nature、Nature Aging, Nature Methods、Genome Research、Nucleic Acids Research、Aging Cell 等杂志发表研究论文近50篇。目前以细胞衰老及癌变为研究体系,结合高通量测序、分子生物学、细胞生物学和生物信息学等手段研究复杂而多样化的转录组调控,特别是内含子保留和选择性多聚腺苷酸化这两种RNA加工成熟过程调控手段的功能、机制及生物学意义。先后主持多项国家科技部973计划课题和重点研发计划项目、国家基金委重大研究计划培育项目及面上项目。
魏刚,博士,复旦大学生命科学学院讲师,主要从事细胞衰老、RNA调控及生物信息学等领域研究。近年来围绕衰老及细胞衰老方向开展工作,在Nature Aging、Nucleic Acids Research、Genome Research、Aging Cell、PNAS 等学术期刊发表研究论文30余篇,系统揭示了基因表达、RNA加工与细胞衰老调控之间的关键联系,为理解衰老机制及开发相关干预策略提供了重要科学依据。
第一作者
李雪萍,复旦大学生命科学学院博士研究生,美国斯坦福大学博士后。现研究内容聚焦于基因转录后调控在衰老中的作用、线粒体介导的炎症与衰老机制,并结合单细胞测序技术解析炎症条件下间充质干细胞与免疫细胞的动态互作。
李雨欣,复旦大学生命科学学院遗传学专业2024届硕士,现为中国科学院北京基因组研究所(国家生物信息中心)在读博士生。致力于从转录及转录后调控层面探究细胞衰老及相关疾病发生发展的机制探究,硕士期间工作聚焦于RBP对肿瘤衰老及免疫识别的调控作用,近期研究进一步拓展至凝聚体与R-loop等前沿领域。相关研究成果已发表于 Phenomics 及 Life Medicine 等学术期刊。
https://blog.sciencenet.cn/blog-3558836-1516594.html
上一篇:Phenomics | 加拿大阿尔伯塔大学和复旦大学联合开发基于文本、音频和视频的多模态抑郁症检测与评估方法
下一篇:Phenomics | 上海交通大学医学院张孝勇教授团队开发磁共振成像降噪新方法,有潜力改善脑小血管病的诊断效能