博文
国自然热点 | “静息”是误解 “M1M2” 已过时 最热的小胶质细胞耗竭, 你必须了解 | MCE
|
小胶质细胞——脑实质内唯一的免疫细胞。随着成像技术进步,人们对其认知从“静息状态”转变为“极度活跃的细胞”,特别是其舞动的分枝“貌似”在探测周围组织、监控神经元活动,使得小胶质细胞成为神经科学领域研究热点。本期咱们就来唠唠小胶质细胞~
Section.01
认识小胶质细胞

先来进行一波知识更新~
(已掌握,请略过)
首先!
小胶质细胞并非仅存在于中枢神经系统

其次,
以往使用的一些广泛术语和命名,
或许需要被重新定义......
小胶质细胞: “静息”与“激活”
20 世纪 70 年代中期,“静息”和“激活”小胶质细胞这两个术语首次出现在文献中,用于在形态学上描述在生理 ("静息") 和病理 ("激活") 条件下观察到的对银染有亲和力的细胞。这种命名法在 20 世纪 90 年代得到广泛使用。
然而,随着近些年双光子显微成像技术的发展,人们逐渐发现小胶质细胞始终活跃,不会因创伤、损伤、感染、疾病等挑战从“静息”转变为“活化”状态。相反,它持续活跃,会根据生命阶段、中枢神经系统区域、物种、性别及健康或疾病环境采取不同状态、执行不同功能 (图 1)。所以,尽管“静息”和“活化”小胶质细胞仍被广泛使用,科学家越来越多的成像数据对“激活”小胶质细胞概念提出质疑[2]。
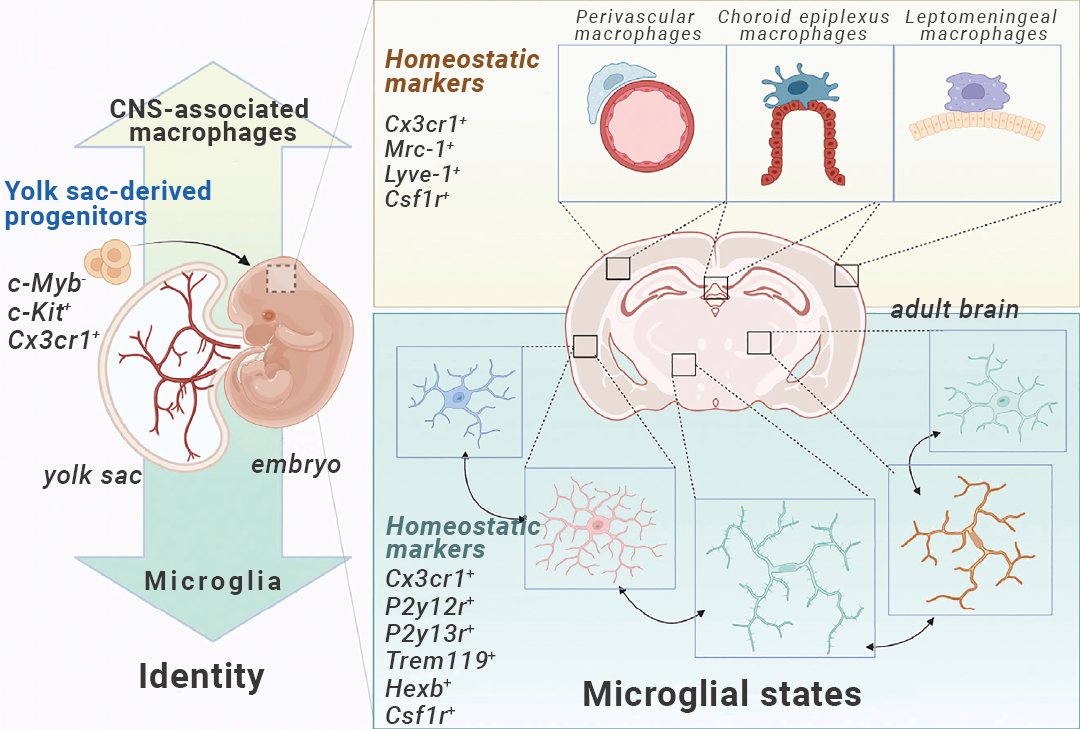
图 1. 小胶质细胞的身份和状态[2]。
与血管周围间隙、脉络丛和软脑膜中的其他中枢神经系统相关巨噬细胞相比,小胶质细胞的身份在早期就由卵黄囊来源的祖细胞确定。一旦它们在脑实质中定植并分化,它们就可以根据特定的时空环境呈现多种状态。
小胶质细胞:M1 与 M2
21 世纪初,免疫学家根据体外模型的研究结果对巨噬细胞进行分类,并提出了另一个术语:“M1”,即经典激活,被认为具有促炎和神经毒性,与“激活”小胶质细胞的概念密切相关,而“M2”即替代激活,被认为具有抗炎和神经保护作用。这些术语在小胶质细胞研究中被广泛采用。
然而,很快发现巨噬细胞的反应比简单的“M1”和“M2”更复杂 (图 2)。就小胶质细胞而言,单细胞技术的出现提供了明确的证据,表明活体脑中的小胶质细胞不会极化为这两种类别中的任何一种,通常同时表达 M1 和 M2 标记物。可以从表观遗传学、转录组学、代谢组学和蛋白质组学数据等多个维度整合小胶质细胞的共存状态[2]。
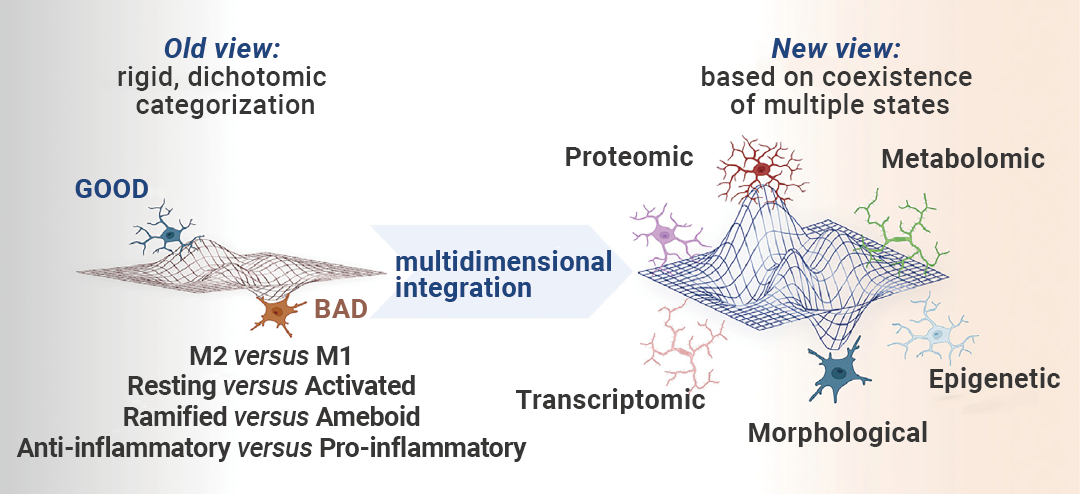
图 2. 小胶质细胞命名法:过去和未来[2]。
尽管目前仍存在争议,但相信在不久的将来,终将对小胶质细胞的一些命名达成共识。
简单了解后,咱们言归正传:作为中枢神经系统的常驻免疫细胞,小胶质细胞是大脑健康的第一道防线!
大脑的“双面卫士”
免疫细胞是免疫系统的重要部分,分布于身体的各个组织器官。CNS 也不例外,小胶质细胞是中枢神经系统内固有的先天免疫细胞[3]。
看到这里,你是不是迫不及待想为小胶质细胞贴上“Good”标签?
的确,生理状态下的小胶质细胞在 CNS 发育、体内平衡和疾病中发挥着重要作用。它们能促进突触的发育和可塑性,通过持续监测、吞噬凋亡神经元或受损细胞碎片。小胶质细胞还可在受到刺激时触发免疫反应,来维持神经系统的健康和稳态 (图 3)。
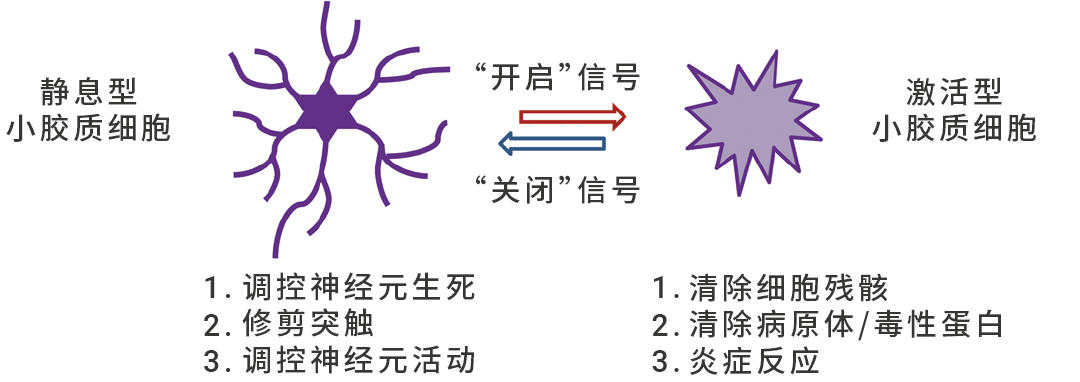
图 3. 小胶质细胞的活化[4]。
Section.02
小胶质细胞耗竭: CSF1Ri
往期小 M 已给大家介绍过不同的小胶质细胞清除技术,如利用毒素、CSF1R 药理性抑制剂 (CSF1Ri)、氯膦酸盐脂质体和构建遗传模型等,每种技术都有其自身的优势和局限性(详见 打开神经系统“黑匣子”----操纵小胶质细胞以探究大脑功能)。
其中,CSF1Ri (代表性化合物包括PLX3397 和 PLX5622) 凭借其独特优势,被广泛应用于生理或病理条件下小胶质细胞的耗竭[6]。
CSF1Ri 清除小胶质细胞的原理是什么?是否可逆?PLX5622 和 PLX3397 区别是什么...... 别急别急,答完你的答你的,答完你的答她的,咱们接着看~
CSF1Ri 清除机制
原理:无配体时,CSF1R 处于非活性状态,通过自我抑制维持活性。当一种配体与之结合,引发 CSF1R 同源二聚化、构象转变及近膜结构域 (JMD) 内酪氨酸残基磷酸化,解除自我抑制,使更多 ATP 进入。这促使更多酪氨酸残基磷酸化,使 CSF1R 完全激活,激活下游信号通路(如 PI3K/Akt、JNK、ERK1/2 和 JAK - STAT 信号通路),促进靶细胞(如巨噬细胞、小胶质细胞、单核细胞等)增殖、分化、存活与活化[5][10][11]。
CSF1Ri(如 PLX3397、PLX5622、BLZ945、JNJ-40346527、Ki20227 和 GW2580)能够阻断 CSF1R 受体的结构改变与自磷酸化,抑制信号传导,致使小胶质细胞丧失生存信号,进而逐步被清除。而且,停用这些抑制剂后,小胶质细胞会迅速重新增殖——也就是说,CSF1Ri 清除是可逆的。
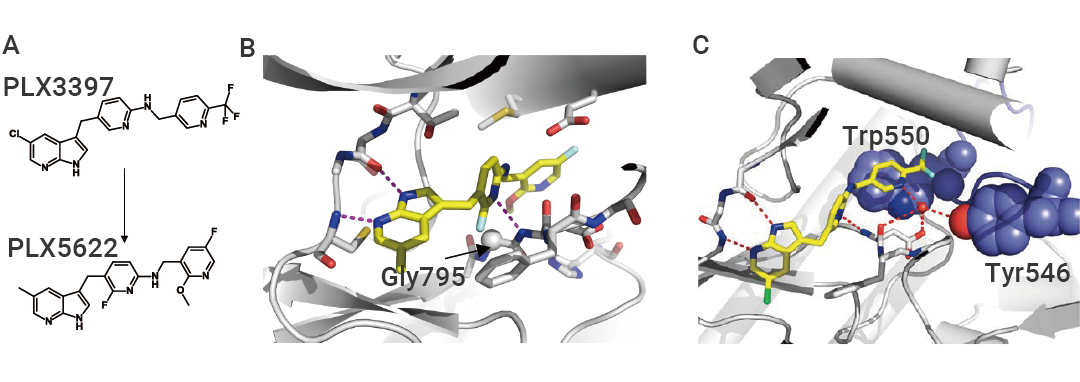
图 4. PLX3397 和 PLX5622 与 CSF1R 的结合位点[12][13]。
A. PLX3397 和 PLX5622的化学结构式。B. CSF1R-PLX5622 复合物的 X 射线晶体结构。C. CSF1R-PLX3397 复合物的 X 射线晶体结构。结合位点表明,PLX3397 能够与近膜结构域 (JMD) 结合,而 PLX5622 能够稳定结合在被近膜结构域 (JMD) 排斥走后形成的 CSF1R 变构口袋中,且 PLX5622 上的 2-氟取代基伸入 CSF1R 特有的 Gly795 附近空间,而 Gly795 在 KIT 和 FLT3 对应位置为较大体积的半胱氨酸,从而导致空间排斥,影响整体结合稳定性,从而避免了对 KIT 和 FLT3 的非特异结合。
表 1. PLX5622 和 PLX3397 生化性质和细胞内的活性差异 (μM)[12]。
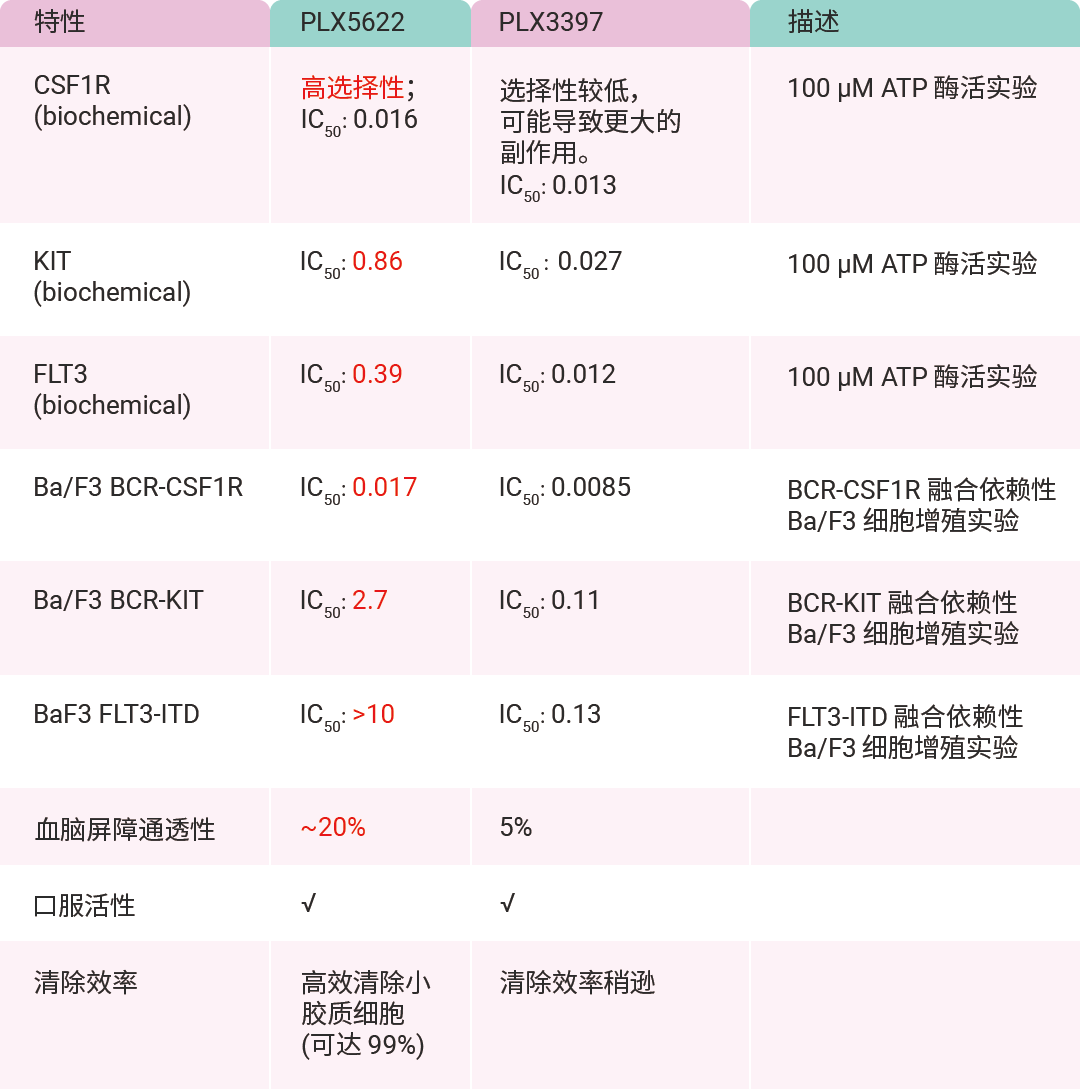
总体而言,相较于 PLX3397, PLX5622 对 CSF1R 的选择性更强,对 KIT 和 FLT3 的抑制活性也更弱。在 CSF1R 依赖性试验中,PLX5622 展现出与 PLX3397 相近的效力。然而,在 KIT 依赖性试验中,PLX5622 的效力比 PLX3397 低约 30 倍。
MCE 验证:PLX5622
MCE 可提供高纯度,高小胶质细胞清除效率,批次间稳定的 PLX5622,产品已经过 MCE 实验室专业的生物验证:7 天小胶质细胞清除率可达 87%, 14 天可达 90% (图 5)。
? 实验动物:雄性 C57BL/6 小鼠 (11-12 周)
? 剂量:自由摄取含 1,200 ppm PLX5622 的 AIN-76A 饲料 7 天或 14 天
? 检测指标:脑组织中 IBA1+ (小胶质细胞标志物) 细胞数目
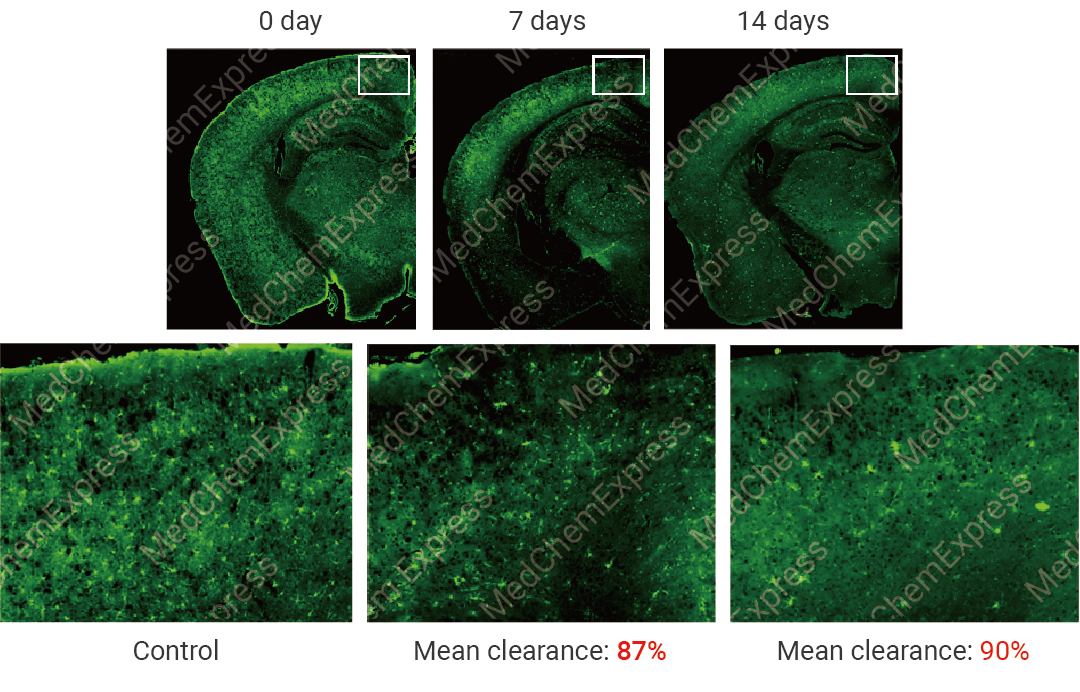
图 5. MCE 实验室对 PLX5622 清除脑部小胶质细胞的效果验证。
产品推荐 |
口服 CSF1R 抑制剂,能透过血脑屏障的、小胶质细胞清除化合物。 |
PLX5622 饲料形式,1,200 ppm。赠送空白对照饲料,提供辐照证明。 |
选择性和脑渗透性的 CSF1R 抑制剂,IC50 为 1 nM。 |
选择性的、具有血脑通透性和口服活性 CSF1R 抑制剂,IC50 为 3.2 nM。 |
口服有效,高选择性 CSF1R 抑制剂,IC50 为 2 nM。 |
口服有效的,选择性的 c-Fms 激酶抑制剂。 |
兔来源、无偶联标记、抗 IBA1 (小胶质细胞标志物) 的 IgG 单克隆抗体。 |
HY-AF0005,诱导肥胖、糖尿病模型纯化型饲料。 |

[1] Wang Z, et al. An immune cell atlas reveals the dynamics of human macrophage specification during prenatal development. Cell. 2023 Sep 28;186(20):4454-4471.e19.
[2] Paolicelli RC, et al. Microglia states and nomenclature: A field at its crossroads. Neuron. 2022 Nov 2;110(21):3458-3483.
[3] Angiulli F, et al. Blood-Based Biomarkers of Neuroinflammation in Alzheimer's Disease: A Central Role for Periphery? Diagnostics (Basel). 2021 Aug 24;11(9):1525.
[4] LI Hui-Quan, et al. The multiple roles played by microglia. Chinese Bulletin of Life Sciences. 1004-0374(2014)06-0620-06.
[5] Elmore MR, et al. Colony-stimulating factor 1 receptor signaling is necessary for microglia viability, unmasking a microglia progenitor cell in the adult brain. Neuron. 2014 Apr 16;82(2):380-97.
[6] Kim N Green, et al. To Kill a Microglia: A Case for CSF1R Inhibitors. Trends Immunol. 2020 Sep;41(9):771-784.
[7] Sara Bachiller, et al. Microglia in Neurological Diseases: A Road Map to Brain-Disease Dependent-Inflammatory Response. Front Cell Neurosci. 2018 Dec 18;12:488.
[8] Gao, C, et al. Microglia in neurodegenerative diseases: mechanism and potential therapeutic targets. Sig Transduct Target Ther 8, 359 (2023).
[9] Tahmasebi F, et al. The Role of Microglial Depletion Approaches in Pathological Condition of CNS. Cell Mol Neurobiol. 2023 Aug;43(6):2459-2471.
[10] Weyer MP, et al. Repurposing of pexidartinib for microglia depletion and renewal. Pharmacol Ther. 2024 Jan;253:108565.
[11] Xiang C, et al. Targeting CSF-1R represents an effective strategy in modulating inflammatory diseases. Pharmacol Res. 2023 Jan;187:106566.
[12] Spangenberg E, et al. Sustained microglial depletion with CSF1R inhibitor impairs parenchymal plaque development in an Alzheimer's disease model. Nat Commun. 2019 Aug 21;10(1):3758.
[13] Tap WD, et al. Structure-Guided Blockade of CSF1R Kinase in Tenosynovial Giant-Cell Tumor. N Engl J Med. 2015 Jul 30;373(5):428-37.
[14] Han J, et al. Inhibition of colony stimulating factor-1 receptor (CSF-1R) as a potential therapeutic strategy for neurodegenerative diseases: opportunities and challenges. Cell Mol Life Sci. 2022 Apr 2;79(4):219.
[15] Wu Z, et al. Peripheral nervous system microglia-like cells regulate neuronal soma size throughout evolution. Cell. 2025 Apr 17;188(8):2159-2174.e15.
https://blog.sciencenet.cn/blog-3536222-1507133.html
上一篇:Cisplatin顺铂肾损伤模型构建|Cisplatin顺铂溶解方案|MCE
下一篇:(S)-AMPA,83643-88-3,≥99.0%_MedChemExpress