博文
N-糖基化:疾病中蛋白质构象和组装的调节剂 | Biomolecules
||
糖基化是一种普遍的翻译后修饰,它通过共价方式将聚糖连接到大分子上,在调节复杂的细胞过程中发挥着关键作用。糖基化失调与包括癌症、神经退行性疾病、先天性疾病、感染和炎症在内的一系列疾病有关。一篇发表在Biomolecules上题为“N-Glycosylation as a Modulator of Protein Conformation and Assembly in Disease”的综述深入探讨了糖基化和蛋白质构象之间错综复杂的相互作用,旨在为潜在的治疗途径提供独特的见解,并加深人们对 N-聚糖如何影响疾病分子复杂性的理解。
糖基化与蛋白质构象
N-聚糖与蛋白质多肽链中特定天冬酰胺残基的连接引入了庞大而灵活的碳水化合物部分,这可能对蛋白质的局部和远端产生巨大影响。对糖基化影响最大的残基不一定在糖基化位点附近,这意味着糖基化的影响不是局部的,而是变构传播到蛋白质的其他区域。蛋白质环是固有的柔性区域,与结构化元件相比很容易发生构象变化。环上的 N-糖苷显示出最高的构象变化,这一观察表明它们对环境线索 (如细胞应激环境) 的敏感性和反应性。事实上,环和无序区域最近已成为蛋白质结构化区域之间传递信息的关键连接器,从而塑造蛋白质的结构和动态特征,并在变构通讯中发挥关键作用。这些区域的糖基化有望对修饰蛋白质的功能运动产生深远的影响。这种功能性适应可能涉及蛋白质在应对不断变化的细胞条件时经历构象变化。此外,这些变化可能会影响与其他分子的相互作用、细胞定位或参与信号传导或其他蛋白质途径。总之,糖基化和蛋白质构象之间的动态相互作用超出了直接糖基化位点,影响了蛋白质动力学,并为功能适应机制增加了额外的复杂性。
N-聚糖对疾病中病理性蛋白质构象的影响
考虑到N-聚糖在调节蛋白质构象方面的异构作用以及对其组装和功能的潜在影响,N-糖基化失调和几种与疾病相关的人类蛋白质有关联也就不足为奇了。此外,这些聚糖可能在调节病原体相关蛋白的构象方面发挥关键作用,影响其在人体细胞内的感染性。本文重点介绍了糖基化促进细胞转化并增强病原体感染性的情况,并研究了蛋白质糖基化将生理蛋白质转化为致病、致病形式的情况。目标是解开这些翻译后修饰的细微差别,揭示它们如何导致蛋白质构象和疾病之间复杂的相互作用。
治疗意义——针对疾病中的构象和组装突变体
了解 N-聚糖在塑造蛋白质的构象和组装中的关键作用,不仅对揭示疾病病理机制的复杂机制至关重要,而且也为治疗干预提供了独特的机会 (图1)。受糖基化调控的疾病特异性构象是构象突变体,为干预提供了独特的靶点。构象突变体是指一种蛋白质的突变形式,其三维结构或构象动态与野生型 (正常) 蛋白质不同。这些蛋白质中异常 N-糖基化诱导的构象突变体和组装突变体是可操作的靶标,为通过抗体、小分子和其他创新方法进行靶向干预提供了途径。这一探索为精准疗法的开发开辟了新的领域,凸显了以高度特异性调节与疾病相关的蛋白质结构和功能的潜力。
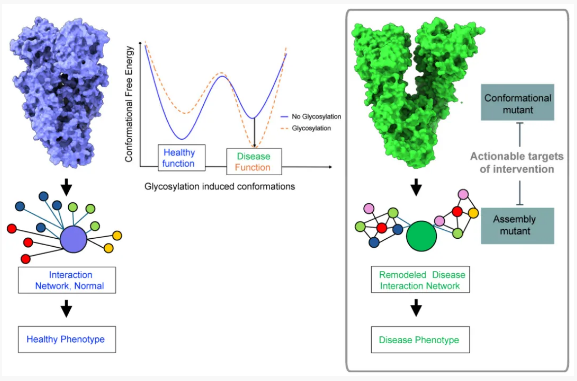
图1. N-聚糖在协调蛋白质构象和组装动力学中的核心作用和对疾病的影响。
结语
总之,研究 N-聚糖、蛋白质构象动力学和疾病发病机制之间复杂相互作用不仅加深了当前对病理生理机制的理解,也为创新治疗策略提供了丰富的前景。这一深刻的见解不仅为精准治疗开辟了新的途径,还强调了多学科方法在制定针对多种复杂疾病的有效策略方面的重要性。当我们探索这一前沿时,学科的融合为未来带来了希望。在未来,基于蛋白质构象细微差别而量身定制的干预措施将成为治疗复杂疾病的基石。
原文出自 Biomolecules期刊:https://www.mdpi.com/2218-273X/14/3/282
期刊主页:https://www.mdpi.com/journal/biomolecules
Biomolecules 期刊介绍
主编:
Lukasz Kurgan, Virginia Commonwealth University, USA;
Peter E. Nielsen, University of Copenhagen, Denmark
期刊旨在发表包括生物活性和生物源性物质的结构和功能,具有生物学和医学意义的分子机制以及生物材料及其应用等在内的高水平文章。期刊2022年JCR及CiteScore分区均为Q1。Journal Rank: JCR-Q1 (Biochemistry & Molecular Biology) / CiteScore-Q1 (Biochemistry)
2023 Impact Factor:4.8
2023 CiteScore:9.4
Time to First Decision:18.4 Days
Acceptance to Publication:2.7 Days


https://blog.sciencenet.cn/blog-3516770-1480296.html
上一篇:Sensors:最佳博士论文奖申请进行中
下一篇:对话Batteries 2025 Travel Award获奖者——王清松博士