博文
电子科大张坤等综述:一种新的前沿癌症治疗方法—工程化癌症纳米疫苗  精选
精选
|
研究背景
疫苗在预防和治疗疾病中至关重要,其中癌症纳米疫苗因其强大的抗肿瘤免疫能力而受到越来越多的关注。通过利用纳米技术在纳米尺度上封装载运肿瘤抗原,工程化癌症纳米疫苗可以实现更为精准的药物递送,从而有效促使免疫系统产生抗体并激活多种免疫细胞。这种技术不仅可以对肿瘤组织产生免疫反应,还能减少传统化疗和手术的负面影响及复发风险。然而目前对工程化癌症纳米疫苗整体发展情况的描述仍然欠缺,因此本文对癌症纳米疫苗相关载体、构建原理、临床应用、优势与缺点进行了详细综述。

Engineered Cancer Nanovaccines: A New Frontier in Cancer Therapy
Yijie Wang, Congrui Liu, Chao Fang, Qiuxia Peng, Wen Qin, Xuebing Yan*, Kun Zhang*
Nano-Micro Letters (2025)17: 30
https://doi.org/10.1007/s40820-024-01533-y
本文亮点
1. 对构建癌症纳米疫苗的载体进行了分类,讨论了它们多样化的应用,并比较了各自的优缺点。
2. 对指导癌症纳米疫苗设计和工程的各种细胞靶点进行了分类,重点强调了它们的特征和优势。
3. 讨论了癌症纳米疫苗的临床案例及所面临的挑战,并提出了合理的解决方案和未来的研究方向。
内容简介
工程化癌症纳米疫苗由纳米颗粒载体和其内部的肿瘤抗原两部分组成,如何合理制造纳米颗粒载体与如何高效靶向杀灭肿瘤组织是设计和生产癌症纳米疫苗中最困难的地方。电子科技大学张坤等人首先介绍了癌症纳米疫苗的基本概念及其工作原理,说明纳米技术在提高疫苗靶向性和免疫应答方面的优势。随后分类讨论了用于癌症纳米疫苗的各种纳米载体,包括无机材料、脂质材料、聚合物材料、病毒和细胞膜等,并分析了它们的生物相容性、免疫原性及其在疫苗制备中的应用挑战。接下来讨论树突状细胞、T细胞、B细胞、癌细胞等上的疫苗靶点,并对比分析每种方式的优缺点。此外还回顾了当前临床试验中的癌症纳米疫苗,强调结合其他治疗方法(如化疗和免疫检查点抑制剂)与癌症纳米疫苗的联合治疗策略更有助于治疗癌症。本综述表明工程化癌症纳米疫苗有希望成为未来治疗癌症的重要手段,但目前仍有许多亟待解决的问题,进一步的研究应克服临床应用中的障碍,加快推动癌症纳米疫苗的临床转化。
图文导读
I 工程化癌症纳米疫苗纳米载体的分类总结
图1所示为纳米载体的分类总结,纳米载体可分为无机纳米颗粒、脂质纳米颗粒、聚合物纳米颗粒、仿生纳米颗粒。无机纳米颗粒分为金、二氧化硅、贴、量子点、碳纳米颗粒、碳酸盐纳米颗粒等;脂质纳米颗粒分为固体脂质纳米颗粒(SLNs)和纳米结构脂质载体(NLCs);聚合物纳米颗粒分为天然聚合物颗粒如壳聚糖与合成聚合物颗粒如聚乳酸-羟基乙酸共聚物(PLGA);仿生纳米颗粒有真核细胞膜、细菌和病毒等。
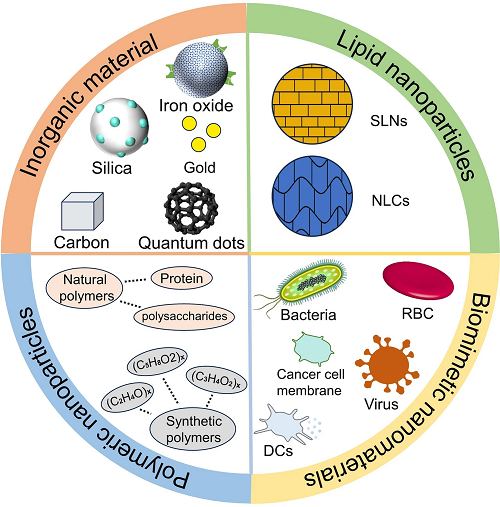
图1. 工程化癌症纳米疫苗纳米载体的总结。
II 纳米颗粒的渗透机制和治疗效果
纳米颗粒首先从动脉外渗,然后扩散到癌组织中,最后与肿瘤微环境中的细胞内或细胞外靶标相互作用。纳米颗粒由于体积小的特点可以高效地渗透到淋巴组织和肿瘤组织中。相较于其他尺寸更大的递送方法而言,纳米颗粒负载抗原物质可以诱导机体释放更多的抗体与细胞因子,有利于增强免疫反应。
图3a显示暴露在潮湿的空气中1小时后,裸露的玻璃瓶中的锂金属与空气中的水分不断反应(图3b,c),导致重量显著增加,最终达到18.7%。pPR-SPE密封的瓶子显示出略微减少的重量增加值(12.5%)。与此明显不同,mPR-SPE密封的瓶子和PTFE密封的瓶子分别显示出6.2%和4%的值。图3d显示了锂金属表面在暴露于空气一段时间后的XRD光谱。对于裸露的锂金属,与LiOH对应的峰值在暴露于气体后立即增长,表明纯锂金属对空气中产生的氧气和水分的敏感性。对于pPR-SPE,在暴露大约1小时后观察到与LiOH对应的峰值。相比之下,对于mPR-SPE,没有观察到明显的与LiOH对应的峰值。这表明mPR-SPE对锂金属保护能力得到了增强,这得益于其更好的疏水性(图3e,f)。
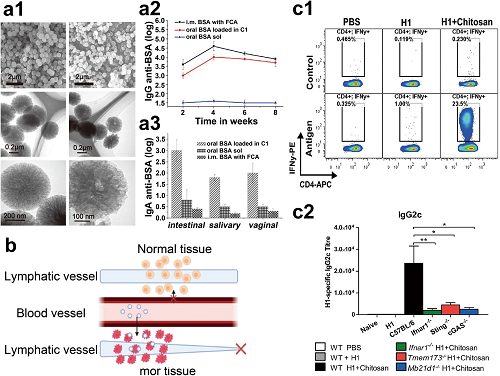
图2. a1 新型疏水性碳纳米颗粒的透射电子显微镜图像。a2 口服给予游离白蛋白(BSA)几乎不会诱导IgG的产生,而将BSA负载于C1进行口服给药则显著提高了免疫反应水平。a3 用负载在碳佐剂中的BSA进行口服免疫接种能够诱导系统性和黏膜免疫反应。b 纳米疫苗的被动递送机制,其中纳米颗粒首先从动脉渗出,然后扩散到癌症组织,最后与肿瘤微环境中的细胞内或细胞外靶点相互作用。c1 干扰素(IFN)对壳聚糖驱动的细胞免疫至关重要。c2 壳聚糖通过cGAS-STING途径驱动细胞免疫。
III 癌症纳米疫苗的设计与靶向策略
3.1 靶向树突状细胞DCs
当纳米颗粒进入体内后,它们会被未成熟的树突状细胞摄取,随后树突状细胞因此被活化,呈递抗原的能力增强。随后,抗原在淋巴结中被呈递给CD4+T细胞与CD8+T细胞,促进T细胞的分化和成熟。此过程还激活了B细胞介导的免疫反应,B细胞分化成为浆细胞。成熟的免疫细胞随后离开淋巴结,迁移到肿瘤侵袭区域,一些免疫细胞可以发挥细胞毒效应来杀伤癌细胞,另一些辅助作用的细胞如CD4+T细胞与活化的树突状细胞分泌细胞因子来进一步增强抗肿瘤免疫效应。因此靶向树突状细胞是制备癌症纳米疫苗的一种良好策略。图3所示为工程化癌症纳米疫苗靶向树突状细胞后激活体内抗肿瘤免疫反应的机制示意图。
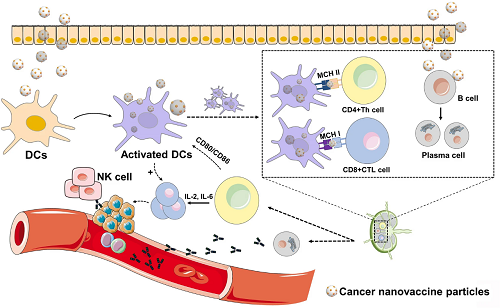
图3. 癌症纳米疫苗靶向树突状细胞(DCs)并激活机体免疫反应的机制示意图。当纳米颗粒进入体内后,它们会被树突状细胞及其他抗原呈递细胞摄取。随后,抗原在淋巴结中被呈递给T细胞,促进T细胞的分化和成熟。此过程还激活了B细胞介导的免疫反应。成熟的免疫细胞随后离开淋巴结,迁移到肿瘤侵袭区域,发挥细胞毒效应。
树突状细胞表面有许多高表达受体,在本文中我们列举了目前研究较多的几类受体。C型凝集素受体(CLRs)包括DEC205 (CD205)、Langerin、CLEC9A、Mincle等。DEC205是巨噬细胞MR家族的一员,可作为B型寡核苷酸的受体,常规树突状细胞1 (cDC1)等细胞中此基因高度表达。有研究将抗DEC205单克隆抗体与 HPV-16 E7致癌蛋白相结合,开发了一种旨在治疗HPV相关肿瘤的治疗性疫苗αDEC205-E7 mAb。与佐剂结合后,αDEC205-E7 mAb可以激活靶向全身和淋巴组织中肿瘤抗原的 CD8+T细胞,导致在不同的肿瘤模型中产生强烈的抗癌反应(图4)。除此之外,还有清道夫受体SR-B1、Toll样受体(TLRs)等。
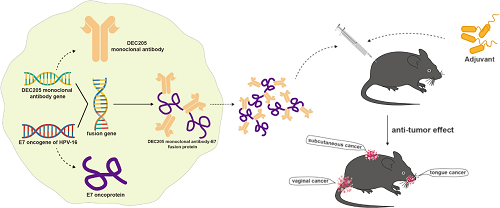
图4. 将DEC205单克隆抗体基因与HPV16 E7致癌蛋白基因融合以生成联合疫苗。与免疫佐剂同时使用可对皮下、舌侧和阴道肿瘤产生强效抗肿瘤作用。
在实际应用中,我们可以明显看出靶向树突状细胞有利于抵抗癌症。例如图5所示,利用树突状细胞上的CLEC9A受体可以激活IL-21依赖的抗肿瘤反应,在使用WT1表位235-245和126-134进行交叉呈递中展现出更优秀的呈递效率并可以诱导促进IFN-β、IL-6和CXCL10、IL-21等细胞因子的释放,以促进T细胞的激活,在治疗小鼠时也可以有效减小肿瘤体积。
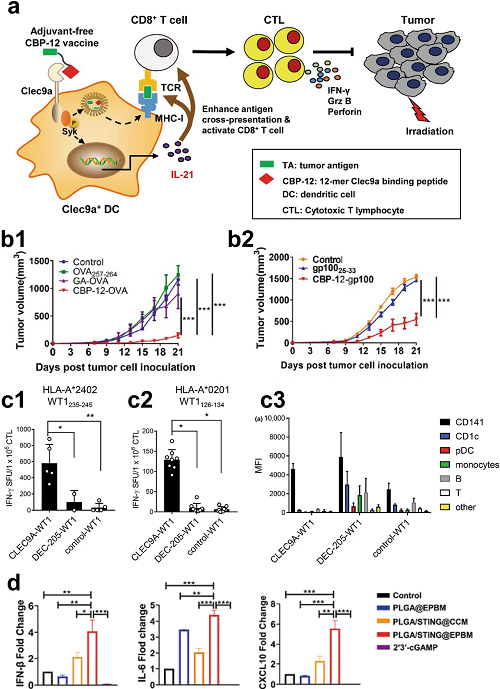
图5. a 无佐剂的CBP-12结合肽疫苗通过靶向树突状细胞上的Clec9a诱导IL-21依赖的抗肿瘤反应。b1 在接受CBP-12-OVA治疗后,小鼠肿瘤体积显著缩小。b2 在接受CBP-12-gp100治疗后,小鼠肿瘤体积显著缩小。c1、c2 使用WT1表位235-245和126-134进行交叉呈递时,CLEC9A-WT1表现出显著优势。c3 尽管DEC-205-WT1可以靶向更多细胞,但CLEC9A-WT1通过交叉呈递,仅靶向CD141即可实现相同效果。d 在使用PLGA/STING@EPBM(工程化肽)处理Clec9a树突状细胞后,抗肿瘤T细胞激活和招募的关键介质IFN-β、IL-6和CXCL10的表达显著增加。
3.2 靶向T细胞
直接靶向T细胞来激活细胞毒性T细胞反应也是制备癌症纳米疫苗的一种策略。靶向T细胞的癌症纳米疫苗可以利用体内原有的树突状细胞与外界合成的仿生树突状细胞。使用纳米颗粒包裹特定肿瘤抗原即可直接靶向体内天然树突状细胞然后激活T细胞,利用仿生技术设计负载抗原的树突状细胞囊泡再导入体内也可以实现T细胞激活。
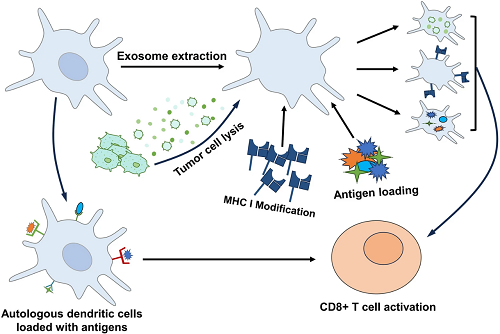
图6. 直接靶向T细胞的癌症纳米疫苗由两种类型的树突状细胞(DCs)组成。一种类型利用负载抗原的自体树突状细胞直接引发T细胞反应,而另一种通过生物仿生树突状细胞膜或树突状细胞来源的囊泡进行受体修饰和抗原负载,从而诱导T细胞反应。
3.3 靶向癌细胞
肿瘤脉管系统表面包含αvβ3和αvβ5整合素,由于它们在肿瘤脉管系统表面大量表达,αvβ3和αvβ5整合素已成为药物靶向治疗的重要靶点。SR-B1与EGFR已被证明在某些肿瘤细胞中异常过表达,其在内源性和外源性配体的识别、结合和摄取中起着关键作用。靶向SR-B1和EGFR递送细胞毒性药物、抗原和佐剂可以有效根除肿瘤,这种策略同样具有类似疫苗的特性。
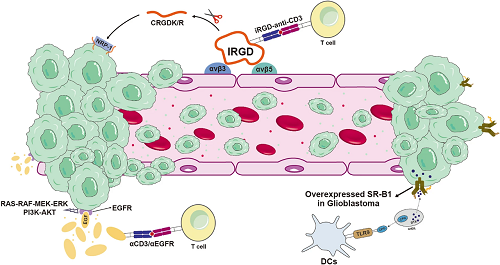
图7. iRGD可以与肿瘤组织内血管上高表达的αvβ3和αvβ5整合素结合,经过酶切生成CRGDK/R,该肽能够结合NRP-1,从而促进药物穿透癌细胞膜。此外,一些癌细胞膜上还过表达蛋白受体,如EGFR和SR-B1,它们也可以作为癌细胞的靶点。
3.4 癌症纳米疫苗联合免疫检查点阻断
免疫检查点是免疫细胞上发现的免疫抑制分子,在控制免疫激活以防止过度活跃的免疫反应中起着至关重要的作用。然而,肿瘤利用这些免疫抑制分子来逃避免疫攻击。程序性细胞死亡蛋白1(PD-1)的跨膜蛋白存在于T细胞表面,当PD-1与肿瘤细胞表面的配体PD-L1或PD-L2结合时,它会传递抑制信号,从而降低T细胞增殖和功能。这种相互作用导致T细胞耗竭,损害细胞有效杀死肿瘤细胞的能力,并使肿瘤细胞逃避免疫监视。细胞毒性T淋巴细胞抗原4(CTLA-4) 通路也存在类似的机制。当阻断PD-1、CTLA-4与其配体的结合可以消除这种抑制作用,此方法与癌症纳米疫苗联合使用后可以显著提高疗效。
3.5 混合癌症纳米疫苗(T细胞+B细胞)
癌症纳米疫苗主要依赖于抗原呈递细胞刺激T细胞免疫反应以根除肿瘤。尽管如此,B淋巴细胞对抗体介导的免疫同样至关重要,也有助于消除肿瘤。在治疗和预防传染病时,通常必须同时刺激 B 细胞和T细胞免疫,以产生持久而强大的免疫反应,这种策略也可能有益于癌症的治疗。B细胞的抗肿瘤作用依赖于其分化而来的浆细胞产生的抗体,即抗体依赖性细胞毒性效应(ADCC效应),这其中也涉及自然杀伤(NK)细胞。当特异性抗体与肿瘤细胞表面的抗原结合时,NK细胞上的Fc受体(FcγRIIIa)与这些抗体的Fc区结合。这会激活NK细胞释放细胞毒性物质,如穿孔素和颗粒酶,这些物质会破坏癌细胞的结构,导致直接细胞杀伤。还有抗体依赖性细胞吞噬作用(ADCP效应)和补体依赖性细胞毒性效应(CDC效应)也有利于杀灭癌细胞。图8详细地对ADCC效应做出了解释。
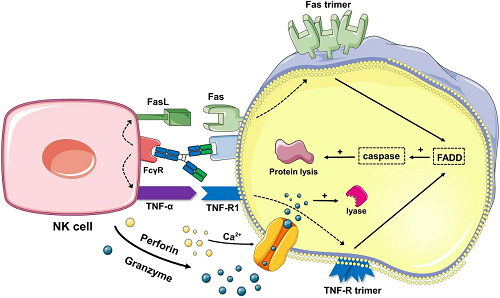
图8. ADCC机制示意图。当抗体的Fab片段与靶细胞上的受体结合时,自然杀伤细胞(NK细胞)上的Fc片段受体与抗体的Fc片段结合,触发NK细胞释放肿瘤坏死因子(TNF)并与Fas结合的FasL,诱导靶细胞上TNF-R和Fas三聚体的形成。这一激活过程导致靶细胞内Caspase蛋白的激活,切割细胞内蛋白。同时,NK细胞释放穿孔素和颗粒酶,激活Caspase蛋白。这两个过程同时进行,以杀死靶细胞。
除了ADCC效应这类直接杀伤肿瘤的手段,B细胞同样可以作为辅助性细胞释放细胞因子来促进体内的炎症和免疫反应,以此进一步增强抗肿瘤效应。图9显示在肿瘤组织血管内的B细胞可以释放IL-6、IL-2、IFN-γ、TNF等促炎因子来增强NK细胞与T细胞的作用。
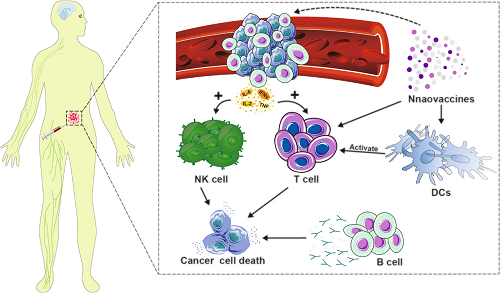
图9. 在肿瘤组织的血管内,B细胞可以产生促炎因子以激活免疫效应细胞。混合纳米疫苗可以与抗体介导的癌细胞细胞毒性协同促进这一过程。
IV 癌症纳米疫苗的临床试验与应用
目前各种高度普遍的人类癌症,如急性髓系白血病、黑色素瘤、乳腺癌、肝癌、鼻咽癌、肺癌、结直肠癌、胶质母细胞瘤和人瘤病毒相关癌症等,动物实验已证明癌症纳米疫苗在抗肿瘤治疗中具有显着疗效。而针对个体患者的独特肿瘤特征,量身定制的个性化纳米疫苗的也是一个值得探索的重要领域。针对特定单型肿瘤的治疗方法可以显着提高疗效并减少副作用,使其成为未来研究的关键领域。例如Moderna公司就正在开发一种名为 mRNA-4157/V940(NCT03897881)的个性化癌症疫苗。表格1中罗列了一些正在进行的临床试验。
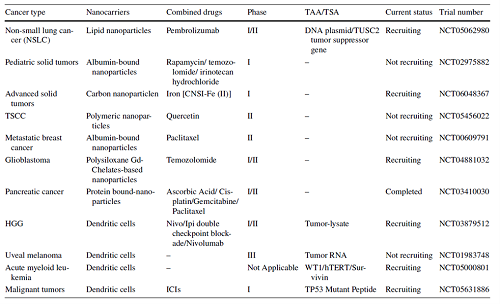
表1. 目前正在进行的癌症纳米疫苗临床试验汇总。
V 挑战与展望
癌症纳米疫苗已经在动物体内取得了良好的抗肿瘤效果,但是如何将其转化进入临床应用仍然有许多困难需要解决,包括疫苗的安全性、有效性和生物相容性等。目前对纳米疫苗的长期效果和潜在副作用的研究仍然不足,实验动物体内的靶点与人类可能不尽相同,在实验中取得的疗效不一定在人类中有相同效果,因此需要更多的长期临床数据来评估其安全性和有效性。同时纳米疫苗的生产过程可能面临规模化和标准化的困难,这可能影响其临床应用的可行性。但得益于纳米科学、材料学与生物学的不断进步,癌症纳米疫苗仍然是非常有前途的癌症免疫疗法。
作者简介

张坤
本文通讯作者
电子科技大学 教授
▍主要研究领域
超声诊疗、介入热消融、肿瘤、免疫、纳米医学、再生医学、神经调控等生物医学工程与多学科交叉方向研究。
▍个人简介
电子科技大学医学院教授、博士生导师。获国家优青、上海市青年拔尖人才、重庆巴渝学者讲座教授、上海市人才发展资金等人才计划,曾获中国抗癌协会一等奖、教育部自然科学奖一等奖、华夏医学科技奖二等奖等奖励。担任首届中国生物医药整合联盟理事、中国抗癌协会合成生物医药专业委员会常务委员等,以及Nano-Micro Letters、Asian Journal of Pharmaceutical Sciences、View-Medicine、Exploration、IRadiology、BMEMat、Brain-X等多个杂志的副主编、编委。第一或通讯在Adv Mater 、Nat Commun 等杂志发表SCI论文60余篇,5篇ESI高被引论文,2篇热点论文。
▍Email:zhang1986kun@126.com
撰稿:原文作者
编辑:《纳微快报(英文)》编辑部
关于我们

Nano-Micro Letters《纳微快报(英文)》是上海交通大学主办、在Springer Nature开放获取(open-access)出版的学术期刊,主要报道纳米/微米尺度相关的高水平文章(research article, review, communication, perspective, highlight, etc),包括微纳米材料与结构的合成表征与性能及其在能源、催化、环境、传感、电磁波吸收与屏蔽、生物医学等领域的应用研究。已被SCI、EI、PubMed、SCOPUS等数据库收录,2023 JCR IF=31.6,学科排名Q1区前3%,中国科学院期刊分区1区期刊。多次荣获“中国最具国际影响力学术期刊”、“中国高校杰出科技期刊”、“上海市精品科技期刊”等荣誉,2021年荣获“中国出版政府奖期刊奖提名奖”。欢迎关注和投稿。
Web: https://springer.com/40820
E-mail: editor@nmlett.org
Tel: 021-34207624
https://blog.sciencenet.cn/blog-3411509-1459564.html
上一篇:韩国高丽大学Dong-Wan Kim等:离子传导通道+分散疏水链助力固态锂-氧电池
下一篇:上海大学丁常胜和高彦峰等综述:钠离子电池正极材料磷酸钒钠的改性策略及研究进展