博文
羊驼抗体:阿片类药物之战的突破  精选
精选
||
羊驼抗体:阿片类药物之战的突破
诸平
据瑞士日内瓦大学(University of Geneva, UNIGE)2024年10月14日提供的消息,羊驼抗体:阿片类药物之战的突破(Llama Antibodies: A Breakthrough in the Opioid Battle)。
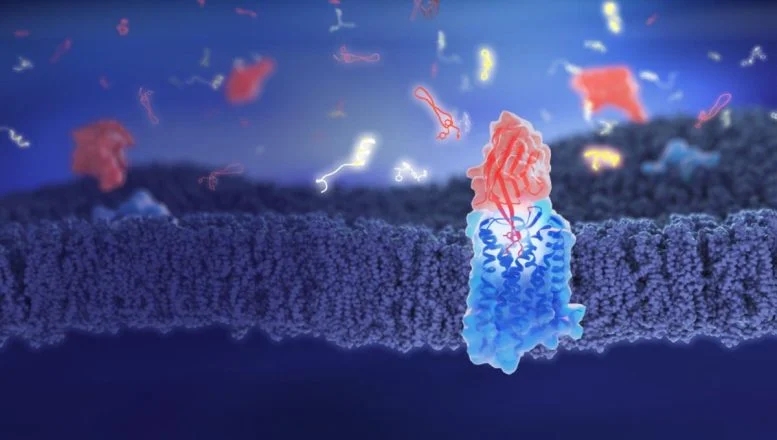
一种基于羊驼抗体(llama antibodies)的新分子可以通过阻止药物与大脑受体结合来抵消阿片类药物的作用,从而解决成瘾和过量服用的问题。
阿片类药物(Opioid medications)是非常有效的止痛药,但也有很大的风险,包括从头晕到危及生命的呼吸抑制等副作用。这些药物的滥用每年造成全世界近50万人死亡。日内瓦大学(UNIGE)的研究人员已经发现了一种名为纳米体NbE(nanobody NbE)的分子,它与阿片样物质一样强烈而持久地结合在相同的细胞受体上,有效地阻断了它们的活性。该团队还开发了更小的分子来保持这些特性,可能提供比目前减少阿片类药物副作用的方法更有效的手段。这些发现2024年10月9日在《自然通讯》(Nature Communications)杂志网站在线发表——Jun Yu, Amit Kumar, Xuefeng Zhang, Charlotte Martin, Kevin Van holsbeeck, Pierre Raia, Antoine Koehl, Toon Laeremans, Jan Steyaert, Aashish Manglik, Steven Ballet, Andreas Boland, Miriam Stoeber. Structural basis of μ-opioid receptor targeting by a nanobody antagonist. Nature Communications, 2024, 15, Article number: 8687. DOI: 10.1038/s41467-024-52947-6. Published: 09 October 2024. https://www.nature.com/articles/s41467-024-52947-6
参与此项研究的有来自瑞士日内瓦大学(University of Geneva, Geneva, Switzerland)、比利时布鲁塞尔自由大学(Vrije Universiteit Brussel, Brussels, Belgium)、比利时康诺治疗公司(Confo Therapeutics N.V., Gent, Belgium)、比利时布鲁塞尔VIB- VUB结构生物学中心(VIB-VUB Center for Structural Biology, VIB, Brussels, Belgium);美国加州大学伯克利分校(University of California, Berkeley, CA, USA)以及美国加州大学旧金山分校(University of California, San Francisco, CA, USA)的研究人员。
阿片危机(The Opioid Crisis)
阿片类(Opioids)药物包括吗啡(morphine)、芬太尼(fentanyl)和曲马多(tramadol)等药物,它们是强效止痛药,也能通过与脑神经细胞相互作用而产生欣快感。它们的高度成瘾性和严重的副作用构成了重大的健康风险。滥用天然和合成阿片类药物已导致它们成为美国最致命的药物,目前危机正在蔓延到欧洲。
“我们的新分子有可能逆转或减少阿片类药物的有害副作用。”发起并协调这个项目UNIGE医学院细胞生理学和代谢系(Department of Cell Physiology and Metabolism at UNIGE Faculty of Medicine)副教授Miriam Stoeber解释说:“我们迫切需要开发新的分子,以更好地减轻患者的副作用,并管理阿片类药物过量的风险。要了解分子是如何工作的,我们需要知道它是如何影响脑细胞的。在我们的研究中,我们使用了从美洲驼抗体(llama antibodies)中提取的微小天然蛋白质,称为纳米体(nanobodies),旨在与细胞表面的目标受体特异性结合。”
纳米体NbE增强的结合和阻断作用(Enhanced Binding and Blocking by the Nanobody NbE)
UNIGE的研究人员发现,一种正在研究的纳米体NbE具有一种独特的能力,可以与特定的阿片受体紧密而持久地结合,从而阻止阿片受体与这些受体结合,从而阻断阿片类药物的活性。“为了确定NbE如何与目标结合,我们使用了高分辨率的结构生物学方法,这要归功于新的杜波切特成像中心(Dubochet Centre for Imaging),”UNIGE理学院分子和细胞生物学系(Department of Molecular and Cellular Biology at UNIGE Faculty of Science)助理教授、也是上述研究论文的合作者安德里亚斯·博兰(Andreas Boland)描述道。
“我们发现了一种独特的结合模式,其中只有一小部分纳米体负责其正确的受体选择性。精确地知道纳米体的哪个部分处于危险之中,使我们能够想象出用药物诱导相同效果的新方法。”
开发更小、更有效的分子(Development of Smaller, More Effective Molecules)
纳米体虽然比抗体小得多,但仍然相当大。它们的生产成本很高,而且可能无法完全到达体内的目标组织。UNIGE研究小组与来自布鲁塞尔大学的史蒂文·巴莱(Steven Ballet)教授团队合作,在体外合成了一组更小的分子,模拟NbE的关键部分,负责选择与阿片受体结合。
通过持久地阻断阿片受体,我们的新分子有可能逆转或减少阿片样物质的有害副作用。在过量服用的情况下,它们可以提供比目前使用的纳洛酮(naloxone)更好、更持久的选择。
Miriam Stoeber总结道:“我们现在将改进它们的结构,以进一步提高它们的效率,并促进它们向大脑中目标神经细胞的传递。”
这项工作得到了瑞士国家科学基金会{Swiss National Science Foundation (PCEFP3_181282, 310030_185235 and TMSGI3_211581)}、瑞士赫尔穆特·霍尔滕基金会(Helmut Horten Foundation Switzerland)、瑞士Boninchi基金会(Boninchi Foundation)、EMBO青年研究者计划(EMBO Young Investigator Programme)、瑞士联邦外国学生奖学金委员会颁发的瑞士政府优秀博士奖学金{Swiss Government Excellence PhD Scholarship (ESKAS-2021.0329) of the Swiss Federal Commission for Scholarships for Foreign Students}、布鲁塞尔自由大学研究委员会通过战略研究计划{Research Council of the Vrije Universiteit Brussel for the financial support through the Strategic Research Program (SRP50 and SRP95)}、弗兰德斯研究基金会{Research Foundation Flanders (FWO) Hercules MZW OZR3939 grant}以及美国国立卫生研究院(National Institutes of Health R01-GM129325)的资助或支持。
上述介绍,仅供参考。欲了解更多信息,敬请注意浏览原文或者相关报道。
The μ-opioid receptor (μOR), a prototypical G protein-coupled receptor (GPCR), is the target of opioid analgesics such as morphine and fentanyl. Due to the severe side effects of current opioid drugs, there is considerable interest in developing novel modulators of μOR function. Most GPCR ligands today are small molecules, however biologics, including antibodies and nanobodies, represent alternative therapeutics with clear advantages such as affinity and target selectivity. Here, we describe the nanobody NbE, which selectively binds to the μOR and acts as an antagonist. We functionally characterize NbE as an extracellular and genetically encoded μOR ligand and uncover the molecular basis for μOR antagonism by determining the cryo-EM structure of the NbE-μOR complex. NbE displays a unique ligand binding mode and achieves μOR selectivity by interactions with the orthosteric pocket and extracellular receptor loops. Based on a β-hairpin loop formed by NbE that deeply protrudes into the μOR, we design linear and cyclic peptide analogs that recapitulate NbE’s antagonism. The work illustrates the potential of nanobodies to uniquely engage with GPCRs and describes lower molecular weight μOR ligands that can serve as a basis for therapeutic developments.
https://blog.sciencenet.cn/blog-212210-1455624.html
上一篇:被发现在42篇论文中伪造数据的化学家亀田直弘开始撤回论文
下一篇:索尔·纽曼博士及其发现活到110岁的秘诀