博文
免疫细胞被认为是肠道中的“代谢工厂”
||
免疫细胞被认为是肠道中的“代谢工厂”
诸平

Fig. 2 A research team from MedUni Vienna and the FWF-sponsored Special Research Area SFB F83
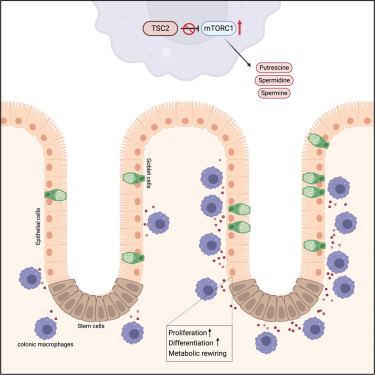
Fig. 3 Graphical abstract
据奥地利维也纳医科大学(Medical University of Vienna简称MedUni Vienna, Vienna, Austria)2023年10月10日提供的消息,来自奥地利、比利时(Belgium)以及芬兰(Finland)的研究人员组成的免疫代谢研究小组,现已首次证明了巨噬细胞(macrophages)在肠道细胞更新中的核心作用,这揭示了免疫细胞和组织再生之间复杂的相互作用(详见Immune cells identified as ’metabolic factories’ in the gut)。
特别是,可以描述巨噬细胞大量产生代谢物亚精胺(spermidine)和精胺(spermine),从而有益于器官中的其他组织细胞。结果,组织细胞不再需要自己产生这些物质,并且能够更好地执行其适当的功能。对巨噬细胞“共生代谢”("commensal metabolism")的首次描述2023年10月6日已经在《细胞代谢》(Cell Metabolism)杂志网站发表——Stephanie Deborah Fritsch, Nyamdelger Sukhbaatar, Karine Gonzales, Alishan Sahu, Loan Tran, Andrea Vogel, Mario Mazic, Jayne Louise Wilson, Stephan Forisch, Hannah Mayr, Raimund Oberle, Jakob Weiszmann, Martin Brenner, Roeland Vanhoutte, Melanie Hofmann, Sini Pirnes-Karhu, Christoph Magnes, Torben Kühnast, Wolfram Weckwerth, Christoph Bock, Kristaps Klavins, Markus Hengstschläger, Christine Moissl-Eichinger, Gernot Schabbauer, Gerda Egger, Eija Pirinen, Steven H.L. Verhelst, Thomas Weichhart. Metabolic support by macrophages sustains colonic epithelial homeostasis. Cell Metabolism, 2023. DOI: 10.1016/j.cmet.2023.09.010. Available online 6 October 2023. https://doi.org/10.1016/j.cmet.2023.09.010
参与此项研究的有来自奥地利维也纳医科大学、维也纳大学(University of Vienna, Vienna, Austria)、奥地利格拉茨医科大学(Medical University of Graz, Graz, Austria)、奥地利维也纳奥地利科学院分子医学CeMM研究中心(CeMM Research Center for Molecular Medicine of the Austrian Academy of Sciences, Vienna, Austria)、奥地利维也纳玻尔兹曼应用诊断学研究所(Ludwig Boltzmann Institute Applied Diagnostics简称LBI AD, Vienna, Austria)、奥地利维也纳类风湿性关节炎和多发性硬化症精氨酸代谢克里斯蒂安多普勒实验室(Christian Doppler Laboratory Arginine Metabolism in Rheumatoid Arthritis and Multiple Sclerosis, Vienna, Austria);芬兰赫尔辛基大学(University of Helsinki, Helsinki, Finland)、芬兰奥卢大学(University of Oulu, Oulu, Finland)、芬兰奥卢大学医院(Oulu University Hospital, Oulu, Finland);比利时鲁汶大学(KU Leuven, Leuven, Belgium)等机构的研究人员。
肠道负责消化食物和吸收营养,依靠单层上皮细胞(表面细胞)来维持肠道屏障的完整性。这些细胞每4~7天就会完全更新一次。这一过程对于保护身体免受微生物威胁、维持肠道功能以及预防炎症性肠病和结肠癌等疾病至关重要。
巨噬细胞是存在于身体每个器官中的免疫细胞。由维也纳医科大学病理生物化学和遗传学中心(MedUni Vienna’s Center for Pathobiochemistry and Genetics)、SFB免疫代谢(SFB Immunometabolism)协调员托马斯·韦克哈特(Thomas Weichhart)领导的研究小组发现,结肠中的巨噬细胞战略性地位于靠近肠上皮细胞(epithelial cells)的位置。研究人员发现了这些巨噬细胞支持上皮细胞增殖的关键机制。这种代谢支持在增殖应激时期尤其重要,例如炎症相关的结肠炎。
该研究的第一作者斯蒂芬妮·弗里奇(Stephanie Fritsch)评论道:“我们能够证明巨噬细胞通过mTORC1信号通路产生大量的多胺亚精胺和精胺(polyamines spermidine and spermine)”。这些多胺被上皮细胞吸收,导致细胞代谢发生转变,促进其增殖并加强其防御机制。精胺对结肠细胞的增殖尤其具有重要的刺激作用。重要的是,这种mTORC1激活和多胺产生对动物模型中的炎症性肠损伤具有保护作用。多胺尤其是亚精胺已经被大量研究了一段时间,因为研究表明这些物质可以延长寿命并减缓衰老过程。
巨噬细胞支持其他细胞的新陈代谢(Macrophages support the metabolism of other cells)
这项研究代表了理解肠道微环境的范式转变。它首次强调巨噬细胞是支持其他细胞新陈代谢的“代谢工厂”("metabolic factories"),这对于肠上皮的有效自我更新至关重要。此外,该研究还为炎症性肠病和其他与肠道功能障碍相关的疾病的潜在治疗靶点提供了见解。
为组织再生和肠道疾病的新疗法铺平道路(Paving the way for new therapies for tissue regeneration and intestinal diseases)
托马斯·韦克哈特表示:“感谢奥地利科学基金(FWF)在这一特殊研究领域框架内的支持,这些发现才成为可能。” SFB F83免疫代谢包括来自维也纳和格拉茨的小组,他们正在研究组织细胞和巨噬细胞的代谢相互作用。这项研究的结果为未来的研究开辟了有希望的途径。研究人员可能会研究巨噬细胞介导的代谢支持的操纵,作为增强组织再生和对抗肠道疾病的策略。此外,进一步研究多胺和mTORC1信号在免疫细胞中的作用可能会揭示新的治疗方法。托马斯·韦克哈特表示:“这些结果代表着我们在更好地了解肠道和改善人类健康方面向前迈出了重要一步。”
本研究得到了以下资金来源的支持:奥地利科学基金(Austrian Science Fund简称FWF)拨款(P34266-B, P34023-B ); FWF特殊研究领域SFB F83 (FWF Sonderforschungsbereich SFB F83); 维也纳科学技术基金(Vienna Science and Technology Fund简称WWTF grant LS18-058)拨款;克里斯蒂安多普勒实验室类风湿性关节炎和多发性硬化症的精氨酸代谢(Christian Doppler Laboratory Arginine Metabolism in Rheumatoid Arthritis and Multiple Sclerosis)以及奥地利科学院博士奖学金(DOC fellowship of the Austrian Academy of Sciences)的支持。
上述介绍,仅供参考。欲了解更多信息,敬请注意浏览原文或者相关报道。
• Macrophages are located directly adjacent to epithelial crypt cells in mice
• Activation of mTORC1 in macrophages induces polyamine synthesis
• Epithelial cells take up the polyamines, which supports their proliferation
• Macrophage-derived polyamines support the metabolic rewiring of colonic epithelial cells
The intestinal epithelium has a high turnover rate and constantly renews itself through proliferation of intestinal crypt cells, which depends on insufficiently characterized signals from the microenvironment. Here, we showed that colonic macrophages were located directly adjacent to epithelial crypt cells in mice, where they metabolically supported epithelial cell proliferation in an mTORC1-dependent manner. Specifically, deletion of tuberous sclerosis complex 2 (Tsc2) in macrophages activated mTORC1 signaling that protected against colitis-induced intestinal damage and induced the synthesis of the polyamines spermidine and spermine. Epithelial cells ingested these polyamines and rewired their cellular metabolism to optimize proliferation and defense. Notably, spermine directly stimulated proliferation of colon epithelial cells and colon organoids. Genetic interference with polyamine production in macrophages altered global polyamine levels in the colon and modified epithelial cell proliferation. Our results suggest that macrophages act as “commensals” that provide metabolic support to promote efficient self-renewal of the colon epithelium.
https://blog.sciencenet.cn/blog-212210-1405545.html
上一篇:癌症研究:代谢驱动肿瘤发展
下一篇:元素周期表之外:超重元素和超密度小行星