博文
新发现为听力损失治疗铺平道路
||
新发现为听力损失治疗铺平道路
诸平
Fig. 2 Graphical abstract
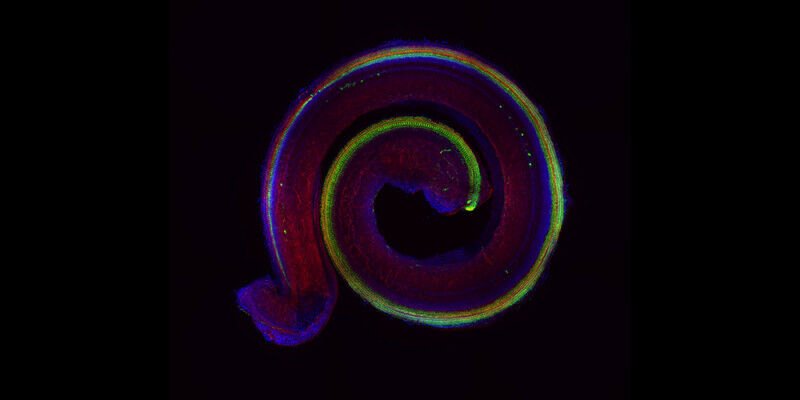
据瑞士巴塞尔大学(University of Basel)2023年10月5日提供的消息,随着年龄的增长,我们中的许多人最终将需要助听器。在某些情况下,其原因可能是控制听觉感觉细胞功能并随着年龄的增长而下调的信号通路。巴塞尔大学的研究人员正在寻找线索。上述由巴塞尔大学生物医学系(University of Basel, Department of Biomedicine)毛里齐奥·科塔达(Maurizio Cortada)提供的图片,是小鼠耳蜗的荧光显微图像。毛细胞用绿色标记,细胞骨架用红色标记,带有遗传物质的细胞核用蓝色标记。
听力损失最终会影响几乎每个人:大声的噪音或简单的衰老逐渐导致内耳的听觉感觉细胞及其突触退化和死亡。唯一的治疗选择是助听器,或者在极端情况下,植入人工耳蜗。
巴塞尔大学生物医学系和巴塞尔大学医院的毛里齐奥·科塔达博士解释说:“为了开发新疗法,我们需要更好地了解听觉感觉细胞需要什么才能发挥正常功能。”毛里齐奥·科塔达与巴塞尔大学Biozentrum的迈克尔·哈尔(Michael N. Hall)教授的研究小组合作,研究了哪些信号通路影响内耳中所谓的感觉“毛细胞”(“hair cells”)。在此过程中,研究人员发现了一个中央调节器(central regulator),相关研究结果于2023年8月19日已经在《iScience》杂志网站发表——Maurizio Cortada, Soledad Levano, Michael N. Hall, Daniel Bodmer. mTORC2 regulates auditory hair cell structure and function. iScience, 2023, 26(9): 107687. DOI: 10.1016/j.isci.2023.107687. Published: August 19, 2023. https://doi.org/10.1016/j.isci.2023.107687.
该信号通路被研究人员称为 mTORC2 信号通路,在细胞生长和细胞骨架等方面发挥着重要作用。此前尚未研究过它在内耳毛细胞中发挥的作用。
当研究人员去除小鼠内耳毛细胞中这一信号通路的中心基因时,动物逐渐丧失了听力。作者在研究中报告说,到12周大时,他们就完全失聪了。
更少的突触(Fewer synapses)
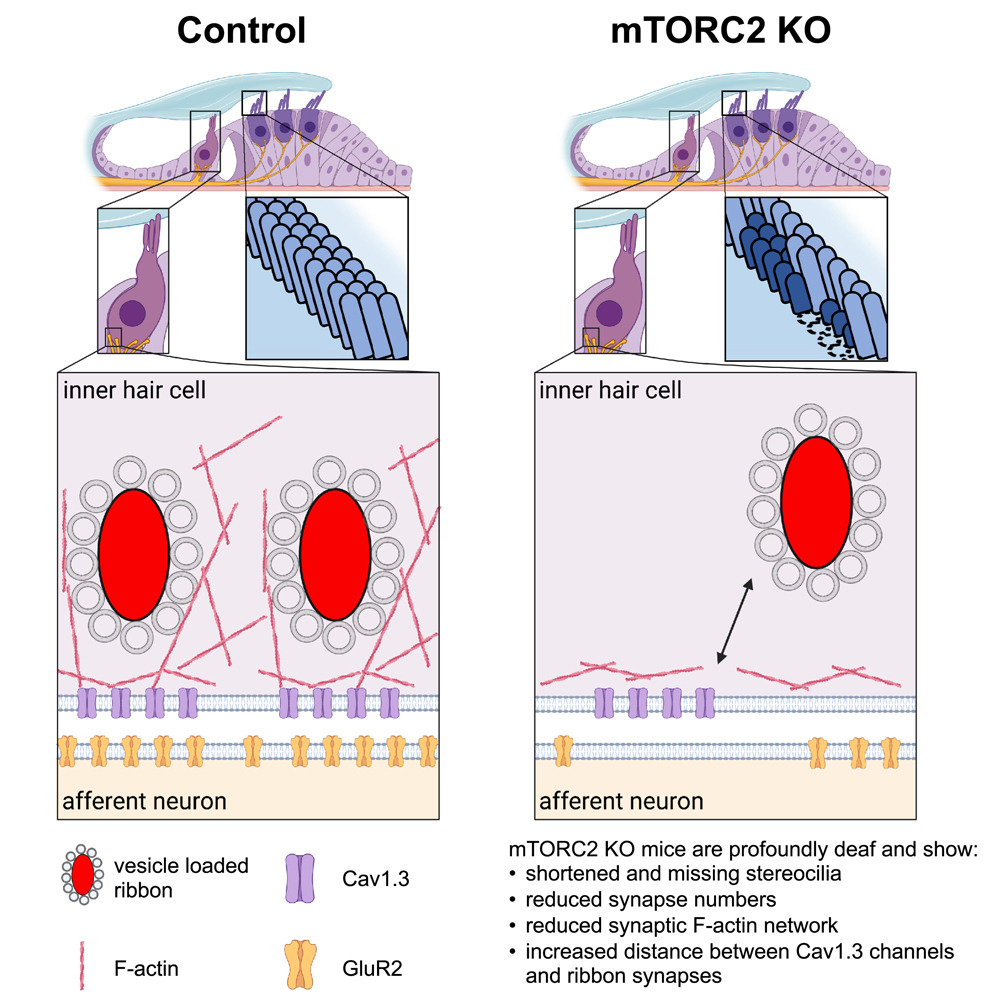
更仔细的检查表明,如果没有 mTORC2 信号通路,内耳的感觉毛细胞就会失去传感器:毛细胞具有类似于微小毛发的突起,对于将声音转换为神经信号非常重要。研究人员使用电子显微镜确定,这些“微小的毛发”被缩短了。向听觉神经传输信号的突触数量也减少了。
“从其他研究中,我们知道该信号通路中关键蛋白质的产生随着年龄的增长而减少,”毛里齐奥·科塔达解释道。随着年龄的增长,听力损失可能与突触丧失和内耳听觉感觉细胞功能下降有关。
研究人员说:“如果这一点得到证实,这将成为未来治疗的可能起点。” 例如,中耳和内耳可以很容易地进行局部药物或基因治疗。此研究结果可能为开发此类治疗方案铺平道路。
本研究由瑞士国家科学基金会(Swiss National Science Foundation简称SNSF)资助,本研究论文第一作者毛里齐奥·科塔达获得瑞士国家医学博士奖学金(323530_191222),本研究并得到了瑞士巴塞尔大学医学院的AlumniMedizin资助。
上述介绍,仅供参考。欲了解更多信息,敬请注意浏览原文或者相关报道。
• mTORC2 knockout (KO) in sensory hair cells (HCs) leads to profound hearing loss
• HC loss occurs only secondary to hearing loss in mTORC2 KO mice
• mTORC2 KO in HCs leads to stereocilia shortening and synaptic defects
•mTORC2 KO in HCs reduces synaptic actin cytoskeleton and disorganizes Ca2+ channels
mTOR broadly controls cell growth, but little is known about the role of mTOR complex 2 (mTORC2) in the inner ear. To investigate the role of mTORC2 in sensory hair cells (HCs), we generated HC-specific Rictor knockout (HC-RicKO) mice. HC-RicKO mice exhibited early-onset, progressive, and profound hearing loss. Increased DPOAE thresholds indicated outer HC dysfunction. HCs are lost, but this occurs after hearing loss. Ultrastructural analysis revealed stunted and absent stereocilia in outer HCs. In inner HCs, the number of synapses was significantly decreased and the remaining synapses displayed a disrupted actin cytoskeleton and disorganized Ca2+ channels. Thus, the mTORC2 signaling pathway plays an important role in regulating auditory HC structure and function via regulation of the actin cytoskeleton. These results provide molecular insights on a central regulator of cochlear HCs and thus hearing.
https://blog.sciencenet.cn/blog-212210-1404781.html
上一篇:2023年诺贝尔化学奖简介及其他
下一篇:2023年诺贝尔文学奖授予挪威作家乔恩·福斯