博文
《自然》:受体“爆破”可视化
||
《自然》:受体“爆破”可视化
诸平
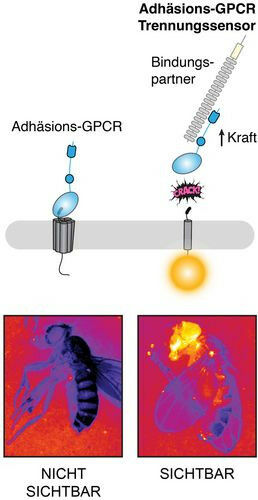
Fig. 2 Professor Tobias Langenhan. Photo: Swen Reichhold, Leipzig University
Fig. 3 Dr Nicole Scholz. Photo: Martin Scholz
据德国莱比锡大学(Leipzig University)2023年3月14日提供的消息,该校的研究人员与德国图宾根大学(University of Tübingen, Germany)的研究人员合作研究,使受体“爆破”可视化(Receptor ’blasting’ visualised)。
粘附GPCRs(Adhesion G-protein-coupled receptors)是一组与许多身体功能和疾病相关的G蛋白偶联受体(G protein coupled receptors)的简称。然而,它们尚未得到充分研究以用于治疗。莱比锡大学医学院鲁道夫·肖恩海默生化研究所(Rudolf Schönheimer Institute of Biochemistry, Division of General Biochemistry, Medical Faculty, Leipzig University)的两个研究小组现在联合开发了一项技术来改变这一现状。新颖的NRS(NTF Release Sensor)技术捕获了以前对研究人员隐藏的粘附GPCRs(Adhesion GPCRs简称aGPCRs)的独特分子开关事件。这些重要发现2023年3月8日已经在著名的科学期刊《自然》(Nature)杂志网站发表——Nicole Scholz, Anne-Kristin Dahse, Marguerite Kemkemer, Anne Bormann, Genevieve M. Auger, Fernando Vieira Contreras, Lucia F. Ernst, Hauke Staake, Marek B. Körner, Max Buhlan, Amelie Meyer-Mölck, Yin Kwan Chung, Beatriz Blanco-Redondo, Franziska Klose, Mohamed Ali Jarboui, Dmitrij Ljaschenko, Marina Bigl, Tobias Langenhan. Molecular sensing of mechano- and ligand-dependent adhesion GPCR dissociation. Nature, Published: 08 March 2023. DOI: 10.1038/s41586’023 -05802-5. https://www.nature.com/articles/s41586-023-05802-5
上述图1(Fig. 1)是aGPCRs的外观(左)和NRS技术的功能原理(右)。果蝇神经系统揭示了aGPCR何时、何地以及如何分离(底部图示)。
大约40%的药物作用于GPCRs,可以缓解甚至治愈多种疾病。它们包括用于治疗帕金森病(Parkinson’s disease)、疼痛、高血压和过敏症的化合物。GPCRs很容易让药物到达,因为它们位于细胞表面。此外,身体及其器官中的每个细胞都具有非常特殊的GPCR模式,这意味着GPCR药物的副作用可以得到很好的限制。“然而,在拥有700多个成员的GPCR类的一个大家族中,即粘附GPCRs (aGPCRs),仍然是未知的药理学和制药领域。这些分子与多种疾病有关,从癌症到精神疾病(psychiatric disorders),”尼科尔·舒尔茨博士(Dr Nicole Scholz, Fig. 3)解释说。尼科尔·舒尔茨是鲁道夫·肖恩海默生化研究所普通生物化学的主席,也是这项新研究的两位领导者之一。
aGPCRs是一大类表面蛋白,可识别体内的化学和机械刺激。它们尚未被开发用于治疗药物。aGPCRs具有双组分结构和独特的激活机制。来自莱比锡大学的科学家现在提出了一种分子传感器系统,可用于活生物体和细胞培养皿中,以检测某种aGPCR何时何地因机械刺激而分裂,从而分离这两种成分。这种断裂可以激活受体,因此在生化信号的传递中起着至关重要的作用。尼科尔·舒尔茨博士和托拜厄斯·朗恩汉(Tobias Langenhan, Fig. 2)教授与莱比锡大学技术转让办公室(Technology Transfer Office of Leipzig University)密切合作,为这项技术申请了专利。其目的是为新发现提供法律保护,并帮助将目前可用的aGPCR药物鉴定方法推向实际应用。
重要的生物过程(Important biological process)
“有一种观点认为许多aGPCRs像手榴弹一样被激活。一种aGPCR的两个部分就像安全别针和炸药。当安全别针被机械刺激和受体结合分子移除时,炸药以受体活性的形式武装起来。通过我们的工作,我们现在可以提供一种使这种机制可见的方法。特别是,我们已经能够显示受体分离发生在哪些细胞中以及发生在什么条件下,”鲁道夫·肖恩海默生化研究所普通生物化学教授托拜厄斯·朗恩汉说。他与尼科尔·舒尔茨博士共同负责这项研究。
尼科尔·舒尔茨博士补充说:“我们已经成功地可视化了活体动物果蝇中一个大型受体家族的重要生物学过程。未来的项目将包括将这些发现转化为人类aGPCR。在最好的情况下,从长远来看,我们将能够找到调节这些受体活性的化合物,并开发出可以治疗aGPCR相关疾病症状的药物。”
正是对于这个项目,发明者现在已被德国联邦教育和研究部推荐资助,这将使他们能够深化他们目前的发现并验证商业用途的过程。“作为研究中心的莱比锡大学对NRS工艺的发展具有重要意义。它汇集了世界上可能数量最多的研究小组,致力于aGPCRs研究,并提供了一个关键的科学环境,”托拜厄斯·朗恩汉教授说。
这项工作得到了德国研究基金会{Deutsche Forschungsgemeinschaft through FOR2149, project numbers 265903901 (project P01) and 265996823 (project P03) and through CRC 1423, project number 421152132 (projects A06 and B06) ; and by a junior research grant from the Faculty of Medicine, Leipzig University}的资助。
上述介绍,仅供参考。欲了解更多信息,敬请注意浏览原文或者相关报道。
Adhesion G-protein-coupled receptors (aGPCRs) bear notable similarity to Notch proteins1, a class of surface receptors poised for mechano-proteolytic activation2,3,4, including an evolutionarily conserved mechanism of cleavage5,6,7,8. However, so far there is no unifying explanation for why aGPCRs are autoproteolytically processed. Here we introduce a genetically encoded sensor system to detect the dissociation events of aGPCR heterodimers into their constituent N-terminal and C-terminal fragments (NTFs and CTFs, respectively). An NTF release sensor (NRS) of the neural latrophilin-type aGPCR Cirl (ADGRL)9,10,11, from Drosophila melanogaster, is stimulated by mechanical force. Cirl-NRS activation indicates that receptor dissociation occurs in neurons and cortex glial cells. The release of NTFs from cortex glial cells requires trans-interaction between Cirl and its ligand, the Toll-like receptor Tollo (Toll-8)12, on neural progenitor cells, whereas expressing Cirl and Tollo in cis suppresses dissociation of the aGPCR. This interaction is necessary to control the size of the neuroblast pool in the central nervous system. We conclude that receptor autoproteolysis enables non-cell-autonomous activities of aGPCRs, and that the dissociation of aGPCRs is controlled by their ligand expression profile and by mechanical force. The NRS system will be helpful in elucidating the physiological roles and signal modulators of aGPCRs, which constitute a large untapped reservoir of drug targets for cardiovascular, immune, neuropsychiatric and neoplastic diseases13.
https://blog.sciencenet.cn/blog-212210-1380722.html
上一篇:《科学》:探索奇怪金属的特性
下一篇:“反传态”:量子突破为世界上第一个实验虫洞铺平了道路

