博文
免疫疗法:对抗耐药肿瘤的新型二合一武器
||
免疫疗法:对抗耐药肿瘤的新型二合一武器
诸平
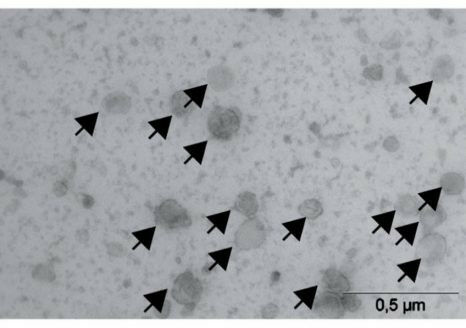
据法国国家健康与医学研究院(Institut de la santé et de la recherche médicale简称INSERM)2023年1月17日报道,免疫疗法是对抗耐药肿瘤的新型二合一武器(Immunotherapy: a new two-in-one weapon against resistant tumors)。上图是由居里研究所(Institut Curie)的尼古拉斯·马内尔博士的团队(Dr Nicolas Manel’s team)开发的新型抗癌免疫治疗药物cGAMP-VLP,图像上由箭头指示的大球体就是电子显微镜图像显示的cGAMP-VLP。
踩下油门踏板同时抬起刹车是法国国家健康与医学研究院(INSERM) 居里研究所免疫和癌症研究部(Immunity and Cancer Unit, Institut Curie, INSERM)的研究员兼团队负责人尼古拉斯·马内尔博士为提高对免疫疗法的反应而提出的创新想法。几年来,研究人员已经确定了一种信号通路-STING-它对于加速对免疫疗法的反应至关重要。2023年元月中旬,该团队又迈出了新的一步,确定了一种能够特异性激活免疫系统关键细胞中的STING的新型生物药物。这项工作于2023年1月13日已经在《科学免疫学》(Science Immunology)杂志网站发表——Bakhos Jneid, Aurore Bochnakian, Caroline Hoffmann, Fabien Delisle, Emeline Djacoto, Philémon Sirven, Jordan Denizeau, Christine Sedlik, Yohan Gerber-Ferder, Frédéric Fiore, Ramazan Akyol, Carine Brousse, Robert Kramer, Ian Walters, Sylvain Carlioz, Hélène Salmon, Bernard Malissen, Marc Dalod, Eliane Piaggio, Nicolas Manel. Selective STING stimulation in dendritic cells primes antitumor T cell responses. Science Immunology, January 13, 2023, 8(79). DOI: 10.1126/sciimmunol.abn6612. https://www.science.org/doi/10.1126/sciimmunol.abn6612
参与此项研究的有来自巴黎文理研究大学(Paris Sciences et Lettres–PSL Research University, Paris, France)和法国艾克斯·马赛大学(Aix Marseille Université, INSERM, CNRS, Marseille, France)的研究人员。此研究为开发新策略和提高癌症免疫疗法的有效性开辟了有希望的治疗前景。
免疫疗法是一种抗癌策略,在过去15年里一直是新闻报道的焦点。在接受治疗的患者中,它产生了惊人的效果,但50%~80%的患者对这些治疗没有反应。在居里研究所,由INSERM研究主任尼古拉斯·马内尔博士领导的先天免疫团队(Innate Immunity team)刚刚开发出一种创新策略,可以很好地改变这些患者的状况。
研究人员使用机械比喻来解释当前的抗检查点免疫疗法(anti-checkpoint immunotherapies)是如何工作的:“这些疗法解除了免疫系统的‘刹车’,将患者的癌细胞识别为要被摧毁的细胞(没有这些抑制剂,免疫系统就无法攻击癌细胞)。但只有当免疫系统有一个“天然油门踏板”来攻击这些细胞时,它们才会起作用。这个油门踏板与一种叫做 STING 的生化途径有关,并且在50%~80%的患者中缺失。”
了解基本机制(Understand the fundamental mechanisms)
大约五年前,研究人员才意识到STING的油门作用。制药公司立即开发小分子来激活 STING。尽管他们的结果在体外令人信服,但在临床上却令人失望。
在居里研究所,尼古拉斯·马内尔博士和他的团队回到基础来破译所涉及的整个级联事件:“我们的研究表明,STING必须在某些细胞(树突细胞)中被选择性激活,才能产生加速作用,而在其他细胞中激活STING会破坏免疫反应。
研究人员使用假病毒颗粒(类似于病毒但不具有传染性),因为它们可以被树突状细胞有效捕获。然后,他们将激活STING的天然分子cGAMP置于颗粒内部。由此产生的药物名为 cGAMP-VLP,优先激活树突状细胞中的 STING,而不会对其他免疫系统细胞产生负面影响。这些活化的树突细胞因此训练淋巴细胞识别肿瘤抗原。因此,研究人员确定了一种非常抢手的能够激活油门踏板的治疗产品!
“在不同的系统(体外、动物和人类肿瘤样本)中进行了测试,这种策略显示出很强的抗肿瘤作用,即使在低剂量下也是如此。与抗检查点免疫疗法相结合,它甚至更有效,”尼古拉斯·马内尔说。
因此,对他来说,是时候向患者提供这种新的治疗武器了。这是他与他人共同创立的生物技术公司Stimunity的目标,通过目前的筹资,该公司可以启动这种创新免疫疗法的临床开发。
如果这些结果在人类身上得到证实,就有可能在不进行化学疗法或放射疗法的情况下攻击对所有已知疗法具有抗药性的癌症。
该研究得到了欧洲研究理事会(H2020 European Research Council: ERC-2016-P)、英国微循环学会(British Microcirculation Society: ANR-10-IDEX-0001-02 PSL, ANR-11-LABX-0043)以及投资通道计划PHENOMIN法国国家基础设施(Investissement Avenir program PHENOMIN French National Infrastructure: ANR10-INBS-07)资助或支持。
上述介绍,仅供参考。欲了解更多信息,敬请注意浏览原文或者相关报道。
T cells that recognize tumor antigens are crucial for mounting antitumor immune responses. Induction of antitumor T cells in immunogenic tumors depends on STING, the intracellular innate immune receptor for cyclic guanosine monophosphate–adenosine monophosphate (cGAMP) and related cyclic dinucleotides (CDNs). However, the optimal way to leverage STING activation in nonimmunogenic tumors is still unclear. Here, we show that cGAMP delivery by intratumoral injection of virus-like particles (cGAMP-VLP) led to differentiation of circulating tumor-specific T cells, decreased tumor regulatory T cells (Tregs), and antitumoral responses that synergized with PD1 blockade. By contrast, intratumoral injection of the synthetic CDN ADU-S100 led to tumor necrosis and systemic T cell activation but simultaneously depleted immune cells from injected tumors and induced minimal priming of circulating tumor-specific T cells. The antitumor effects of cGAMP-VLP required type 1 conventional dendritic cells (cDC1), whereas ADU-S100 eliminated cDC1 from injected tumors. cGAMP-VLP preferentially targeted STING in dendritic cells at a 1000-fold smaller dose than ADU-S100. Subcutaneous administration of cGAMP-VLP showed synergy when combined with PD1 blockade or a tumor Treg-depleting antibody to elicit systemic tumor-specific T cells and antitumor activity, leading to complete and durable tumor eradication in the case of tumor Treg depletion. These findings show that cell targeting of STING stimulation shapes the antitumor T cell response and identify a therapeutic strategy to enhance T cell–targeted immunotherapy.
Activating the STING in tumor dendritic cells
Agents that activate the DNA-sensing cGAS-STING pathway have been explored for cancer immunotherapy in both preclinical and clinical settings, but how to optimally activate the pathway remains unclear. Jneid et al. found that incorporation of the naturally occurring STING ligand cyclic guanosine monophosphate-adenosine monophosphate (cGAMP) into non-infectious enveloped virus-like particles (VLPs) selectively activates STING in antigen-presenting cells (APCs) including dendritic cells when administered intratumorally. Compared to a non-targeted synthetic STING agonist, VLPs delivering cGAMP systemically enhanced tumor-specific T cell responses and anti-tumor effects during immune checkpoint blockade in mice. These results demonstrate that selectively targeting STING agonists to APCs may improve their therapeutic effects, particularly in poorly immunogenic tumors. —CO
https://blog.sciencenet.cn/blog-212210-1372579.html
上一篇:研究人员开发出一种依靠光合作用运行的活“生物太阳能电池”
下一篇:科学家解开大自然超选择性结合的秘密