博文
Phenomics | 四川大学华西医院张立和李为民团队利用Hi-C技术鉴定揭示了肺腺癌组织中的晚期结构变异
|
近日,《表型组学》(Phenomics)在线发表了四川大学华西医院张立和李为民团队题为Integrative Identification by Hi-C Revealed Distinct Advanced Structural Variations in Lung Adenocarcinoma Tissue的研究论文。

扫二维码|查看原文
论文DOI链接:
https://link.springer.com/article/10.1007/s43657-023-00103-3
论文pdf链接:
https://link.springer.com/content/pdf/10.1007/s43657-023-00103-3.pdf?pdf=button
引用格式:
Song, T., Yao, M., Yang, Y. et al. Integrative Identification by Hi-C Revealed Distinct Advanced Structural Variations in Lung Adenocarcinoma Tissue. Phenomics 3, 390–407 (2023). https://doi.org/10.1007/s43657-023-00103-3
研究背景
目前,Hi-C技术已在多种肿瘤细胞系中应用,以检测染色质结构变异。例如,已有研究在多发性骨髓瘤(MM)细胞系(RPMI-8226和U266)中,通过结合ChIP-seq和全基因组序列(WGS),检测到超过100个染色体相互作用以及与MAPK信号通路和细胞因子-细胞因子受体相互作用通路密切相关的A/B间隔区室[1]。在对前列腺癌的研究中,对正常前列腺上皮细胞系PrEC和两种前列腺癌细胞系(PC3和LNCaP)进行Hi-C和WGS检测则发现肿瘤细胞中TADs数量更多,拷贝数变化与新的TADs 的形成有关[2]。在另一项关于前列腺癌的研究中,研究者揭示了前列腺癌细胞系(C42B和22Rv1)中特异的增强子-启动子环[3]。这些结果表明,高级结构变异(A/B区室、TADs和染色质环)可能在肿瘤的发生发展中发挥重要作用。
然而,以往的研究仍有一定的局限性。以往针对肿瘤的染色质结构变化的研究几乎都是针对肿瘤细胞系,而不是来自临床患者的肿瘤组织,而肿瘤细胞系中的分子事件并不能反映肿瘤发展的真实情况。因此我们对恶性肿瘤的高级结构变异的了解仍然很少,不同肿瘤组织类型之间染色质相互作用模式的变化尚不明确,且其与基因调控的功能关系仍有待确定。
而在该研究中,研究者对两对非吸烟肺癌(LUAD)患者的肿瘤和邻近正常组织进行了Hi-C测序。进一步分析肿瘤组织和正常组织间的A/B区室、TADs和染色质环的差异,确定了肿瘤特异性的A/B间隔、TADs和染色质环。结果表明LUAD的染色质结构变异主要来自Chr3且发现了5个重要的与肿瘤进展相关的基因(SYT16、NCEH1、NXPE3、MB21D2、DZIP1L)。
研究结果
Hi-C检测显示,在非吸烟者的LUAD肿瘤组织中存在多种结构变化
染色体位点之间的相互作用可能导致基因组重排,从而导致许多肿瘤相关基因的空间结构变异,并导致肿瘤的发生。与正常组织相比,肿瘤组织中小基因丰富染色体(Chr16-22)的相互作用频率较低,而患者1的Chr2和Chr3的相互作用频率增加,患者2的ChrY和Chr14的相互作用频率增加。与正常组织相比,肿瘤组织中Chr3的A/B腔间隔转换区最为明显,其次是Chr4。该文研究者使用10kb分辨率的软件处理Hi-C数据,确定了显著的交互位点,癌症组织中识别出了更多但更小的环结构。在所有样本中共观察到15848个环,在肿瘤组织中鉴定出307个特异性环。该研究发现了三种类型的环,包括增强子增强子(E-E)、增强子启动子(E-P)和启动子启动子(P-P),它们在肿瘤组织中显著增加,提示这些环在肿瘤进展中的重要作用 (Fig. 1)。
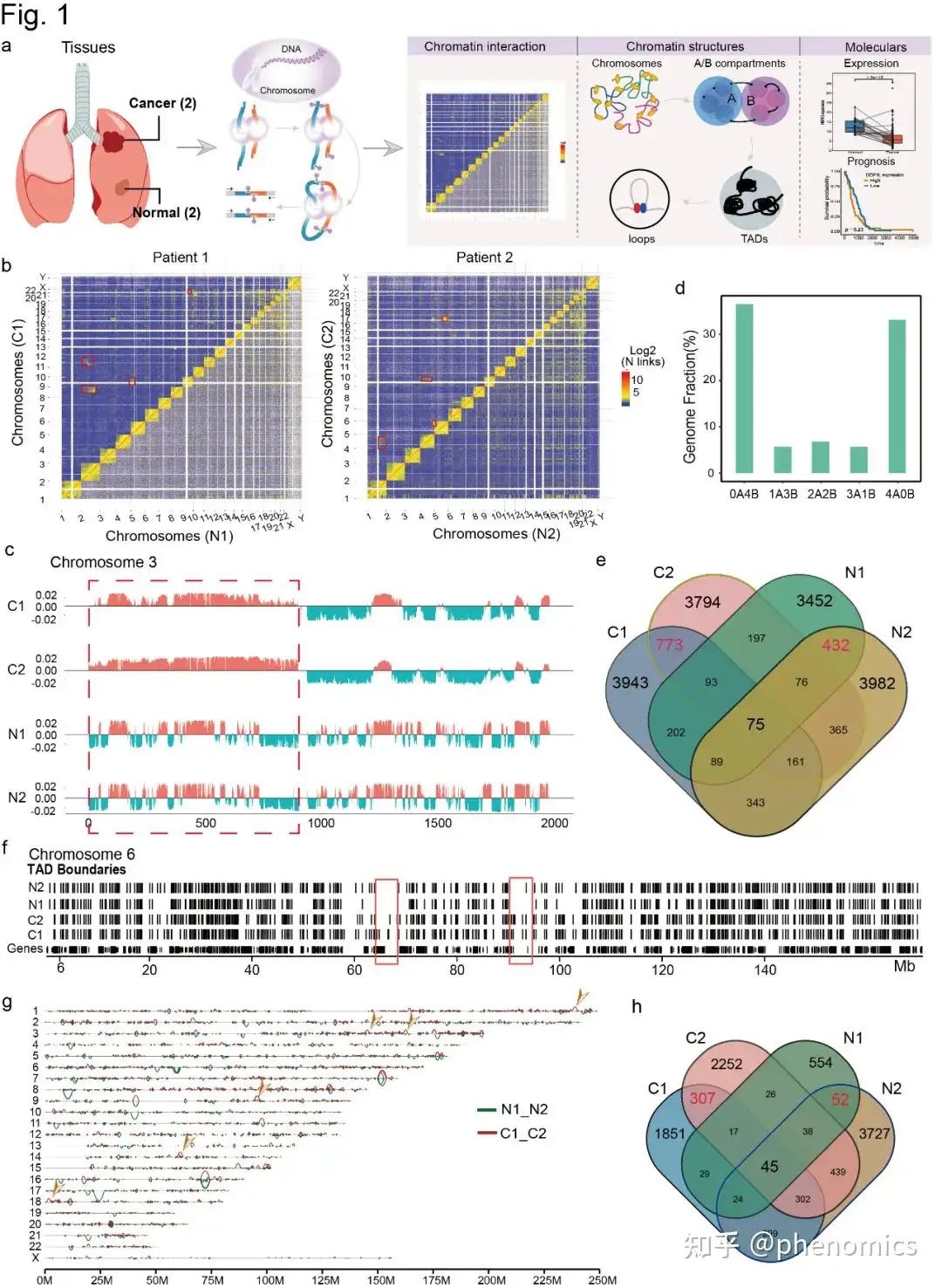
两种LUAD和正常组织三维基因组的全局特征
肿瘤组织中A/B间隔的转化主要集中在Chr3
所有样本的每条染色体上都发生了区室转换,而A/B转换是肿瘤组织中主要的转换类型。这表明多个基因失去了转录活性,执行正常功能阻碍,促进了癌症的发展。在所有染色体中,能关注到大多数A/B转换事件发生在Chr3(580/1,728,33.6%),肿瘤与癌旁组织基于PC1值的差异评估也表明Chr3包含了区室间转换最频繁,最高程度变化的区域,这些区域包含一些重要的基因,如ERC2、WNT5A和NMAT3。该文研究者进一步在肿瘤组织中特异的89个区室转换区域发现了几个重要的肿瘤相关基因,包括ERC2、FRG2C、DAZL和MB21D2等。通路及功能分析表明,A→B区室转换区域相关基因主要富集于−乳糖和新乳糖系列和多巴胺能突触通路,参与了多个肿瘤相关信号通路,包括PI3K−Akt、MAPK、Ras和Rap1。总的来说,该研究证明了A→B是LUAD中主要的区室转换类型,并与肿瘤过程中的重要信号通路密切相关 (Fig. 2)。
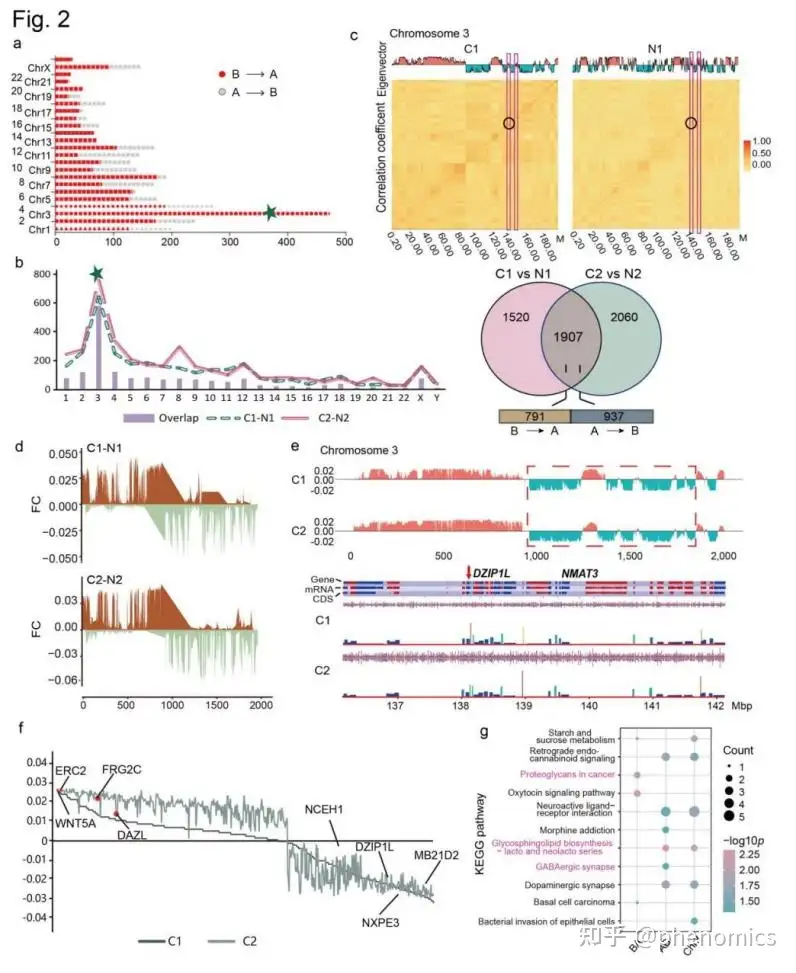
肿瘤组织中A/B区室的转化主要集中在Chr3上
LUAD中存在明显的TAD边界变化
在TADs层面,该文研究者发现了216个肿瘤特异性TADs,主要集中于Chr1, Chr2和Chr3染色体上。此外,还发现了5个肿瘤相关基因SYT16、NCEH1、DZIP1L、NXPE3和MB21D2,在A→B的区室转换区域中被鉴定。对TAD边界的广泛分析显示,在肿瘤组织中检测到一些显著的边界,这清楚地表明了新的TADs的形成。功能和KEGG通路分析TADs相关基因,发现他们参与生物粘附、细胞连接、转运活动、货物受体活动和生殖过程在肿瘤过程和转移发挥关键作用,和一些重要的肿瘤相关途径包括细胞粘附分子、胆碱代谢,以及wnt和mTOR信号通路 (Fig. 3)。
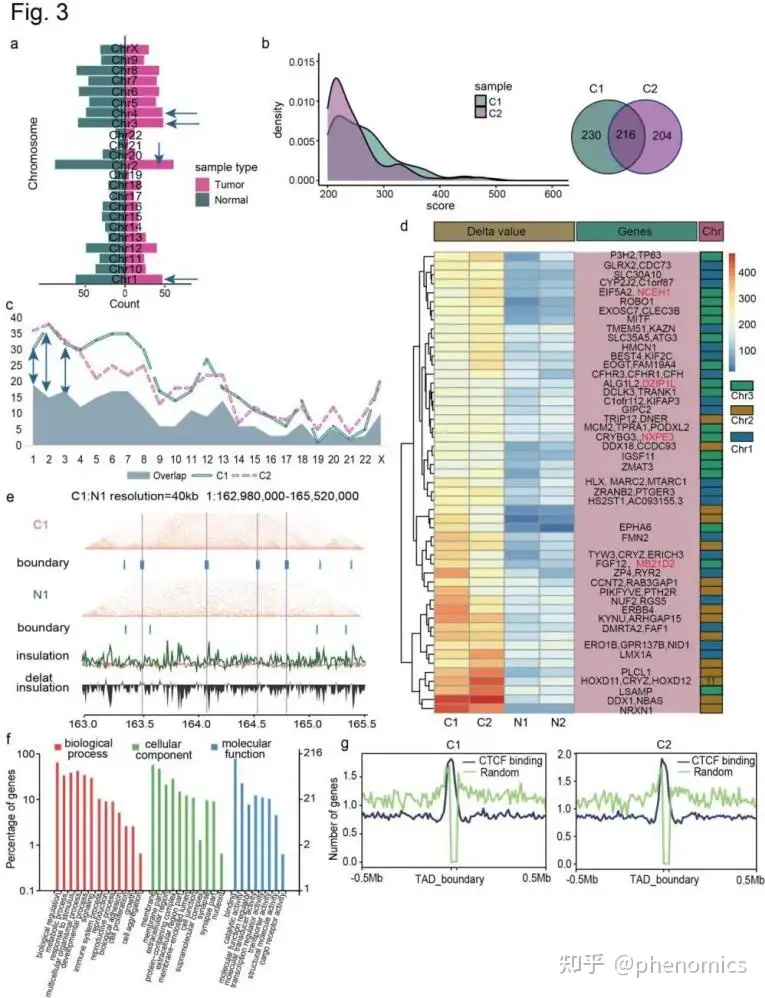
在LUAD中发现了明显的TAD边界变化
在LUAD肿瘤组织中发现了特异性的染色质增强子-启动子环
研究者们进一步分析染色质环,发现肿瘤组织特有的131个染色质环结构,主要分布在Chr3上。增强子-增强子(E-E)、增强子-启动子(E-P)和启动子-启动子(P-P)是染色质环的三种主要类型,启动子-增强子环在疾病的发生发展中起着重要的调控作用。在该研究中,发现了41个E-P,且之前在A/B区室转换和TADs中发现的5个基因(SYT16、NCEH1、DZIP1L、NXPE3和MB21D2)也在Chr3上的E-P环中发现。因此,这些结果进一步证实了Chr3在染色质环形成和肿瘤发生中的重要性 (Fig. 4)。

在LUAD组织中发现了不同的染色质增强子-启动子环
SYT16、NCEH1、NXPE3、MB21D2、DZIP1L是LUAD中染色质结构变异中最重要的基因
结合公共来源的CHIP-seq数据发现这5个在A/B区室转换、TADs和环状结构存在变化的基因,随着肿瘤中RNAPII和H3k27ac信号的改变而变化。基于TCGA-LUAD数据集也发现,相较于正常组织,位于Chr3上的4个基因(NCEH1、DZIP1L、NXPE3和MB21D2)在LUAD和非吸烟女性患者中均下调,而SYT16在肿瘤样本中均上调。敲除这些基因后,NCEH1和MB21D2显著增加了肺癌H1299和H1975细胞的侵袭,而SYT16降低了细胞的侵袭,表明它们具有致癌或抗肿瘤的重要性。此外,尽管这些基因的预后无差异,但它们在死亡组均高表达,这可能代表了NCEH1和MB21D2在非吸烟女性患者中的促肿瘤作用,提示这些基因可能在促进LUAD的发生发展中发挥作用 (Fig. 5, 6)。

LUAD高级结构变异的五个最重要基因
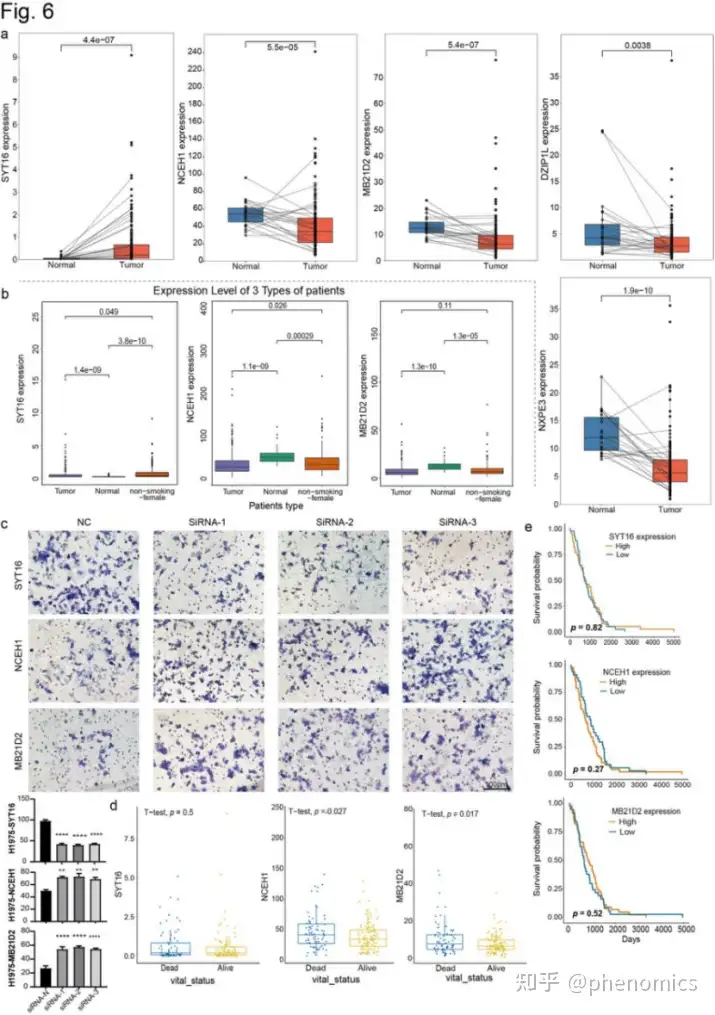
基于TCGA-LUAD数据集的这5个基因的表达及预后价值预测
Abstract
Advanced three-dimensional structure variations of chromatin in large genome fragments, such as conversion of A/B compartment, topologically associated domains (TADs) and chromatin loops are related closely to occurrence of malignant tumors. However, the structural characteristics of lung cancer still remain uncovered. In this study, we used high-throughput chromosome (Hi-C) conformation capture technology to detect the advanced structural variations in chromatin of two non-smoking lung adenocarcinoma (LUAD) tumor and paired normal tissues. The results indicate that significant chromatin variations are detected in tumor tissues compared with normal tissues. At compartment scale, the main conversion type of compartment is A → B in tumor tissues, which are concentrated mainly on chromosome 3 (Chr3) (33.6%). A total of 216 tumor-specific TADs are identified in tumor tissues, which are distributed mainly in Chr1 (19), Chr2 (15) and Chr3 (17). Forty-one distinct enhancer-promoter loops are observed in tumor tissue, which are associated closely to tumor-related pathways including mitogen-activated protein kinase (MAPK), Phosphatidylinositol-3-kinase-Protein kinase B (PI3K-AKT), Ras, Wnt and Ras1. The most important observation in this study is that we identify five important genes (SYT16, NCEH1, NXPE3, MB21D2, and DZIP1L), which are detected in both A → B compartment, TADs and chromatin loops in tumor samples, and four of these genes (NCEH1, NXPE3, MB21D2, and DZIP1L) locate on q arm of Chr3. Further gene expression and invasion experiment analysis show that NCEH1, MB21D2 and SYT16 are involved in the tumor development. Thus, we provide a comprehensive overview of advanced structures in LUAD for the first time and provide a basis for further research on the genetic variation of this tumor.
Reference:
[1] Wu P, Li T, Li R, Jia L, Zhu P, Liu Y, Chen Q, Tang D, Yu Y, Li C (2017) 3D genome of multiple myeloma reveals spatial genome disorganization associated with copy number variations. Nat Commun 8(1):1937. https://doi.org/10.1038/s41467-017-01793-w
[2] Taberlay PC, Achinger-Kawecka J, Lun ATL, Buske FA, Sabir K, Gould CM, Zotenko E, Bert SA, Giles KA, Bauer DC, Smyth GK, Stirzaker C, O'Donoghue SI, Clark SJ (2016) Three-dimensional disorganization of the cancer genome occurs coincident with long-range genetic and epigenetic alterations. Genome Res 26(6):719-731. https://doi.org/10.1101/gr.201517.115
[3] Rhie SK, Perez AA, Lay FD, Schreiner S, Shi J, Polin J, Farnham PJ (2019) A high-resolution 3D epigenomic map reveals insights into the creation of the prostate cancer transcriptome. Nat Commun 10(1):4154. https://doi.org/10.1038/s41467-019-12079-8
通讯作者
李为民

华西临床医学院/华西医院院长,教育部长江特岗学者
呼吸和共病全国重点实验室副主任,兼华西团队负责人,呼吸健康研究所所长
疾病分子网络前沿科学中心主任、国家精准医学产业创新中心主任
专注肺癌、肺部感染早期精准诊疗关键临床问题研究,以通讯作者在Cell、Cell Res,Cell Host &Microbe Nat.commun等期刊发表论文200余篇;以第一完成人获国家科技进步进步奖二等奖。
张立

张立,研究员,博士生导师,2007年获医学博士学位,2007-2010赴美国哈佛大学医学院做博士后研究,2015年获“四川省海外高层次留学人才”称号。四川省医学会精准医学专委会副主委,中国抗癌协会病理专委会肺癌专家组成员,中国抗癌协会肿瘤靶向治疗专委会青委会专家组成员,GE药业精准医学研究院基因组学和代谢组学组长。获批三项国自然面上项目,获年度国家科学技术进步二等奖(2020年,排名第3),四川省科技进步一等奖(2018年)及二等奖(2006年)各一次(均排名第4)。
一作介绍
宋婷婷

宋婷婷,四川大学华西医院呼吸健康研究所肺癌分子表型研究室技术员,研究生期间及毕业后一直从事生物信息学分析工作,目前主要研究方向是利用单细胞转录组技术解析肺癌不同分子表型的异质性,寻找肺癌治疗的诊治靶点。
姚梦琳

姚梦琳,四川大学华西医院呼吸健康研究所肺癌分子表型研究室技术员,主要从事单细胞转录组和空间转录组建库方面的工作,管理和维护单细胞显微切割系统。主要研究方向肺癌空间结构异质性。
Phenomics期刊简介

Phenomics是一本新创的同行评审国际期刊,聚焦表型组学前沿研究,搭建全球表型组学领域专家交流的国际平台,推动该领域相关的理论创新和学科发展。
本期刊拥有强大的国际编委团队,复旦大学金力院士担任主编,美国系统生物学研究所Leroy Hood院士、澳大利亚莫道克大学Jeremy Nicholson院士、德国莱布尼兹环境医学研究所Jean Krutmann院士、复旦大学唐惠儒教授共同担任副主编,复旦大学丁琛教授担任执行主编,另有来自全球多国的三十多位著名科学家共同组成编委团队,以及四十多位青年科学家组成青年编委团队。
我们诚挚地邀请广大科研人员投稿!
Phenomics官网:https://www.springer.com/journal/43657
投稿链接:https://www.editorialmanager.com/pnmc/
编辑部邮箱:phenomics@ihup.org.cn、phenomics@fudan.edu.cn
欢迎关注Phenomics官方公众号

文章来源:人类表型组计划公众号
https://blog.sciencenet.cn/blog-3558836-1401069.html
上一篇:Phenomics表型组学前沿论坛第六十八期“序列、结构、功能和表型:从结构预测谈起”圆满举办
下一篇:Phenomics|一种用于大型人群队列研究的睡眠表型标准操作程序