博文
化学电池的原理分析及趋势思考
||
现在市面上可充电化学电池(二次电池)的种类很多,包括碱性锌锰电池、铅酸电池、锂电池、液流电池等,其中锂电池还分锂离子电池、锂金属电池、锂硫电池、锂空气电池等等。
让人不禁产生疑问:
为什么当下最常用的是锂电池?
究竟哪一种电池最有前途?
今天我就从化学电池的原理出发,盘一盘各种化学电池的前途。
图1是我们平时最容易看到的电池原理图,但我觉得还不够原理,疑问一大堆,比如为什么要分正极和负极,为什么要有隔膜,为什么正负极和隔膜都要浸泡在电解液中。
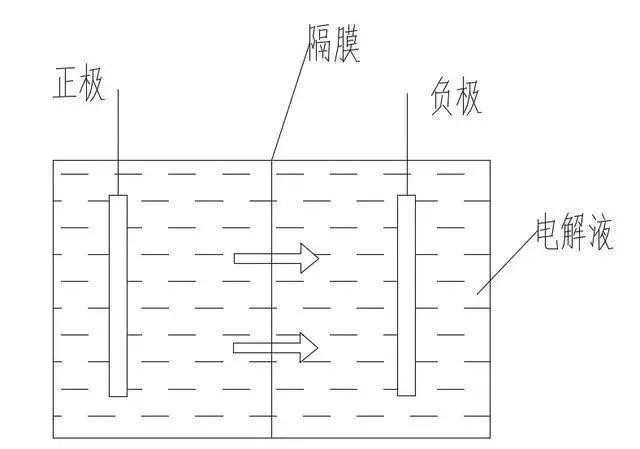
图1
下面开始从电池的底层原理开始思考。
1 如何储存电子
电能是老百姓最常用的能源形式之一,其本质是电子的流动。
电池,顾名思义是“电子的池子”,其作用是储存电子并在需要用电的时候释放,最基础的性能是储存容量(能量密度)和充放电速率(倍率性能)。
电子带负电,根据电荷守恒,电子不会单独释放和流动,而是与其反离子(也就是阳离子)同时产生、反向流动。
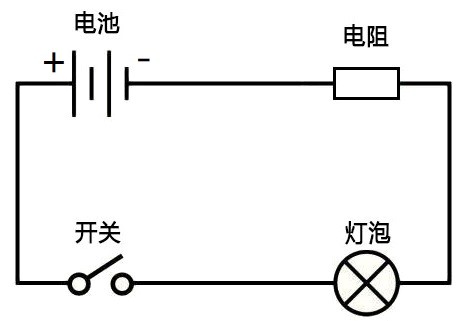
图2
图2是最基础的电路图,电池点亮灯泡时,电子在电池的负极产生,流经电阻、灯泡、开关到达正极,相应的阳离子也在负极产生并流向正极,与到达正极的电子结合,重新回到不带电的状态。可见,电池并不是直接储存电子,而是储存能释放电子的高能物质。
电池放电的完整过程是,电池的负极含有一种高能物质,当电路连通时,该高能物质自发分解成电子和阳离子,电子沿着外电路去正极,阳离子在电池内通往正极,阳离子和电子在正极处形成低能物质。类似的,电池充电的过程,是正极处的低能物质在外电场的作用下发生电解,电子和阳离子分别到达负极并形成高能物质。
高能物质和低能物质统称为储电物质,相互之间存在能量差,这种能量差表现为分解产生电子的难以程度,并可通过外加电场缩小甚至逆转差距(外加电场使低能物质分解出电子),效仿重力势能,命名为电势差,更通俗地称为电压。电压越高,说明物质在负极时的能量相对于在正极时更高,外电路连通时能释放的能量越多。
2 化学电池的构成
从电池储存电子的原理可知,电池需要构建内电路。
正极和负极需要允许储电物质的嵌入和脱出,放电时,储电物质从负极脱出、到正极嵌入;充电时则从正极脱出、到负极嵌入。储电物质在正负极以不同的形式存在,充电时外加电场使负极流入电子,发生还原反应,因此在负极以还原态存在,正极则流出电子,以氧化态存在;放电时,外电路(通常包含用电元器件)的存在使负极的储电物质转移到正极。
正极的氧化态物质和负极的还原态物质直接接触会发生氧化还原反应并大量放热导致电池报废,俗称短路,需要在阳离子连通的情况下进行电子隔离。用于隔离正负极电子流通的介质称为电解质,需要满足多方面的要求:首先,需要有一定的机械强度,以防在电池扭曲、变形时发生正负极短路;其次需要绝缘,否则电子可以从电池内流向正极,相当于短路;再次是要能让阳离子顺畅地流动;最后,还需要能与正负极充分接触,使储电物质可以在电极-电解质之间顺畅地转移。电解质的多方面要求,决定其需要包含流体,以便充分渗透到电极的毛细孔隙中;需要有合适的粘度,粘度越低,阳离子的流动就越顺畅,同时机械强度会下降。由于充放电性能是电池的两大基础性能之一,机械性能向流动性让步,常用电解质都是低粘度液态的,称为电解液,机械强度则由额外插入的半透隔膜提供。隔膜用于物理隔离正负极,但允许电解液通过。
至此,电池的四大主材就到齐了,分别是正极、负极、电解液、隔膜。除了四大主材外,还需要用于汇集电极电流的铜箔、作为电池容器的铝皮等。
储电物质需要在电极处发生氧化或还原反应,因此通常吸附在电极上,比如锂电池、碱性锌锰电池、铅酸电池等,只有液流电池例外。由于储电物质在电极之间来回迁移都需要经过电解质,于是液流电池使用电解液作为储电物质:充电时,含有储电物质的电解液在负极被还原(化合价降低)后,被输送到容器中储存,放电时,再将储存的含有还原态储电物质的电解液源源不断地送到电池中进行氧化。由于含有还原态和氧化态物质的电解液直接接触会短路,因此正极电解液和负极电解液同样需要用隔膜进行隔离,称为离子膜,只允许离子通过,不允许电解液中的其他成分通过。
3 化学电池的材料
电极的正极材料需要耐氧化,通常使用氧化物;负极材料需要耐还原,通常使用金属单质或石墨。根据不同的正负极材料,再搭配与正负极相容的电解质,即可组装成各种电池。
为什么当下最常用的是锂电池?
因为以锂为高能物质,具有可实用的最高的能量密度和最好的倍率性能——除了氢和铍之外。能量密度与荷质比有关,荷质比越大,理论可能的能量密度就越高;倍率性能与放电活性有关,化合价越容易升高,往往倍率性能也越好。
氢电池。氢是第1号元素,最高可被氧化成+1价,具有所有元素中最大的荷质比(1/1),单位重量能释放的电子数最最多,氢电池也因此具有最高的理论能量密度。问题是,氢电池的负极得储存氢单质,正极得储存质子酸,所谓的充电是把质子酸电解成氢单质,放电是使氢单质氧化成质子酸。氢单质的分子间作用力太小,常温下蒸气压超过10MPa,能承受如此高压力的电池容器的成本过高。另外,氢气放电至+1价的条件苛刻,需要强氧化剂和催化剂的辅助,类似于燃烧过程的助燃物和火源,因此氢电池通常被称为燃料电池,在结构上比常规电池更复杂,且并不可以充电。以金属氢化物为负极材料的镍氢电池,由于使用了储氢合金,能量密度并不高,逐渐被锂电池替代。
铍电池。铍是第4号元素,最高可被氧化成+2价,荷质比2/4仅次于氢。铍的主要问题在于性价比太低,不仅从0价放电至+2价的活性不够高,而且地壳中丰度仅约6ppm,导致铍电池虽然能量密度高,但存在倍率性能不佳且价格昂贵的缺点。
锂电池。锂是3号元素,最高可被氧化到+1价,荷质比1/3仅次于氢和铍。锂在地壳中丰度约65ppm,放电只需从0价放电至+1价,活性非常高。锂电池的倍率性能和成本优势甩铍电池10条街,轻松弥补了能量密度上的劣势,因此当锂电池的技术获得突破,就可以替代其他大多数种类的电池。
钠电池。钠与锂同为碱金属,倍率性能和能量密度都劣于锂电池,优点是钠资源丰富,地壳中丰度约2.75%,是锂的400多倍,造价更低。
锌锰、镍铬、铅酸电池,最高可以氧化到+4价,荷质比还算凑合,以强酸或强碱为电解质促进金属单质放电,能量密度和倍率性能劣于锂电池,成本也更低,适合用于性能相对要求较低的场合。
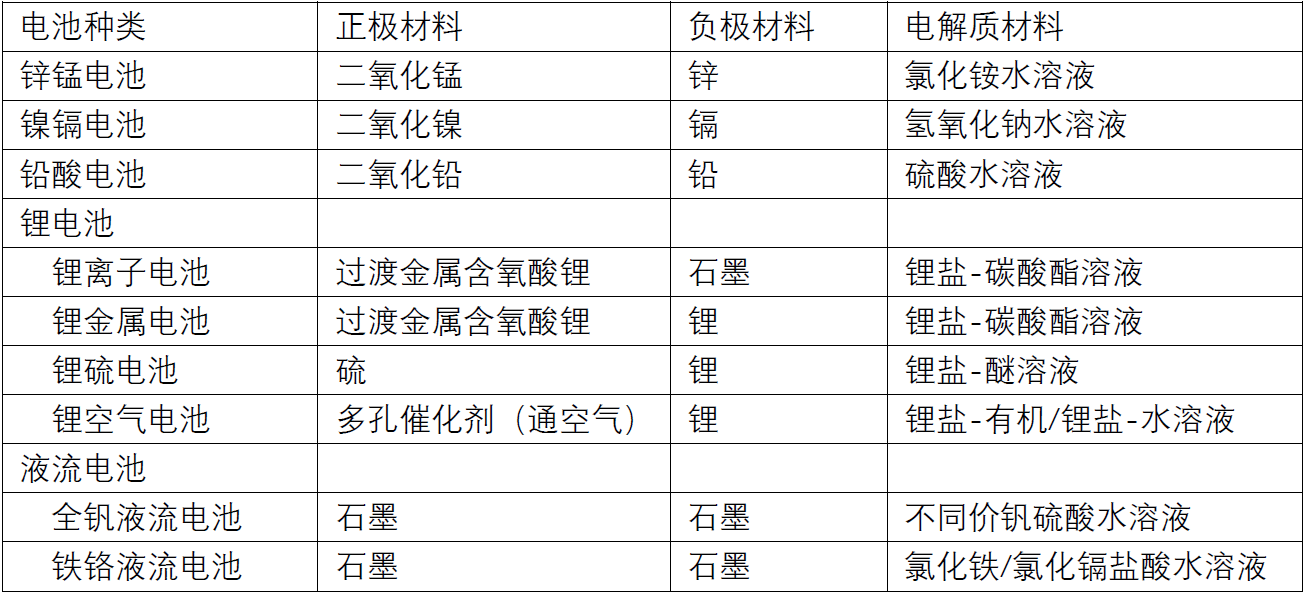
表1 常见电池的正极、负极及电解质材料
4 锂电池选拔
表1中可以看到,同样以锂金属为高能物质的锂电池,还存在锂离子电池、锂金属电池、锂硫电池、锂空气电池等品种。日常所用的主要是锂离子电池,其余三种的共同点是以锂金属为负极。锂金属是高能物质,当电池的负极从惰性的石墨调整为活性的锂金属时,意味着能释放的电子数量大幅提升,因此会比锂离子电池具有更高的能量密度。
以锂金属作为负极这种小把戏从锂电池发明之处就众所周知,至今未商用的原因是存在几乎致命的缺陷,主要是稳定性。以锂金属为负极时,理论上整个负极都能放电,但随着锂金属转化为锂离子并迁移到正极,电极的体积会发生变化,正极膨胀、负极收缩,放电时则正极收缩、负极膨胀,负极脱出的锂金属比例越高,电极的膨胀收缩幅度也越大。若要锂金属负极充分发挥能量密度,意味着放电时负极将完全分解,充电时又要重新沉积形成负极,即负极的体积将膨胀无限倍。一旦某处通路的电阻较周围更低,该处就会沉积更多的锂金属,且沉积的锂金属会使通路缩短、电阻进一步降低,恶性循环下,不仅每次充放电的倍率性能不稳定,局部堆积的锂金属甚至会刺穿隔膜导致短路。
锂离子电池比锂金属电池更安全更稳定,寿命也更长。锂离子电池使用层状石墨等作为骨架,充电时负极析出的锂金属嵌入石墨层间,整个负极的体积几乎不变。电极体积保持稳定带来的重大好处是会在电解液与电极之间形成多孔的半透界面膜,即SEI膜。SEI膜可以隔离电极液与电极,同时让锂离子顺畅通过,从而减少在电极处被电解的溶剂量,延长电池寿命。
几种锂电池商业化的难度按顺序是锂离子电池<锂金属电池<锂硫电池<锂空气电池。后三者的负极材料相同,锂金属电池由于使用与已商业化的锂离子电池相同的材料,故实现难度最低;锂硫电池用硫代替金属氧化物作为正极,存在不同化合价硫化物的稳定性差、正极膨胀问题等;锂空气电池与氢燃料电池一样需要强氧化剂和催化剂,或许可称为锂燃料电池,由于充电过程氧化锂电解释放氧气,实际需要考虑的因素比比氢燃料电池更多,后者不存在充电过程。
由于稳定的SEI膜可使电池的寿命延长数倍,在锂资源稀缺的地球上,以锂金属为负极的锂金属电池、锂硫电池、锂空气电池主要适用于对能量密度有极高要求的场景,比如无人机、航空器等。
5 锂电池的结构优化
锂电池是存在改进空间的。四大主材中,电解液和隔膜共同作为电解质,实现了对电极的物理隔离、电子隔离和阳离子连通,因此更理想的情况是将电解液和隔膜合二为一,可能的实现形式包括凝胶聚合物电解质、无机固态电解质、有机-无机复合电解质等。
电解质材料需要具有流动性。
在凝胶聚合物电解质中,凝胶聚合物作为结构材料,其结构孔隙中充满了电解液,相当于用凝胶聚合物代替了常规的PE、PP隔膜,整体上呈果冻状。凝胶聚合物电池的理想加工流程是在电池中充入含聚合单体的电解液,充分渗透到电极空隙后再原位生成凝胶聚合物,难点在于聚合反应的控制;相比之下,先形成果冻状聚合物,刷到电极上,再卷制或叠片形成电池更容易操作,缺点则是果冻状聚合物无法充分渗透到电极孔隙,导致电极-电解质界面电阻较高、倍率性能较差。凝胶聚合物电解质在1990年代已有商业化使用,安全性能提升有限,一旦有少量泄漏燃烧,高温将使凝胶聚合物熔化。
在无机固态电解质中,固态主体与电极之间仍然需要使用其他具有流动性的介质,相当于做了个夹层,使锂离子通路从负极→电解液→正极调整为负极→连接层→无机固态电解质→连接层→正极,锂离子需要穿梭的材料界面从2个增加到4个,界面电阻相应地成倍增大,因此商业化的关键点在于降低界面电阻以及固态电解质的成本。
在有机-无机复合电解质中,多孔的无机固体作为结构材料,有机流体作为锂离子流动的通道,无机固体比聚合物更耐高温,有机流体可升级为聚合物以进一步提升安全性。多孔无机固体的形式可以是小微颗粒或片状,后者的情况相当于使用了无机多孔隔膜,从当前的隔膜商业化现状可知没有竞争力。小微颗粒形态的无机固体与有机流体的复合是材料领域的常规做法,涂料、粘合剂、塑料、橡胶等均使用了该复合体系,区别在于,涂料等材料成型后不需要流动性,因此聚合物也部分充当了结构材料,而电解质中的有机物质需要较好的流动性,这种情况下,小微颗粒会形成紧密堆积,所占的体积非常大,可用于锂离子流通用的有机流体所占比例就小。作为参考,芯片封装所用的环氧塑封料中填充有紧密堆积的小微二氧化硅颗粒,其重量占到总体的80%以上,体积占比在65%以上。若有机-无机复合电解质中,无机颗粒的填充量也达到65%以上,对电解质的锂离子传导性将是重大考验,除非多孔填料本身能促进锂离子的流动。
表2 锂电池电解质优化方向对比
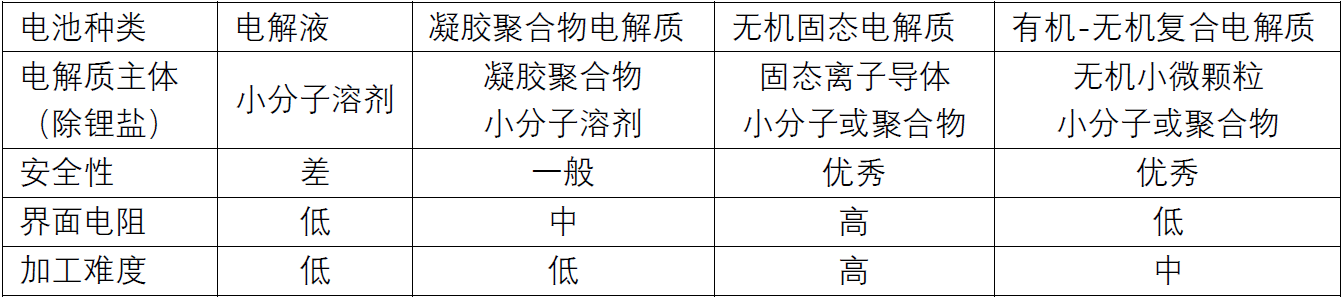
表2中后三种电解质相比,我更看好有机-无机复合电解质。凝胶聚合物电解质的电性能不如电解液,安全性又远不如其他两种,注定只能作为过渡。无机固态电解质的的界面电阻大、结构复杂,都是硬伤;有机-无机复合电解质的关键在于小微颗粒的堆积不能影响锂离子的通路,或有一丝突围可能。
2004年,A. J. Bhattacharyya等[1]证明了,证明了SiO2等表面酸性(水溶液中零电荷时为酸性pH)的氧化物可以通过吸附阴离子促进锂盐离子对解离、提高锂离子电导率,可使四氢呋喃(THF)溶液提升超过7倍,使甲醇溶液提升约5倍,而商用1 M LiPF6/EC+DMC(重量1:1)电解液仅可提升1-2倍,且随着SiO2的添加量超过4%,电导率将下降至0,如图3所示。
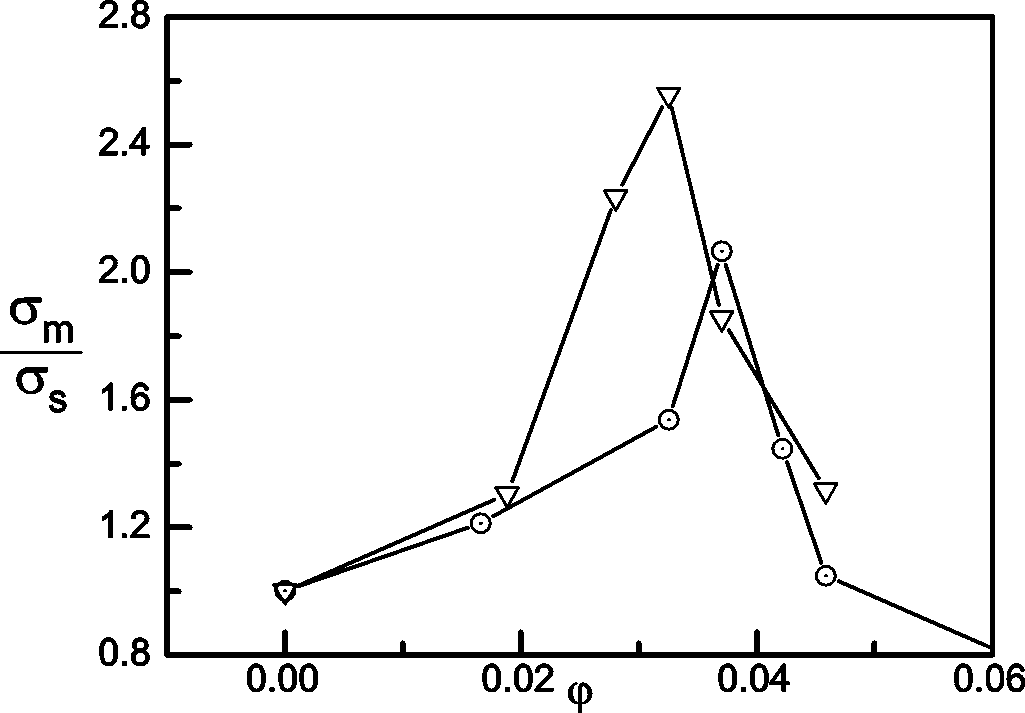
图3
显然,多孔SiO2会比实心的更适合用作电解质填充,从而避免在紧密堆积时堵塞离子通道。在保证机械强度的前提下,SiO2颗粒的堆积比重越小越好。
小结
通过以上对化学电池的原理分析,可知锂离子电池具有可实用的最高的能量密度和最好的倍率性能,会不断替代其他种类的化学电池。
在多种锂电池中,锂离子电池以层状石墨等可嵌入锂金属的材料为负极,通过形成稳定的SEI膜使电池的寿命延长数倍,在锂资源稀缺的地球上,性价比高、适用范围广;负极为锂金属的电池则适用于对能量密度有极高要求的场景。
在锂电池结构的优化方面,当前电解液加隔膜存在安全性差的缺点,在有机电解液中复合无机的多孔二氧化硅是较有潜力的改善思路,或可重点关注。
受篇幅限制,液流电池的材料选择留待下回再分析。
参考文献:
[1]Bhattacharyya A J, Maier J. Second Phase Effects on the Conductivity of Non‐Aqueous Salt Solutions:“Soggy Sand Electrolytes”[J]. Advanced Materials, 2004, 16(9‐10): 811-814.
https://blog.sciencenet.cn/blog-3528455-1367776.html
上一篇:让固体流动起来
下一篇:塑料污染已突破地球安全边界