博文
代谢学人--NCB: “热辣滚烫”的秘密:唤醒脂肪EPAC1
||
代谢学人
NCB: “热辣滚烫”的秘密:唤醒脂肪EPAC1
撰文 | 李姿萱 郭钰涵 刘梓棋 于柳 李章燕 周文豪 邱瑾
编辑 | 孟美瑶
校对 | 于柳

背景介绍
棕色脂肪组织(BAT)主要通过解偶联蛋白1 (UCP1)以非震颤性产热的形式(NST)将能量转化为热量。研究发现,在较瘦人群与心脑血管疾病低风险人群中BAT的质量较高。米色脂肪细胞主要存在于皮下白色脂肪组织(WAT)中,白色脂肪组织能够在冷暴露或药物诱导的条件下发生棕色化(米色化)。cAMP是棕色化过程中的主要调节因子。激活与G蛋白偶联的β-肾上腺素能受体或嘌呤能受体可以促进cAMP的产生,cAMP通过激活PKA促进脂肪分解,并上调UCP1的表达从而促进产热。除此之外,cAMP还能够通过EPAC(cAMP直接活化交换蛋白,exchange protein directly activated by cAMP)传递信号。EPAC蛋白是一种鸟嘌呤核苷酸交换因子,对cAMP的亲和力与PKA接近,能够调控瘦素信号传导、胰岛素分泌和骨骼肌中AKT的磷酸化。EPAC1蛋白包含一个cAMP结合位点和一个与鸟嘌呤核苷酸交换因子GEFs同源的结构域,EPAC1结合cAMP后会激活其GEFs活性;因此EPAC1也被认为是一种GEFs,且直接被cAMP调控(Epac is a Rap1 guanine-nucleotide-exchange factor directly activated by cyclic AMP. Nature. 1998; 396, 474–477.)。而GEFs通常通过调节小G蛋白的活性来控制细胞功能。研究发现,GEFs通过催化与G蛋白结合的GDP到GTP的交换来开启信号传导。如:Ras蛋白,最典型的小G蛋白,需要释放其结合的GDP然后再结合GTP才能活化,这一过程可被GEFs催化(GEFs and GAPs: critical elements in the control of small G proteins. Cell. 2007;129(5):865-77.)。另外,EPAC蛋白缺失后可抑制瘦素的合成和分泌,使血浆瘦素水平下降,并通过上调蛋白酪氨酸磷酸酶(SHP2)促进JAK2激酶磷酸化以及下丘脑和免疫细胞中的Stat3转录因子转录,进而促进瘦素信号传导; EPAC还可作为cAMP的下游信号分子被激活,而促进β细胞分泌胰岛素;此外, EPAC1可通过激活Rap1(Ras相关蛋白1,是一种小G蛋白,属于Ras超家族。与其他G蛋白一样,Rap1与GTP结合时具有活性,而与GDP结合时无活性),使其与PI3K亚基结合并激活骨骼肌中AKT磷酸化。总的来说,EPAC1是一种催化酶,可被认为是一种需要cAMP激活的GEFs,可通过其GEFs活性功能参与细胞功能调控。
在本研究中,研究人员发现EPAC1能够调控产热祖细胞和能量平衡。从机制上来看,与经典的PKA信号通路不同,EPAC1能够特异性地促进棕色脂肪的生长和米色脂肪的形成,EPAC1基因在人类产热脂肪细胞内相对保守,其功能缺失性突变会增加体重指数(BMI),并抑制去甲肾上腺素(NA)诱导的棕色前体脂肪细胞的增殖。

敲黑板啦!
1、EPAC1促进棕色前体脂肪细胞的分化
2、EPAC1促进白色脂肪细胞棕色化
3、EPAC1可促进BAT的生长
4、PDGFRα+细胞中EPAC1的缺失导致BAT质量降低,并加重肥胖
研究结果
1. EPAC1在BAT和WAT中的表达情况
研究人员检测了BAT、iWAT(腹股沟WAT)和gWAT(性腺WAT)中Epac 1和Epac 2的表达,结果显示,EPAC1在BAT中的表达量最高(附图1a,b)。无论是在前体脂肪细胞还是成熟脂肪细胞中,EPAC1在棕色/米色脂肪细胞中的表达水平都显著高于白色脂肪细胞(附图1c、d),这表明EPAC1可能在棕色或米色脂肪细胞中发挥重要作用(小编注:calnexin是内质网膜上的钙结合蛋白,作为比较各组织中EPAC表达的内参蛋白。d图的beige和a图的wati不一样,a图的wati来自于未经处理的八周龄小鼠;而d图的beige是经过甲肾上腺素(NE)持续处理后的)。

附图1. 激活EPAC1促进棕色脂肪的形成。
2. EPAC1促进棕色前体脂肪细胞的分化
为了探究EPAC1在棕色前体脂肪细胞分化中的作用,研究人员用EPAC1特异性激活剂——8-pCPT2 ' -O-Me-cAMP(007)处理从BAT中分离的前体脂肪细胞,分化过程中,棕色脂肪细胞中出现了明显的脂滴积累(附图1e),并且与对照组相比,007处理的棕色前体脂肪细胞中产热基因(Ucp1、Pgc1a)和脂肪生成相关基因(Fabp4,Pparg)表达水平显著上调(附图1f,BA代表棕色脂肪细胞),UCP1、FABP4和PPARγ的蛋白表达水平和线粒体氧化磷酸化系统复合物(CI、CII、CIII、CIV、CV)的表达水平显著升高(图1a, b)。与此一致的是,007处理的WT小鼠棕色脂肪细胞的基础呼吸水平(附图1g)和UCP1依赖性呼吸水平(图1c)显著增加,而在UCP1−/−小鼠的棕色脂肪细胞中细胞呼吸能力无明显变化。研究人员用007分别处理了从WT和Rapgef3 KO(Rapgef3编码EPAC1)小鼠中分离的原代棕色前体脂肪细胞,发现EPAC1敲除后,007不会促进原代棕色前体脂肪细胞向棕色脂肪细胞的分化(附图1h),这说明了007激活EPAC1的特异性。综上所述,EPAC1能够刺激棕色脂肪的生成。
3. 前体脂肪细胞中EPAC1信号通路的鉴定
研究人员使用007、PKA特异性活化剂[6-MB-cAMP (6-MB)和去甲肾上腺素 (NA/NE)]处理成熟棕色脂肪细胞,并通过检测脂肪细胞中甘油的释放量来反映脂肪的分解程度,结果发现直接激活EPAC1并不会激活棕色脂肪细胞的脂解能力(附图2a)。为了探究棕色前体脂肪细胞中EPAC1-cAMP和cAMP/PKA信号通路之间的差异,研究人员对007、6-MB处理组与对照组进行了高灵敏度磷酸化蛋白质组学分析,结果显示,三组之间均存在显著差异(图1d)。mTORC1是细胞生长和合成代谢的重要调控因子,激活EPAC1后mTORC1底物(4E-BP1Ser64/Thr69、LARP1 Ser743/751和MAP1B Ser1247/1260)的表达水平提高,但在激活PKA后mTORC1底物的表达水平并没有增加(图1e),说明EPAC1可能会影响棕色前体脂肪细胞的增殖。为了验证这一假设,研究人员对MAPK和CDK1信号分子展开研究(注:MAPK和CDK1是响应细胞外信号,调控细胞进入细胞周期的关键信号分子)。先前已有研究证明,cAMP浓度升高会抑制PKA对CDK1的Tyr15位点的磷酸化作用,从而阻断细胞周期进入m期。研究发现,激活PKA会促进棕色前体脂肪细胞中CDK1的Tyr15位点的磷酸化(附图2b),但MAPK14 (即p38α,Ser2)只有在EPAC1激活时才能发生磷酸化(图1f)。尽管EPAC1和PKA的激活均诱导ERK1 (Thr88和Tyr90)和ERK2 (Tyr185和Thr183)的磷酸化(图1f),但它们具有不同的ERK底物磷酸化特征(附图2c)。
研究人员用Western Blot对上述结果进行验证,结果显示,与对照组相比,007显著促进了棕色前体脂肪细胞中ERK1/2的磷酸化,而U0126(小编注:U0126是一种选择性、非竞争性MAPK激酶抑制剂,抑制MAPK通路中的MEK1和MEK2的磷酸化进而抑制其活性)处理则可阻断其对ERK1/2的磷酸化(附图2d)。与此一致的是,与WT小鼠相比,EPAC1 KO小鼠的前体脂肪细胞和BAT中ERK1/2的磷酸化水平均显著降低(图1g, 附图2e)。为了进一步分析EPAC1-和PKA依赖性的cAMP信号传导差异,研究人员检测了007、6-MB处理后棕色前体脂肪细胞中DUSP1(DUSP1可以去磷酸化ERK1/2,抑制ERK信号传导)的表达水平,结果显示,激活PKA会促进DUSP1的表达(附图2f)。与DUSP1的表达增加相符,研究人员用007或6-MB持续处理棕色前体脂肪细胞48h后,发现使用6-MB持续激活PKA会显著抑制ERK1/2的磷酸化水平,而持续激活EPAC1则仍会显著促进ERK1/2的磷酸化水平(附图2g)(小编注:在图1f中,研究人员是用007或6-MB急性刺激棕色前体脂肪细胞,6-MB是PKA特异性活化剂,结果发现ERK1/2能够被活化的PKA磷酸化,在附图2g中,研究人员是用007或6-MB持续处理48h,发现与对照组相比,ERK1/2的磷酸化水平显著降低。因此,此处作者认为“持续激活”PKA会显著抑制ERK1/2的磷酸化水平。这也在一定程度上反映了,EPAC1和PKA依赖性的cAMP信号传导之间存在差异的可能的原因)。
已知冷应激会刺激机体释放NA,促进BAT的生长,而ERK1/2在许多细胞中都能被NA激活,为了探究NA和007是否可以通过MEK/ERK途径促进棕色前体脂肪细胞的增殖,研究人员通过EdU实验发现,007和NA处理促进了棕色前体脂肪细胞的增殖,但使用U0126处理棕色前体脂肪细胞之后,反而抑制了棕色前体脂肪细胞的增殖 (图1h),并且消除了007促进棕色前体脂肪细胞分化的效果(附图2h),这表明MEK/ERK通路在EPAC1诱导的棕色前体脂肪细胞分化中起到至关重要的作用。此外,研究人员使用NA和EPAC抑制剂ESI-09处理细胞发现,NA诱导的ERK1/2磷酸化的能力被显著抑制(图1i),证明NA激活ERK1/2需要EPAC1的参与。
此外,ESI-09能够完全消除NA诱导棕色前体脂肪细胞增殖的效果(图1j),同样,与WT小鼠相比,从EPAC1 KO小鼠中分离的棕色前体脂肪细胞的增殖水平显著降低(附图2i)。与此一致的是,007处理组中含有脂滴的细胞数目显著增加(附图2j)。
值得注意的是,雷帕霉素(mTOR抑制剂)也减弱了007和NA对棕色前体脂肪细胞增殖的影响,这表明ERK1/2和mTORC1都是EPAC1诱导棕色前体脂肪细胞增殖的下游通路(附图2k)。
以上数据表明,EPAC1信号介导NA诱导的棕色前体脂肪细胞的增殖。
为了进一步确定EPAC1调控前体脂肪细胞分化的时间点,研究人员在分化的不同阶段用007激活cAMP/EPAC通路,结果显示,所有处理组中含有脂滴的细胞数量均显著增加,并且Pparg和Ucp1表达水平都显著上调,但在增殖和诱导阶段使用007处理的效果最为明显(附图2l-n) (小编注:脂肪前体细胞诱导分化的过程主要分为两个阶段:第一阶段是细胞增殖长满后,接触抑制2天,该过程目的是让细胞退出生长周期;第二阶段是添加分化诱导剂诱导细胞分化成熟阶段。因此d-2到d0对应增殖到最大密度后持续接触抑制的阶段,而d0到d2对应开始添加诱导分化剂的诱导阶段)。
为了探究在分化诱导阶段使用007处理时其他相关因子的作用机制,研究人员对C/EBPβ展开研究。C/EBPβ是调控棕色前体脂肪细胞分化的关键转录因子,在诱导产热过程中起关键作用,并且在管状上皮细胞中受到EPAC1的调节。研究人员在诱导阶段用007处理棕色前体脂肪细胞发现,在WT棕色前体脂肪细胞中C/EBPβ表达水平显著增加,而在EPAC1 KO细胞中无显著变化(图1k, 附图2o)。
研究人员用表达不同CRISPR-Cas9构建体的LV(慢病毒)转染棕色脂肪细胞,并检测C/EBPβ基因的表达,最终确定了用靶向C/EBPβ的CRISPR构建体#2转染棕色脂肪细胞以敲低C/EBPβ基因的表达水平(编码C/EBPβ)(附图2p, q, r)。研究人员用007处理LV-NTC组(非靶向对照组)与CRISPR组后发现,与LV-NTC组相比,敲低C/EBPβ抑制了脂肪生成和产热基因的表达水平(附图2q,r)(小编注:敲低C/EBPβ抑制了脂肪生成和产热基因的表达水平,而给予EPAC1特异性激活剂007处理后,可部分逆转敲低C/EBPβ带来的效应,但却不能恢复到与LV-NTC组相当的水平,因此也可以说敲低C/EBPβ部分抑制了007对脂肪生成和产热的促进作用,这也初步提示007处理细胞的作用机制可能和增强C/EBPβ的转录调控作用有关)。
为了探究cAMP/ EPAC调控C/EBPβ的相关机制,研究人员对PDE4展开了研究,PDE4是调节棕色前体脂肪细胞胞浆内cAMP的一种磷酸二酯酶(小编注:PDE4是催化cAMP分解的酶之一,即PDE4会降低胞内cAMP水平。在棕色前体脂肪细胞中,PDE4是调节细胞膜cAMP 的主要PDE(Phosphodiesterase,磷酸二酯酶)。PDE抑制剂的加入可使cAMP水平增高,并促进棕色脂肪细胞分化。参考文献:Kannabiran SA, Gosejacob D, Niemann B, Nikolaev VO, Pfeifer A. Real-time monitoring of cAMP in brown adipocytes reveals differential compartmentation of β1 and β3-adrenoceptor signalling. Mol Metab. 2020;37:100986),与EPAC1信号传导有关。研究人员用咯利普兰(Rolipram,PDE4抑制剂)处理棕色前体脂肪细胞,发现咯利普兰进一步促进了007诱导的C/EBPβ表达水平的升高(附图2s),在该实验的基础上,研究人员用U0126处理棕色前体脂肪细胞,发现阻断ERK通路后,不会影响007与咯利普兰促进C/EBPβ的表达,因此这一过程与ERK1/2通路无关(附图2t)。

图1.激活EPAC1促进棕色脂肪的形成

附图2. EPAC 1通过ERK 1/2信号转导上调棕色前体脂肪细胞中的C/EBPβ表达水平
4. EPAC1促进白色脂肪细胞棕色化
在白色前体脂肪细胞中刺激cAMP-EPAC1通路不会促进脂肪生成基因Fabp4和Pparg的表达(图1l)。与WT白色脂肪细胞相比,EPAC1 KO白色脂肪细胞的脂肪生成和分解能力也无显著差异(附图3a-c)。此外,用007处理原代白色前体脂肪细胞不会促进细胞增殖和ERK1/2的磷酸化(附图3d, e),体现了EPAC1的调控作用在棕色和白色脂肪细胞之间的差异(小编注:根据前文推测,作者检测了EPAC1在BAT和WAT中的表达情况,发现EPAC1在BAT中最高,在米色脂肪中含量居中,在白色脂肪中最少,暗示EPAC1可能主要在BAT中发挥更重要的作用;结合下文可知EPAC1在WAT中主要促进其发生棕色化)。相比之下,用007处理白色前体脂肪细胞促进了分化过程中Ucp1、Pgc1a、Cox8b和Tfam的表达,并且白色脂肪细胞的脂滴明显变小(图1m, 附图3f),C/EBPβ表达水平增加(附图3g)。综上所述,cAMP可以通过调控EPAC1促进产热,并促进白色脂肪细胞的棕色化。
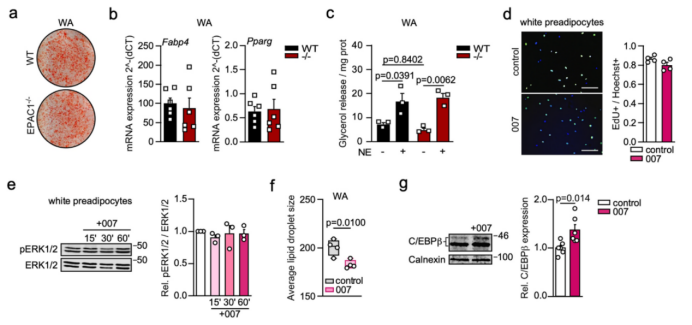
附图3. 白色前体脂肪细胞的增殖与EPAC1无关
5. EPAC1可促进BAT的生长
为了探究EPAC1信号传导在体内的作用,研究人员每天给成年小鼠注射007,持续1周,结果显示,与对照组相比,实验组小鼠的BAT质量和脂肪细胞密度均显著增加,UCP1蛋白表达水平增加,而甘油三酯含量无显著差异(图2a,b, 附图4a),研究人员将小鼠暴露于4℃环境并检测其耗氧量,发现与对照组相比,实验组小鼠的BAT依赖的能量消耗显著增加(图2c,d)。此外,用NA处理从注射007的小鼠中分离出来的BAT之后,发现UCP1依赖性呼吸水平显著增强(图2e)(小编注:文中作者用NA处理注射了007的UCP1 WT和 KO小鼠的BAT,发现与KO组相比,WT组BAT的呼吸能力显著增加,即定义为UCP1依赖的呼吸)。
为了进一步研究EPAC1在机体内代谢的作用,研究人员将EPAC1全身敲除的小鼠暴露在寒冷条件下1周,结果发现,与WT小鼠相比,EPAC1 KO小鼠的BAT质量明显减少 (图2f),耗氧量显著降低,BAT功能下降(图2g), UCP1表达水平和产热基因(Cox8b、Tfam和Nd5)表达水平也显著降低(图2h, 附图4b)。接下来,研究人员每天给EPAC1 KO小鼠注射007或NaCl(vehicle),持续一周后在4℃环境下暴露1h,结果显示,007处理的EPAC1 KO小鼠的能量消耗情况(附图4c,d)和BAT的生长情况(附图4e)与NaCl组相比无显著差异,进一步确定了007是通过调控EPAC1来发挥作用的。
研究人员发现,在室温(RT, 23℃)和热中性(TN, 30℃)条件下,EPAC1在BAT中的表达水平无显著差异(附图4f),于是研究人员将WT小鼠饲养在30℃环境,每天注射007,持续一周,发现与vehicle组(注射NaCl)的小鼠相比,注射007的小鼠的BAT质量显著增加,但耗氧量无显著差异(附图4g, h)。而EPAC1 KO小鼠的BAT质量和脂滴大小与WT小鼠接近(附图4i,j)。热中性条件下EPAC1 KO和WT小鼠的能量消耗水平、产热和炎症基因表达无显著差异(附图4k-n)。
以上结果表明,EPAC1能够促进BAT生长,当机体处于冷暴露或生理性激活状态时促进产热。
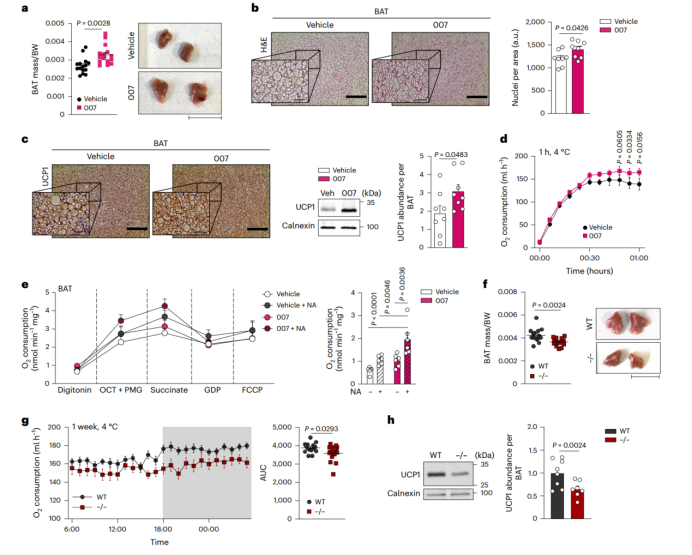
图2. EPAC1信号在小鼠体内促进BAT的生长和功能
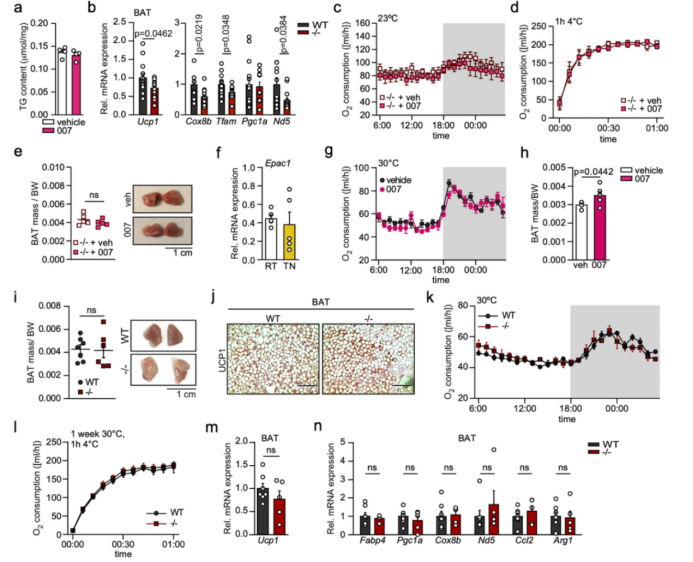
附图4. 热中性时的EPAC 1信号传导情况
6. PDGFRα+细胞中EPAC1的缺失导致BAT质量降低
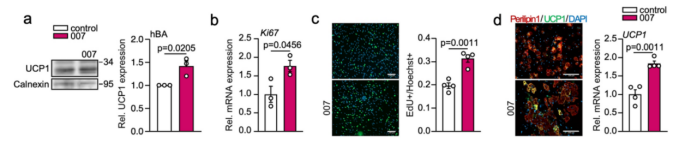
PDGFRα+细胞是产热脂肪细胞的前体细胞,由于EPAC1在前体脂肪细胞中具有重要作用,研究人员对PDGFRα+细胞展开了研究,发现BAT中PDGFRα+细胞的EPAC1表达量明显高于PDGFRα-细胞(图3a)。研究人员对冷暴露小鼠的BAT进行了单细胞测序,发现EPAC1在PDGFRα+前体脂肪细胞ASC1亚群(小编注:是脂肪干细胞亚群1,属于前体脂肪细胞的一种)中的表达量最高,该亚群对寒冷具有敏感性(附图5a-d)。
值得注意的是,冷暴露的EPAC1 KO小鼠BAT中的Pdgfra基因(前体脂肪细胞标志物)表达显著低于冷暴露的WT小鼠,这表明EPAC1的缺失抑制了PDGFRα+棕色前体细胞的增殖(图3b)。相比之下,用007激活EPAC1后,PDGFRα+细胞增殖水平明显增加(图3c)。
因此,研究人员通过在PDGFRα+细胞中选择性敲除EPAC1构建Pdgfrα-cre小鼠模型—EPAC1 PKO小鼠。研究人员将EPAC1 PKO小鼠和WT小鼠置于室温观察24h,发现二者在室温下的耗氧量无显著差异(附图6a)。随后研究人员将EPAC1 PKO小鼠和WT小鼠在4℃环境中暴露一周,发现EPAC1 PKO小鼠在冷暴露环境下的耗氧量明显低于WT小鼠(图3d),但二者的体重没有差异(附图6b)。重要的是,与WT小鼠相比,冷暴露后的EPAC1 PKO小鼠的BAT质量和UCP1表达水平显著降低(图3e-g)。研究人员对WT和EPAC1 PKO小鼠进行了为期7天的冷暴露实验,每天连续监测小鼠的身体核心温度,结果发现,EPAC1 PKO小鼠的核心体温整体低于WT小鼠,但这种变化主要出现在冷暴露后的第4天至第7天(附图6c,d)。
此外,研究人员将EPAC1flox/flox与UCP1 cre/+小鼠杂交获得EPAC1 UCP1 KO小鼠。冷暴露1周后,WT小鼠与EPAC1 UCP1 KO小鼠的体重、BAT质量、产热基因表达水平和耗氧量均无显著差异(图3h-l)。(小编注:上述研究结果表明,在PDGFRα+细胞中选择性敲除EPAC1会影响机体产热,而冷暴露后的EPAC1 PKO小鼠的UCP1表达水平显著降低。因此作者构建了EPAC1 UCP1 KO小鼠进行验证,排除是UCP1导致的这一结果。)
综上所述,PDGFRα+前体脂肪细胞中的EPAC1能够维持BAT的质量,并调控BAT的适应性产热。
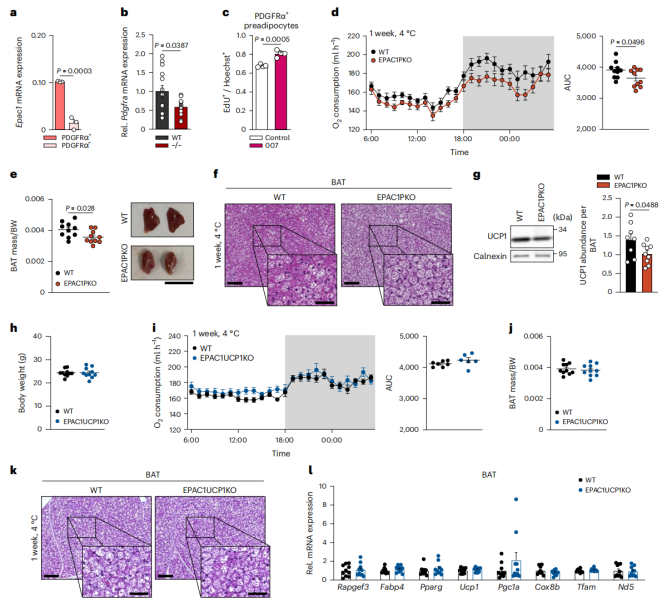
图3. 冷暴露条件下,EPAC1 KO小鼠的BAT质量减少,BAT中PDGFRα+细胞耗氧量降低
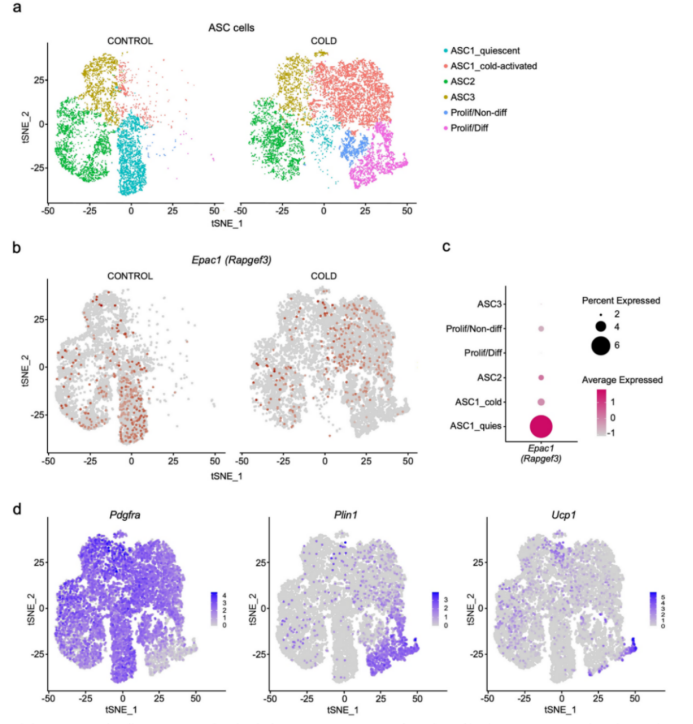
附图5. 单细胞RNA测序数据显示EPAC1在PDGFRα+前体脂肪细胞ASC1亚群中特异性高表达
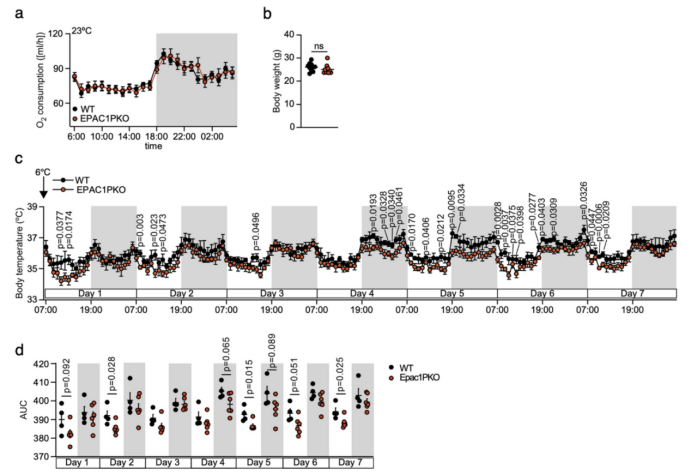
附图6. EPAC1 PKO小鼠的PDGFRα+细胞表型情况
7. PDGFRα+细胞中EPAC1的缺失会加重肥胖
为了探究EPAC1在饮食诱导肥胖(DIO)过程中的功能,研究人员给小鼠喂食高脂肪饮食(HFD),发现EPAC1 PKO小鼠的体重明显高于其WT同窝小鼠(图4a),但摄食量无显著差异(附图7a)。与喂食HFD的WT小鼠相比,喂食HFD的EPAC1 PKO小鼠葡萄糖耐量水平显著降低(图4b),总体脂肪量(图4c,d)、iWAT(腹股沟WAT)和gWAT(性腺WAT) 质量、脂肪细胞面积均显著增加(图4e-h, 附图7b)。此外,在HFD喂养12周后,与WT小鼠相比,EPAC1 PKO小鼠BAT中的UCP1表达水平显著降低,但二者的BAT质量无显著差异(图4i, 附图7c,d)。研究人员将HFD喂养的EPAC1 PKO和WT小鼠分别在23°C和4°C环境下暴露 1小时,结果显示,EPAC1 PKO小鼠的耗氧率明显低于WT小鼠(图4j,k),而在正常饮食(CD)组中,两种基因型小鼠的耗氧率无显著差异(附图7e,f)。
综上所述,在HFD情况下,在PDGFRα+细胞中特异性敲除EPAC1降低了BAT的产热能力,并促进肥胖。
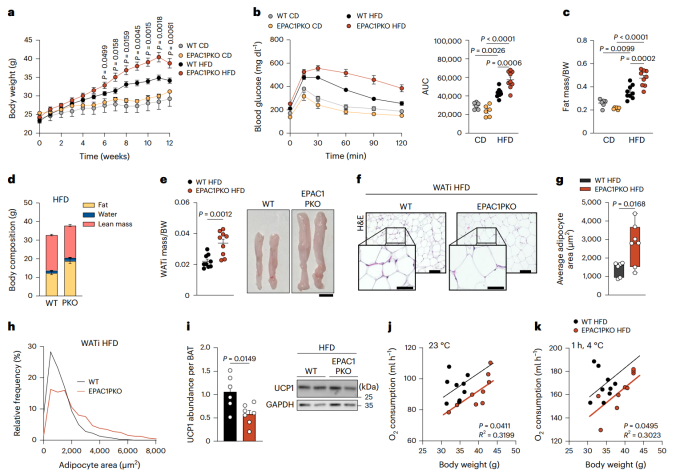
图4. PDGFRα+细胞中EPAC1的敲除加剧了DIO
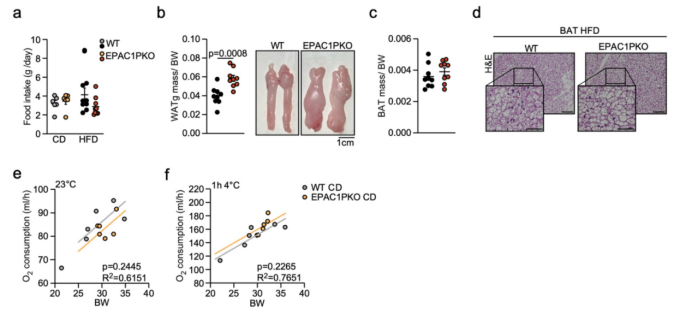
附图7.DIO过程中PDGFRα+细胞EPAC1特异性敲除的代谢表型
8. EPAC1的激活可以改善肥胖
为了探究激活EPAC1是否能够改善肥胖,研究人员分别给小鼠喂食高脂饮食和普通饮食12周并每天注射007或NaCl(vehicle)。结果发现,HFD+007处理组小鼠的体重明显低于HFD+vehicle处理组,且二者的摄食量无显著差异(附图8a)。与HFD+vehicle组相比,HFD+007组总体脂肪质量(图5c和附图8b)、iWAT和gWAT质量(图5d和附图8c)均显著降低。虽然两组的BAT质量无显著差异,但与HFD+vehicle处理组相比,HFD+007处理组的UCP1表达水平较高,BAT脂质积累较少(附图8d-f)。此外,007处理会导致iWAT中脂肪细胞面积显著减少,UCP1阳性细胞占比增加(图5e,f和附图8g,h)。值得注意的是,HFD+007组小鼠的iWAT中UCP1的表达量是HFD+vehicle组的22倍,同时,Pgc1a、Tfam、Cox8b和Adbr3基因的表达也显著上调(图5g)。在CD组中,与CD+vehicle组小鼠相比,CD+007处理组小鼠的BAT质量和UCP1表达水平均增加(附图8i-k), 而在iWAT中,UCP1的阳性细胞占比显著增加,脂肪细胞面积变小(附图8m-p),但二者的iWAT质量(附图8l)和gWAT质量(附图8q)无显著差异,这表明CD+007处理组中iWAT的棕色化水平增加。在HFD+007处理组的iWAT中,促炎基因Tnf和Ccl2的表达水平显著下调,而抗炎基因Il10的表达水平显著上调(附图8u),在BAT中也观察到同样的趋势(附图8v)。
综上所述,EPAC1信号可以改善肥胖引起的代谢失调,减少脂肪组织炎症反应,并在摄入高脂饮食时促进BAT产热。(小编注:本文在小鼠的表型上主要观察到产热能力的变化,而检测脂肪细胞增殖情况主要是通过分离小鼠前体脂肪细胞,检测EdU阳性点;讨论中提到的也是前体脂肪细胞增殖相关内容。推测作者认为从小鼠中分离的原代细胞能够反映小鼠体内情况,因此没有在小鼠模型上进一步验证。)
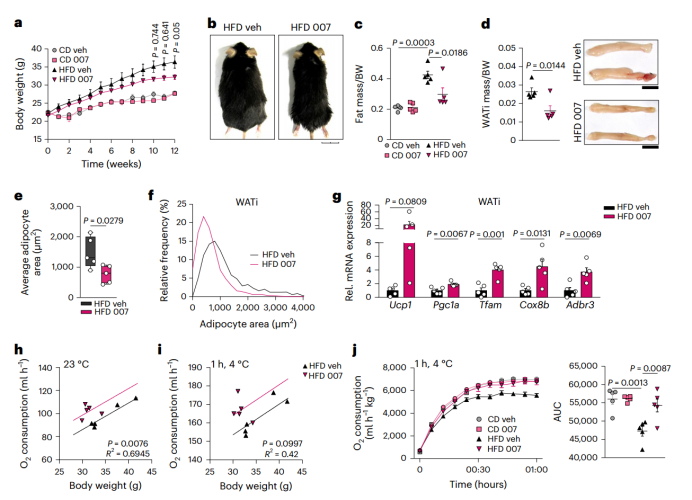
图5. EPAC1的激活可以改善肥胖

附图8. 在DIO期间。激活EPAC1会增加iWAT的棕色化,并缓解HFD引起的体重增加
9. EPAC1在人棕色脂肪细胞中的作用
EPAC1在人棕色前体脂肪细胞中的表达水平明显高于成熟的棕色脂肪细胞、白色脂肪细胞和白色前体脂肪细胞(图6a),NA能够促进人棕色前体脂肪细胞的增殖,而用EPAC抑制剂ESI-09与NA同时处理棕色前体脂肪细胞则会使抑制其增殖能力(图6b),相比之下,用007处理会使细胞增殖水平显著提高(图6c)。此外,与正常分化的棕色脂肪细胞相比,在分化诱导期用007处理棕色前体脂肪细胞会使细胞中脂滴积累增加,脂肪生成基因Fabp4、Pparg和产热基因Pgc1α、Ucp1的表达水平显著上调(图6d,e 和附图9a)。与小鼠类似,用007处理人棕色前体脂肪细胞后,C/EBPβ的表达也显著增加(图6f)。
研究人员使用人诱导多能干细胞(hiPSCs)诱导生成人米色/棕色样脂肪祖细胞(hiPSC-BAPs)以用于3D培养。与对照组相比,用007处理的 hiPSC-BAP类器官的细胞增殖水平显著提高(图6g, 附图9b),增殖标志基因MKI67(编码Ki67)表达显著上调。用007处理hiPSC-BAP类器官之后诱导分化,分化结束后能观察到UCP1的表达水平增加(图6h)。此外,2D培养(平面培养)时,在前体脂肪细胞中用007处理hiPSC-BAPs后,细胞增殖数量和UCP1表达水平均显著增加(附图9c,d)。
综上所述,EPAC1的激活诱导了人类棕色前体脂肪细胞和iPSC来源的棕色前体脂肪细胞的增殖和分化能力,这也显示出,除了药理性激活产热脂肪细胞的增殖和分化能力之外,移植iPSC来源的BAT前体细胞也可能是增加产热脂肪数量的另一种策略。
之前有研究发现,EPAC1基因突变变体与BMI呈正相关。为了研究这种突变是否会影响EPAC1对前体脂肪细胞的促增殖作用,研究人员用慢病毒载体WT EPAC1或EPAC1变体(EPAC1(L300P))转染EPAC1 KO小鼠的棕色前体脂肪细胞,结果显示,用007或NA处理后,转染WT EPAC1的棕色前体脂肪细胞增殖均显著增加,相比之下,转染EPAC1(L300P)或空载对照的棕色前体脂肪细胞在使用007和NA处理前后,棕色前体脂肪细胞的增殖能力无显著变化(图6i)。综上所述,EPAC1(L300P)会导致BAT质量降低,扰乱能量稳态,从而导致携带这种变体的人BMI增加。
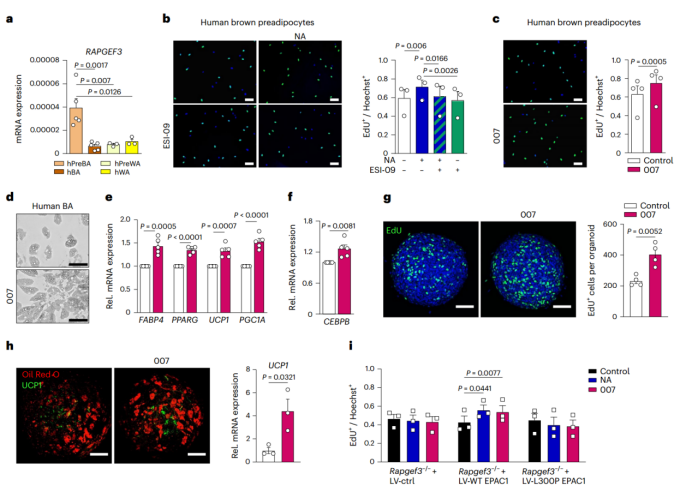
图6. 激活EPAC1可诱导褐色脂肪细胞的增殖和分化
附图9. 激活EPAC1诱导hiPSC-BAP增殖和分化
总结
综上所述,EPAC1是棕色脂肪细胞增殖和分化的主要调节因子,是一种可以通过药理学激活剂直接靶向、能够促进人类棕色/米色脂肪组织生长、能量消耗的潜在靶点。在BAT移植治疗手术中,体外激活iPSC衍生的人棕色/米色前体脂肪细胞中的EPAC1可能是一种增强BAT移植疗效的方法,激活EPAC1能够通过增加BAT质量和能量消耗来改善糖尿病和肥胖。
原文链接:https://doi.org/10.1038/s41556-023-01311-9
关注微信公众号代谢学人
了解更多代谢前沿资讯

https://blog.sciencenet.cn/blog-3483272-1423433.html
上一篇:Neuron: Irisin让你不再困在时间里
下一篇:代谢学人 Cell Metabolism: 代谢与免疫 成也萧何败也萧何