博文
Nature Metabolism: 肥胖可意会,亦可“炎”传
||
代谢学人
Nature Metabolism:肥胖可意会,亦可“炎”传
撰文 | 程诗淼 高铭远 生茂正 郭盈盈 于剑
编辑 | 孟美瑶
校对 | 于剑

背景介绍
目前肥胖已成为全球健康流行病之一,流行病学研究表明,肥胖与胰岛素抵抗、代谢综合征、心血管疾病、骨关节炎和各种癌症发展密切相关。在临床和小鼠模型中均已发现慢性WAT炎症与胰岛素抵抗和2型糖尿病的发展存在相关性,然而哺乳动物脂肪组织炎症的根本来源仍有待研究。
研究表明,在饮食诱导的肥胖(Diet-induced obesity, DIO)和遗传性肥胖小鼠模型中,脂肪组织整合蛋白αX (Integrin alpha X, CD11c)阳性的炎性巨噬细胞释放的促炎细胞因子和外泌体microRNA的增加会导致WAT和肝脏炎症水平显著上调,进而诱发全身胰岛素抵抗,而促炎因子的缺失或CD11c+细胞的诱导性缺失能够改善饮食诱导肥胖小鼠的葡萄糖稳态。此外,临床研究也表明,在成年肥胖症患者中,IFN-γ能够调节单核细胞向WAT炎性巨噬细胞的发育,减少WAT中的调节性T细胞数量,并与胰岛素抵抗指数(Homeostatic Model Assessment for Insulin Resistance, HOMA-IR)呈正相关。
近期研究发现IL-12白细胞介素12(Interleukin 12, IL-12)能够刺激肥胖期间WAT中Ⅰ型先天淋巴细胞(Innate lymphoid cells, ILC)产生IFN-γ,进而驱动WAT炎症和全身代谢功能障碍。然而,在肥胖期间IL-12产生的具体机制以及WAT中产生IL-12的具体细胞种类尚不清楚。为了解决这一问题,加州大学洛杉矶分校的Timothy E. O’Sullivan团队进行相关研究,其成果“Adipose cDC1s contribute to obesity-associated inflammation through STING-dependent IL-12 production”近期发表在Nature Metabolism上,该研究发现肥胖期间含有自身DNA的凋亡小体的内吞作用能够以cGAS-STING依赖性方式驱动常规1型树突状细胞(Conventional type 1 dendritic cells, cDC1s)产生IL-12,进而导致肥胖期间脂肪组织炎症和代谢功能障碍。

敲黑板啦!
1、肥胖期间活化的cDC1s表达IL-12b
2、NK细胞通过产生Xcl1积累WAT cDC1s
3、cDC1s调节肥胖相关的WAT炎症和代谢功能障碍
4、WAT cDC1s产生IL-12需要STING
5、凋亡小体内吞作用诱导cDC1s中IL-12的产生
研究结果
1. 肥胖期间活化的cDC1s表达IL-12b
为了探究肥胖期间IL-12的来源,研究人员对先前发表的四个人类和小鼠WAT scRNA-seq数据集进行了Meta分析。IL-12仅由髓样细胞(巨噬细胞和树突状细胞)产生,因此研究人员着重分析了肥胖患者和肥胖小鼠的髓样细胞簇,人类和小鼠WAT髓样细胞图谱中分别包含22,029和17,781个人类细胞以及60,783和8,458个小鼠细胞,基于标记基因的差异表达,研究人员对图谱中的细胞进行聚类分析,并使用UMAP算法进行可视化分析(图1A、B、图S1A、B)。在人类数据集确定8个保守细胞簇:cDC1s、活化的cDC1s、常规2B型树突状细胞(cDC2Bs)、炎性巨噬细胞、脂质相关巨噬细胞、血管周围巨噬细胞、中性粒细胞和非经典单核细胞(图1A、图S1A);在小鼠数据集中确定7个保守细胞簇:cDC1s、活化的cDC1s、cDC2Bs、炎性巨噬细胞、脂质相关巨噬细胞、血管周围巨噬细胞和经典单核细胞 (小编注:此处研究人员分别对肥胖患者和肥胖小鼠的两个WAT髓样细胞簇进行分析,并将两组髓样细胞簇共有的细胞类型定义为保守细胞簇。由于与其他髓系细胞相比,中性粒细胞的基因表达数量和水平普遍较低,且该类群细胞半衰期短、易受外力损伤破坏,因此在常规数据集中可能无法准确测出中性粒细胞群。在本文小鼠使用的两个数据集中,一个图谱里鉴定出中性粒细胞的数量较少,而另一个图谱里没有鉴定出中性粒细胞,因此作者认为中性粒细胞不是肥胖小鼠的保守细胞簇)(图1B、图S1B)。通过跨物种分析最终鉴定出6个保守的髓细胞亚群,分别是cDC1s、活化的cDC1s、cDC2Bs、炎性巨噬细胞、脂质相关巨噬细胞和血管周围巨噬细胞。并且研究人员还发现,在所有数据集中,只有活化的cDC1细胞簇高表达IL12B/Il12b 转录本(图1C、D),因此推测小鼠和人类肥胖期间IL-12可能仅来源于活化的cDC1s。
为进一步验证这一发现,研究人员使用Il12btm1.1Lky/J(即Il12bYFP)报告小鼠探究饮食诱导肥胖小鼠WAT中IL-12b的表达情况。通过对HFD和LFD喂养4周的小鼠的总YFP+细胞进行无偏分析,发现WAT内YFP信号高度激活,并且约70%产生IL-12b的细胞被鉴定为是CD45+Lin−CD88−MHCII+CD11c+CD11b−XCR1+细胞,这与cDC1s的标志基因相一致(图S2A、B)。此外,与LFD相比,HFD喂养小鼠的YFP+细胞在VAT cDC1s和SAT cDC1s中的比例和平均荧光强度均有所增加,而cDC2s和巨噬细胞群中YFP+细胞并未发生变化(图1E、图S2B-D)。此外,对YFP+细胞绝对密度的分析表明,肥胖期间产生IL-12b的cDC1s的数量增加,且与SAT相比,YFP+细胞在VAT中的积累更多(图1F)。除此之外,研究人员还发现YFP+细胞比例和平均荧光强度在LFD和HFD喂养小鼠的脾脏和肝脏cDC1s中没有差异(图S2E-H),进一步表明了肥胖早期只有WAT cDC1s产生的IL-12b增多。接下来,研究人员进一步发现脂肪组织YFP+cDC1s中IL-12b的产生和积累并不局限于HFD,因为Il12bYFP小鼠经西方饮食喂养4周后,YFP+细胞在WAT cDC1s中的比例、MFI和绝对密度也有所增加(图S2I-K)。先前研究已经表明WAT cDC1s数量与患者体重指数呈正相关,研究人员也发现cDC1s和YFP+cDC1s数量均与小鼠VAT重量呈正相关(图1G、H),而YFP+cDC1s的百分比与VAT重量没有相关性(图1I),这表明WAT中cDC1s的积累可能会导致HFD喂养小鼠IL-12水平的增加。
已知IL-12b是构成IL-12p70(IL-12)和IL-23的共同亚基,因此研究人员通过ELISA分析了LFD和HFD喂养4周龄小鼠的内脏WAT基质血管部分(SVF)上清液中的IL-12p70和IL-23蛋白水平,结果发现LFD喂养小鼠的细胞上清液中不含有这两种细胞因子,而HFD喂养小鼠的细胞上清液中只含有IL-12p70(图1J)。这些结果与人类和小鼠scRNA-seq数据集中IL23A/Il23a和IL12B/Il12b转录本没有在任何一个髓系细胞群共表达的结果一致(图S2L、M)。此外,研究人员还对HFD喂养小鼠的WAT cDC1s、cDC2s和巨噬细胞群的上清液进行ELISA分析,发现只有WAT cDC1s分泌IL-12p70,表明肥胖期间WAT中的IL-12主要由cDC1s产生。
拓展阅读
树突状细胞(Dendritic cells,DCs)是机体专职抗原递呈细胞(Antigen presenting cells,APC),通过向淋巴细胞呈递自身抗原,从而介导免疫耐受并维持组织稳态。在脂肪组织中主要包含DCs的两个主要亚群:常规树突状细胞(conventional DCs,cDCs)和浆细胞样树突状细胞(plasmacytoid DCs,pDCs)。pDCs是产生大量I型干扰素(IFN-I)的特化分泌细胞,可促进机体对病毒感染的反应,而cDCs主要应用于抗原呈递和启动T细胞反应,并且cDCs能够上调内脏脂肪组织中参与脂肪细胞分化的途径,通过适应肥胖早期的组织扩张,在调节全身代谢反应及脂肪组织炎症方面发挥关键作用。
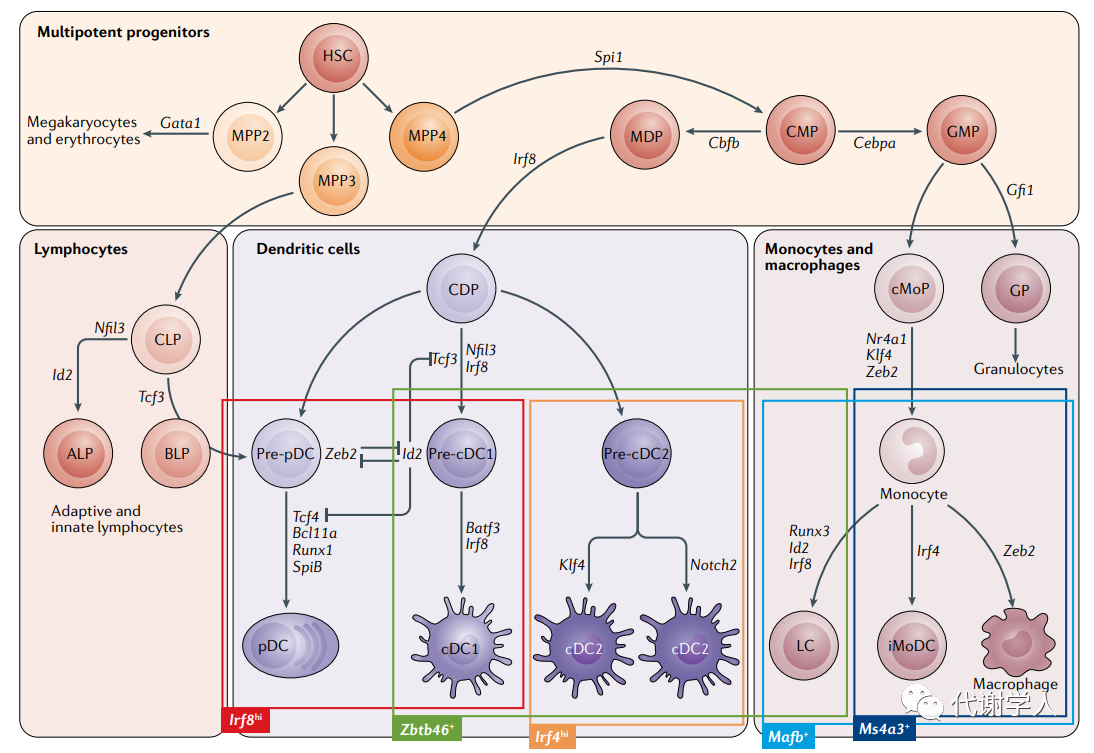
参考文献:
[1]Qian X et al. FEBS J. 2022 Dec;289(24):7830-7853.
[3]Anderson DA 3rd et al. Nat Rev Immunol. 2021 Feb;21(2):101-115.
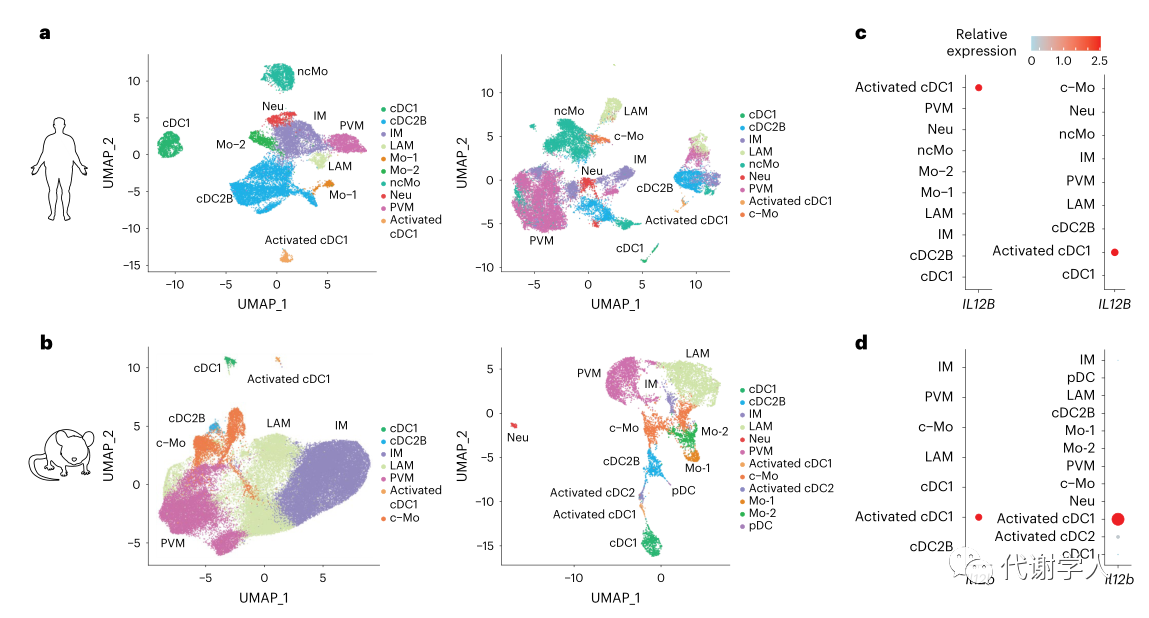
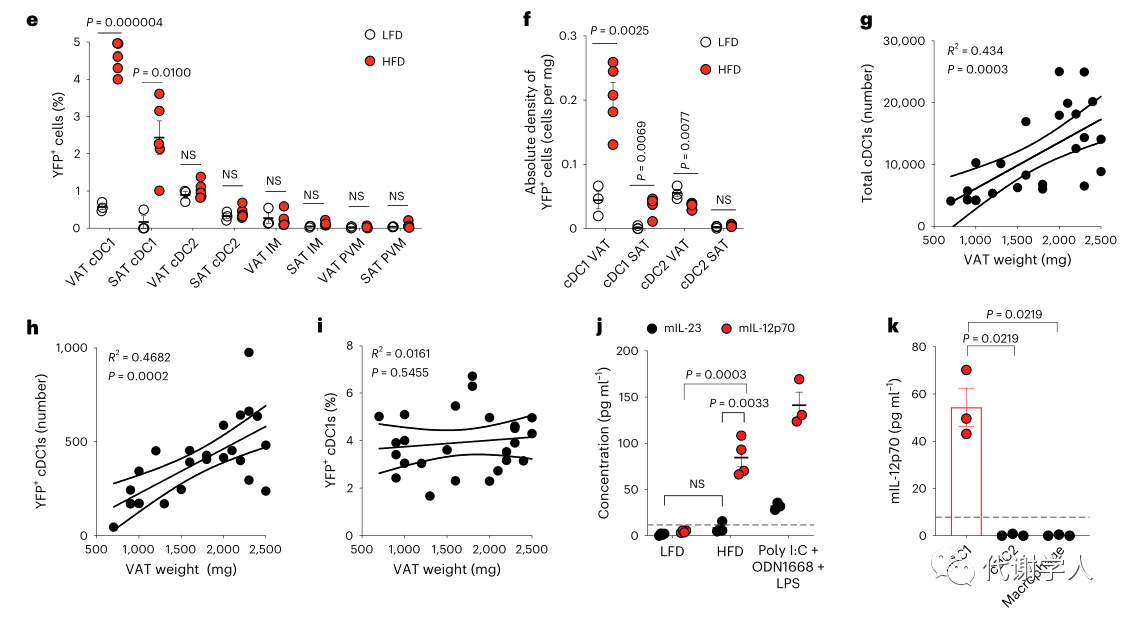
图1.在小鼠和人类肥胖期间,来自激活的cDC1s的IL-12信号传导增加
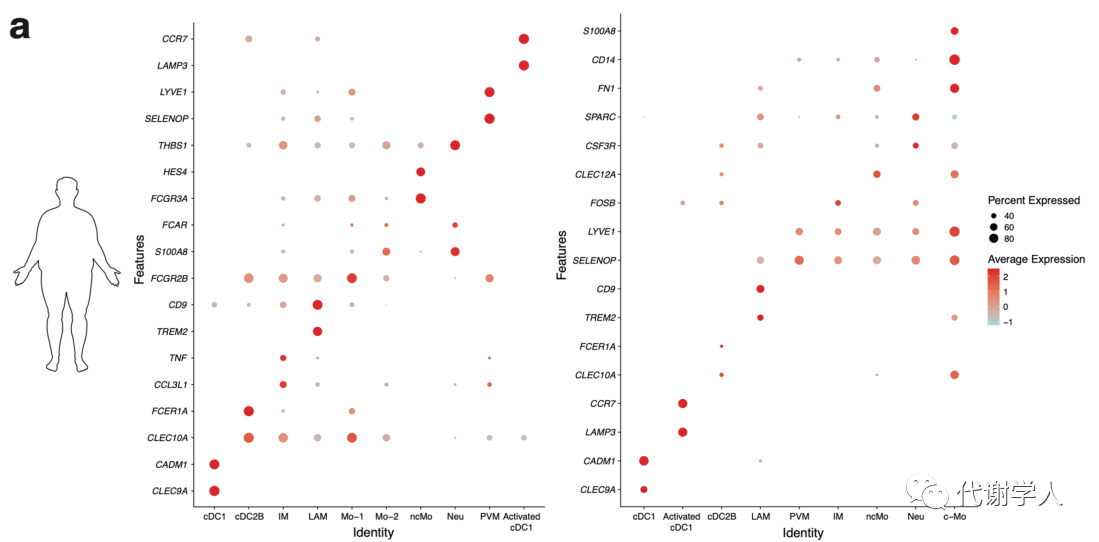
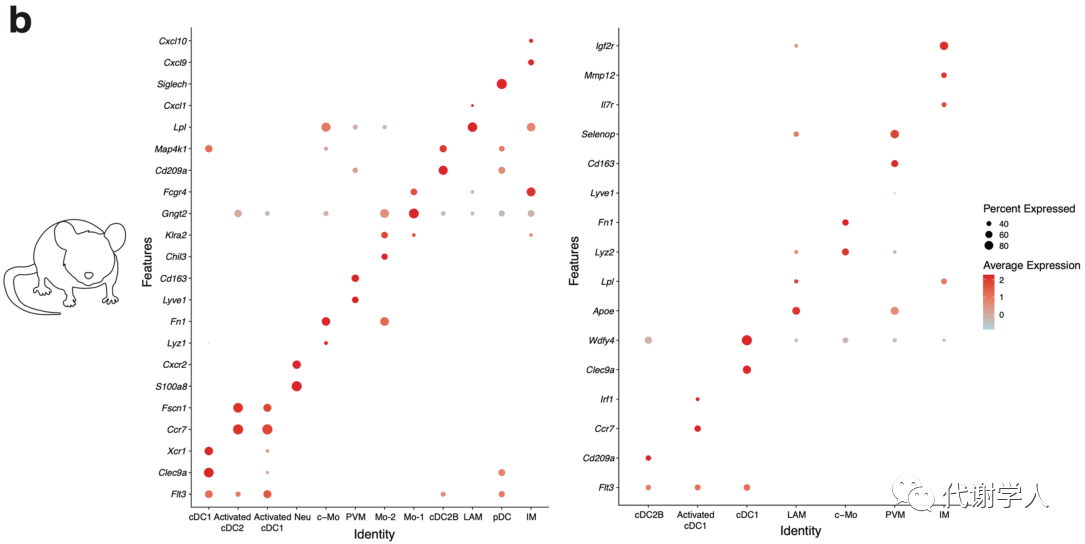
图S1.来自肥胖小鼠和人类WAT scRNAseq数据集的髓系细胞谱系相关基因特征

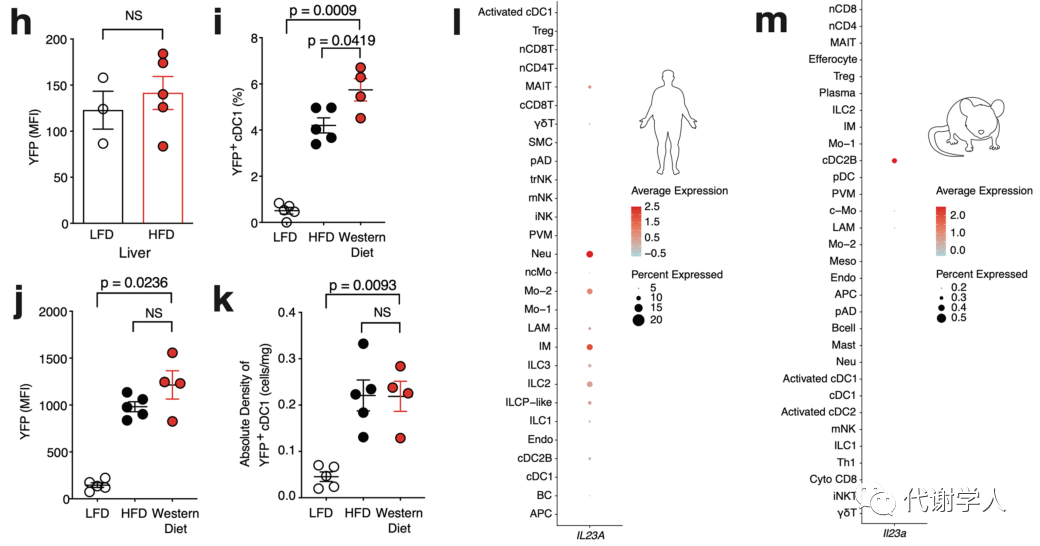
图S2.肥胖期间WAT cDC1s中IL-12的产生增加,与饮食无关
2. NK细胞产生的Xcl1有助于WAT cDC1s的积累
虽然先前的研究已经证实树突状细胞在小鼠和人类脂肪组织内积累,但在肥胖期间将cDC1s募集到WAT的细胞类型和机制尚不清楚。与此同时有研究表明NK细胞在抗病毒反应和肿瘤微环境中参与募集cDC1s,并且cDC1s在HFD小鼠的WAT中积累,于是研究人员认为在肥胖期间WAT内也存在类似的通路。研究人员利用先前的人类WAT scRNA-seq数据集进行受体-配体分析,发现成人NK细胞中的趋化因子XCL1(Lymhotactin)与cDC1s上XCL1的同源受体XCR1(X-C Motif Chemokine Receptor 1)间存在显著相互作用(图2A)。与来自瘦人的WAT scRNA-seq样本相比,肥胖患者NK细胞中的XCL1转录水平升高(图2B),说明肥胖期间NK细胞-cDC1通路上调。为了进一步探究NK细胞是否在体内产生Xcl1,研究人员使用LFD和HFD喂养Xcl1mTfp1-fl小鼠4周后,发现HFD喂养小鼠内脏WAT中TFP+细胞比例、MFI和细胞数量显著上调,这证明了NK细胞是Xcl1的主要来源(图2C-E、图S3A、B)。
接下来,为了探究肥胖期间WAT cDC1的积累是否需要NK细胞,研究人员使用LFD和HFD喂养4周的Ncr1(icre)/+Eomesflox/flox小鼠(小编注:该品系小鼠为NK细胞特异性敲除小鼠),并分析其中的cDC1s群体。结果表明,两组小鼠的体重,食物摄入量及脂肪组织重量均没有差异(小编注:作者在后文通过大量实验证实了cDC1能够促进WAT炎症和全身代谢功能障碍,而HFD喂养的对照组和NK细胞特异性敲除组小鼠的体重,食物摄入量及脂肪组织重量没有差异,推测NK敲除后可能存在除了cDC1以外的其他机制调控代谢进程,消除了cDC1抑制肥胖的作用)(图S3C-F),但HFD喂养的NK细胞特异性敲除小鼠中VAT cDC1s的绝对密度降低,甚至在HFD喂食12周后仍然降低(图2F-H)。为了确定是否是NK细胞产生的Xcl1导致了这种表型,研究人员对过继移植策略进行优化,将1×106纯化的同源特异性脾脏NK细胞转移到NK细胞缺陷小鼠中,从而对VAT内的NK细胞群进行重建(图S3G-I)。为了敲除成熟NK细胞中的Xcl1,研究人员使用CRISPR-Cas9基因组编辑技术,为Xcl1和非靶向对照(NTC)的Rosa26位点开发了高效向导RNA,结果发现过继转移NTC能够恢复HFD喂养的NK细胞缺陷小鼠中VAT cDC1的数量,而Xcl1 cRNP编辑的细胞并不能发挥该作用(图2F、G),表明肥胖期间NK细胞通过产生Xcl1募集WAT cDC1s。
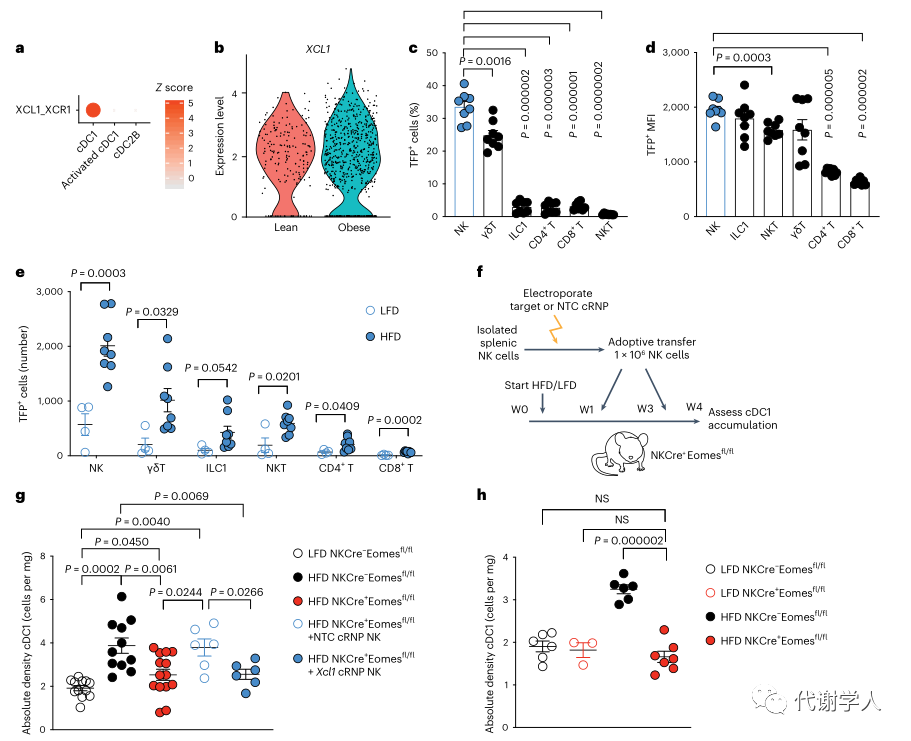
图2.NK细胞在肥胖期间通过Xcl1募集cDC1s
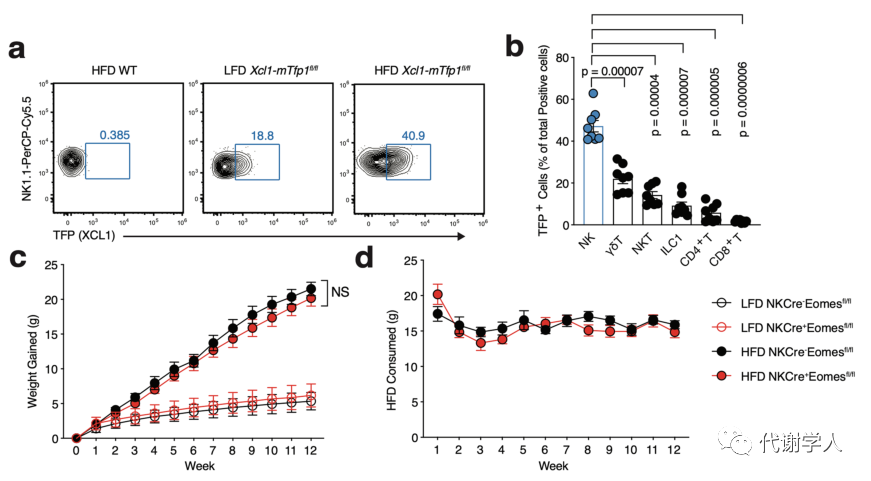
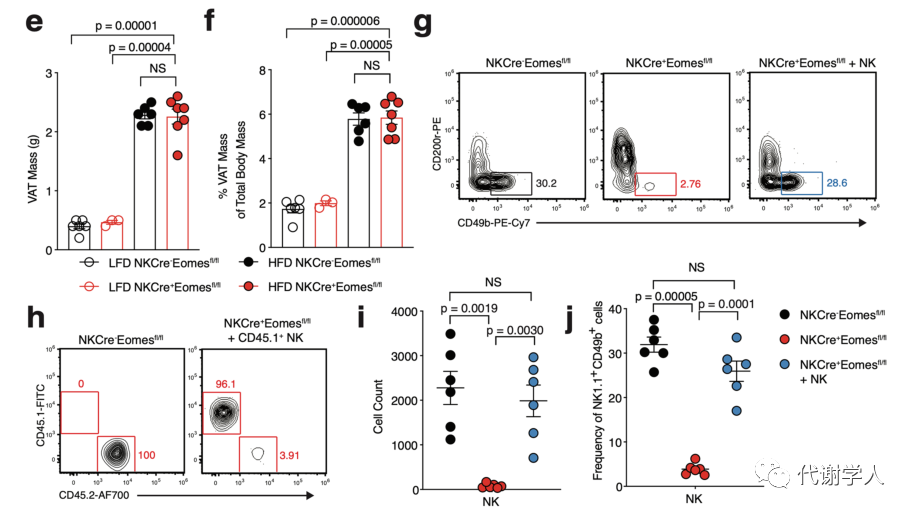
图S3.NK细胞是Xcl1的主要来源,NKCre+Eomesfl/fl小鼠可用体内研究NK细胞功能
3. cDC1s调节肥胖相关的WAT炎症
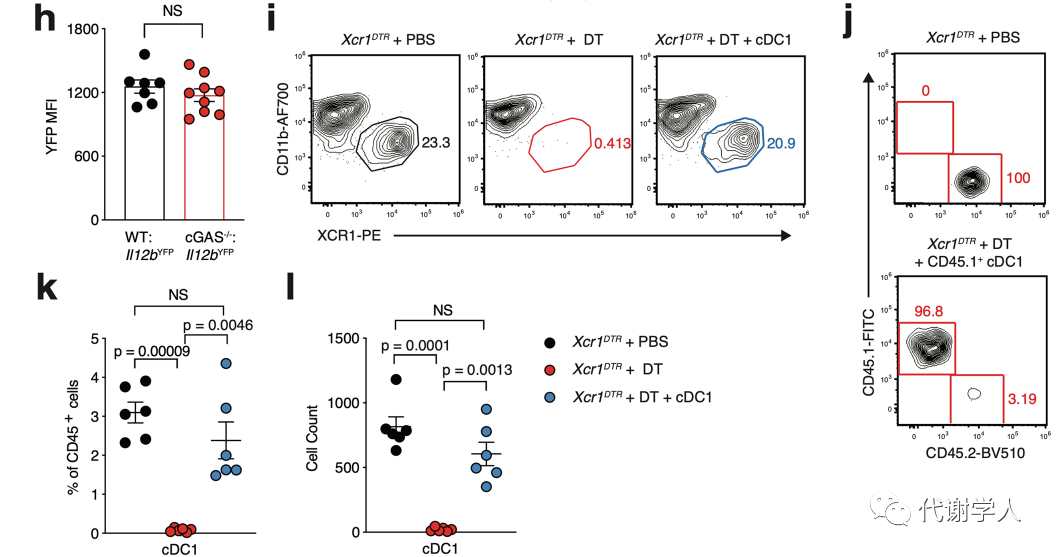
为了进一步确定肥胖期间IL-12的产生是否需要cDC1s,研究人员使用了Xcr1DTR小鼠,该种小鼠能够在白喉毒素(DT)介导下诱导清除Xcr1cDC1细胞。基于此,研究人员给Xcr1DTR小鼠腹腔注射20 ng·g−1 DT并在24小时后测定cDC1s的消耗情况,结果发现内脏WAT cDC1s完全被清除(图3A、B),但不影响cDC2s的比例和数量(图S4A、B),这证实了DT确实能够诱导清除Xcr1cDC1细胞。然后研究人员对Xcr1DTR小鼠LFD或HFD喂养4周,并且每3天腹膜内注射DT或PBS,发现在DT治疗后小鼠内脏WAT cDC1s仍全部被消耗(图S4C)。研究人员还发现从HFD喂养、DT处理的Xcr1DTR小鼠中分离培养的内脏WAT SVF细胞上清液中的IL-12p70水平显著下调(图3C)。
接下来,为了探究cDC1s消耗对肥胖相关的WAT炎症的影响,研究人员对PBS或DT处理的Xcr1DTR小鼠内脏WAT中的巨噬细胞群进行分析,发现在LFD或HFD喂养4周后,cDC1s的消耗导致HFD喂养的Xcr1DTR小鼠中炎症巨噬细胞和脂质相关巨噬细胞群减少(图3D、E、图S2B),表明cDC1s可以在稳定状态下调控脂质相关巨噬细胞的丰度。由于IFN-γ与WAT中促炎巨噬细胞亚群的极化和积聚有关,于是研究人员假设能够产生IL-12的cDC1s细胞群被消耗后会下调肥胖期间IFN-γ的水平进而抑制促炎巨噬细胞的积聚,并对其进行了探究。
已有研究报道NK细胞和WAT固有的1型先天性淋巴细胞(ILC1s)是饮食诱导肥胖期间IFN-γ的主要来源。实验结果也表明,HFD喂养小鼠内脏WAT中NK细胞和ILC1s产生的IFN-γ水平上调(图3F-H、图S4D),而cDC1s的持续消耗则减少了两个细胞亚群中IFN-γ水平(图3F-H)。已有报道证实HFD喂养能够增加内脏WAT NK细胞和CD8+T细胞的绝对密度,但研究人员发现DT清除cDC1s不会影响NK细胞、ILC1s、NK T细胞和CD8+T淋巴细胞的绝对密度(图S4D、E)。此外,研究人员还发现LFD喂养小鼠的NK T细胞和CD8+T细胞中产生的IFN-γ少于HFD组,cDC1s消耗对IFN-γ细胞的占比或数量未产生影响(图S4F、G)。虽然cDC1s消耗不影响ILC1s增殖,但研究人员通过Ki-67染色发现HFD喂养期间cDC1s的消耗确实降低了Ki-67+NK细胞的占比(图S4H、I),说明cDC1s可能参与内脏WAT NK细胞的增殖。以上数据表明,cDC1s通过上调WAT中IFN γ的水平来促进炎症巨噬细胞的积累,进而导致肥胖相关炎症的产生。
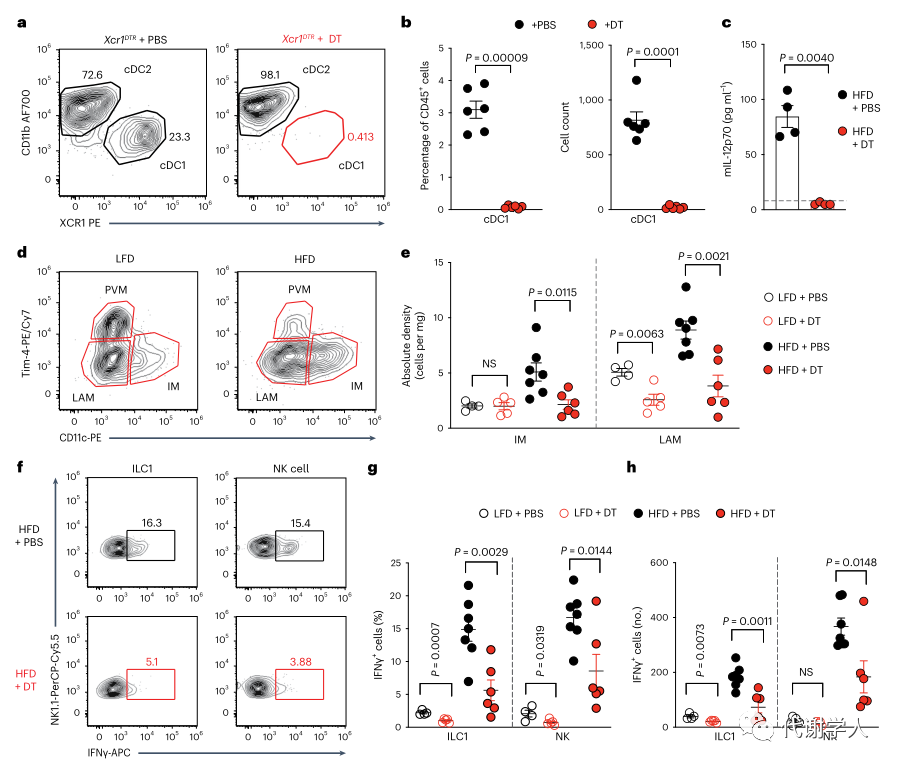
图3.cDC1s通过IM积累和第1组ILC IFN-γ的产生调节肥胖相关的WAT炎症
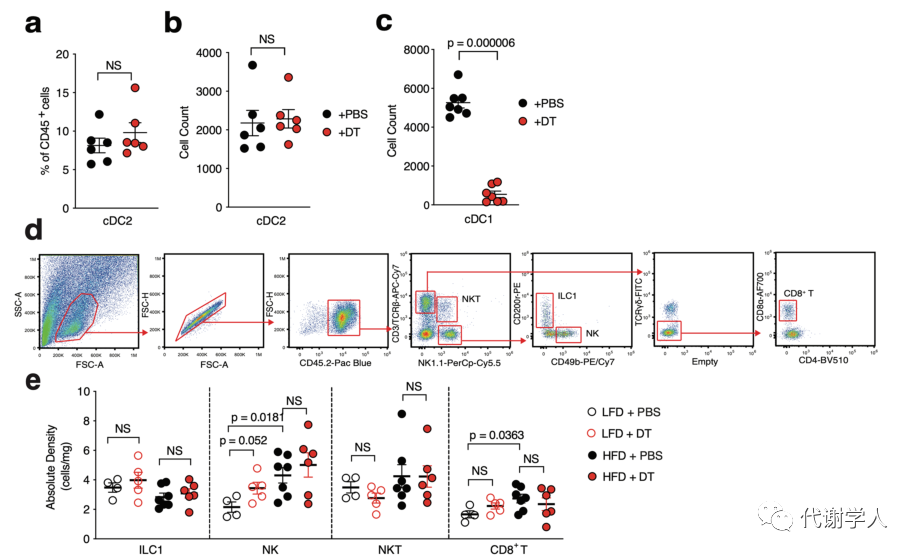
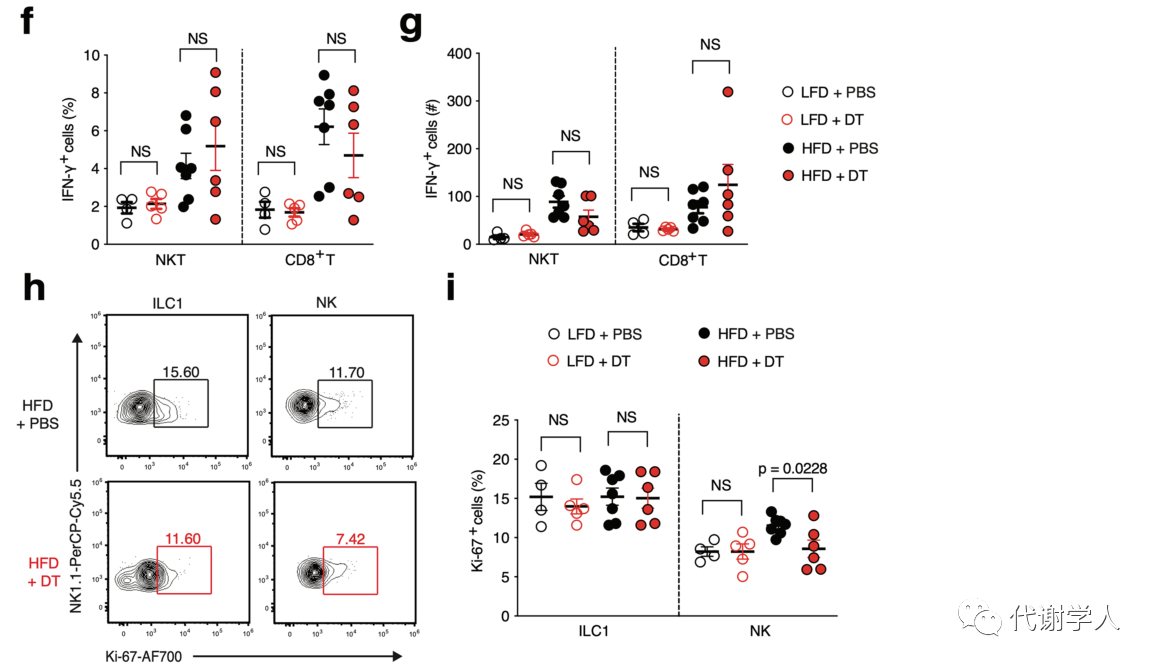
图S4.cDC1s耗竭不会影响WAT中cDC2s、1型淋巴细胞积累或ILC1增殖
4. 棕色脂肪组织对初次产热反应的响应
虽然树突状细胞与维持脂肪组织和肠道稳态有关,但树突状细胞亚群在肥胖相关代谢功能障碍中的具体作用仍不清楚。为了探究cDC1s是否能够促进肥胖期间成年小鼠的代谢功能障碍,研究人员使用LFD或HFD喂养Xcr1DTR小鼠6周,并在第二周使用DT清除固有的cDC1s,以确定DT处理和肠道cDC1s消耗对微生物组成的潜在复杂影响。然后,研究人员分别使用DT或PBS处理小鼠4周,以保证连续消耗cDC1s或重建组织中内源性cDC1(图4A、图S5A、B)。研究人员发现DT处理的WT小鼠和Xcr1DTR小鼠中cDC1s的消耗都没有导致HFD诱导的体重增加、WAT和肝脏重量积累以及食物消耗增加(图4B、图S5C-I),并且PBS或DT处理的LFD喂养小鼠间没有差异。而与WT和cDC1重建对照组(PBS组)相比,HFD喂养的cDC1消耗小鼠的空腹血清胰岛素水平、血糖水平和HOMA-IR指数值均降低(图4C-E)。此外,与cDC1重建组相比,HFD喂养、DT处理的Xcr1DTR小鼠全身糖耐量增加(图4F)。在所有分析中,PBS处理的重建对照组小鼠与未经DT处理的Xcr1DTR小鼠没有差异(图4B、图S5C-I),表明内源性重建或募集cDC1s足以诱导所观察到的肥胖表型。3种不同处理的HFD喂养小鼠的全身胰岛素敏感性没有差异(图4G),但研究人员通过对磷酸化Akt进行WB分析,发现HFD喂养的小鼠中cDC1s的消耗上调VAT中的胰岛素信号,但没有影响肝脏的胰岛素信号(图4H-K),这些数据表明虽然cDC1s在稳定状态下不参与调节代谢稳态,但cDC1s诱导肥胖期间的全身性葡萄糖耐受不良和组织特异性WAT胰岛素抵抗(小编注:已有研究表明IL-12能够刺激肥胖期间WAT中ILC产生IFN-γ,进而驱动WAT炎症和胰岛素抵抗。在上文中研究人员主要探究的是WAT中产生IL-12的具体细胞种类,补充IL-12相关的信号通路)。
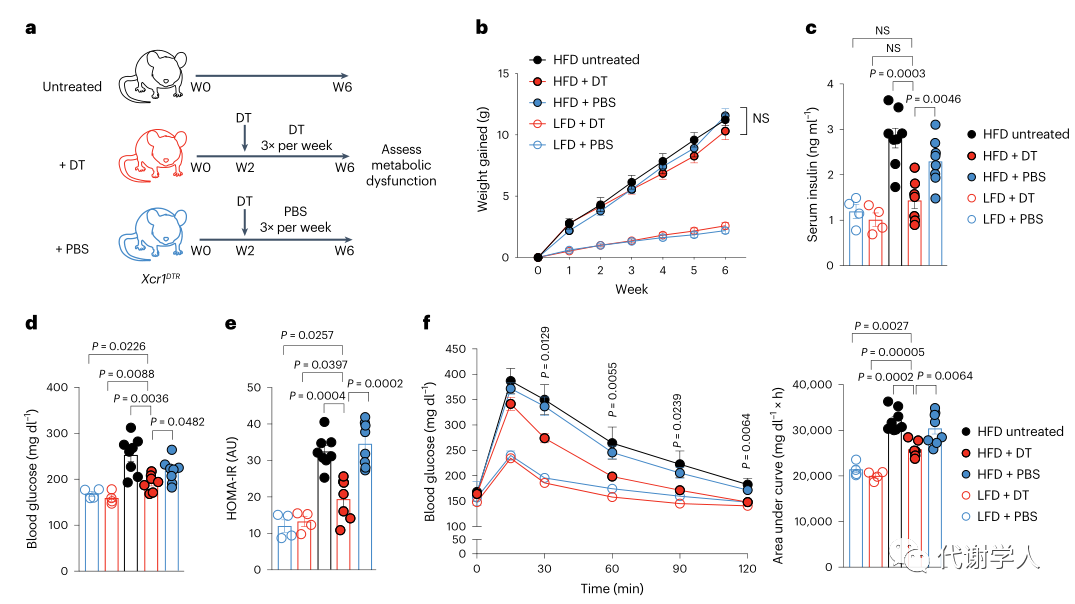
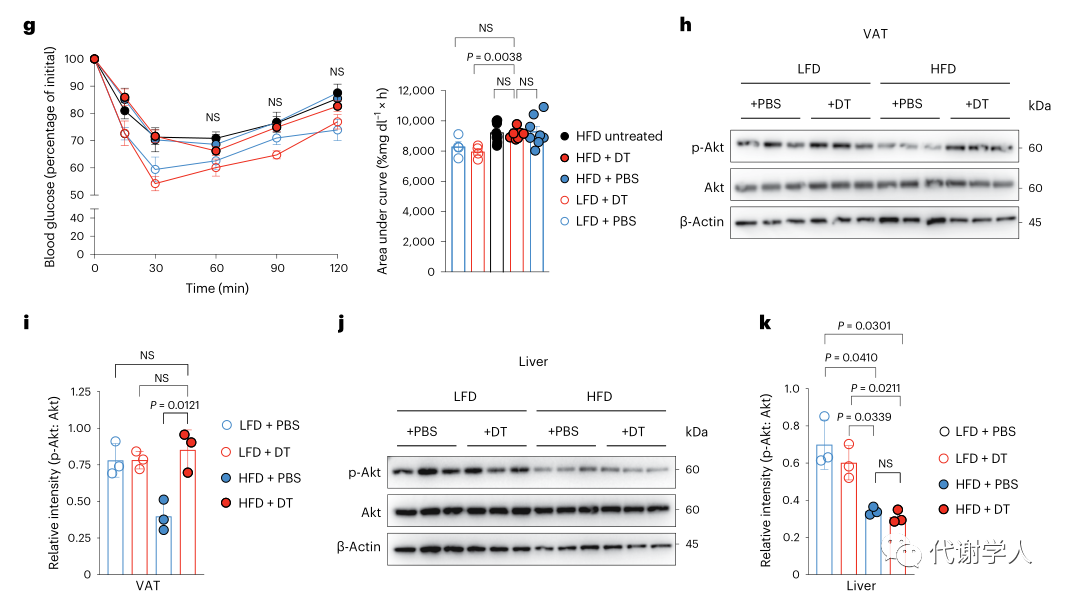
图4.cDC1s导致肥胖期间的代谢功能障碍
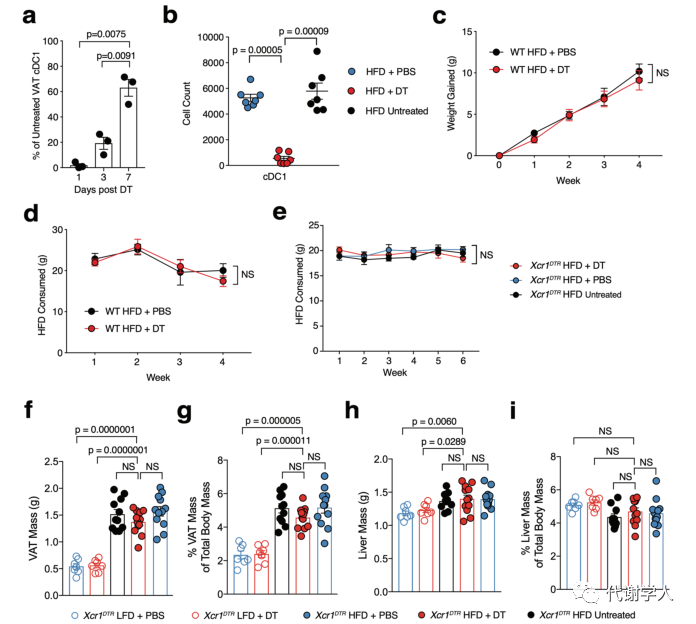
图S5.WT小鼠的DT治疗和成年小鼠的cDC1s耗竭都不会影响体重增加、消耗或组织质量积累
5.WAT cDC1s产生IL-12需要STING
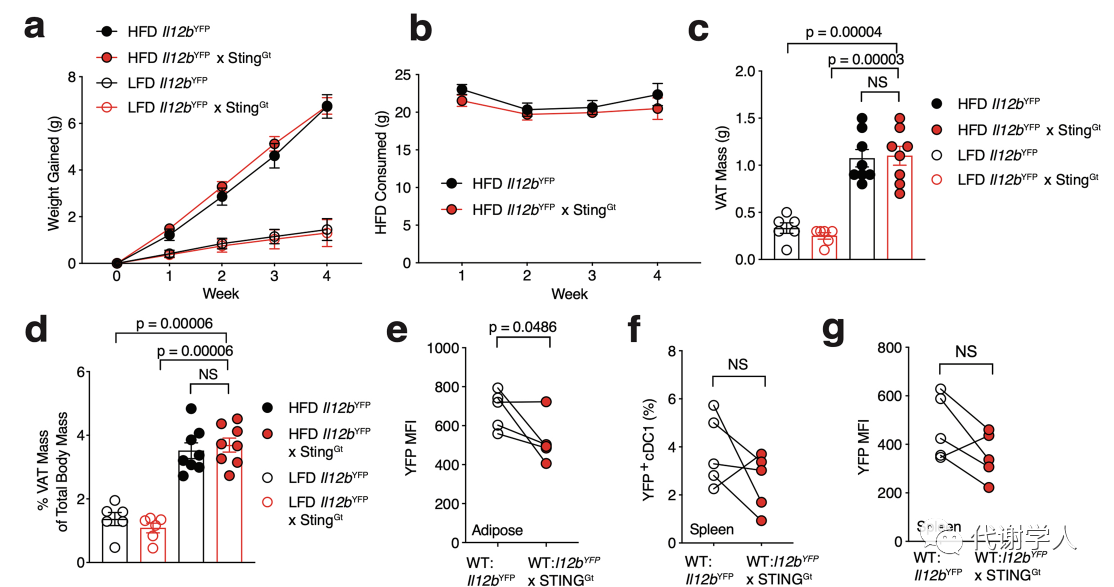
先前研究报道内质网应激、脂毒性、缺氧和Toll样受体激活与肥胖早期促炎细胞因子的产生有关,然而WAT如何诱导IL-12产生尚不清楚。于是研究人员对LFD或HFD喂养小鼠的VAT cDC1s进行分选纯化和RNA测序,随后对差异表达基因进行富集分析,发现HFD喂养小鼠的cDC1s中感知细胞质DNA的先天免疫激活通路显著上调(图5A),差异表达基因富集发现许多参与树突状细胞活化和STING信号通路的转录本包括Cd84、Il12b、TANK结合激酶1(TANK Binding Kinase 1,Tbk1)、IFN基因刺激因子(Stimulator of Interferon Genes,Tmem173)、TNF受体相关因子6(TNF receptor associated factor 6,TRAF6)水平显著上调(图5B)。接下来,为了探究STING的激活是否参与肥胖期间cDC1中IL-12的产生,研究人员使用了携带YFP报告基因和Tmem173(Sting)基因发生错义突变的小鼠(Il12bYFPx StingGt小鼠)。然后研究人员LFD或HFD喂养Il12bYFPx StingGt小鼠和WT小鼠以评估cDC1 IL-12的产生,发现与WT小鼠相比,HFD喂养的Il12bYFPx StingGt小鼠的体重、WAT重量和食物摄入量均没有差异(图S6A-D),但内脏WAT cDC1中IL-12的比例和MFI均有所降低(图5C、D)。为了进一步确定IL-12的产生是否需要cDC1内在STING信号转导,研究人员采用骨髓嵌合方法,首先用busulfan处理受体WT小鼠,清除受体小鼠的骨髓,再分别给两种小鼠注射Il12bYFP小鼠骨髓(对照组)或Il12bYFP小鼠和IL12bYFPxStingGt小鼠的骨髓1:1混合骨髓(实验组)(图5E),前者STING基因可以正常表达,后者的STING基因表达则被显著抑制。通过建立这种模型,研究人员可以评估STING含量对cDC1s IL-12的影响。在恢复6周后,研究人员发现与STING充足的cDC1s相比,STING缺乏的WAT cDC1s中YFP+cDC1s的比例和MFI降低(图5F、图S6E),而其他外周器官中YFP+cDC1s的比例和MFI没有变化(图S6F、G),表明cDC1内在STING激活有助于肥胖期间WAT中IL-12的产生。
为了确定WAT cDC1s内的STING信号是如何启动的,研究人员评估了几种潜在的上游机制。通常环鸟苷酸-腺苷酸合成酶(Cyclic GMP-AMP synthase,cGAS)感应胞质DNA会触发第二信使2'3'-cGAMP的产生,该信使结合并激活STING可导致树突状细胞激活。然而,2'3'-cGAMP也被证实可以不通过cGAS对胞质DNA的感知并直接激活临近细胞中的STING信号(小编注:肿瘤细胞内产生的cGAMP可以在病毒感染的背景下通过间隙连接、病毒颗粒转移,以及膜融合等多种机制转移到宿主细胞以触发STING信号通路,例如肿瘤来源的cGAMP能够在非肿瘤细胞中触发STING介导的干扰素通路),因此肥胖期间邻近细胞cGAS的激活和旁分泌2'3'-cGAMP信号转导可能间接促进cDC1s中STING信号的激活。为了探究实质细胞cGAS激活产生的外源2'3'-cGAMP是否有助于cDC1 IL-12的产生,研究人员采用骨髓嵌合方法,使用Il12bYFP小鼠的骨髓重建了WT和cGAS−/−小鼠的骨髓(图5E)。由此产生的骨髓嵌合小鼠发育出的所有造血谱系细胞均来自Il12bYFP供体骨髓,而实质细胞仍然来自自身。在HFD喂养4周后,研究人员发现cGAS−/−:Il12bYFP和WT: Il12bYFP小鼠的内脏WAT cDC1s YFP+比例及MFI没有差异(图5G、图S6H),表明实质细胞依赖cGAS产生的2'3'-cGAMP并不能促进cDC1 IL-12的产生。
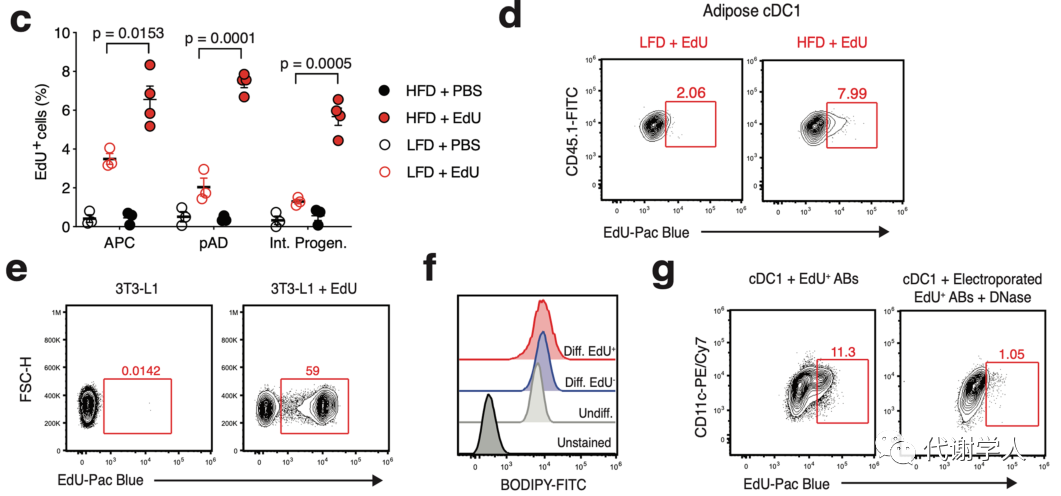
cDC1s细胞质中cGAS-STING通路的激活也被证明是通过摄取细胞外DNA进行的。肥胖期间凋亡的脂肪细胞释放的DNA已被证明可以增强WAT炎症和胰岛素抵抗,研究人员假设肥胖期间WAT内DNA摄取促进了STING介导cDC1产生IL-12。为了验证这一观点,研究人员开发了一种体内模型,使用5-乙基-2′-脱氧尿苷(EdU)标记增殖的宿主细胞DNA(图5H),以评估过继转移的cDC1s对EdU DNA的摄取。接着对Xcr1DTR(CD45.2)小鼠LFD或HFD喂养4周,每3天腹腔注射一次EdU或PBS,并在4周后对小鼠进行DT处理以耗尽宿主的CD45.2+cDC1s,然后过继转移CD45.1+cDC1s,发现在24小时后,过继转移的cDC1s已经完成VAT中的CD45+细胞重构,并在比例和数量上接近WT水平(图S6I-L)。随后研究人员对EdU处理小鼠中的WAT非免疫细胞亚群进行分析,发现一部分前脂肪细胞、脂肪前体细胞和间质祖细胞掺入了EdU(图S7A、B),由于在HFD喂养和脂肪组织扩张过程中脂肪细胞祖细胞的增殖增强,EdU在这些细胞类型中的掺入比例增加(图S7B、C)。对WAT中cDC1s的分析表明,过继转移的cDC1s不仅从宿主细胞中摄取了EdU标记的DNA,而且与LFD喂养的EdU处理小鼠相比,HFD喂养小鼠的cDC1s中只增强了EdU标记的DNA摄取(图5I、图S7D),而PBS处理的对照小鼠在任何条件下都没有观察到EdU+cDC1s(图5I)。此外,研究人员还发现cDC1s增强的DNA摄取仅限于HFD期间的WAT中,因为在LFD和HFD喂养、EdU处理小鼠的肝脏或脾脏中,过继转移EdU+cDC1s的比例没有差异(图5I)。这些数据表明,在肥胖期间cDC1s对外源性自身DNA的摄取在WAT中选择性增加,并且WAT cDC1s中STING信号的激活可能是由典型的胞质DNA感应机制诱导。
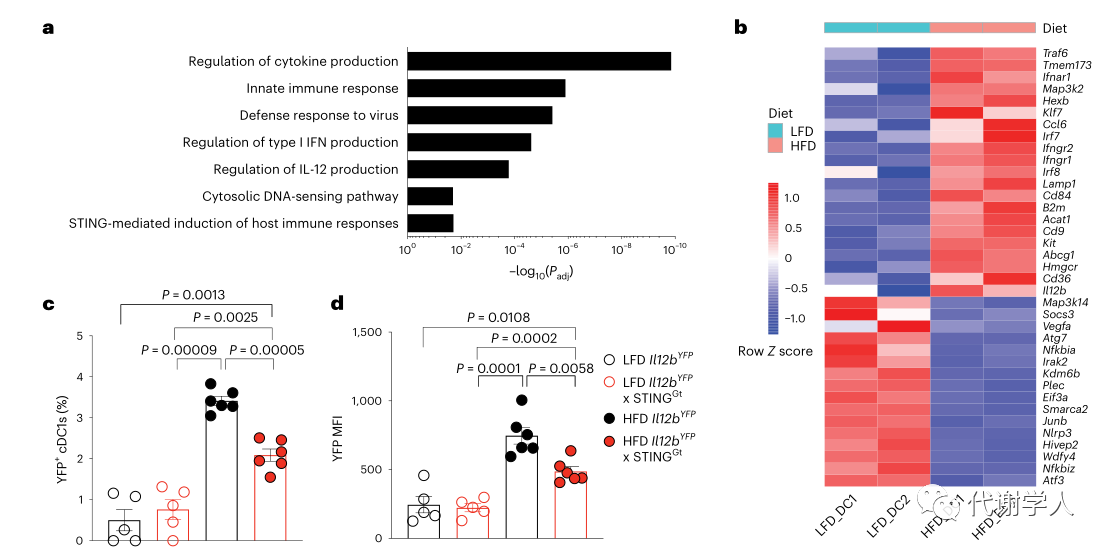

图5.STING信号驱动肥胖期间cDC1 IL-12的产生
图S6.STING缺乏不会影响肥胖期间体重增加、食物消耗或肝脏和脾脏中cDC1 IL-12的产生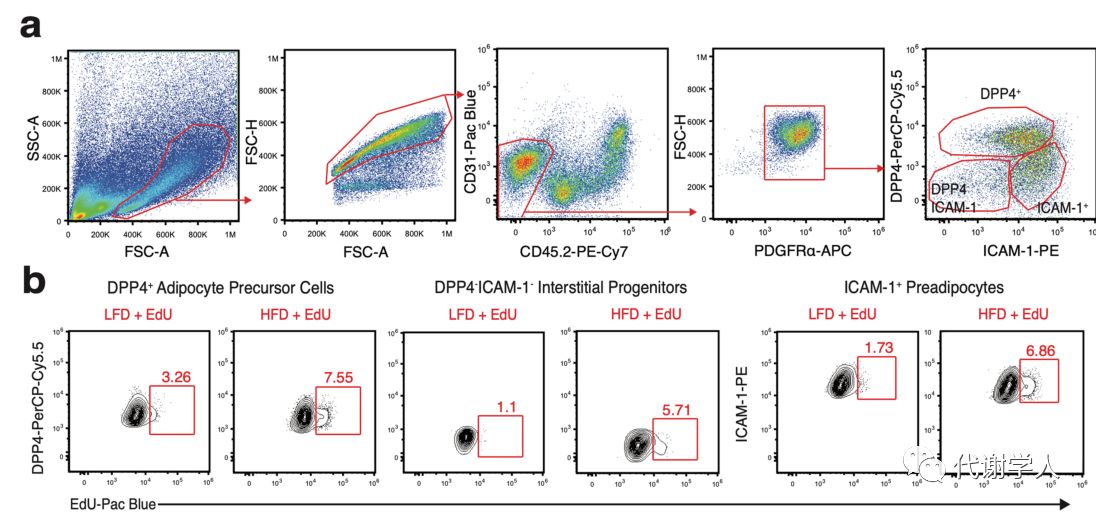
图S7.脂肪细胞系细胞在体内掺入EdU, 并且3T3-L1前脂肪细胞的EdU标记允许在体外探究cDC1s的DNA摄取机制
6. 凋亡小体内吞作用诱导cDC1s中IL-12的产生
为了更好地了解控制外源性DNA介导的cDC1s激活的机制,研究人员接下来利用EdU标记的3T3-L1前脂肪细胞优化了体外骨髓来源的cDC1共培养模型(图5A)。3T3-L1前脂肪细胞在有或无EdU的培养基中分化,导致增殖的3T3-L1s大量摄取EdU,并通过BODIPY染色确定EdU对分化没有影响(图S7E、F)。3T3-L1s一旦成熟就对细胞进行多次洗涤以去除含EdU的培养基,然后与骨髓来源的cDC1s共培养。仅2小时后,研究人员就观察到与EdU标记的3T3-L1s共培养的cDC1s对EdU+DNA的强烈摄取(图6B、C)。同时研究人员还发现用EdU标记的3T3-L1s的上清液培养cDC1s产生了与细胞本身共培养相似水平的EdU+cDC1s,并且使用0.45 μm过滤器对上清液进行无菌过滤去除大碎片发现对EdU+cDC1s的比例没有影响(图6D)。这些结果进一步支持了cDC1s在体外非依赖性地摄取细胞外DNA的机制。
肥胖相关的脂肪细胞应激和细胞死亡可以释放游离DNA,含有DNA的外泌体或较大的含有DNA的囊泡被称为“凋亡小体”。研究人员评估了这其中每一种机制促进cDC1摄取EdU+DNA的潜力。虽然对上清进行DNase1处理会略微降低EdU+cDC1s的比例,但使用GW4869处理3T3-L1对外泌体释放没有影响(图6D),并且EdU标记的3T3-L1产生的凋亡小体和cDC1s共培养产生的EdU+cDC1比例与3T3-L1细胞或这些细胞的上清液共培养相似(图6E)。研究人员还发现,只有在使用电穿孔破坏囊泡膜完整性时,DNase1处理才能降低EdU+cDC1s的百分比(图6E、图S7G),表明含有来自死亡和濒死脂肪细胞的自身DNA的凋亡小体在体外介导cDC1s对DNA的摄取。
已知cDC1s通过吞噬和内吞途径的各种机制来促进死亡或濒死的细胞抗原呈递给局部淋巴细胞群。于是研究人员使用吞噬作用(Ciliobrevin D)或内吞作用(Dynasore)的选择性抑制剂探究凋亡小体介导cDC1s对DNA摄取的机制。cDC1s的DNA摄取在与细胞凋亡小体的培养过程中不受Ciliobrevin D的影响,但会被Dynasore完全阻断(图6F),表明含有自身DNA的凋亡小体的内吞作用可能是cDC1激活的上游机制。研究人员还发现Dynasore处理在18小时后显著降低了凋亡小体刺激的cDC1 IL-12产生(图6G)。最后为了确定cGAS-STING通路是否与凋亡小体刺激IL-12的产生相关,研究人员在刺激前使用CRISPR cRNPs技术从骨髓来源的cDC1s中敲除了Mb21d1(cGAS)或Tmem173(Sting),发现与对照细胞相比,cDC1s中任一基因的敲除都导致IL-12的产生减少(图6H),表明cDC1s对脂肪细胞谱系来源的含有DNA的凋亡小体的内吞作用可导致cGAS-STING依赖性IL-12的产生,并可能促进肥胖期间cDC1介导的肥胖相关炎症和WAT的代谢功能障碍(图S8)。
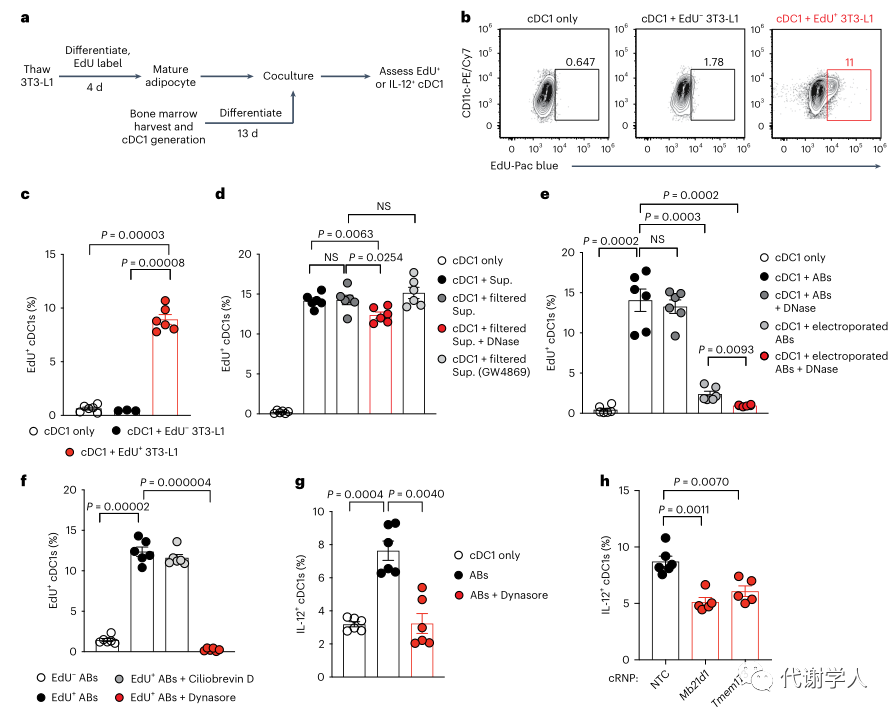
图6.含有自身DNA的凋亡体的内吞作用诱导cGAS-TING依赖性cDC1 IL-12的产生

图S8.cDC1通过死细胞来源的DNA的内吞作用和cGAS-STING介导IL-12产生,导致肥胖相关的炎症和代谢功能障碍
总结
在本研究中,研究人员发现肥胖期间WAT中的IL-12主要由cDC1s产生,NK细胞产生的Xcl1有助于WAT中cDC1s的积累,并且WAT cDC1通过激活ILC IFN-γ的产生和WAT中炎症性巨噬细胞的积累,导致WAT炎症和全身代谢功能障碍。从机制上讲,cDC1在含有自身DNA的凋亡小体的内吞作用下,以cGAS-STING依赖性方式产生IL-12,进而促进肥胖相关的WAT炎症。总之,本研究发现cDC1s能够作为肥胖期间脂肪组织炎症和全身代谢稳态的关键调节因子,这对肥胖期间有关WAT病理反应的研究具有重要意义。
文章链接:https://www.nature.com/articles/s42255-023-00934-4

https://blog.sciencenet.cn/blog-3483272-1414335.html
上一篇:代谢学人 Cell Metabolism:强健之道:揭秘免疫与运动的默契共舞
下一篇:代谢学人——Cell Metabolism:雪旺招兵买马,"脂"为拯救细胞