博文
噬菌体展示技术诞生的启示:循序渐进,水到渠成
||
噬菌体展示(Phage Display)技术之父乔治·史密斯(George P Smith)教授第一次接触噬菌体是在哈弗福德学院(Haverford College)读大学期间。他想挑战抗体产生的模板学说,证明抗体的抗原特异性决定于编码抗体的mRNA。于是他用噬菌体T4免疫兔子,然后从兔子脾脏提取RNA,加入无细胞蛋白合成系统,确定所生成的蛋白(包括抗体)能否中和T4噬菌体。1964年,史密斯到哈佛医学院攻读博士学位,从事抗体测序设备研发与抗体V区基因进化的理论研究。1970年,他获得哈佛医学院博士学位,并到威斯康星大学做博士后,合作导师是奥利弗·史密斯教授(因基因敲除小鼠研究的重要贡献获得2007诺贝尔奖生理学或医学奖)。1975年,乔治·史密斯到密苏里大学工作,刚开始的研究仍然主要围绕抗体V区基因展开。后来,在参加同事用秀丽线虫作为模式生物的一个发育生物学项目期间,他对噬菌体旧情复燃。只不过,这一次是丝状噬菌体(filamentous phage)。
顾名思义,丝状噬菌体外形很像一根长长的棒子、纤维或细丝。如图1所示,它的长度从800纳米到4微米不等,而直径只有大概6纳米左右[1,2]。我们关于丝状噬菌体的主要知识源自f1[3]、fd[4]、M13[5]等感染大肠杆菌的噬菌体。这三种噬菌体都是1960年代从污水中分离出来的,它们的基因组都是单链环状DNA。由于它们基因组的碱基序列98%都是相同的,都只能溶原性感染有性菌毛的大肠杆菌,因此它们一般也被统称为Ff噬菌体[1]。
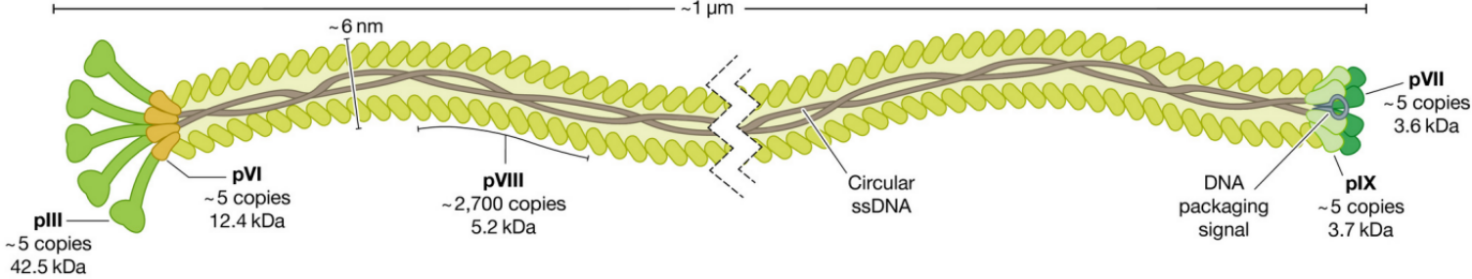
图1:Ff丝状噬菌体结构示意图[1]
上述丝状噬菌体中,fd的基因组序列最先被测定并在1978年发表[6];紧接着是M13噬菌体基因组(1980年)[7]和f1基因组(1981年)[8]。这三种噬菌体中,fd基因组有6,406个碱基,只比M13和f1基因组少1个碱基;fd与f1相比,只有不到200个碱基不同,而在氨基酸残基水平只有十个氨基酸的差异;M13和f1更为相似,两者只有50多个碱基的不同与5个氨基酸的差异。如图2所示,fd、M13、f1等Ff丝状噬菌体结构较为简单,基因组也较小,共有11个基因。它们基因组有一个约500bp的基因间区,含有病毒复制起始点与病毒包装的信号;编码区域紧凑并按功能集中排列。基因g3、g6、g7、g8、g9分别编码了衣壳蛋白P3、P6、P7、P8、P9;基因g2、g5、g10分别编码复制相关蛋白P2、P5、P10; 基因g1、g4、g11分别编码组装相关蛋白P1、P4、P11。
在所有衣壳蛋白中,P8数量最为丰富,因此又被称为主要衣壳蛋白。成熟的P8肽链有50个氨基酸残基。每个Ff噬菌体约有2700个P8,螺旋形包裹基因组形成噬菌体长长的轴。P8的拷贝数与Ff基因组大小相匹配。如果基因工程改造后Ff基因组变长,P8拷贝数相应增加,噬菌体长度也相应变长。在Ff两端还有几种次要衣壳蛋白。其中头端在电子显微镜下看起来似乎有一些像球形把手一样的结构,这就是P3,有5个拷贝,它的功能也的确像个门把手,与大肠杆菌性菌毛结合介导Ff进入大肠杆菌。P3之所以在电镜下能鼓出来构成不太规则球形把手的结构,是因为成熟的P3块头比较大,肽链有400多个氨基酸残基。头端还有P6,一个由112个氨基酸残基构成的次要衣壳蛋白,也与Ff进出大肠杆菌有关。另一端称为尾端,因为没有P3,在电镜下看起来较为平整,所以又被称为钝端,分别有5个拷贝的次要衣壳蛋白P7和P9,它们分别含33和32个氨基酸残基。钝端的这两种蛋白质都很小,无怪乎在电镜下看起来是钝钝的。P7和P9与组装好的噬菌体芽出大肠杆菌有关。
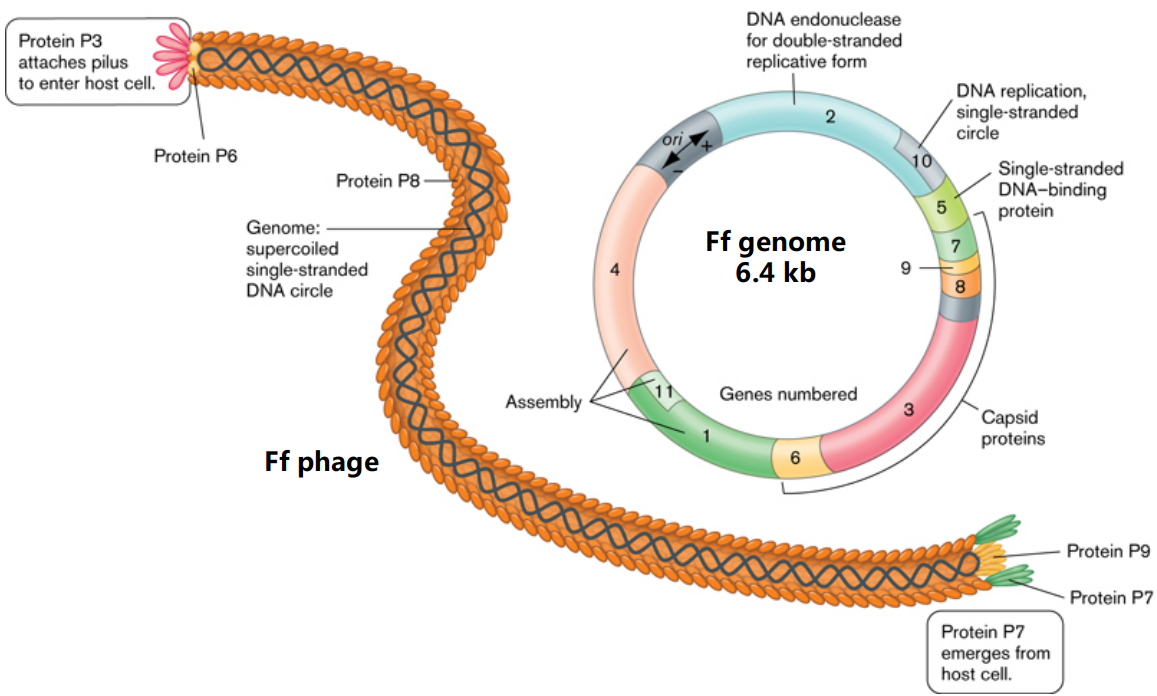
图2:Ff噬菌体及其基因组结构示意图
如前所述,史密斯教授到密苏里大学几年后与噬菌体旧情复燃。那时丝状噬菌体fd的基因组正好已被测定[6],但这些丝状噬菌体能有什么用,相关基因的结构与功能,仍有不少未解之迷。史密斯课题组先在野生型fd基因组基础上加入了一段含有四环素抗性基因的Tn10转座子序列,构建了fd-tet噬菌体。被该噬菌体感染的F+大肠杆菌产生了四环素抗性,fd-tet转染F-大肠杆菌后也能增殖。因此,fd-tet可用作克隆载体,获得大量单链形式的目标DNA[9]。紧接着,他们又构建了fKN16,后者在fd-tet的基础上,删除了基因3前半部分的507个碱基。这样一来,fKN16感染大肠杆菌的能力虽然比fd-tet降低了8个数量级,但作为克隆载体转染大肠杆菌后产出目标DNA的量大大提高[10]。为了研究fd基因3的功能,他们进一步构建了删除了基因3更多碱基的fCA55并与fKN16进行了对比。结果发现,抗蛋白3的抗体能够与fKN16噬菌体颗粒反应,但不能和fCA55噬菌体颗粒;fCA55噬菌体颗粒的长度会变得很长,内有多个噬菌体基因组。因此,史密斯认为:fd基因3的蛋白产物可分为两个结构域,N端结构域游离在病毒衣壳外,决定噬菌体的感染力;C端结构域整合到病毒衣壳中,帮助封装出正常长度的病毒颗粒[11]。
就在史密斯教授与噬菌体旧情复燃之时,他在密苏里大学游泳馆偶遇了身着绿色泳衣的 玛约丽.塞布尔(Marjorie Sable)并堕入爱河,史密斯常昵称她为玛姬(Margie)。他们俩于1981年10月10日结婚(图3)。

图3:在婚礼上跳舞的史密斯夫妇
1983年8月,玛姬到北卡罗莱纳大学公共卫生学院读研究生。史密斯为了能和妻子在一起,就申请去杜克大学罗伯特·韦伯斯特(Robert Webster)实验室度过他的学术年假。一则,韦伯斯特教授实验室在丝状噬菌体研究上很有造诣;二则,杜克大学与北卡罗莱纳大学相距不远。
1983年7月到1984年8月,史密斯在韦伯斯特实验室期间想开展的项目研究是把外源蛋白整合到P3形成一个融合蛋白,希望既不大影响P3的功能,又能方便用抗体等来检测暴露或者说展示在噬菌体表面的外源蛋白[12]。也是说,他想在之前基于丝状噬菌体的克隆载体基础上,开发出便于检测与筛选的表达载体。在韦伯斯特实验室旁边的保罗·莫德里奇(Paul Modrich,因DNA修复的细胞机制研究荣获2015年诺贝尔化学奖)实验室当时正在研究大肠杆菌限制性内切酶I(EcoRI),有现成的纯化好的EcoRI蛋白、编码EcoRI基因的质粒pAN4、抗EcoRI的血清(抗体)。于是史密斯就去蹭了来开展自己的项目研究。他用限制酶Sau3A消化pAN4,用限制酶BamHI消化噬菌体f1,体外混合后得到多种候选的重组噬菌体f1。他进一步研究了其中一种命名为fECO1的重组噬菌体DNA,其基因3中插入了编码EcoRI的171bp的外源DNA[13]。
用fECO1转染大肠杆菌后,细菌产生了具有感染力fECO1病毒颗粒。用抗EcoRI的血清可显著降低fECO1的滴度(阻断了融合丝状噬菌体fECO1感染大肠杆菌)而对野生型f1滴度无影响,用过量EcoRI与其抗血清孵育,可阻断抗血清降低fECO1滴度的作用,说明EcoRI基因的部分片段整合到f1基因3后,通过产生的融合蛋白把相应外源EcoRI蛋白展示在了噬菌体表面,能够被相应抗体识别与结合[13]。有趣的是,抗EcoRI血清与相应噬菌体的结合也可被PH2.2或2.7的缓冲液逆转,fECO1恢复原有滴度,说明弱酸性缓冲液可以解离抗体与噬菌体的结合,也就是说目标噬菌体也可以洗脱下来。
于是史密斯又利用这一点进一步做了亲和纯化实验。他把抗EcoRI血清吸附到小的塑料培养皿上,没有吸附的地方用过量牛血清白蛋白封闭。接着将fECO1与过量M13mp8噬菌体组成混合文库悬液,加入上述塑料培养皿后旋转孵育。然后用新鲜培养基清洗培养皿,去掉不能与抗EcoRI血清结合的M13mp8噬菌体,最后用弱酸性缓冲液洗脱fECO1噬菌体。结果,在三次实验中,fECO1均比M13mp8富集了1500到7200倍[13]。
在当前乃至当时,将两个基因全部或部分融合在一起表达后形成重组的融合蛋白是很常见的,选择f1的基因3作为切入点似乎也并没有非常特别的创新[12]。例如,源自λ噬菌体的经典表达载体λgt11,其β-半乳糖苷酶基因(LacZ)的3’端内有EcoRI限制性内切酶位点,可与外源基因重组后感染高频溶原大肠杆菌菌株,产生大量融合蛋白[14]。但是,经典的λgt11表达的融合蛋白虽然也在大肠杆菌细胞内积累,却并不是子代病毒衣壳的一部分。这是经典方法与史密斯发明的新方法的一个根本不同。相较于λgt11表达文库筛选的各种繁杂与耗时费力,史密斯发明的这种新方法无疑具有革命性的进步。噬菌体展示技术就这样在看似寻常中诞生了,而且一开始也没有被史密斯响亮地命名为噬菌体展示(Phage Display),而是被总结为基于融合丝状噬菌体的新表达载体在病毒表面展示抗原与方便的亲和纯化。
1984年12月26日,史密斯将这一系列研究工作写成了噬菌体展示领域的第一篇论文《Filamentous fusion phage: novel expression vectors that display cloned antigens on the virion surface》并投稿到《科学》杂志;该论文于1985年3月4日被接受,1985年6月14日正式出版。史密斯在该论文中展望:可用同样的办法从随机插入DNA构成的文库中富集特定噬菌体,单轮亲和纯化就可富集数千倍,第二轮可能富集程度更高,富集的噬菌体可以帮助制备针对隐蔽表位的抗体,甚至也可能开发成为疫苗,对医学与兽医领域具有意义[13]。在这篇论文的最后,史密斯写道:这项工作很大一部分是在杜克大学韦伯斯特教授的实验室进行的,我感谢他支持我的工作并为我提供工作环境;同时我也感谢P·莫德里奇提供纯化的EcoRI蛋白、pAN4质粒和EcoRI抗血清,感谢C·科尔纳(C. Kerner)的技术协助……
33年后,因为这一开创性的工作,乔治·史密斯教授荣获2018年诺贝尔化学奖。在他题为《Phage Display: Simple Evolution in a Petri Dish》的获奖演讲幻灯片的第二页,是一副比约恩·荣格(Björn Runge)执导的电影《贤妻》(Wife)的电影海报(见图4)。

图4:史密斯教授诺奖演讲幻灯片第二页截图
他虽然在此页批注说玛姬的确没有发明噬菌体展示,但海报中那一句“每个伟大男人的背后都有一个更伟大的女人(Beside any great man is a far greater woman)”显然是在向妻子致敬。当初若非为了玛姬跑到韦伯斯特教授的实验室,今日若何,尚未可知。韦伯斯特教授在获悉史密斯教授荣获2018年诺贝尔化学奖后接受采访时说,“史密斯是非常聪明与敏锐的学者,这完全是他的构思、他的成果,我只是在一段时间内为他提供了工作场所和资助。”韦伯斯特、莫德里奇等科学家的君子之风,学者之范,令人肃然起敬。
乔治·史密斯教授的诺贝尔奖获奖演讲已在德国化学会志国际版(Angewandte Chemie International Edition)发表[12]。在演讲中还有这么一段令人深思的话:“这不是英雄般灵光一现的故事。相反,这个案例说明了科学进步如何在交织的全球科学界中以逐步的方式逐渐出现。为了促进科学发展,享受其物质和文化利益,我相信我们的社会必须保持整个科学界的稳定,就像噬菌体展示技术的出现一样,而不是试图找出一小撮似乎注定要取得突破性发现或创新——或将获得诺贝尔奖的人。”
作为密苏里大学1839年建校以来的首个诺奖得主,密苏里大学专门为史密斯教授开了一个庆祝会。学校决定授予其一份特殊荣誉:一个专属停车位。可史密斯教授不太擅长开车,基本上是骑自行车。于是,学校在自行车公共车位中,为他辟出了一个专属的自行车停车位(见图5)。

图5:史密斯教授专属自行车位揭幕仪式海报
2019年3月12日,史密斯教授夫妇宣布将其所获得的诺贝尔奖的全部奖金捐赠给他所在的密苏里大学文理学院,用于资助该院学生。史密斯教授的君子之风,学者之范,也令人肃然起敬。
参考文献
[1] Hay ID, Lithgow T. Filamentous phages: masters of a microbial sharing economy. EMBO Reports 2019; 20(6): e47427.
[2] Rakonjac J, Russel M, Khanum S, Brooke S J, Rajič M. Filamentous Phage: Structure and Biology. Advances in Experimental Medicine and Biology. 2017: 1-20.
[3] Loeb T. Isolation of a Bacteriophage Specific for the F+ and Hfr Mating Types of Escherichia coli K-12. Science 1960; 131(3404): 932-933.
[4] Marvin DA, Hoffmann-Berling H. Physical and Chemical Properties of Two New Small Bacteriophages. Nature 1963; 197(4866): 517-518.
[5] Hofschneider PH. Untersuchungen uber kleine E. coli K 12 bakteriophagen. Zeitschrift für Naturforschung B 1963; 18(3): 203-210.
[6] Beck E, Sommer R, Auerswald E A, Kurz C, Zink B, Osterburg G, Schaller H, Sugimoto K, Sugisaki H, Okamoto T, Takanami M. Nucleotide sequence of bacteriophage fd DNA. Nucleic Acids Research 1978; 5(12): 4495-4504.
[7] van Wezenbeek PMGF, Hulsebos TJM, Schoenmakers JGG. Nucleotide sequence of the filamentous bacteriophage M13 DNA genome: comparison with phage fd. Gene 1980; 11(1-2): 129-148.
[8] Beck E, Zink B. Nucleotide sequence and genome organisation of filamentous bacteriophages f1 and fd. Gene 1981; 16(1-3): 35-58.
[9] Zacher AN, Stock CA, Golden JW, Smith GP. A new filamentous phage cloning vector: fd-tet. Gene 1980; 9(1-2): 127-140.
[10] Nelson FK, Friedman SM, Smith GP. Filamentous phage DNA cloning vectors: A noninfective mutant with a nonpolar deletion in gene III. Virology, 1981, 108(2): 338-350.
[11] Crissman JW, Smith GP. Gene-III protein of filamentous phages: Evidence for a carboxyl-terminal domain with a role in morphogenesis. Virology 1984; 132(2): 445-455.
[12] Smith GP. Phage Display: Simple Evolution in a Petri Dish (Nobel Lecture). Angewandte Chemie International Edition 2019; 58(41): 14428–14437.
[13] Smith GP. Filamentous fusion phage: novel expression vectors that display cloned antigens on the virion surface. Science 1985; 228(4705): 1315-1317.
[14] Young RA, Davis RW. Efficient isolation of genes by using antibody probes. Proceedings of the National Academy of Sciences 1983; 80(5): 1194-1198.
https://blog.sciencenet.cn/blog-204973-1417302.html
下一篇:超越轮回的沫蝉故事