博文
“120万一针清零癌细胞”:希望还是奢望?
|
癌症,一度被视为“绝症”,让无数家庭陷入绝望。但如今,一种叫CAR-T的细胞疗法,正在悄悄改变这一局面。
28岁的李晴(化名),患上淋巴瘤三年,尝试了各种治疗都无效。最终,她接受了CAR-T疗法,仅半个月,癌细胞几乎清零。副作用也比化疗轻得多,只是发烧几天。
听起来像奇迹,但现实却很扎心:这“一针”要价120万元,而且不在医保范围内。很多患者只能靠商业保险或参加临床试验,普通人根本负担不起。
CAR-T疗法的原理并不复杂:医生从患者体内提取T细胞,改造后让它们变成识别癌细胞的特种兵,再回输到体内,精准打击癌细胞。它在治疗血液癌症中效果惊人,部分患者完全缓解率超过80%,甚至有儿童白血病患者已无癌生存13年。
为何这么贵?
研发成本高,失败率也高
每位患者都要定制,不能批量生产
设备和材料多依赖进口
单次生产成本就高达60万以上
未来如何破局?
技术升级:实现自动化和通用型CAR-T,让它们能够像普通药物一样批量生产
国产替代:降低设备和材料成本
医保+商保联动:让更多人用得起新药
CAR-T疗法是医学的一大突破,但真正的希望,不是“120万一针”,而是让这种疗法走进千家万户,成为人人用得起的救命稻草。
一、CAR-T疗法的原理与发展历程
嵌合抗原受体T细胞(CAR-T)疗法,作为近年来癌症免疫治疗领域的一项革命性突破,极大地拓展了人类对于免疫学、细胞治疗及精准医疗的认知。CAR-T细胞疗法的核心原理,源自对人体T淋巴细胞的基因改造:科学家通过体外基因工程技术,将能够特异识别肿瘤抗原的嵌合抗原受体(Chimeric Antigen Receptor,CAR)导入患者自身T细胞,使改造后的T细胞获得精准识别并强效杀伤肿瘤细胞的能力(图1)。这种方法绕过了肿瘤在机体免疫逃逸中的经典伪装机制,实现了对癌细胞的靶向清除与持久免疫控制。
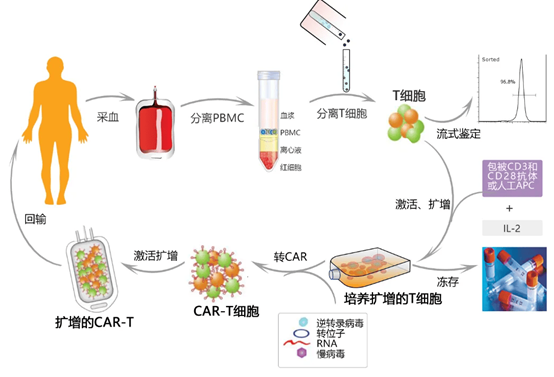
图1. CAR-T疗法的原理(图片来自全球重大突破!CAR-T治疗难治性红斑狼疮患儿取得历史性成果!_细胞_患者_改造)
CAR-T技术的发展可以追溯至20世纪80年代T细胞受体及抗体工程的基础研究,1993年Eshhar等人首次构建出原始型CAR分子,但第一代临床疗法迟迟未能在人体试验中取得突破,效果有限。进入21世纪,随着分子生物学与病毒载体技术的发展,第二代、第三代CAR结构陆续问世,并成功迈向临床。2012年,首例接受CD19靶向CAR-T治疗的白血病患者获得长期缓解,这一里程碑事件引起了全球肿瘤学界的极大震动,为CAR-T疗法打开了广阔前景。本文作者美捷登Daniel,转载请标明来自美捷登。
美国FDA于2017年率先批准了诺华的Kymriah(tisagenlecleucel)和Kite Pharma(吉利德子公司)的Yescarta(axicabtagene ciloleucel)的两款产品,用于治疗复发难治性B细胞急性淋巴细胞白血病及弥漫大B细胞淋巴瘤,标志着全球首批CAR-T细胞疗法正式进入临床应用。中国在2019年开启本土CAR-T疗法注册临床试验,2021年复星凯特的阿基仑赛注射液(奕凯达,Yescarta中国版)获国家药监局(NMPA)批准,成为首款国产上市CAR-T产品,推动国内细胞治疗步入创新快车道。
纵观CAR-T疗法三十年发展史(图2),从基础科学到工程技术,从小规模临床试验到多中心、全球协作,CAR-T已成为精准医疗最具标志性的创新之一。今天,CAR-T不再只是科学家的尝试之作,而是逐步转化为实际临床应用、希望与争议并存的现实治疗方案。
表1. CAR-T细胞疗法发展历程时间表(涵盖其技术演进、临床突破与应用拓展)
时间 | 事件与进展 | 说明与影响 |
1987年 | CAR-T概念首次提出 | 以嵌合抗原受体(CAR)为核心,赋予T细胞识别癌细胞的能力 |
90年代 | 第一代CAR-T研发 | 仅含CD3ζ信号域,识别癌细胞但抗癌能力弱,回输后易凋亡 |
2003年 | Carl June团队开始研究4-1BB共刺激结构CAR-T | 奠定第二代CAR-T基础,增强T细胞存活与活性 |
2012年 | Emily Whitehead成为首位CAR-T治愈白血病患者 | 推动CAR-T进入公众视野,开启临床应用爆发期 |
2017年 | 首款CAR-T药物Kymriah在美国获批上市 | 标志CAR-T正式进入商业化阶段 |
2018–2021年 | 多款CAR-T产品陆续上市(如Yescarta、Abecma、Carvykti) | 主要用于白血病、淋巴瘤、多发性骨髓瘤等血液肿瘤 |
2022年 | 中国已有6款CAR-T产品上市 | 标志着中国在CAR-T领域实现快速发展 |
2023–2024年 | CAR-T在系统性红斑狼疮等自身免疫病中取得突破 | CD19 CAR-T治疗SLE患者,缓解期超2年 |
2024年 | Lifileucel成为首款获批的TIL疗法药物 | 过继细胞治疗(ACT)分支在黑色素瘤中取得进展 |
2025年 | CAR-T向实体瘤拓展(如胃癌、脑胶质瘤、前列腺癌) | 采用双靶点、局部注射等策略,突破肿瘤微环境限制 |
发展趋势 | 第三至第五代CAR-T技术持续演进 | 加入多重共刺激域、诱导因子、自杀开关、JAK-STAT通路等,提升安全性与疗效 |
应用拓展 | 涉及艾滋病、衰老相关疾病等非肿瘤领域 | 如M10细胞治疗HIV、靶向衰老细胞改善肺纤维化 |
注:CAR-T技术迭代已进入第五代,未来重点在于通用型CAR-T、自动化制备、国产替代与医保支持等方向。
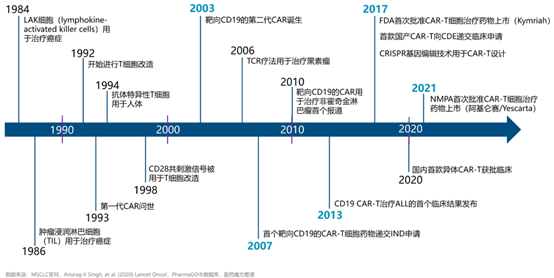
图2. 细胞免疫治疗与CAR-T细胞疗法发展历程(图片来自CAR-T细胞疗法研发现状与发展趋势_临床_中国地区_白皮书)
二、临床应用与疗效数据
2.1 血液肿瘤中的疗效与适应症拓展
CAR-T疗法目前在临床上最为成熟且被广泛应用于血液系统恶性肿瘤,尤其以CD19靶向CAR-T最为典型。这类产品在复发难治性急性B淋巴细胞白血病(R/R B-ALL)、弥漫大B细胞淋巴瘤(DLBCL)、滤泡性淋巴瘤(FL)等适应症中的疗效令人瞩目。例如,诺华Kymriah和吉利德Yescarta上市时的临床三期数据均显示,客观缓解率(ORR, Objective Response Rate)可达80%以上,完全缓解率(CR, Complete Response Rate)在40%~60%区间,大幅超越传统化疗与免疫治疗方案。
中国本土的CAR-T产品也陆续取得突破。以复星凯特阿基仑赛注射液为例,2021年注册临床数据显示,中国R/R DLBCL患者的ORR为83%,CR为52%,中位无进展生存期(PFS)达到6.8个月,安全性与国际同类产品相当。此外,2022-2025年期间,恒润达生、药明巨诺及齐鲁制药等多家企业先后获得CD19、BCMA等靶点CAR-T新药临床审批与上市许可,极大丰富了中国患者的治疗选择。
表2. 几款代表性上市CAR-T疗法的重要临床指标
产品名称 | 靶点 | 适应症 | ORR (%) | CR (%) | 主要不良反应 | 国家 | 上市时间 |
Kymriah (诺华) | CD19 | ALL/DLBCL | 81~83 | 45~58 | CRS、神经毒性 | 美国/全球 | 2017 |
Yescarta (吉利德) | CD19 | DLBCL | 82 | 51 | CRS、神经毒性 | 美国/全球 | 2017 |
阿基仑赛 (复星凯特) | CD19 | DLBCL | 83 | 52 | CRS、神经毒性 | 中国 | 2021 |
奕凯达 (药明巨诺) | CD19 | B-ALL | 68~77 | 45~55 | CRS、神经毒性 | 中国 | 2022 |
阿基仑丙赛 (恒润达生) | BCMA | 复发难治性多发性骨髓瘤 | 72~100 | 33~74 | CRS、感染并发症 | 中国 | 2022 |
可以看出,无论是全球范围的先驱性产品,还是中国本土研发成果,CAR-T在复发难治性血液肿瘤的疗效都远超传统治疗,为无药可用的患者带来了生的希望。客观缓解率高、完全缓解发生率明显提升,是推动其被誉为“超级癌症药”的最核心依据。
2.2 真实世界数据与治疗安全性
近几年,CAR-T治疗的真实世界数据(Real-world Evidence, RWE)为临床效果与安全性提供了进一步验证。大量实践显示:对于化疗失败、移植失败等极晚期患者,CAR-T不仅提高了短期缓解率,还有相当一部分人获得长期生存;但同时,细胞因子风暴(Cytokine Release Syndrome,CRS)以及神经毒性等严重副作用仍须高度警惕,部分病例可危及生命,临床管理对此提出了更高要求。
以中国CAR-T治疗的全国多中心真实队列为例,CRS发病率大致在60%-90%,其中重度(≥3级)约10%~20%,短暂中性粒细胞减少、脱靶效应、感染风险等问题仍存在。为此,国内外指南建议采用托珠单抗等抗IL-6药物、激素等干预措施,并加强多学科协作管理。值得关注的是,2024-2025年,国产CAR-T在安全性提升、自动化制备和副反应管理上已有显著进步。
2.3 实体瘤与自身免疫疾病中的探索
CAR-T疗法能否像在血液肿瘤领域一样,突破实体瘤甚至自身免疫性疾病,是细胞治疗的下一个高峰。实体瘤中,CAR-T疗效相对有限,主要受制于肿瘤微环境免疫抑制、靶点异质性、T细胞浸润障碍等瓶颈。不过,2023-2025年,国内外临床试验显示某些新靶点(如CLDN18.2在胃癌、GPC3在肝癌、EGFRvIII在脑胶质瘤)CAR-T产品取得了初步客观缓解(ORR 10%-50%),呈现破冰态势。少部分患者获得完全缓解,有望带动实体瘤适应症的持续扩容。
更具前沿意义的是,CAR-T细胞疗法已延伸至部分自身免疫疾病探索领域。如2023年发表的海外临床资料报道,一例严重全身性红斑狼疮(SLE)经CD19 CAR-T治疗后实现长期病情缓解,无严重副反应,为难治性自身免疫病的治疗打开新窗口。2024-2025年中国也有初步试验正在推进,并关注其长期安全性与复发风险。
三、价格构成与成本分析
CAR-T疗法在带来革命性希望的同时,“天价药”的标签为其大规模应用蒙上现实阴影。以目前中国上市的CAR-T产品为例,常规一次治疗费用约为120万元人民币;与美国、欧洲同类产品30-40万美元/次价格相近,是全球医疗费用最贵的治疗之一。
3.1 CAR-T治疗费用构成解析
CAR-T之所以价格极高,主要包含如下成本环节:
原材料与耗材费用:T细胞的采集、分离、纯化及高端溶液、细胞培养器材、质控试剂等,费用庞大。
基因修饰与细胞扩增:使用慢病毒或新型载体将CAR基因导入T细胞,涉及昂贵的生物反应设备、病毒制备车间等。
GMP级别生产与质控:全部操作需在严格的GMP(药品生产质量管理规范)环境下完成,生产周期长达2~4周,人工及合规成本极高。
个体化定制与冷链物流:每名患者的细胞治疗须独立定制,跨地冷链运输增加费用。
住院、检测及管理费用:CAR-T治疗期间需要住院、持续检测、并发症管理(如CRS干预用药)、专科护理团队,导致医疗环节成本居高不下。
创新和知识产权溢价:关键专利技术、药企研发投入和审批费用亦显著抬高产品定价。
有定量分析指出,一个典型国产CAR-T疗程的直接生产成本约30-100万元,终端到患者则达120万元左右。
表3. 典型CAR-T治疗的价格构成
费用环节 | 占比(估算) | 主要内容 |
原材料/耗材 | 15~20% | 细胞采集、培养、溶液、实验室材料 |
基因修饰/扩增 | 15~20% | 病毒载体、基因转染、细胞扩增设备 |
生产与质控 | 20~25% | GMP设施、认证、质控、人工、能耗 |
个体定制/物流 | 10~12% | 个体化操作、样本/药品全程冷链运输 |
医疗服务 | 18~22% | 住院、护理、检测、药物、危重并发症处理 |
创新溢价 | 10~20% | 知识产权许可、企业利润、管理 |
3.2 患者实际负担与案例分析
正如《人民日报》等媒体报道的患者李晴、洪丽案例所示,高昂的CAR-T治疗费用目前完全由患者负担。大部分中国家庭为患者挽救生命,不得不倾尽所有,甚至出现“众筹治疗”“卖房看病”等极端现象,引发社会关注。媒体调研多位血液肿瘤患者发现,绝大多数家庭需多方举债或依赖亲友、公益基金,导致心理与经济双重压力剧增。且一旦出现合并症、随访或二次治疗需求,费用更是难以承受。
整体而言,CAR-T疗法的“高技术壁垒—高生产成本—高市场售价”逻辑,造成其对全民健康公平的巨大挑战。如何在保障企业创新激励和回本周期的同时,通过政策、技术突破和国际合作降低终端费用,成为亟待解决的社会性议题。
四、技术进展与国产替代
4.1 技术迭代推动新一代CAR-T升级
CAR-T疗法自诞生以来,其技术迭代与升级可谓一日千里。经典的CAR结构由“抗原识别区—跨膜区—信号传导区”三部分组成。第一代CAR仅含CD3ζ信号,但活性有限;第二、三代CAR通过引入CD28、4-1BB等共刺激分子,极大增强了T细胞的扩增与存活能力,促进了临床疗效显著提高。
2022年后,全球研究核心从结构优化逐步转向多靶点组合、自杀开关设计、通用CAR-T、记忆CAR-T、纳米抗体、靶向肿瘤微环境因子的创新类型。例如,通用型CAR-T突破自体取材难题,研发“立即可用”式异体细胞治疗,有望提升大规模工业化、批量化生产能力,切实降低成本。国内部分团队已实现基于CRISPR基因编辑的“自杀开关”功能,降低治疗相关致死危险。
2023-2025年间,CAR-T领域重大前沿创新如下:
新靶点开发:BCMA(多发性骨髓瘤)、CLDN18.2(消化系统肿瘤)、GPC3(肝癌)等开拓新适应症。
细胞制备工艺升级:标准化、自动化流水线,使生产周期由4周缩短至7-10天,鲜活度更高。
纳米制剂与递送技术:新型纳米抗体融合、溶瘤病毒伴随输注,提高肿瘤微环境穿透性。
基因安全开关/可控机制:CRISPR编辑的“自杀开关”,提升安全性与临床可逆性。
4.2 国产CAR-T的研发与产业化现状
面对进口CAR-T产品技术壁垒与专利壁垒,中国制药企业、学术机构和资本早在2015年前后即陆续布局本土研发赛道。2021-2025年期间,以复星凯特、药明巨诺、恒润达生、齐鲁制药、康宁杰瑞等公司为代表的本土企业,已实现CD19、BCMA、CD20等主流靶点CAR-T从进口仿制到创新引领的跃迁(图3),推动中国本土CAR-T疗法实现量产上市,在全球CAR-T创新格局中占据了一席之地。
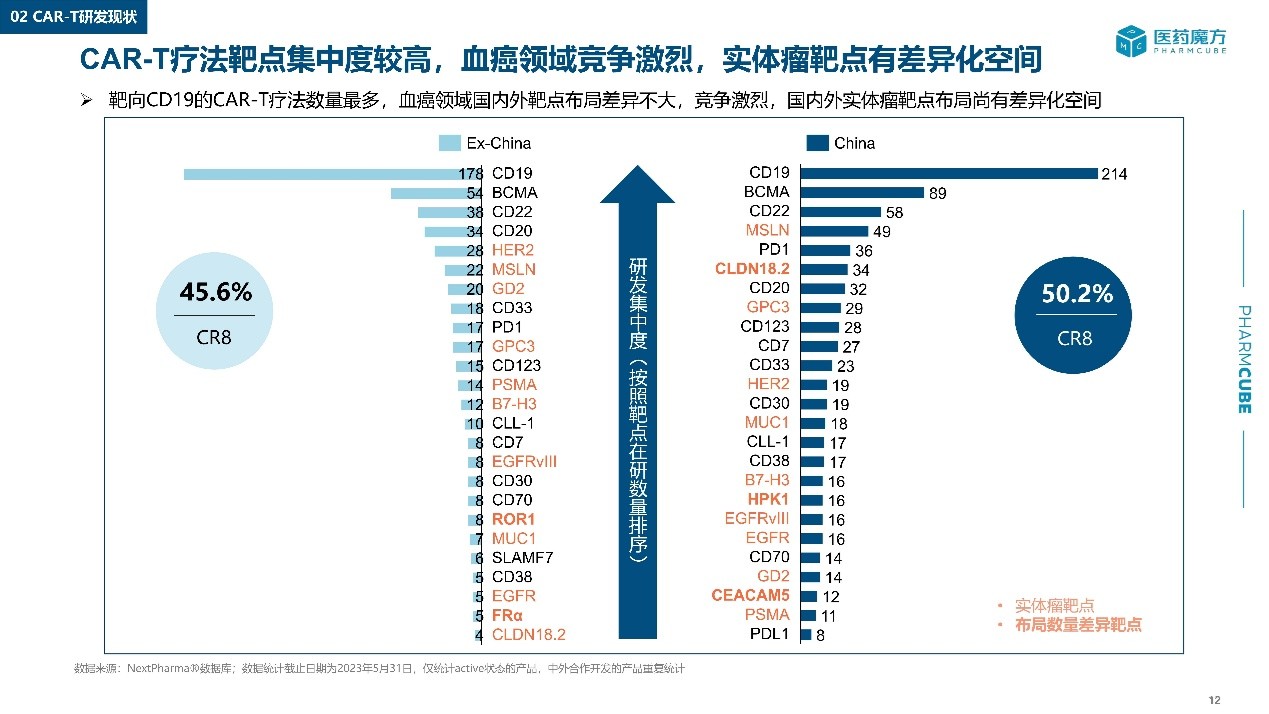
图3. CAR-T疗法的主要靶点(图片来自CAR-T细胞疗法研发现状与发展趋势_临床_中国地区_白皮书)
最新数据显示,2025年中国CAR-T独立在研项目超过300项,累计获批IND(新药临床申请)120+,覆盖大部分国际主流靶点和部分原创新靶点。同类型国产产品已在三甲医院取得临床应用,与进口产品疗效、耐受性总体相当,价格略优。部分企业实现技术出口与国际临床合作,国产CAR-T出海趋势日益明显(图4)。
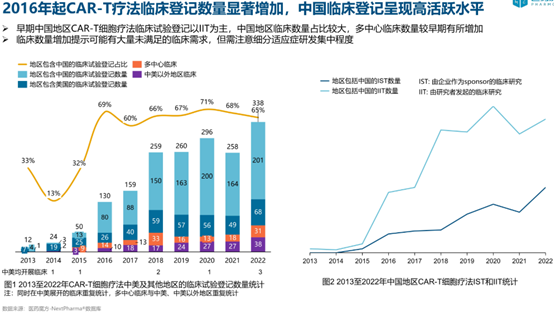
图4. CAR-T疗法临床在研项目逐年变化趋势(图片来自CAR-T细胞疗法研发现状与发展趋势_临床_中国地区_白皮书)
国产替代化带动了成本的局部下降,但受限于原材料、质控、物流等基础环节,整体终端价格降幅有限。2025年国内头部产品如阿基仑赛注射液、药明CAR-T等挂牌市价依然在80-100万元/次,但相较进口版本已下降近30%。
五、医保与商业保险政策
5.1 国家医保政策进展:现状与痛点
CAR-T疗法高昂费用能否为患者所及,关键在于能否纳入国家医保体系。截至2025年9月,中国大陆尚无任何CAR-T细胞产品被正式纳入《国家医保目录》;全部费用需由患者自负,部分省市试点多元支付模型,但覆盖面仍极有限。
医保未覆盖的主要原因:一是价格过高,医保年度控费压力极大;二是尚无大规模、长周期真实世界数据支撑支付决策;三是还涉及技术安全性、适应症限制、公共资源配置等多重权衡。部分专家呼吁比照瑞士、德国等国家,通过结果付费、风险分担等机制支持高价创新药早期纳入医保,但目前政策路径尚未明确。
2024-2025年,个别地区试点按病种付费和商业补充支付等模式。例如,北京、上海、广州提出对特定重症血液肿瘤患者给予“医疗救助+慈善捐赠”联合机制,小范围减轻部分患者负担,但远未形成全国性长远解决方案。
5.2 商业保险与公益基金探索
为弥补医保空白,众多商业保险与健康管理机构尝试细胞治疗专项医疗险,按照实际发生费用一定比例(5-50万元)予以报销,甚至购买CAR-T专属医疗险,部分保险产品涵盖10-30万元理赔额度。不过由于险种设计门槛高、保额上限低、给付条件严苛,以及既往症、健康告知等限制,绝大多数患者很难完全依赖商业险覆盖全部治疗费用。
除此之外,一些公益基金、慈善众筹平台(如水滴筹、轻松筹)成为“天价药”患者的现实资金来源。2024-2025年,部分国内一线肿瘤专科联合公益组织推出“患者援助计划”、药企捐赠等,旨在特殊困难群体中二次分配,但基数有限、可持续性堪忧。
5.3 国际医保与支付创新借鉴
国外部分国家/地区已将CAR-T纳入公立医保体系。例如德国、英国、加拿大、日本分别基于条件性支付、真实世界数据回归分析和分阶段结算等模式,部分创新药以疗效挂钩付费为基础,不达缓解目标由药企部分退费,极大降低国家医保投入压力。中国学界、医疗支付系统正积极论证相关经验,但落地仍面临多重制度障碍和技术瓶颈。
六、适应症扩展与未来前景
6.1 适应症快速扩容:从血液瘤到实体瘤、自免病
2020年至今,CAR-T疗法已经从血液系统肿瘤扩展至新靶点、实体瘤及难治性自身免疫性疾病。如BCMA靶点CAR-T在多发性骨髓瘤中数据突出,首批产品于2022年国内上市。新近的临床进展表明,针对骨髓瘤、淋巴瘤、部分白血病的CAR-T覆盖率已大幅提升,罕见类型白血病、恶性浆细胞病变等纳入临床试验队列(图5)。
实体瘤方面,2024-2025年中国GPC3-CAR-T(肝癌)、CLDN18.2-CAR-T(胃癌)及EGFRvIII-CAR-T(脑部肿瘤)等多项临床试验取得积极成果,部分患者实现部分或完全缓解,为实体瘤大规模应用积累宝贵数据。
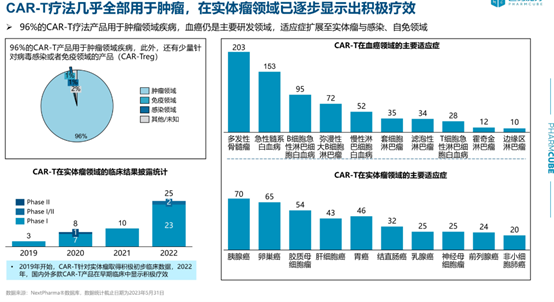
图5. CAR-T疗法研究现状(图片来自CAR-T细胞疗法研发现状与发展趋势_临床_中国地区_白皮书)
更具前瞻性的,是CAR-T细胞在自身免疫疾病治疗中的快速推进。临床研究显示,以中国为首的科研团队成功探索CD19、CD22等靶向CAR-T在系统性红斑狼疮、重症肌无力等难治性自身免疫病患者中的疗效,为未来“免疫重编程”治疗提供新范式。
6.2 未来技术革新与产业格局趋势
CAR-T疗法正朝着“更安全/高效、更多靶点、更广适应症、更经济可及”方向持续进化。短期看,产品结构升级、生产自动化与标准化、国产替代深入,将进一步降低成本。中长期,异体通用型CAR-T、纳米CAR-T、开关可控型CAR-T、靶向微环境等新策略有望解决实体瘤、免疫副作用等重大壁垒。同时,伴随真实世界数据的积累,为医保纳入和多维度风险分担模式提供决策依据。
产业方面,国内创新企业与跨国药企形成协同与竞合,部分龙头企业具备“自主研发—临床转化—生产商业化”一体化能力。头部资本加速涌入,国际多中心临床项目、技术授权及出口业务增多,中国CAR-T产业朝着“全球创新中心”的目标渐行渐近。
政策层面,随着国家战略性新兴产业定位的确立、医保支付持续探索及伦理监管优化,未来有望出台更具包容性的创新药政策组合拳,促进“高价救命药”实现可持续惠民。公众、患者群体的科学认知也在快速提升,对风险收益、伦理挑战有更加理性和多元的诉求。
七、启示
CAR-T疗法以其救命稻草般的疗效与“天价药”身份,在舆论和医疗界引发巨大碰撞。《人民日报》等主流媒体关注李晴、洪丽等患者的亲历故事,既展现了科学进步带来的生存奇迹,也揭示了科技红利与健康公平之间的现实鸿沟。
从临床创新角度看,CAR-T疗法的最大价值在于为无数晚期血液肿瘤患者开启了“治愈的窗口期”,部分人获得长达数年的无病生存。国产替代、本地转化让中国在国际创新竞赛中抢占先机,正逐步形成科研—产业—临床协同发展的良性循环。
从社会公平和全民健康角度看,CAR-T“极小患者获大收益”与“极高支付壁垒”共存,成为医疗可及性新挑战。高昂费用无医保报销,令绝大多数普通家庭难以承受,不仅影响患者生存权,也可能加剧社会心理焦虑。医保支付体系的创新——如疗效挂钩、风险共担、多元混合支持等——既需政策智慧,也急需科学数据支撑和社会共识。
从未来展望看,CAR-T生物医药是高科技、资本和政策多重驱动的典型案例。技术创新、适应症拓展和生产自动化将推动价格优化、普惠型CAR-T未来可期。实体瘤和自身免疫病领域的突破,会令大众切身受益。对于中国和全球公共卫生体系,这既是医疗进步的挑战,也是科技普惠精神的考验。
因此,CAR-T疗法不应被简单定性为“天价绝招”或“富人的希望”。科学家、企业、政策制定者、保险机构乃至社会大众,都应以理性、共建、包容心态,共同推动创新疗法进入可持续惠民新阶段。唯有科技进步和全民协作,方能把超级药物的光芒照进寻常百姓家庭生活的现实。
CAR-T疗法已成为医学、人文和社会三重维度的重大热题。在突破性疗效与公平性挑战并存的今天,我们呼吁“创新驱动+政策保障+公众参与”共同发力,努力推进CAR-T等新生代救命药走向普及,让更多中国患者真正享受生命科学的进步,寻回希望,超越无助。
参考资料:
1.全球重大突破!CAR-T治疗难治性红斑狼疮患儿取得历史性成果!_细胞_患者_改造
2.CAR-T细胞疗法研发现状与发展趋势_临床_中国地区_白皮书
3.从 “改造免疫细胞” 到攻克癌症:CAR-T 疗法 20 年进化史|抗原|实体瘤|特异性|肿瘤细胞_网易订阅
4.“一针根治”——CAR-T在自身免疫疾病中的应用 - 知乎
5.CAR-T细胞疗法生产制造全解析:如何突破技术围城? - 知乎
6.全球 CAR-T 细胞疗法临床试验全景解读|肿瘤|免疫|靶点|抗原|实体瘤|新适应症_网易订阅
7.百万抗癌药有望进入商保目录,5款CAR-T疗法通过专家评审
8.CAR-T成本究竟是多少?在CAR-T细胞疗法的成本讨论中,首先需明确两个核心概念:企业价格与单纯制备成本。二者的构成差异直接决定了成本数值的... - 雪球
9.中国首个多中心商业化CAR-T真实世界应用数据发布,疗效与全球一致!_生物探索
10.万物可CAR系列 | CAR-T技术5代发展史 - 知乎
Nature综述 | 长远来看,CAR-T疗法对患者的治疗效果到底如何? - 知乎

https://blog.sciencenet.cn/blog-475824-1509141.html
上一篇:“综述”类文章的共性问题—兼对 410 篇综述稿的分析
下一篇:国自然“国产化”新政下,生物医学投稿怎么选?