博文
脑部中风心脏也会受伤!《细胞》  精选
精选
|
脑部中风心脏也会受伤!
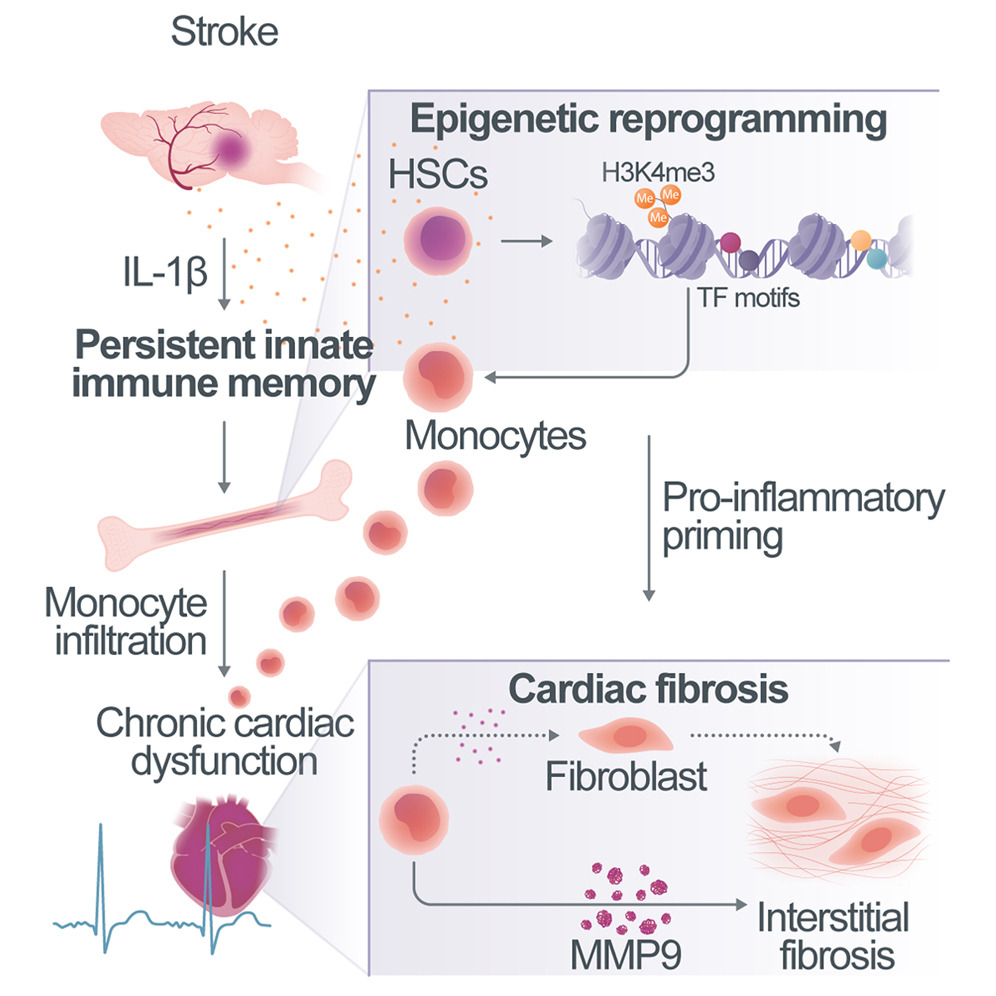
脑部中风可能会引发心脏炎症,但根据一项在小鼠中的研究表明,阻断特定的免疫反应可以限制这种损伤。
中风会暂时性地阻断大脑中的氧气流动,但同时也可能对其他身体部位造成长期损害。为了找出原因,德国慕尼黑路德维希·马克西米利安大学的Alba Simats及其同事确定了一个中风后一个月在小鼠免疫细胞中活跃的基因。
他们发现,中风导致了多个器官的炎症,特别是心脏。一种叫做IL-1β的免疫蛋白在中风后急剧增加。IL-1β改变了称为单核细胞的免疫细胞DNA上的标志物,并“训练”这些细胞促进炎症。然后,这些单核细胞迁移到心脏并对其造成损伤。
当研究人员使用抗体中和IL-1β,或用药物阻止经过训练的单核细胞迁移到心脏时,动物的心脏功能得到了改善。作者表示,类似的治疗可能会防止经历过中风的人出现进一步的健康问题。
Innate immune memory after brain injury drives inflammatory cardiac dysfunction: Cell
亮点
l 急性脑缺血导致持久的先天免疫记忆
l 先天免疫记忆引起中风后的慢性心脏功能障碍
l IL-1β通过表观遗传修饰诱导中风后的训练免疫
l 阻断IL-1β或单核细胞招募可预防心脏功能障碍
摘要
中风的医疗负担超出了大脑损伤本身,主要由随后发展的慢性并发症决定。我们假设这些并发症可能有一个共同的免疫学原因,然而中风后对系统性免疫的慢性影响尚未得到充分探索。在这里,我们将髓系先天免疫记忆识别为中风后远程器官功能障碍的原因。单细胞测序揭示了在脑损伤后多达3个月内,多个器官中的单核细胞/巨噬细胞持续存在促炎变化,尤其是在心脏中,导致心脏纤维化和功能障碍,这在小鼠和中风患者中都有观察到。IL-1β被鉴定为先天免疫记忆中表观遗传变化的驱动因素。这些变化可以被移植到未经处理的小鼠中,诱导心脏功能障碍。通过中和中风后的IL-1β或用CCR2/5抑制剂阻断促炎单核细胞的迁移,我们预防了中风后的心脏功能障碍。这样的免疫靶向疗法有潜力预防各种由IL-1β介导的并发症,为二级预防免疫疗法提供了一个框架。
引言
我们和其他人之前已经表明,急性脑损伤会引发一种无菌的全身性炎症反应。 对无菌损伤的炎症反应是通过将免疫源性警报素,如核蛋白或来自坏死细胞的DNA释放到血液循环中迅速启动的。 其特征进一步表现为血液中细胞因子水平增加、免疫细胞动员以及免疫细胞组成和功能的深刻变化。 与数小时至几天内的急性炎症反应相比,脑损伤对全身免疫系统的慢性影响在很大程度上是未知的。少数主要研究血液生物标志物的研究已经暗示了循环细胞因子和其他炎症标志物的浓度发生慢性变化,例如白细胞介素(IL)-6、IL-1、C反应蛋白(CRP)、干扰素(IFN)-γ 和高迁移率族蛋白1 (HMGB1)。 然而,对于脑损伤后系统性免疫区室的长期受损仍缺乏详细分析,其潜在机制也大都是未知的。
由于缺血性中风导致的急性脑损伤是成人死亡率和长期残疾的主要原因之一。除了缺血性脑损伤本身引起的早期死亡和发病外,中风后的长期发病还归因于二级并发症和合并症的高发,如认知障碍和痴呆、中风后抑郁、心脏事件、持续的血管炎症和中风引起的代谢紊乱。
然而,中风后这种长期二级并发症风险增加的确切原因仍然不明。近期研究表明,在细菌感染或接种疫苗后,固有免疫细胞的功能会发生长期变化。这一现象被称为固有免疫记忆或“训练免疫”,与抗原特异性适应的长寿淋巴细胞(T细胞和B细胞)形成对比。
在概念验证感染研究中已证明,固有免疫记忆能够改变再次感染后对病原体的反应性。这代表了一种有益的进化机制,有助于清除感染性病原体,但也可能在老化和自身免疫期间由于异常炎症而导致潜在的病理功能。 然而,关于无菌组织损伤后训练免疫的机制和后果的信息几乎为零。在器官移植模型、 实验性关节炎和系统性红斑狼疮患者中报道了髓系细胞的表观遗传变化。类似地,造血变化和促炎单核细胞启动与心血管疾病有关,尤其是动脉粥样硬化及其相关并发症。
我们假设,无菌组织损伤如中风可能导致类似的长期固有免疫记忆,而这些中风后的长期免疫学后果可能驱动二级并发症。
结果
中风诱导全身单核细胞/巨噬细胞中的长期炎症变化
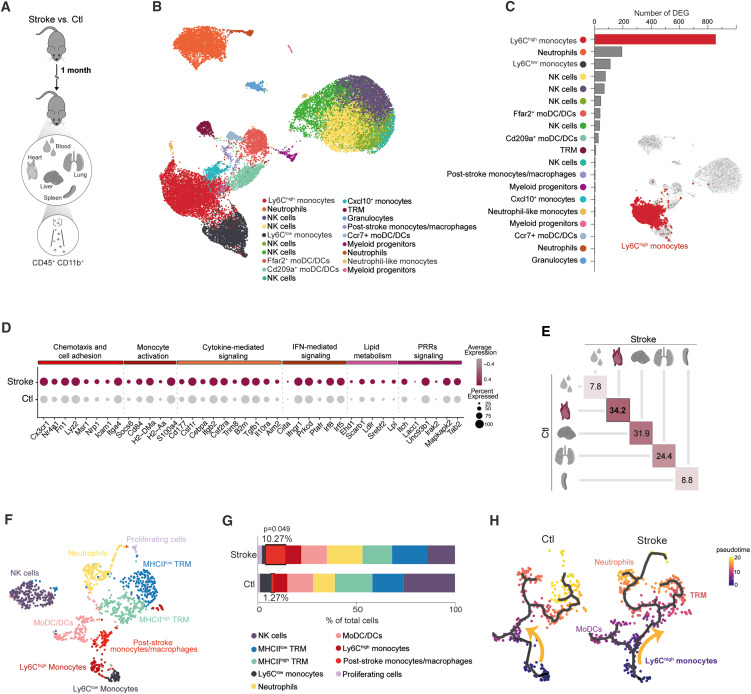
为了测试中风对长期全身性炎症的潜在影响,我们对实验性缺血性中风后1个月来自血液和多个外周器官的CD45+CD11b+髓系细胞进行了全面的单细胞mRNA测序分析,这些细胞先前已被关联到脑损伤在急性阶段的炎症后果(图1A)。
为此,我们使用了一个成熟的实验性中风模型,即暂时阻塞大脑中动脉, 这导致相对大的病灶体积,但小鼠在1-2周内从神经症状中基本恢复(图S1A)。在进行无监督聚类后,我们投射了总共29,124个髓系细胞,并根据最可变基因确定了20个独立簇(图1B和图S1B)。我们发现,在这个晚期慢性时间点之后,大量基因仍然存在差异调节,特别是在单核细胞/巨噬细胞群体中,而其他细胞群体,包括中性粒细胞或树突状细胞,受影响较小(图1C)。此外,单核细胞/巨噬细胞的转录组变化与任何子簇的频率变化无关(图S1C和图S1D),这解释了差异。中风后的单核细胞转录组签名与促炎表型相关联,特征是循环单核细胞和组织巨噬细胞的各种生物学相关的炎症信号通路显著上调,包括趋化因子和细胞粘附(例如,Cx3cr1、Lyz2、Icam1 和 Itga4)、细胞因子和IFN介导的信号通路(例如,Csf1r、Cebpa、Itgb2、Il10ra、Aim2、Irf8 和 Irf5)以及模式识别受体(PRRs)(例如,Irak2 和 Tab2)的表达增加(图1D、图S1E 和图S1F)。
此外,通过生物网络分析,我们确认了其他促炎介质的参与,如IL-12、IL-1和IFN-α及IFN-β,以及激活的外周器官常驻单核细胞/巨噬细胞表型的下游NF-κb和Akt信号通路(图S1G)。
https://blog.sciencenet.cn/blog-41174-1444628.html
上一篇:氢气缓解癌症放化疗副作用的研究【综述】
下一篇:氢气用于心血管代谢疾病管理【欧洲】