博文
FDA批准的第一种活细胞癌症药物  精选
精选
|
FDA批准的第一种活细胞癌症药物
使用患者的淋巴细胞被批准用于治疗黑色素瘤,并具有更广泛的应用
2024年2月15日,美国食品和药物管理局(FDA)批准了一种新型免疫疗法——lifileucel,作为第一种针对实体瘤的细胞疗法。这种自体细胞转移(ACT)免疫疗法使用患者自身的肿瘤浸润性淋巴细胞(TILs),这些细胞从手术切除的生长中的肿瘤中分离出来;在实验室中使用白细胞介素-2(IL-2),一种T细胞生长因子扩增到大量;然后在特殊条件下重新注入同一患者体内,它们会靶向肿瘤细胞。因此,这些TILs代表了一种“活的药物”,能够在携带癌症的患者体内增殖数千倍。该疗法获批用于对其他有效治疗无效的晚期黑色素瘤成人患者,这是在一项73名患者(NCT02360579)参与的多中心单臂研究中,按照标准肿瘤学标准显示出31.5%的癌症消退率后获得的批准。
使用TILs进行ACT导致已建立的癌症消退的能力首次在1986年的小鼠实验中报道,并在1988年在人类身上报道(1)。从发现到获得广泛使用的批准似乎长达36年的时间间隔,是由于几个因素造成的,包括为提高临床反应率而进行的不断改进,以及需要开发和完善适合FDA良好生产规范(GMP)的细胞生产指南。随着治疗发展到其当前状态,通过在细胞输注前立即给予淋巴耗竭化疗方案以提高临床反应率,主要是为了消除限制TIL活动的内源性抑制性T细胞。在小鼠肿瘤模型中的研究表明,在细胞输注后给予IL-2有助于促进转移细胞在体内的存活和生长,因此IL-2给药被加入到治疗方案中。
在使用TILs进行ACT的描述后的几十年里,多项研究报道了使用TILs在难治性黑色素瘤患者中获得积极临床反应的情况(2–4),包括一项随机对照试验显示其优于使用免疫检查点抑制剂ipilimumab的治疗(5)。在国家癌症研究所外科分部接受TILs治疗的192名转移性黑色素瘤患者中,在接受免疫检查点抑制剂抗程序性死亡蛋白1(PD1)之前,有56%的患者诱导出客观反应率,包括25%的患者出现完全持久的癌症消退(4)。由于转移细胞在患者体内的扩增能力,48名经历完全消退的患者中只有46名需要单次细胞输注,并且经过7年以上的中位随访,只有两名完全响应者复发。
TIL输注产品的生产在实验室中涉及多个步骤,首先将一个或多个切除的肿瘤沉积物解剖成直径为2至3毫米的碎片,然后共同在含有高剂量IL-2的生长培养基中组织培养瓶中培养。肿瘤基质内的淋巴细胞渗出到培养基中,并生长10至14天,之后用抗CD3单克隆抗体刺激,这是一种由过量照射的正常外周淋巴细胞呈现的非特异性生长因子,以使TILs进一步增殖额外的10至14天,然后收获用于输注。因此,生产TILs需要20至28天,它们代表了一种只适用于个体患者的独特药物。
为了使这种治疗广泛可用,关于TILs是否可以在护理点生产(如异体干细胞和器官移植所模型化的),或者是否可以由商业公司在中央设施生产后分发,进行了大量讨论。然而,很少有治疗机构拥有准备足够细胞的GMP资源。治疗的复杂性和高成本——lifileucel产品的成本为515,000美元——以及生产这种“活”产品所涉及的独特监管障碍,阻碍了使这种治疗广泛可用所需的商业发展。传统制药公司依赖于开发适用于大量患者的“瓶中药物”,并且容易广泛分发。尽管新药的开发有时可能需要数亿美元,但商业发展通常取决于能否以可负担的价格创造最终产品。相比之下,使用TILs进行ACT涉及为每位患者创建新药的一系列复杂步骤,使用患者自己的淋巴细胞。此外,最近对TILs作用机制的研究表明,大多数抗肿瘤TILs识别的是癌症突变的处理产物,这些产物对每个患者都是特定的,因此使得最终输注产品的精确表征变得复杂(6)。
使用TILs进行ACT免疫疗法未来发展面临的主要挑战是为那些无法通过任何现有治疗治愈的转移性实体上皮癌患者开发有效疗法,这些癌症占所有癌症死亡的90%。当前的系统性药物治疗通常能显著延长许多类型转移性上皮癌患者的生命,但治愈极为罕见。免疫系统的精确特异性和敏感性有潜力控制最后一个癌细胞,正如许多患有转移性黑色素瘤的患者在用IL-2或TILs治疗后超过20年仍然存活且无病一样。
黑色素瘤是少数几种被证明可以重复响应未筛选TIL疗法的癌症之一,这很可能是因为与实体上皮癌相比,其潜在的免疫原性突变频率更高。然而,最近的研究表明,超过70%的所有人类上皮癌类型都可以产生与自体癌症中的随机体细胞突变产生的表达蛋白反应的TILs(7)。上皮癌中肿瘤反应性TIL的频率很低(大约每千个浸润T细胞中有一个)。因此,为了将TIL疗法扩展到常见实体癌,一个高优先级是开发方法来选择性培养识别癌症抗原的TILs并减少非活性旁观者细胞的生长。一种已经显示出一些成功的方法是从切除肿瘤的不同区域获得的单个碎片中选择性培养TILs,并对每个产生的培养物进行体外测试,以识别表达的癌症突变(6)(见图)。
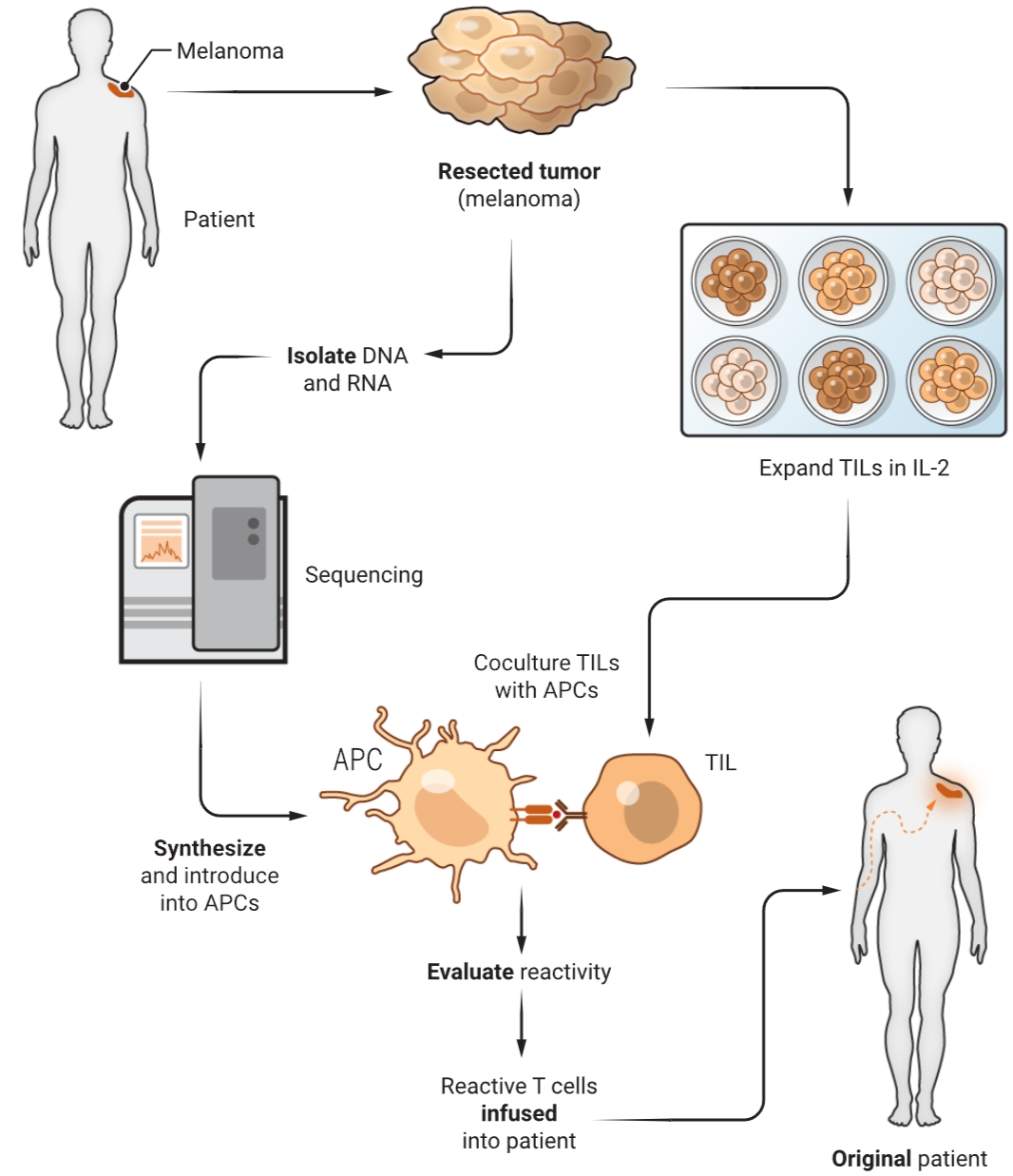
在使用这种选择方法培养TILs的早期研究中,包括胆管癌、结肠癌、乳腺癌、宫颈癌、卵巢癌和头颈癌在内的转移性上皮癌患者中报告了显著的客观消退。这表明,随着进一步的发展,TIL免疫疗法可能对常见上皮癌患者有用(8-10)。
增加反应性TIL培养物生长的其他方法包括识别肿瘤反应性T细胞的特征性基因签名,这可以用来从新鲜肿瘤消化物中识别这些细胞(11)。此外,可以使用针对已识别癌症抗原的体外致敏来促进它们的选择性增殖(12)。当TIL与它们的同源抗原共培养时,如41BB和OX40等标记物的表达上调,也可以用来纯化肿瘤反应性淋巴细胞。
对响应与非响应患者输注的转输细胞进行的详细分子研究证明了输注TILs的分化状态的重要性(13)。当抗肿瘤T细胞在接触抗原后在体外被激活并生长时,它们从更幼稚的干细胞样状态转变为分化的衰老表型,因此失去了关键功能特性,并且在体内增殖的能力降低。开发改进的培养条件以维持干细胞样状态的同时促进淋巴细胞生长,可以提高体内的抗肿瘤效果。可以潜在改善或降低成本的进一步发展涉及努力从核心活检中获得TILs、简化准备方案以及遗传修饰TILs以增强其抗肿瘤功能。将TILs与针对TIL靶向的相同抗原的多种附加剂如癌症疫苗结合使用也可能提高效果。
使用“活药物”如TILs促使了使用其他类型淋巴细胞进行ACT免疫疗法的额外方法的发展。正常循环中的淋巴细胞被转导以表达嵌合抗原受体(CAR)——一种实验室构建物,将单克隆抗体的抗原识别区域与淋巴细胞内信号链连接起来——可以重新定位淋巴细胞到抗体目标。针对许多B细胞恶性肿瘤上表达的共同CD19细胞表面分子的CAR已在ACT中使用。从2010年开始,这些细胞的管理被证明可以成功治疗侵袭性淋巴瘤患者(14),后来是B细胞白血病,并于2017年获得FDA批准。针对其他血液恶性肿瘤如多发性骨髓瘤表达的分子的CAR也在使用中。CAR T细胞尚未有效应用于治疗实体上皮癌患者,因为缺乏能够识别癌细胞特有的三维结构细胞表面分子的单克隆抗体,这些分子同样不被同样易受免疫破坏的正常组织共享。因此,对癌细胞的特异性至关重要。
编码识别癌症上独特主要组织相容性复合体(MHC)-肽结构的常规T细胞受体(TCRs)的基因可以被转导到正常的自体淋巴细胞中,并且在临床试验中,这些基因工程细胞可以导致癌症消退(15)。此外,已经生成了识别p53和KRAS癌蛋白中突变的基因库,这些癌蛋白分别在约50%和30%的实体癌中表达,并且正在作为现成的受体用于ACT实验。然而,MHC分子的巨大异质性需要大量不同种类的TCRs。总的来说,FDA最近批准了第一种针对实体癌的细胞疗法,这将激励学术机构和商业公司改进这一治疗方法。
https://blog.sciencenet.cn/blog-41174-1441095.html
上一篇:解决阿片类药物过量使用的潜在策略
下一篇:一种潜在治疗镰刀贫血病的表观遗传调节药物