博文
慢性应激如何伤害肠道,中国学者给出线索  精选
精选
|
长期以来,精神应激一直与肠易激综合征(IBS)等胃肠道疾病的发作有关。现在,研究人员已经发现了压力伤害肠道的一种方式的确切细节 - 通过引发重塑肠道微生物组的生化级联反应。
他们的研究今天发表在《细胞代谢》杂志上1费城宾夕法尼亚大学的微生物学家和神经科学家克里斯托夫·泰斯(Christoph Thaiss)说,研究很好,因为它强调了大脑可以影响胃肠道。
肠易激综合征会引起腹痛和腹泻,影响十分之一的人。全世界有多达1000万人患有炎症性肠病(IBD),这会导致肠道发炎并引发类似的症状。该研究的合著者中国药科大学郑啸(Xiao Zheng)想了解在细胞水平上发生了什么来触发这些情况。
为了找到答案,他和同事将小鼠暴露在慢性压力下两周,并观察其影响。与没有受到压力的小鼠相比,这些动物最终降低了有助于保护肠道免受病原体侵害的细胞水平。这是因为通常转化为这些保护细胞的肠道干细胞的新陈代谢功能失调。
为了寻找原因,研究人员转向了动物的微生物组 - 肠道中细菌和其他微生物的集合,以帮助消化。以前的工作2研究表明,交感神经系统的激活可以重塑微生物组,交感神经系统负责身体的“战斗或逃跑”反应,通常由精神压力触发。乳酸菌属的一些细菌天然存在于肠道中,在压力条件下增殖,产生一种叫做吲哚-3-乙酸酯(IAA)的化学物质。研究人员发现,由压力引发的IAA水平升高会阻止小鼠肠道干细胞成为保护细胞。
虽然这项研究是在小鼠身上进行的,但研究人员收集的证据证明他们的发现可能适用于人类:研究小组发现,与没有抑郁症的人相比,抑郁症患者的粪便中乳酸菌和IAA的水平升高。“当我们遭受压力时,我们的肠道微生物组也会遭受压力,”郑说。
作者还发现了一种可能的解毒剂,至少在小鼠身上是这样。当他们给应激小鼠一种叫做α-酮戊二酸的补充剂时,一些健美运动员服用这种补充剂,它启动了肠道中受损干细胞的新陈代谢。Thaiss警告说,需要更多的工作来了解补充剂的长期影响,以及它是否能减轻肠道功能障碍的症状。
Thaiss补充说,由于压力会引发体内的大量生化变化,因此仅凭这项研究并不能说明压力与肠道联系的全部情况。在去年发表在《细胞》杂志上的一篇论文中3,他和他的同事们发现了一种单独的生化途径,该途径始于压力大的大脑发出信号,并以肠道中的免疫细胞变得过度活跃而结束。这些机制如何相互作用(如果有的话)尚不清楚。
Thaiss还说,IAA的研究只解决了压力对肠道的下游影响 - 需要更多的工作来了解大脑如何传递启动细菌增殖的信号。郑说,他和他的同事们计划接下来研究这些上游效应,此外还进一步测试α酮戊二酸的安全性和有效性。
爱尔兰科克大学(University College Cork)的神经胃肠病学家杰拉德·克拉克(Gerard Clarke)说,IAA的研究“当然是一块新的拼图”,“但这个拼图中有多少块仍然是一个悬而未决的问题”。
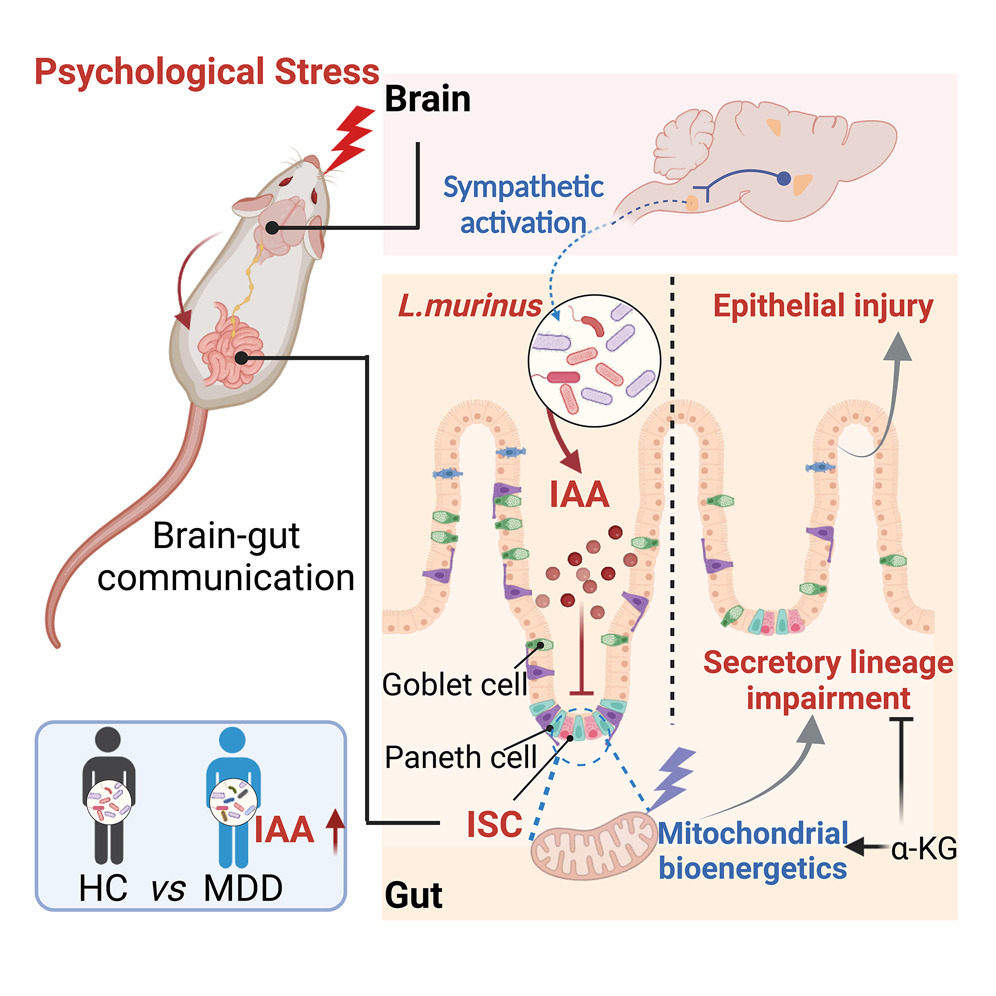
大脑和肠道错综复杂地联系在一起,并对各种刺激做出反应。应激诱导的脑肠通讯与肠道疾病的发病机制和复发有关。将心理压力传递到肠上皮,导致适应不良的机制仍然知之甚少。在这里,我们描述了一种应激反应的大脑到肠道代谢轴,该轴损害了肠道干细胞 (ISC) 谱系的承诺。心理压力触发的交感神经输出富集肠道共生鼠乳杆菌,增加吲哚-3-乙酸酯 (IAA) 的产生,从而导致肠道分泌细胞的可转移损失。细菌 IAA 破坏 ISC 线粒体生物能量学,从而以细胞内在方式阻止分泌谱系承诺。口服α-酮戊二酸补充剂可增强 ISC 分化,并赋予其对应激引发的肠上皮损伤的复原力。
大脑和肠道之间存在一个精确而复杂的调节网络,用于对环境挑战进行综合适应。众所周知,肠道会传递局部代谢、免疫和微生物线索,为大脑和行为变化提供信息。反过来,中枢神经和内分泌输出调节肠道蠕动、粘膜免疫以及微生物生态学。长期以来,人们一直知道这种双向肠脑连接会参与有机体应激反应,其对压力的适应不良通常表现为肠易激综合征 (IBS) 和炎症性肠病 (IBD) 等疾病,这些疾病在传统疗法中管理不佳。最近,据报道,心理压力会触发单核细胞介导的肠道炎症以加剧IBD,从而揭示了精神压力对肠道炎症影响的机制。然而,关键问题仍然存在,例如如何在肠道界面感知远端脑应激源,以及哪些信号分子将控制传递给肠道上皮紊乱。
肠道干细胞 (ISC) 的高度协调增殖和分化对于应对各种挑战的肠上皮更新和稳态至关重要。众所周知,ISC 对来自相邻潘氏细胞、基质细胞和免疫细胞的各种生态位信号产生动态响应,以及各种外部线索,如饮食成分和微生物组。然而,对于这些信号如何被重新连接以在心理压力的背景下决定 ISC 的命运决定知之甚少。
作为肠脑串扰的关键调节因子,肠道微生物组受到心理因素的动态影响。先前的研究表明,在应激下,乳酸杆菌属、拟杆菌属和链球菌属等多种细菌物种的水平发生了变化,尽管对脑肠信号传导背后的关键参与者的共识和见解仍然有限。系统发育多样化的微生物可以依靠相似的代谢物进行宿主相互作用。有趣的是,我们之前的研究和其他研究表明,一些微生物代谢物是ISC增殖的重要调节因子。因此,微生物代谢物轴的鉴定可能有助于揭示肠道稳态在心理压力下是如何丧失的。
在这项研究中,我们揭示了一种从大脑到肠道的途径,将心理压力传递给肠上皮功能障碍。通过宏基因组学、代谢组学、谱系追踪、代谢生物工程和肠道类器官技术,我们将鼠乳杆菌衍生的吲哚-3-乙酸乳杆菌 (IAA) 鉴定为应激响应中继信号,触发分泌谱系承诺的 ISC 内在缺陷。我们在不同的心理困扰患者队列中验证了这种联系,并在小鼠中提供了概念验证证据,证明补充α-酮戊二酸 (α-KG) 可有效缓解压力驱动的肠道上皮损伤。总之,这些发现揭示了微生物介导的 ISC 命运决定的调节途径,该途径是压力驱动的脑肠共病的基础。
https://blog.sciencenet.cn/blog-41174-1419224.html
上一篇:《爱因斯坦革命》:爱因斯坦取得突破的历史根源
下一篇:中国科学家颠覆教科书的新发现,多细胞生命出现时间提前6亿年