博文
蛋白质免疫印迹实验 | MCE
|
蛋白质免疫印迹(Western Blot, WB)是一种用于检测特定样品或提取物中目标蛋白的分析方法。该技术利用聚丙烯酰胺凝胶电泳(PAGE)将蛋白质按分子量大小分离并转移到固相膜载体后利用特异性抗体识别目标蛋白。其检测原理基于抗原-抗体特异性结合,可实现蛋白质的鉴别和半定量分析,广泛应用于蛋白质表达水平检测、修饰状态分析及相关机制探索等领域。
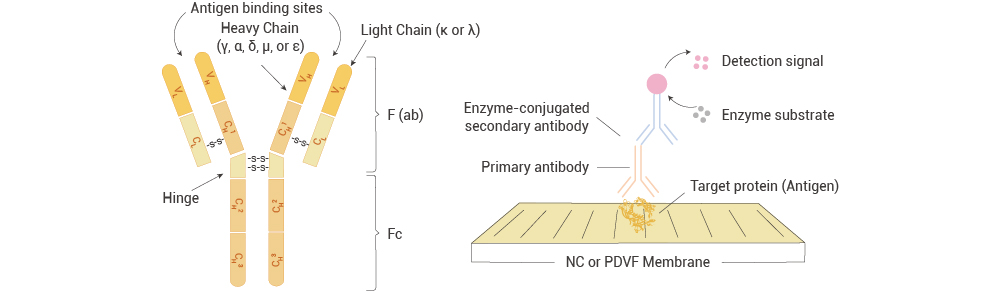
图 1. 抗体结构(左)和检测原理(右)示意图。
一、实验前准备实验开始前需要对所研究的目的蛋白在待测样本中的表达水平、蛋白大小、蛋白时空表达特征以及潜在的翻译后修饰等背景信息进行深入的了解,有助于我们设置合适的实验方案。
1.1 蛋白的定位注意:(1)特定组分蛋白检测:若目标蛋白在全细胞裂解液中含量较低,可能难以检测到,建议根据蛋白定位提取相应组分,如核蛋白,膜蛋白,线粒体蛋白。
(2)核蛋白提取:检测核蛋白时,推荐采用超声裂解以提高提取效率。
(3)分泌型蛋白检测:对于分泌型蛋白,可在细胞培养时加入 BFA(HY-16592)抑制分泌或检测细胞培养上清液。
(4)跨膜蛋白处理:对于多次跨膜蛋白,建议避免高温煮样,或者可以设置温度梯度进行预实验,以减少蛋白变性和降解。
实验前需确定样本中是否表达目的蛋白。 通常会参考文献或数据库进行样本的选择,常用的数据库如下:
(1)proteinatlas,简称 HPA 数据库,提供人类蛋白质在组织和细胞系中的表达和定位信息。
(2)phosphosite,蛋白质翻译后修饰数据库,查阅修饰类蛋白的表达条件和丰度、刺激方式等。
(3)biogps,可以查询人、小鼠、大鼠中某种蛋白的 mRNA 表达水平。
1.3 蛋白的翻译后修饰编码蛋白的基因在表达以后,通常还需不同翻译后修饰(post-translation modifications, PTMs)如磷酸化、糖基化、乙酰化、甲基化、泛素化等,才能获得正常的结构与功能。这些翻译后修饰过程受多种修饰酶和去修饰酶等的严格调控,使得蛋白在特定瞬间或时期背景下呈现持续稳定或动态可逆的功能状态。
在进行蛋白检测(如 WB)时,如果蛋白存在翻译后修饰,结果可能会出现分子量大小与预期理论值不符、条带弥散、多条带或条带较弱等情况。如糖基化修饰通常会导致蛋白表观分子量大于预测值。
在蛋白提取和检测过程中,为了最大程度保留目标蛋白的天然修饰状态并避免降解,实验操作中应加入蛋白酶抑制剂(防止蛋白被内源性蛋白酶降解)以及磷酸酶抑制剂(防止已存在的磷酸化修饰被去除),必要时还可根据研究对象选择相应的去乙酰化酶抑制剂或其他特异性抑制剂(如激酶抑制剂)。抑制剂添加能够有效保证目标蛋白的稳定性与修饰完整性,从而获得更准确的检测结果。
常用查询数据库uniprot,可查询目的蛋白的基因名、别名、功能、可变剪切体、亚细胞定位及可能的翻译后修饰类型等信息,为实验设计与结果分析提供参考。
1.4 蛋白是否存在异构体/剪切体通过数据库/文献查询靶蛋白是否有异构体以及可变剪切体。如果存在,此类结构差异可能导致 WB 实验中出现多条蛋白条带。为避免遗漏重要信息,建议首次实验时尽量保留完整膜片进行检测。
二、Western Blot 实验流程蛋白样本制备 → 电泳 → 转膜 → 封闭 → 孵育抗体→ 显影
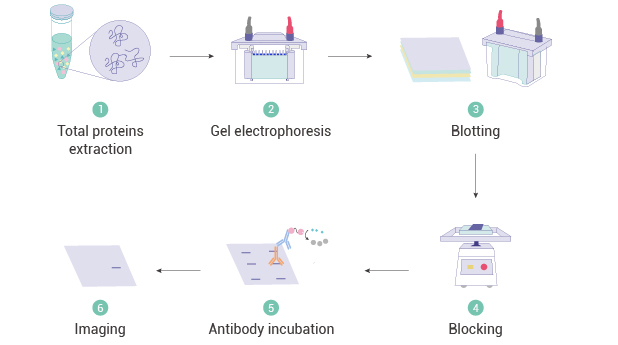
图 2. Western blot 的流程图[1]。
三、蛋白样本制备目的:细胞裂解是蛋白样本制备的关键环节,目的是释放细胞内的蛋白质,以便后续检测。
3.1 总蛋白提取 (使用 RIPA 裂解液 (强) 为例)(1)准备溶液:室温融解蛋白裂解液 RIPA,加入蛋白酶磷酸酶抑制剂混合物 (50×),使最终浓度为 1×,混匀,立即放置在冰上。
(2)不同样本裂解方法
对于贴壁细胞:用 4℃ 预冷的 PBS Buffer (1×) 洗 2~3 遍,用细胞刮刀刮下细胞,或用 EDTA 溶液处理细胞使细胞不再贴壁很紧,并用移液器吹打下细胞。离心收集细胞,尽可能吸尽上清,留下细胞沉淀备用。细胞样品按 1×106 细胞数加 100 μL 裂解液,冰上裂解 30 min(或冰上裂解 5 min,超声仪冰浴超声 20 s)。
对于悬浮细胞:用 PBS 洗 2~3 遍,离心收集细胞,尽可能吸尽上清,留下细胞沉淀备用。细胞样品按 1×106 细胞数加 100 μL 裂解液,冰上裂解 30 min(或冰上裂解 5 min,超声仪冰浴超声 20 s)。
对于组织样品:剪取适量组织和蛋白裂解液于匀浆器中磨匀(0.01 g 组织加上 50-100 μL 的蛋白裂解液),直至看不见组织块。将组织样品匀浆液转移至 1.5 mL EP 管中,置于冰上蛋白裂解 15 min。12000 rpm,4℃ 离心 10 min,立即吸取上清至一预冷的 1.5 mL EP 管中,即为抽提得到的细胞浆蛋白。
(1)制备好 BSA 标准品,准备 BCA 工作液 A 液: B 液 = 50:1。样品用预冷 PBS 进行稀释。
(2)孵育 30 min,酶标仪 562 nm 波长读取各孔 OD 值。根据标准曲线和使用的样品体积计算出样品的蛋白浓度。
聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,简称 PAGE),是以聚丙烯酰胺凝胶作为支持介质的一种常用电泳技术,用于分离蛋白质和寡核苷酸。它有两种形式:非变性聚丙烯酰胺凝胶电泳(Native-PAGE)和变性聚丙烯酰胺凝胶电泳。
在蛋白质的非变性聚丙烯酰胺凝胶电泳中,蛋白质能够保持完整状态,并依据蛋白质的分子量大小、蛋白质的形状及其所附带的电荷量而逐渐呈梯度分开;在 DNA 的非变性聚丙烯酰胺凝胶电泳中,DNA 呈双链状态泳动,其迁移率会受碱基组成和序列的影响。
在变性聚丙烯酰胺凝胶电泳中,由于加入了变性剂——蛋白质变性剂常为 SDS(SDS-PAGE),核酸变性剂常为尿素、甲酰胺等,故其分离仅依据于分子量大小。
在高电压的作用下,所有孔道中的蛋白会同时开始向下迁移,分子量大的蛋白,阻力大,位置靠上,分子量小的蛋白则靠下,示意图如下:
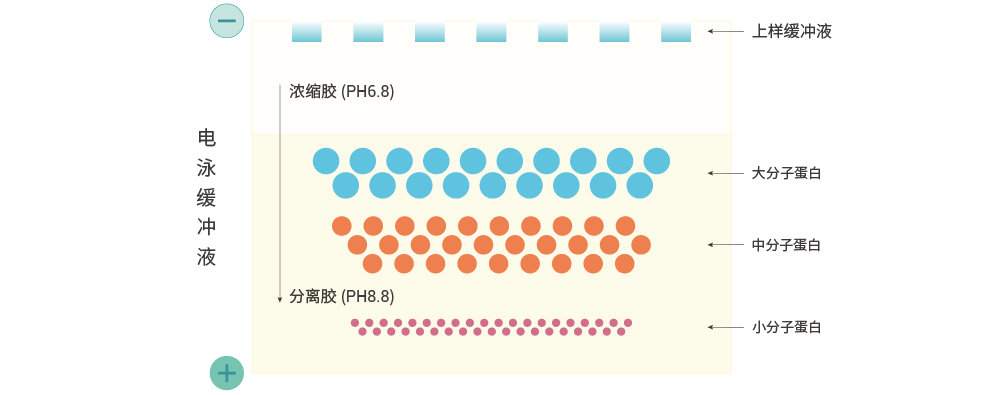
图 3. 电泳示意图。
4.1 制胶 (使用预制胶板请忽略此步骤)(1)准备玻璃板,确保两块玻璃板下缘水平且均无豁口,安装时内长外短,用手压实玻璃板及垂直槽制胶架。
(2)倾斜垂直槽制胶架子装入垂直槽制胶固定架,注意为防止胶片变形漏液体,不要过分用力下压,并确保卡好。
(3)按照每块 5 mL 配制配制分离胶(1 mm 厚度),轻轻混匀后立即铺板(SDS-PAGE 凝胶配方详见“怎么做 Western blot? 看这一篇就够了!”或直接选购凝胶制备试剂盒)。
(4)铺板后用异丙醇将分离胶液面压平。
(5)凝固 40 min 后,吸干异丙醇。用 ddH2O 轻轻冲洗并吸干。
(6)按照每块 1.5 mL 配制浓缩胶,并插上合适大小的梳子,注意操作要迅速且水平,不能产生气泡。
(7)待浓缩胶凝固后,拔下梳子,并把配好的凝胶从制胶架上拆下,用 ddH2O 将残留在胶板上的胶清洗干净,并用保鲜膜包裹住,立即使用或 4℃ 储存。
根据实验需求和蛋白特性,选择合适的 SDS-PAGE 蛋白质上样缓冲液制备还原样本或非还原样本,以满足不同实验设计的分析要求。
4.3 上样尽量保持每个泳道的蛋白量一样,体积尽量一致,空置的泳道用等体积的 1× 上样缓冲液补齐,以避免由于凝胶受力不均而导致最后的一两个样品条带出现上扬现象。
4.4 跑胶(2)根据 BCA 测定结果,目的蛋白每孔上样量 20 μg-40 μg,内参蛋白每孔上样量 5 μg-10 μg。
(3)电泳时上层胶使用低电压恒压电泳,80 V,约 30 min。
(4)溴酚蓝进入下层胶时使用高压恒压电泳,120 V,至溴酚蓝到达胶的底端处附近即可停止电泳。
参考文献:
[1] Pillai-Kastoori L, et al. Antibody validation for Western blot: By the user, for the user. J Biol Chem. 2020 Jan 24;295(4):926-939.[2] Ferguson RE, et al. Housekeeping proteins: a preliminary study illustrating some limitations as useful references in protein expression studies. Proteomics. 2005 Feb;5(2):566-71.
https://blog.sciencenet.cn/blog-3536222-1519912.html
上一篇:Metformin,二甲双胍,657-24-9_MedChemExpress
下一篇:Ionomycin,离子霉素,56092-81-0_MedChemExpress