博文
科研助攻 | RTKs∶ 既是激酶, 也是受体 干货已整理好, 速览!| MCE
|
众所周知,蛋白质有那么多多多多多多的功能往往都是需要经过修饰才能实现滴,而蛋白质的修饰通常由酶驱动。欸,有这样一类兼具激酶与受体的双重功能的酶类,了解一下?
Section.01
受体酪氨酸激酶 (RTKs),
了解一下!
提到酶,大家最熟悉的应该是这一对:激酶 (Kinase) —— 磷酸化,磷酸化酶 (Phosphorylase) —— 去磷酸化。具体小 M 不再赘述,感兴趣的小伙伴可以翻翻往期推文:“激酶”与“磷酸酶”,靶向治疗两手抓。
本期我们重点要聊的是信号通路中的重要参与者——蛋白激酶!其中,受体酪氨酸激酶 (Receptor Tyrosine Kinases, RTKs) 具备激酶与受体的双重功能,是规模最大的一类跨膜酶联受体!
RTKs 的结构组成
RTKs 家族由保守的结构域构成,即具备配体结合位点的细胞外结构域、单次跨膜的疏水 α 螺旋区,以及拥有酪氨酸蛋白激酶 (PTK) 活性的细胞内结构域[1][2]。
细胞外结构域:具备配体 (生长因子) 结合位点,负责识别并结合特定配体。此部分包含多种具有特定氨基酸序列的结构域,例如富半胱氨酸结构域、酸性结构域、免疫球蛋白样结构域等。
跨膜区:通常为单次跨膜的疏水 α 螺旋区,起到连接胞外区与胞内区的作用。
细胞内结构域:含有酪氨酸蛋白激酶活性域,借助自磷酸化以及对下游信号蛋白的磷酸化来启动信号转导。
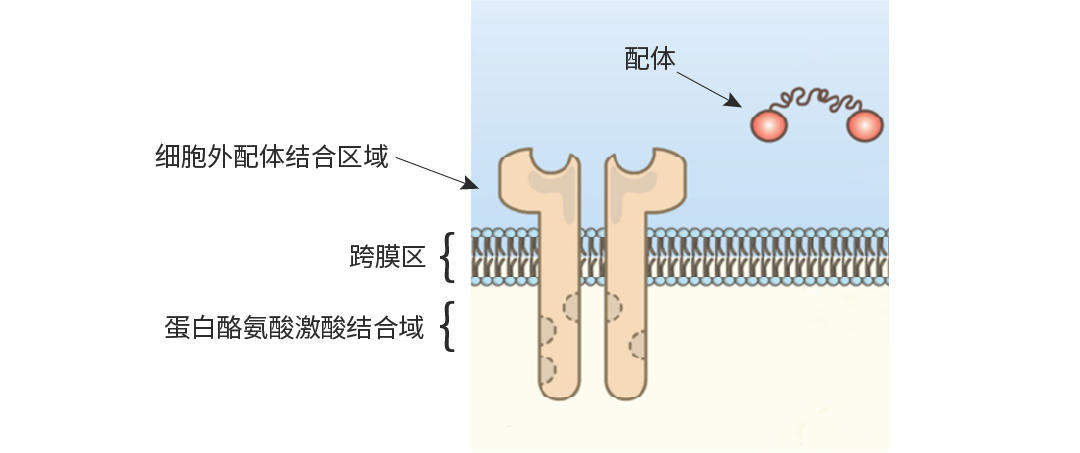
图 1. RTKs 结构域[2]。
RTKs 的激活
RTKs 的激活是一个多维度的过程,受外部配体可及性与内在受体构象动力学之间微妙平衡的影响[1][3]。在分子层面上,RTKs 激活并非单一的事件,而是不同调节机制的汇聚,这些机制反映了它们所调控的复杂生物系统。
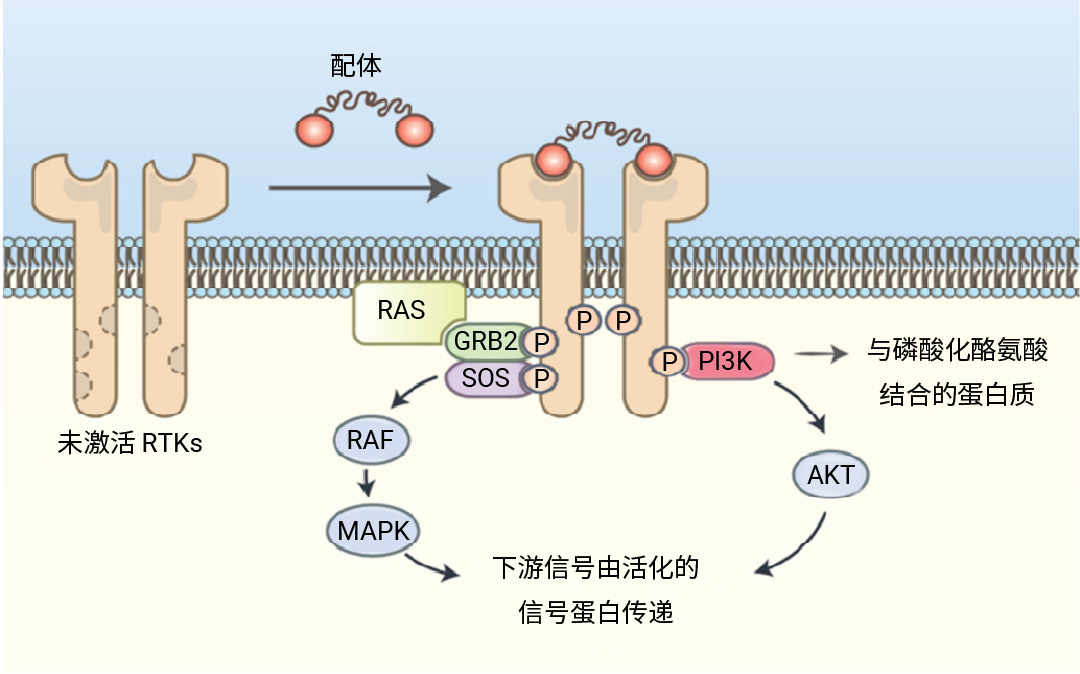
图 2. RTKs 激活过程[2]。
Section.02
RTKs家族大盘点
人类体内已鉴定出 58 种 RTKs,这些蛋白依据其细胞外结构域的组成差异被划分为 20 个家族,其独特的结构特征决定了它们在细胞信号传导中功能的多样性 (图 1)[1][3]。同一家族的成员通常能够识别并结合相同或结构相似的配体,从而激活特定的下游信号通路。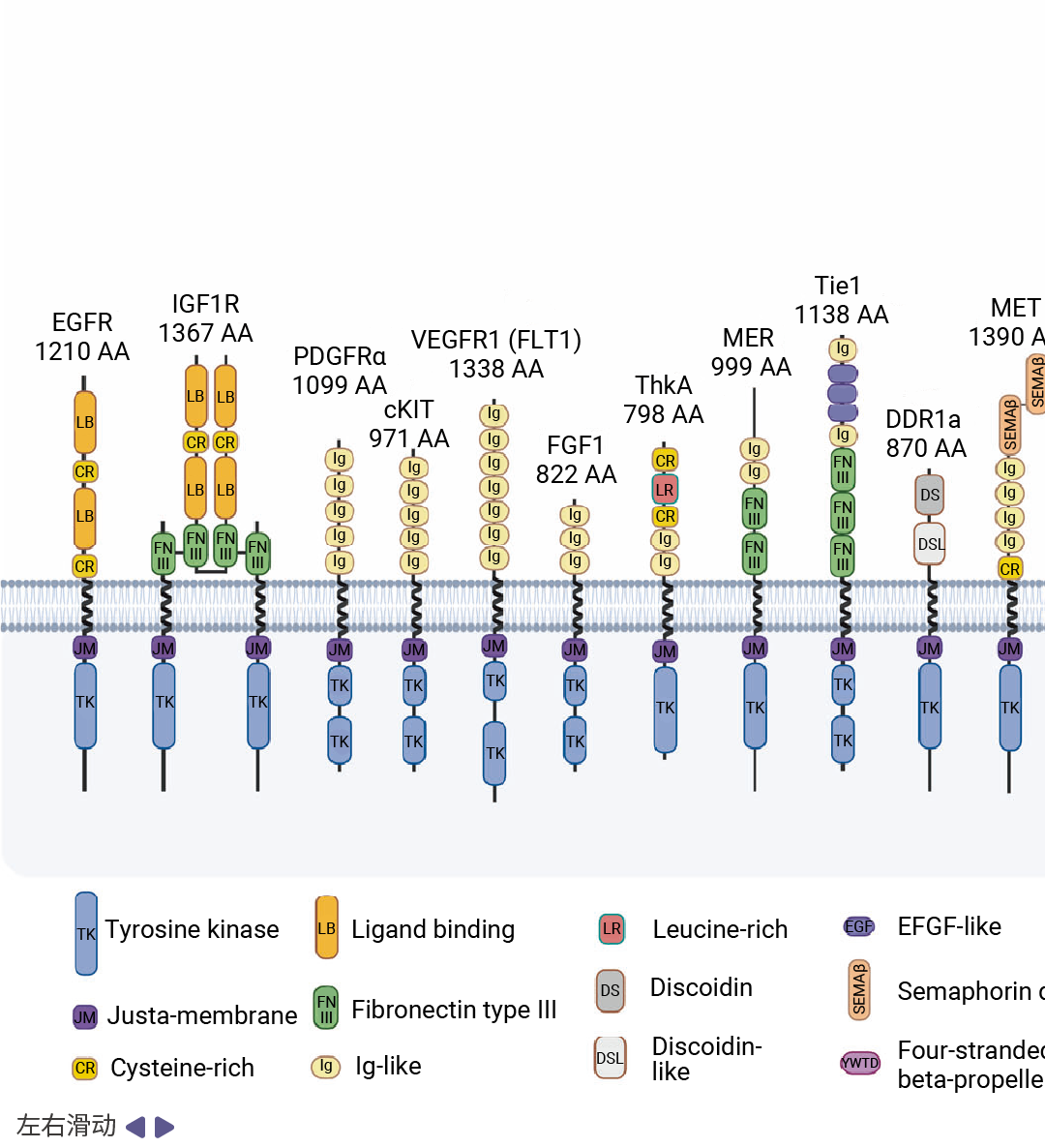
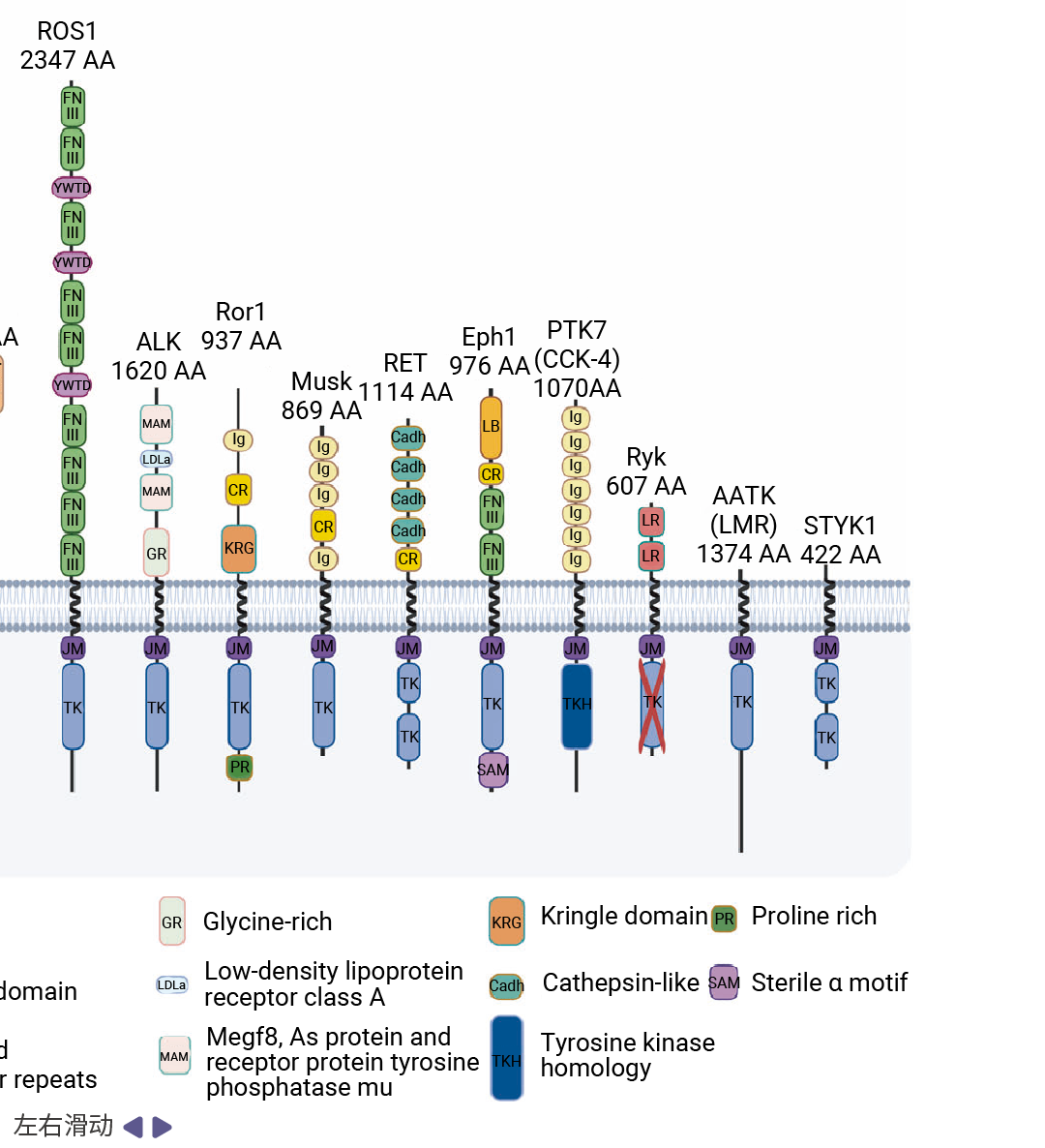
图 3. 20 种受体酪氨酸激酶的结构[3]。
下面我们重点介绍下 RTKs 中的表皮生长因子受体 (EGFR/ErbB)、肾上腺素受体 (Eph) 和成纤维细胞生长因子受体 (FGFR)。
表皮生长因子受体 (EGFR/ErbB)
表皮生长因子受体 (EGFR/ErbB) 家族由四种高度同源的受体酪氨酸激酶构成,涵盖 ErbB - 1 (HER1/EGFR)、ErbB - 2 (HER2/Neu)、ErbB - 3 (HER3) 和 ErbB - 4 (HER4)。这些受体在间充质、上皮及神经元来源的组织中广泛表达,通过调控细胞的增殖、分化和存活,参与多种生理过程[4]。
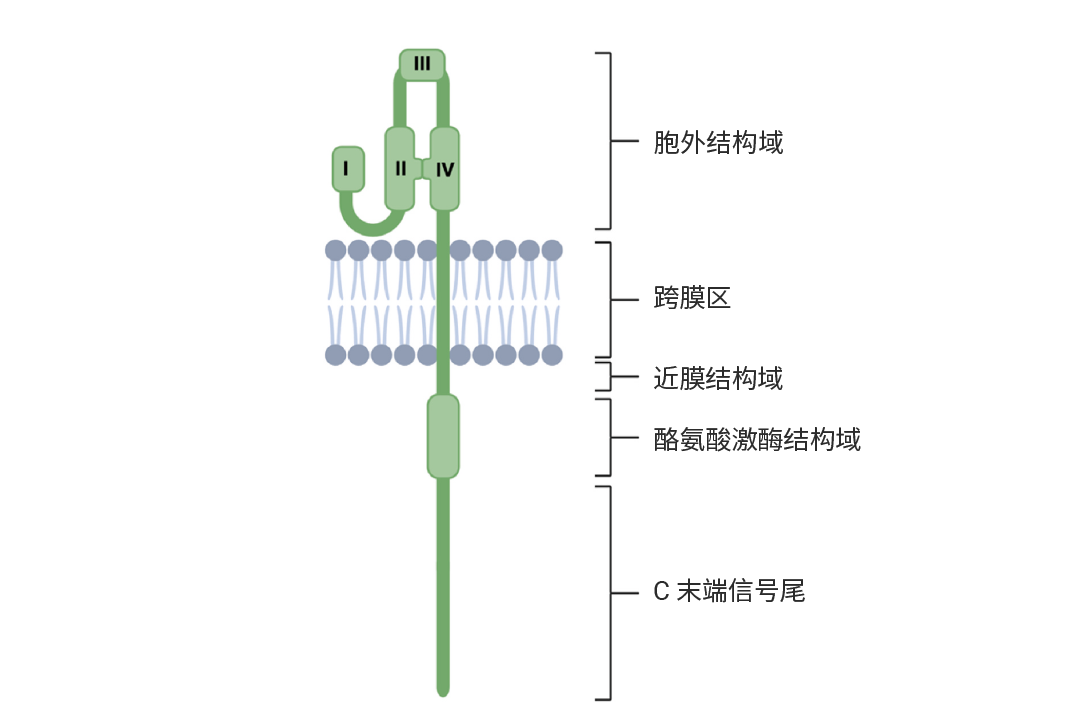
图 4. ErbB-3 受体的单体形式示意图[6]。
Eph 受体
Eph 受体是目前已知的受体酪氨酸激酶 (RTKs) 中最大的家族,其配体为产生促红细胞生成素的肝癌受体相互作用蛋白 (Ephrins)[7]。在哺乳动物中,该家族已鉴定出 14 个成员。依据序列同源性、配体结合特性以及结构差异,它们被系统地划分为 EPHA (包含 EPHA1 - 8 及 EPHA10) 和 EPHB (包含 EPHB1 - 4 及 EPHB6)。
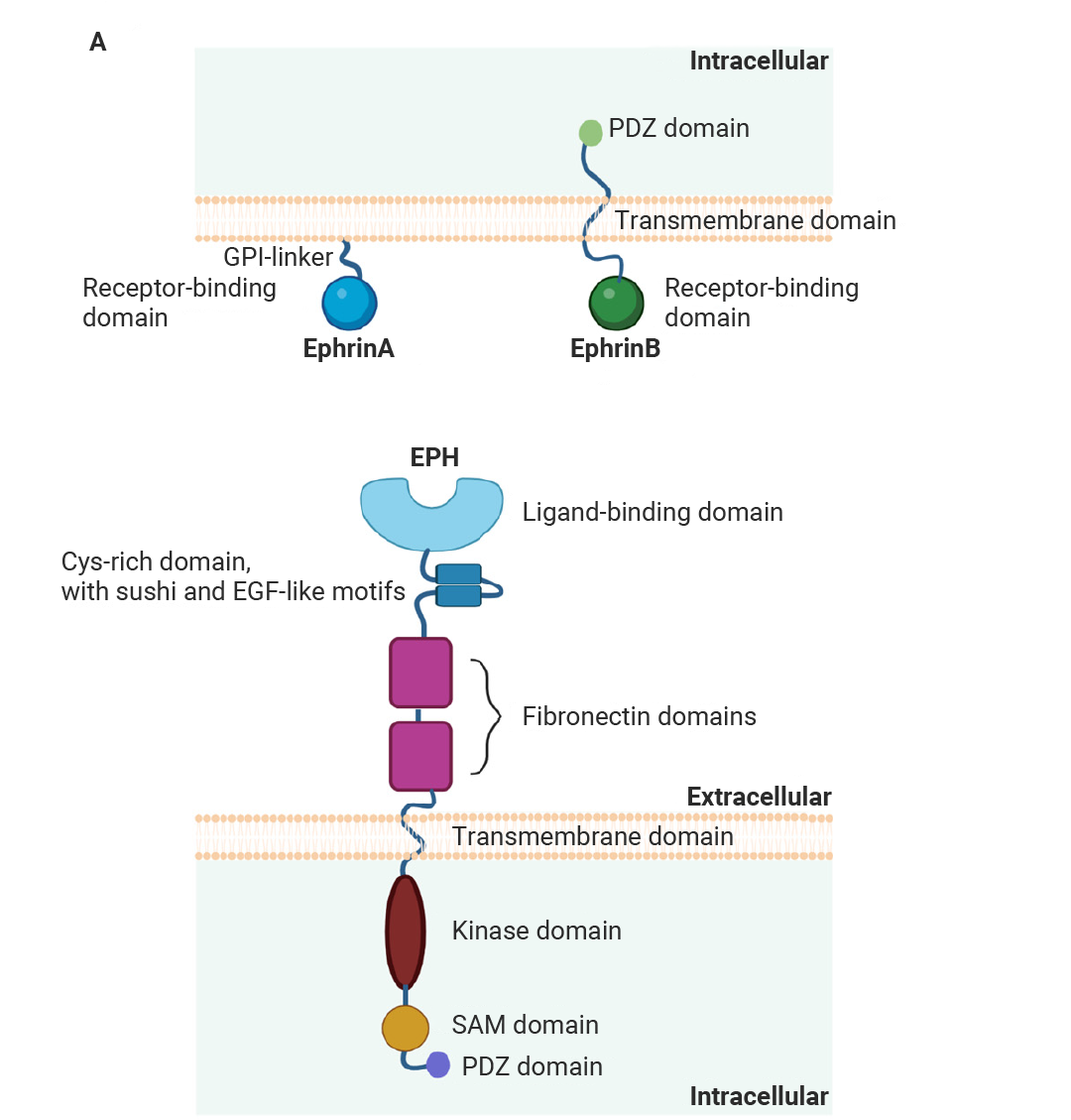
图 5. Ephrins 与 Eph 受体的结构[8]。
成纤维细胞生长因子受体 (FGFR)
成纤维细胞生长因子受体 (FGFR) 是一类具有高度保守性的跨膜酪氨酸激酶受体,能够特异性地与成纤维细胞生长因子 (FGF) 蛋白家族的不同配体相结合。在脊椎动物中,已鉴定出五种不同的膜 FGFR,它们均隶属于酪氨酸激酶超家族 (FGFR1、FGFR2、FGFR3、FGFR4、FGFR5)[9]。其中部分受体与病理状况存在关联,例如 FGFR3 中的点突变可经由组成型激活受体,进而引发软骨发育不全。
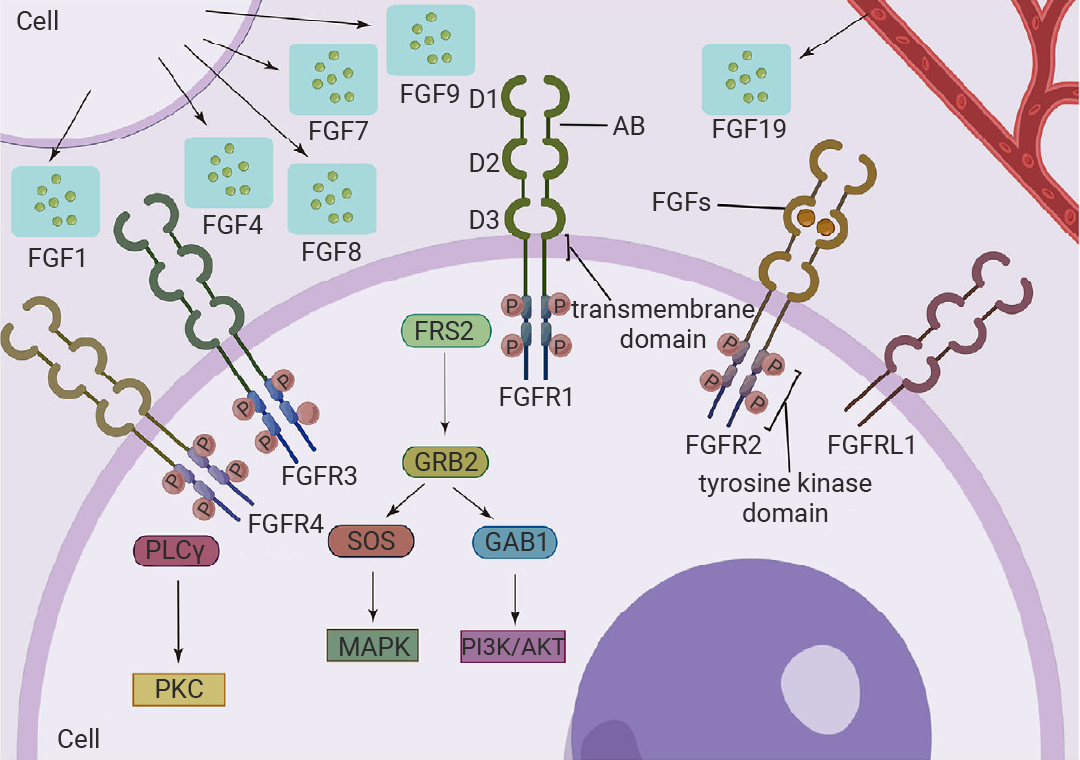
图 6. FGFR 家族的基本结构[9]。
Section.03
RTKs 失调与癌症
RTKs 通过调控细胞增殖、存活、迁移以及血管生成等关键通路,维持机体的正常生理稳态。但在癌症的发生与发展过程中,RTKs 的异常激活是驱动肿瘤恶性转化的核心机制之一。
在癌细胞中,RTKs 的失调主要由功能获得性突变、过表达与基因组扩增、染色体重排、激酶结构域重复以及自分泌/旁分泌激活这五种机制介导[3][10]。这些机制会致使 RTKs 发生持续性磷酸化,进而过度激活下游的致癌信号通路,打破细胞生长与死亡的平衡,最终引发肿瘤转移、血管生成以及治疗耐药性。
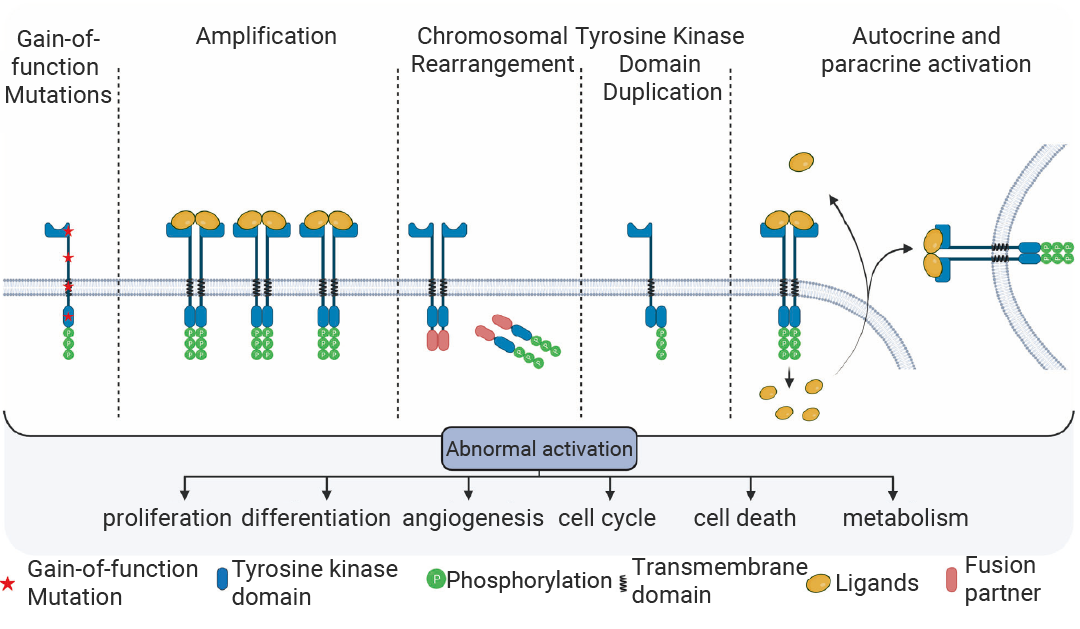
图 7. RTKs 失调机制[3]。
产品推荐 |
EGFR/ErbB 家族由四种紧密相关的受体酪氨酸激酶组成,分别是 ErbB-1 (HER1/EGFR)、ErbB-2 (HER2)、ErbB-3 (HER3) 和 ErbB-4 (HER4)。 |
Eph 受体可分为 EphA 或 EphB 亚家族,啮齿动物中有 9 个EphA 和 5 个 EphB 成员。 |
在人类中,目前鉴定出 6 个 FGFR 家族成员 (FGFR1-6)。 |
TAM 受体家族由三种保守的受体酪氨酸激酶组成,即 Tyro3、Axl 和 Mer。 |
血管内皮生长因子受体 (VEGFR) 家族 由三种蛋白酪氨酸激酶 (VEGFR1、VEGFR2 和 VEGFR3) 和两种非蛋白激酶共受体 (neuropilin-1 和 neuropilin-2) 组成。 |
Trk 家族由 TrkA、TrkB 和 TrkC 三种受体酪氨酸激酶 (RTKs) 组成,又称为神经营养酪氨酸受体激酶。 |
受体酪氨酸激酶样孤儿受体 (ROR) 家族,包含细胞外卷曲样半胱氨酸富结构域 (CRDs) 和膜近端 Kringle 结构域。在脊椎动物中,RORs 家族由 Ror1 和 Ror2 两个结构相关的成员组成。 |
血小板衍生生长因子受体 (PDGFRs) 主要位于血管内皮细胞、成纤维细胞和 Kupffer 细胞,有 PDGFR-α 和 PDGFR-β 两种类型。 |
盘状结构域受体氨酸激酶 (DDRs) 家族包括两个不同的成员,DDR1 和 DDR2。DDRs 表达广泛,DDR1 主要表达于上皮细胞,DDR2 主要表达于间充质细胞。 |

[1] Zhang N, et al. Receptor tyrosine kinases: biological functions and anticancer targeted therapy. MedComm (2020). 2023;4(6):e446.
[2] Azad T, et al. Hippo Signaling Pathway as a Central Mediator of Receptors Tyrosine Kinases (RTKs) in Tumorigenesis. Cancers (Basel). 2020;12(8):2042.
[3] Tomuleasa C, et al. Therapeutic advances of targeting receptor tyrosine kinases in cancer. Signal Transduct Target Ther. 2024;9(1):201.
[4] Talukdar S, et al.. EGFR: An essential receptor tyrosine kinase-regulator of cancer stem cells. Adv Cancer Res. 2020;147:161-188.
[5] Chen Y, et al. ERBB3 targeting: A promising approach to overcoming cancer therapeutic resistance. Cancer Lett. 2024;599:217146.
[6] Yu J, et al. Antibody-Drug Conjugates Targeting the Human Epidermal Growth Factor Receptor Family in Cancers. Front Mol Biosci. 2022;9:847835.
[7] Zhu Y, et al. Recent advances of the Ephrin and Eph family in cardiovascular development and pathologies. iScience. 2024;27(8):110556.
[8] Stergiou IE, et al. EPH/Ephrin Signaling in Normal Hematopoiesis and Hematologic Malignancies: Deciphering Their Intricate Role and Unraveling Possible New Therapeutic Targets. Cancers (Basel). 2023;15(15):3963.
[9] Liu Q, et al. FGFR families: biological functions and therapeutic interventions in tumors. MedComm (2020). 2023;4(5):e367.
[10] Ebrahimi N, et al. Receptor tyrosine kinase inhibitors in cancer. Cell Mol Life Sci. 2023;80(4):104.
[11] Gotoh N. Somatic mutations of the EGF receptor and their signal transducers affect the efficacy of EGF receptor-specific tyrosine kinase inhibitors. Int J Clin Exp Pathol. 2011;4(4):403-409.
[12] Kannan S, et al. Conformational landscape of the epidermal growth factor receptor kinase reveals a mutant specific allosteric pocket. Chem Sci. 2018;9(23):5212-5222.
[13] Riese DJ 2nd, et al. Mutational activation of ErbB family receptor tyrosine kinases: insights into mechanisms of signal transduction and tumorigenesis. Bioessays. 2007;29(6):558-565.
[14] Hayes TK, et al. Comprehensive mutational scanning of EGFR reveals TKI sensitivities of extracellular domain mutants. Nat Commun. 2024;15(1):2742.
[15] Zhang P, et al. Targeting FGFR for cancer therapy. J Hematol Oncol. 2024;17(1):39.
[16] Liu Q, et al. FGFR families: biological functions and therapeutic interventions in tumors. MedComm (2020). 2023;4(5):e367.
[17] Krook MA, et al. Fibroblast growth factor receptors in cancer: genetic alterations, diagnostics, therapeutic targets and mechanisms of resistance. Br J Cancer. 2021;124(5):880-892.
https://blog.sciencenet.cn/blog-3536222-1513457.html
上一篇:干货分享 | 不懂就问∶ 只有免疫细胞能分泌细胞因子么 | MCE
下一篇:前沿进展 | Cell 最新发现:Mitoxyperilysis —— 新的细胞溶解性死亡途径 | MCE