博文
施剑林院士等:高铁负载单原子催化剂通过密度效应促进活性氧(ROS)生成,实现高效抗菌治疗  精选
精选
|
研究背景
新兴的单原子催化剂(SACs)因其活性高、结构简单易调控、超高原子利用率等特点展现出巨大潜力。为了优化其催化活性,人们通常通过增加活性位点的个数或提升单个位点的活性两种方式来合成催化剂,由于单原子本身的性质和合成上的困难,往往二者不可兼得。目前应用于生物医学领域中的SACs金属负载量普遍较低(甚至低于 0.2%),极大限制其临床转化,因此亟需开发出能同时提升活性位点数量和单个位点本征活性的方法来制备医用SACs。
High Fe-loading single-atom catalyst boosts ROS production by density effect for efficient antibacterial therapy
Si Chen, Fang Huang, Lijie Mao, Zhimin Zhang, Han Lin, Qixin Yan, Xiangyu Lu*, Jianlin Shi*
Nano-Micro Letters (2025)17: 32
https://doi.org/10.1007/s40820-024-01522-1
本文亮点
1. 通过铁元素替换锌元素的方法成功合成了高负载量、高催化活性和高稳定性的铁单原子催化剂(h³-FNCs),一石二鸟,同时提升了金属负载量和比金属质量活性。
2. 首次发现了由活性位点密度高引发的“密度效应”,这种效应导致单原子位点的本征活性发生了显著变化。
3. h³-FNCs 卓越的类氧化酶催化活性可确保高效的杀菌活性。
内容简介
目前应用于医疗领域的单原子催化剂(SACs)仍然存在金属负载量低的问题。中国科学院上海硅酸盐研究所施剑林院士、同济大学逯向雨、陈思等人开发了一种合成方法,能够通过锌与铁的交换来提高 SACs 的金属负载量的同时提高其比金属质量活性。所构建的铁单原子催化剂(h³-FNC)具有 6.27 wt% 的高金属负载量和 ~4 Å 的铁-铁间距,表现出卓越的类氧化酶催化活性,在常温储存 6 个月后不会出现明显的活性衰减,并具有良好的抗菌效果。最吸引人的是,该研究发现了单原子催化中的“密度效应”,高的金属掺杂量会使活性位点的距离变近,达到阈值后近邻活性位点产生相互作用,改变电子结构,进而改变活性位点的本征催化活性。本研究中高负载SACs中的单个铁原子位点的活性约为低、中负载 SACs的 2.3 倍,同时由于活性位点的数量多,h³-FNC 的类氧化酶催化活性大大提高,质量活性和比金属质量活性达到商用 Pt/C 的 66 倍和 315 倍。此外,h³-FNC 在催化氧气还原为超氧阴离子和耗竭谷胱甘肽方面的能力也得到了显著增强。体外和体内实验证实了h³-FNCs 在通过抗菌促进伤口愈合方面具有卓越的功效。
图文导读
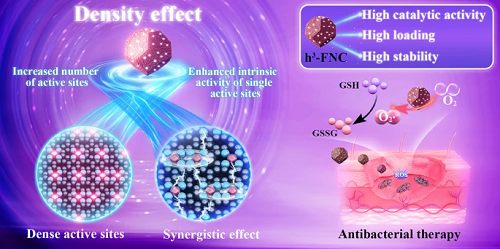
单个铁原子在高负载单原子催化剂(h³-FNCs)中密集分布,导致相邻的 Fe-N₄ 结构彼此足够接近,从而产生相互作用,提高了单个活性位点的催化活性,这种活性位点密度的改变影响其本征活性的现象称为 “密度效应”。所合成的 h³-FNCs 具有超高的类氧化酶活性,可有效催化 ROS 生成和 GSH 消耗,导致细菌的细胞膜破坏、DNA 损伤和蛋白质渗漏,从而在体外和体内有效根除细菌促进感染区域的伤口愈合。
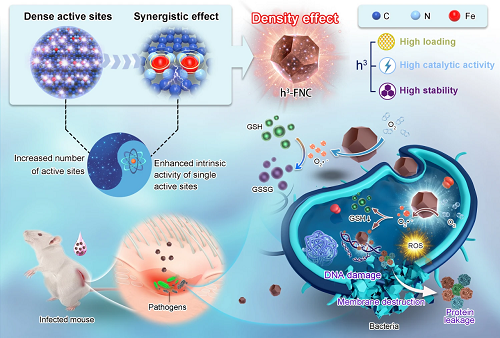
图 1. 具有密度效应的 h³-FNCs 抗菌应用示意图。
I h³-FNC的合成和形貌、结构表征
图 2a 展示了 h³-FNCs 的合成过程。图 2b 中 SEM 图像表明 h³-FNC 具有与 ZIF-8 一致的多面体形态和均匀的分散性。图 2c、d图像展示了 h³-FNCs 中密集分布的铁单原子。通过 ICP-OES 确定材料中铁含量为 6.27 wt%,高含量是产生密度效应的先决条件。图 2e 中 EELS显示出来自孤立铁原子的明显铁信号。同时,对图 2d 中具有代表性的单原子进行统计分析发现,相邻铁原子间距多分布于 3.5 至 5.5 Å 之间,根据高斯拟合 (图 2f),该间距在约 4.17 Å 处最多。由此可得,h³-FNC 中近距离铁原子的比例很高。此外,HAADF-STEM 图像 (图 2g) 和相应的 EDS 图 (图 2h-j) 显示碳基质中 C、N 和 Fe 元素分布均匀,其中 Fe 信号相当强,反映了高 Fe 负载。XRD (图 2k) 和 SAED图 (图 2l) 表明 h³-FNC 的结晶度较低,不存在含铁的团块或颗粒。
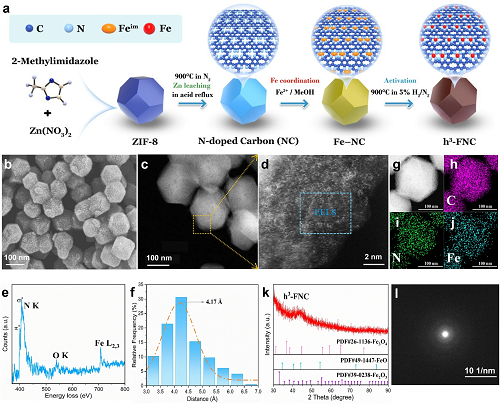
图2. h³-FNCs的形态和结构表征。(a) h³-FNCs 的合成流程图。(b) h³-FNCs 的 SEM 和 (c) TEM 图。(d) c 中标记区域的原子分辨率 AC HAADF-STEM 显微图片。(g) h³-FNC 的 HAADF-STEM 图像和相应的 EDS图:C (h)、N (i) 和 Fe (j)。(k) h³-FNC 的 XRD 图和 (l) SAED 图。
II 精细结构分析
由图 3a 可知 h³-FNCs 中铁的价态介于 +2 和 +3 之间。图 3b 中 EXAFS光谱的傅立叶变换在 2.13 Å 处没有属于 Fe-Fe 键的峰,表明在 h³-FNC 中 Fe 原子相互隔离从而形成原子分散的 Fe 位点。根据 XAFS 拟合结果得到的结构参数(图 3c,表 S2),Fe-N 第一配位层的配位数为 4,表明主要的 Fe-N 结构是 Fe-N₄(图 3d),这种配位与天然氧化酶中的铁卟啉中心非常相似。Fe-foil 的小波变换 WT 图(图3e)显示了Fe-Fe键对应的强度最大值,而 h³-FNCs 的 WT 图(图3f)中却没有,进一步证实 h³-FNCs 中没有金属基纳米颗粒。此外,如图 3g 所示,h³-FNCs 表现出 I 型等温线,表明其主要为微孔结构。采用 BET 法计算得 h³-FNCs 的 比表面积(SSA)为 1242 m²g⁻¹,远高于大多数报道的 Fe-N-C 催化剂(多为600-800 m²g⁻¹)。图 3h 展示了h³-FNCs 的 ⁵⁷Fe Mössbauer 谱,根据同分异构体位移(IS)和核四极分裂(QS),光谱被分解标记为 D1 和 D2 两部分,由 D1 和 D2 的比例可推测大部分 Fe 位于材料表面。图 3i 反映了样品中的碳结构和缺陷密度,通过比较 ID/IG 值可得 h³-FNCs 的石墨化程度最低,缺陷浓度最高,因此表面能最高。
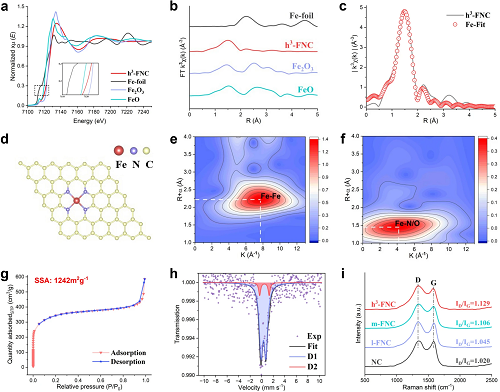
图3. 材料的精细结构分析。(a) Fe K-edge XANES 光谱。(b) EXAFS 光谱的 k² 加权 χ(k)-function 的傅立叶变换。(c) h³-FNCs 在 R 空间的 Fe K-edge EXAFS 拟合结果。(d) h³-FNCs 中 Fe 单一位点的拟合结构。(e) Fe foil和 (f) h³-FNCs 的 k² 加权 Fe K-edge EXAFS 信号的小波变换。(h) h³-FNCs 在环境温度下的 ⁵⁷Fe Mӧssbauer 谱。(i) 各催化剂的拉曼光谱。
III 催化剂的活性测试
如图 4a,b 所示,与参考样品相比,h³-FNCs 表现出优异的类氧化酶活性,其质量活性和比金属质量活性分别是商用 30% Pt/C 催化剂的 66 倍和 315 倍(图 4c,d),并且 h³-FNCs 在水中室温保存半年后催化性能几乎没有衰减(图 4e),表明其催化稳定性极高。图 4f 中 EPR 信号清楚地显示出 •OOH 的特征峰,证明了 h³-FNCs 可催化 O₂•⁻ 的产生。图 4g 显示 h³-FNCs 的引入增强了荧光强度,表明 二氢乙锭(DHE) 被氧化,而加入 GSH 后荧光强度达到最大,表明 GSH 能够加速 h³-FNCs 介导的 DHE 氧化过程。图 4h 显示不同浓度 h³-FNC 的存在明显影响 GSH 的氧化速率。如图 4i,TNB 在 420 nm 处的峰强度随着反应时间的延长而降低,反应 30 分钟后,TNB 的特征峰完全消失,证明溶液中的 GSH 已被完全消耗。GSH 是维持细菌新陈代谢和平衡的主要氧化还原物质。h³-FNCs 的催化特性为随后的抗菌治疗奠定了坚实的基础。
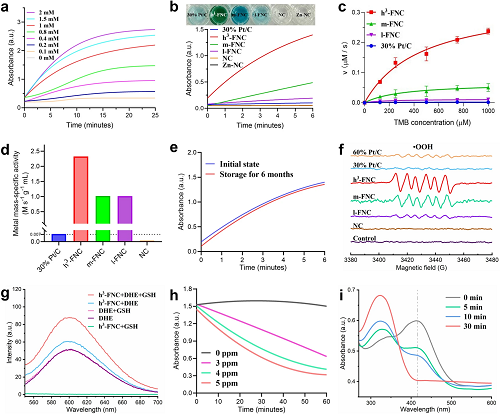
图4. 催化剂的催化性能。(a)不同浓度的 TMB 水溶液在 h³-FNCs存在下的吸光度随时间变化的曲线。(b)水溶液中不同催化剂存在下 TMB的吸收强度曲线。(c) 水溶液中不同催化剂存在下 TMB 的氧化反应速度 (v)。(d) 根据 (c) 中的反应速率计算出的不同催化剂的比金属质量活性。(e) 放置不同时间后的h³-FNCs 对 TMB 的催化氧化情况。(f) DMPO/•OOH 的 EPR 光谱。(g)在添加或不添加GSH水溶液中 h³-FNCs 催化DHE的荧光光谱。(h) 不同浓度的 h³-FNCs 对 GSH 的消耗情况。(i) h³-FNCs 在不同时间内消耗 GSH 的紫外吸收谱 (DTNB 为指示剂)。
IV DFT计算
为了探索 h³-FNCs 具有类氧化酶活性的机理,进行了 DFT 计算并构建 Fe-N₄ 活性中心模型,模拟了其催化反应过程(图 5a)。图 5b 展示了反应过程中 吸附能(Ead )的变化和电子转移情况,结果表明 Fe-N₄ 对中间产物的吸附比 N₄ 容易得多。为了揭示相邻铁原子之间的协同催化效应及其相对于相互远离的单原子位点的优势,我们建立了近邻 Fe 原子位点 (Dn FeN₄-FeN₄) 模型 (图5c)。如图 5d 所示,在 Dn FeN₄-FeN₄ 中,单个铁原子转移的电子数为 1.068 e,而在 FeN₄ 中则为 1.395 e。铁原子转移的电子数越少,对 *OH 的吸附就越弱,从而使 *OH 更容易脱离,催化活性就越高(决速步骤为*OH脱附时)。由图 5e 自由能图可看出所有反应步骤的自由能都在下降,表明室温下该催化反应在热力学上可行。与 N₄ 的 0.84 V 相比,FeN₄ 的过电位约为 0.66 V,而Dn FeN₄-FeN₄ 的过电位为 0.46 V,表明 Dn FeN₄-FeN₄ 的催化活性明显增强,这与之前的实验结果和 Bader 电荷计算结果一致。由图 5f 可看出 Fe-N₄在EF水平上具有较高的 DOS,表明嵌入 Fe 单原子增强了体系的导电性并加速了反应中的电荷转移。而 Dn FeN₄-FeN₄ 在 EF 级的 DOS 明显高于 FeN₄,这表明 Dn FeN₄-FeN₄ 位点对反应中间产物的吸附或解吸更为敏感。
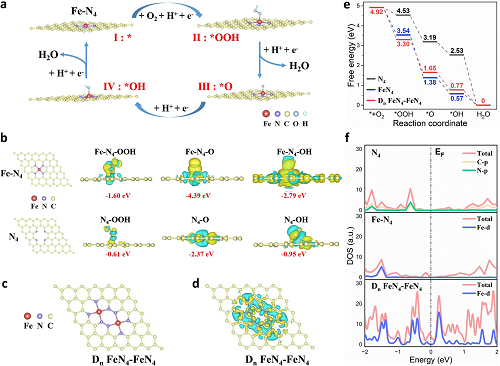
图5. DFT 计算。(a) h³-FNC 上 O₂ 活化的模拟反应路径。(b) 通过 VASP 确定的 Fe-N₄ 或 N₄ 的优化模拟构型,以及与 Fe-N₄ 或 N₄ 相互作用的反应中间产物的拆分电荷密度图。负值为吸附能(Ead)。Dn FeN₄-FeN₄ 的 (c) 模拟构型和 (d) 拆分电荷密度图。(e) N₄、Fe-N₄ 和 Dn FeN₄-FeN₄ 位点模型的 O₂ 活化自由能图。(f) N₄、Fe-N₄ 和 Dn FeN₄-FeN₄ 的PDOS图。
V 体外抗菌效果及抗菌机制
如图6a-c所示, 与对照组相比,在h³-FNC的存在时,S. aureus和P. aeruginosa 均发生死亡,且随着催化剂浓度升高,菌落数明显急剧减小。基于活/死染色的结果(图 6d),大多数细菌在 PI 染色的情况下发出红色荧光,表明细菌发生了显著的膜损伤,这也与图 6e 的 TEM 图像结果一致,即细菌细胞膜严重破损,无法维持正常细胞形态从而死亡。上述实验结果均展现了h³-FNC具备良好的抗菌能力。如图6f 所示,h³-FNC实验组显示出强烈的DHE荧光信号,证明细菌细胞内部ROS的爆发,这也与流式分析结果(图6g,h)一致。火山图显示,在两组总共 2262 个表达基因中,与对照组相比,h³-FNC实验组中有 702 个基因下调,707个基因上调(图 4i,j)。KEGG 通路富集分析表明,经h³-FNC处理后,在TCA 循环、各种次级代谢的生物合成、GSH代谢、嘌呤代谢、电子传递链和 RNA 降解方面对S. aureus有显著影响(图 4k)。
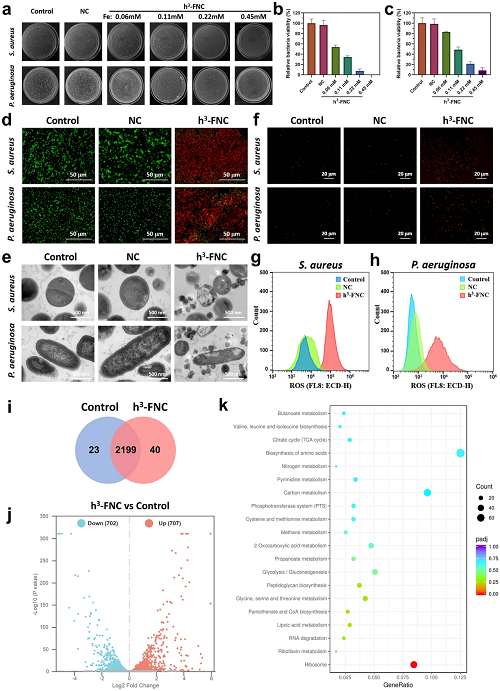
图6. h³-FNCs 的体外抗菌测试。(a) S. aureus 和 P. aeruginosa 经生理盐水 (Control)、NCs 和不同浓度 h³-FNCs 处理后的菌落照片。(b, c) S. aureus 和 P. aeruginosa 的相对存活率。(d) 不同处理下 S. aureus 和 P. aeruginosa 活死染色的共聚焦图像。(e) 不同处理后 S. aureus 和 P. aeruginosa的 TEM 图像。(f) S. aureus 和 P. aeruginosa 细胞内 ROS 水平的荧光图像 (DHE为探针)。(g, h) 对不同处理下的DHE染色细菌进行流式细胞分析。(i) 显著变化基因集合的维恩图(P<0.05)。(j) h³-FNC 中 DEGs 的分布火山图。(k) 经 h³-FNC处理后前 20 个相关的 KEGG 通路富集分析。
VI h³-FNCs体内抗菌效果
图7a展示了体内伤口感染模型的建立及治疗流程。由图7b-c中伤口组织菌落数对比,h³-FNC处理可以有效减少伤口部位的细菌。由图7d-f,未经治疗的小鼠伤口溃烂流脓,用h³-FNC治疗的伤口明显逐渐缩小。而在治疗周期的第10天,经h³-FNC治疗的伤口几乎完全愈合,平均感染伤口愈合率达97.84%,且体重与未染菌的伤口对照组相比无明显变化。以上结果与小鼠感染伤口的H&E和Masson染色结果一致(图7g-h)。此外,各组治疗后伤口处的炎症因子水平(图 7i,j)和小鼠血液中炎症相关细胞数量(图7k)表明经h³-FNC处理后的伤口部位无明显炎症且血液监测指标无异常,进一步验证了h³-FNC在具有优越抗菌性能的同时,兼具良好的生物安全性。
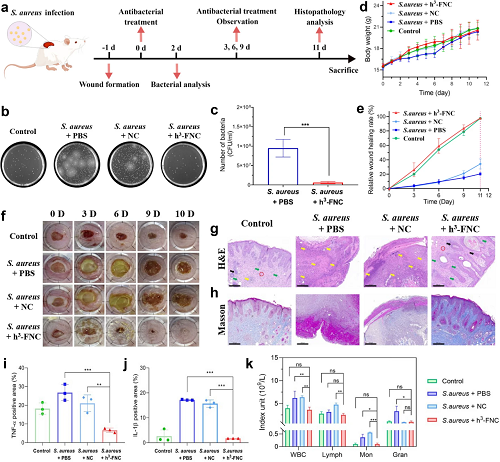
图7. h³-FNCs 的体内抗菌性能。(a) S. aureus 感染伤口模型的治疗策略示意图。(b) 治疗 2 天后伤口组织中的细菌培养生长图像。(c) 经 PBS 和 h³-FNCs 治疗 2 天后伤口组织中存活细菌的数量。(d) 不同组在伤口愈合过程中的体重变化。(e) 各组小鼠在不同治疗时间内伤口的相对愈合率。(f) 未感染伤口和经 PBS、NC 和 h³-FNCs 处理的 S. aureus 感染伤口在不同时间的代表性照片。各实验组伤口组织部位的 (g) H&E 和 (h) Masson 染色。(i, j) 各组伤口组织部位中TNF-α 和 IL-1β 的表达量。(k) 各组小鼠血液里炎症相关细胞的数量。
VII 总结
该工作成功开发了一种离子交换法来合成高金属负载、超高催化活性和高稳定性的单原子催化剂 h³-FNC,用于高效便捷的抗菌治疗。通过材料表征、催化性能测试和 DFT 理论计算,揭示了金属密度和相邻两个铁原子在足够近的距离内的相互作用在赋予 h³-FNCs 超高催化性能方面的重要作用。与文献报道的 用于医疗领域的SACs 相比,具有密度效应的高铁负载 SACs 极大提高了自身的类氧化酶活性。体外和体内实验均证明了 h³-FNCs 的广谱杀菌性能,平均伤口愈合率高达 97.8%,并具有良好的生物安全性。除抗菌治疗外,h³-FNCs 还有望在治疗肿瘤和病毒感染等多种疾病方面发挥巨大潜力,并且为需要多位点协同催化的反提供了催化剂设计新思路。这些发现为提升 SACs 的金属负载量和单个活性位点的本征活性提供了极具吸引力的策略。
作者简介

逯向雨
本文通讯作者
同济大学 助理教授
▍主要研究领域
研究方向涉及催化医学、生物材料、纳米医学和影像诊断/治疗一体化,致力于对肿瘤、皮肤病(如糖尿病足、银屑病、皮炎)、肺炎、肾炎、抗菌、感染、退行性疾病以及其他重大疾病的催化治疗及其机制探究,努力推动其临床转化应用。
▍个人简介
本科毕业于中南大学,博士毕业于中国科学院大学,师从施剑林院士。近年来以第一/通讯作者在National Science Review, Nature Communications, Advanced Materials, J. Am. Chem. Soc.等期刊发表论文多篇,单篇最高被引268次,ESI高被引论文3篇,ESI热点论文1篇,担任Nature Communications,Advanced Materials 等期刊的审稿专家,National Science Open(《国家科学进展》,NSO)青年编委。曾获得中国科学院院长特别奖(2021年)、中国硅酸盐学会优秀博士学位论文奖(2023年)、材料人2023年优秀青年科学家等奖项。欢迎交流讨论。
▍Email:xiangyulu@126.com

施剑林
本文通讯作者
中国科学院上海硅酸盐研究所 研究员
▍主要研究领域
纳米材料的可控合成与催化应用,无机纳米生物医用材料在重大疾病领域的应用基础研究,在国际上率先提出“催化医学”全新生物医学研究方向,促进了生物、医学、化学、药学等领域的交叉研究。
▍个人简介
中国科学院院士,中国医学科学院学部委员,国家杰出青年基金获得者(1996),教育部长江学者特聘教授(2008),国家级高层次领军人才。承担国家重点研发计划、国家自然科学基金委重点项目等科技任务。在Nat. Nanotechnol., Sci. Adv., Adv. Mater., J. Am. Chem. Soc.等期刊上发表学术论文 700 余篇,SCI他引 76,000 余次,H-index为 148,2015年至今连续入选科睿唯安全球高被引科学家。以第一完成人获国家自然科学二等奖一项(2011)、上海市自然科学一等奖两项(2008、2014)和上海市科技进步一等奖一项(2009)等科技奖励。
▍Email:jlshi@mail.sic.ac.cn
撰稿:原文作者
编辑:《纳微快报(英文)》编辑部
关于我们

Nano-Micro Letters《纳微快报(英文)》是上海交通大学主办、在Springer Nature开放获取(open-access)出版的学术期刊,主要报道纳米/微米尺度相关的高水平文章(research article, review, communication, perspective, highlight, etc),包括微纳米材料与结构的合成表征与性能及其在能源、催化、环境、传感、电磁波吸收与屏蔽、生物医学等领域的应用研究。已被SCI、EI、PubMed、SCOPUS等数据库收录,2023 JCR IF=31.6,学科排名Q1区前3%,中国科学院期刊分区1区期刊。多次荣获“中国最具国际影响力学术期刊”、“中国高校杰出科技期刊”、“上海市精品科技期刊”等荣誉,2021年荣获“中国出版政府奖期刊奖提名奖”。欢迎关注和投稿。
Web: https://springer.com/40820
E-mail: editor@nmlett.org
Tel: 021-34207624
https://blog.sciencenet.cn/blog-3411509-1459843.html
上一篇:上海大学丁常胜和高彦峰等综述:钠离子电池正极材料磷酸钒钠的改性策略及研究进展
下一篇:山大韩琳&张宇等综述:柔性石墨烯场效应晶体管及其在柔性生物医学传感中的应用