博文
苏州大学李盛亮等:水溶性聚合物纳米探针用于高效光热NIR-II肿瘤诊疗  精选
精选
|
研究背景
目前报道的有机光热试剂的光热转换效率(PCE)仍然相对较低,特别是在近红外二区 (NIR-II,1000-1700 nm) 窗口具有良好光热性能的材料仍然很少,严重阻碍了光热治疗在抗肿瘤临床应用中的进一步发展。本文通过调节共轭分子骨架侧链,开发了一种具有超高PCE且稳定的共轭双自由基聚合物纳米颗粒。此外,通过将该纳米药物的NIR-II光热效应与PD-1联合使用,可以有效地阻止乳腺癌的肺部转移。
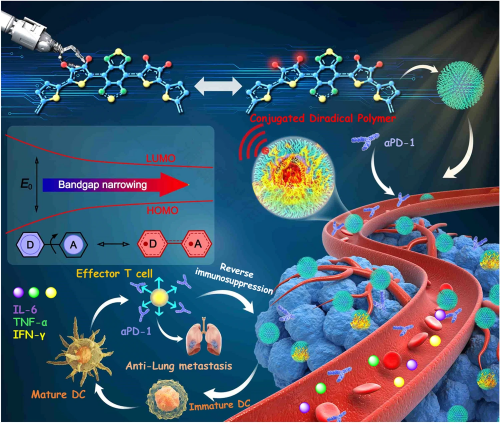
A Stable Open‑Shell Conjugated Diradical Polymer with Ultra‑High Photothermal Conversion Efficiency for NIR‑II Photo‑Immunotherapy of Metastatic TumorYijian Gao, Ying Liu, Xiliang Li, Hui Wang, Yuliang Yang, Yu Luo, Yingpeng Wan, Chun-Sing Lee*, Shengliang Li*, Xiao-Hong Zhang*Nano-Micro Letters (2024)16: 21
https://doi.org/10.1007/s40820-023-01219-x
本文亮点
1. 通过侧链调节,共轭双自由基聚合物的光热响应可以从近红外(NIR)I区红移到NIR-II区。该策略为开发NIR-II双自由基光热材料提供了新的思路和方法。
2. 共轭双自由基聚合物纳米颗粒TTB-2 NPs具有高达87.7%的光热转换效率,远远超过了目前报道的NIR-II光热剂。
3. 共轭双自由基聚合物纳米颗粒TTB-2 NPs在NIR-II窗口中通过光声成像导航实现了良好的肿瘤光消融,且无任何副作用。此外,光热联合免疫作用可有效防止乳腺癌的肺转移。
内容简介
近年来光热疗法凭借其优异的非侵入性和时空分辨性,在癌症治疗领域取得了很大进展,被广泛认为是一种极具前景的治疗新方法。开发高性能光热治疗材料和药物是当前的重要挑战和研究热点。然而,如何从药物设计出发,进一步提高光热材料的性能仍是当前的重大挑战。苏州大学李盛亮教授联合苏州大学张晓宏教授、香港城市大学李振声教授从分子设计的角度入手,通过侧链调节设计D-A共轭双自由基聚合物,有效地将药物分子吸收从NIR-I区红移到NIR-II区。通过纳米制剂技术将聚合物制备成高稳定性的水溶性纳米探针,开发了一种光热转换效率高达87.7%的共轭双自由基聚合物纳米颗粒。体外和体内实验表明,该纳米药物在NIR-II区窗口内实现了高性能的肿瘤光消融和光声成像,且无任何副作用。此外,通过将该纳米药物的NIR-光热效应与PD-1联合使用,可以有效地阻止乳腺癌的肺转移。
图文导读
I 共轭聚合物的设计和结构表征
如图1所示,通过Stille聚合合成了两种具有典型供体(D)-受体(A)构型的共轭双自由基聚合物(CDPs)。为了进一步证明其物理化学性质,利用密度泛函理论(DFT)计算了两种CDPs的电子分布和优化构型, TTB-2具有明显的共轭平面结构和分子内电荷转移的优势。TTB-1和TTB-2都具有良好的双自由基特征和稳定性,其g值为2.0036 (图1d, e)。此外,两种TTB分子在THF溶剂中的吸收光谱表明,TTB-1在750 nm左右有良好的吸收峰,而TTB-2相对TTB-1有接近200 nm的红移,最高吸收峰在950 nm附近。
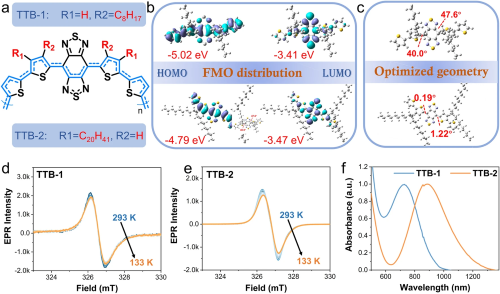
图1. a. TTB的分子结构; b. DFT计算TTB-1和TTB-2的FMO分布; c. TTB-1和TTB-2的分子二面角; d, e. TTB粉末的ESR; f. TTB-1和TTB-2在THF中的吸收光谱。
II 光热性能表征
首先,通过自组装方法将共轭双自由基聚合物制备成纳米颗粒(图2a)。TTB-2 NPs在950 nm处吸收峰最高,而TTB-1 NPs的最大吸收峰位于715 nm处(图2b)。透射电子显微镜(TEM)和动态光散射(DLS)结果证明TTB-2 NPs具有纳米球的形态特征(图2c),并且TTB-2 NPs依然保持双自由基特性(图2d)。其次,在1064 nm激光的照射下,详细表征了TTB NPs的光热性能。如图2e-h所示,TTB-2 NPs具有优异的光热性能,光稳定性和超高的光热转换效率,光热转换效率(PCE)高达87.7%。进一步,通过理论计算得出开壳层单重态(OS)的激发能比闭壳层单重态(CS)低8.94 kcal mol⁻¹,这意味着TTB-2的OS态通常具有良好的非辐射跃迁性质,与其优异的光热性能保持一致。
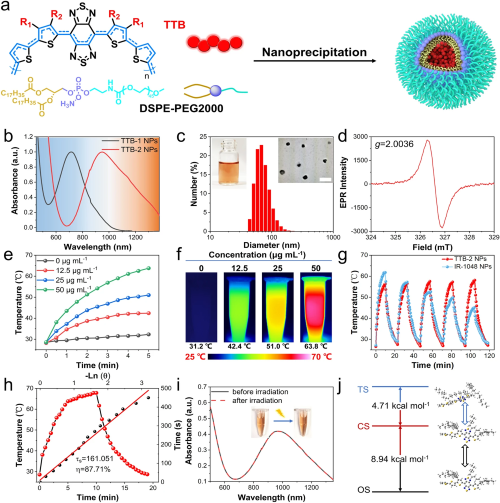
图2. a. TTB NPs制备示意图; b. TTB-1 NPs和TTB-2 NPs的吸收光谱; c. TTB-2 NPs的水合粒径和透射电镜图像, 比例尺:200 nm; d. TTB-2 纳米颗粒的ESR谱; e,f. 不同浓度TTB-2 NPs在1064 nm光照下的升温曲线和红外热成像图; g. 25 μg mL⁻¹ TTB-2 NPs和50 μg mL⁻¹ IR-1048 NPs在1064 nm激光照射(1.0 W cm⁻²)5个开/关周期下的光热稳定性; h. 在1064 nm激光(1.0 W cm⁻²)照射10 分钟并冷却过程中TTB-2 NPs水溶液的温度变化及光热转换效率计算; i. TTB-2 NPs激光照射前后的吸收光谱及照片; j. TTB-2在三重态(TS)、闭壳态单重态(CS)和开壳态单重态(OS)的能级计算。
III 体外细胞毒性试验
由于TTB-2 NPs具有良好的光热性能和稳定性,我们进一步评估了其体外抗肿瘤光消融性能。如图3a和3b所示,在1064 nm激光照射下,TTB-2 NPs对人宫颈癌(HeLa)细胞和小鼠乳腺癌(4T1)细胞产生了明显的光热消融作用,在30 μg mL⁻¹浓度时,光热8分钟可以导致近95%的细胞被完全杀死。而不照激光的情况下对细胞几乎无任何毒性,证明了其体内良好的安全性和光热抗肿瘤潜力。进一步,通过肿瘤细胞活/死双染色实验(图3c)也同样证明了TTB-2 NPs在NIR-II区良好的抗肿瘤细胞增殖性能和生物安全性。
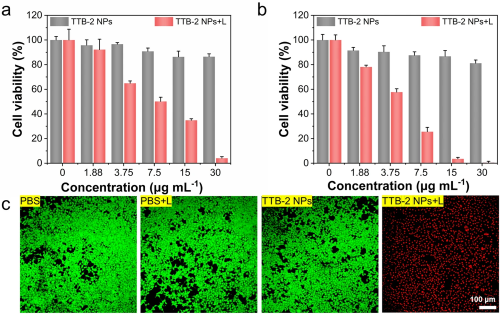
图3. a,b. TTB-2 NPs在1064 nm (1.0 W cm⁻²)照射或不照射8分钟后HeLa和4T1细胞的体外光热消融效果; c. 不同处理条件下4T1细胞的活死共染色成像。
IV 体内光声成像和光热治疗将4T1荷瘤小鼠静脉注射TTB-2 NPs,然后通过PA成像系统成像,观察到TTB-2 NPs的信号逐渐出现在4T1荷瘤小鼠的肿瘤部位,并在注射后9 h出现明显的峰值;注射24 h后,TTB-2 NPs几乎完全从肿瘤部位消失。之后如图4b、c所示,在激光照射5分钟后,注射TTB-2 NPs后9小时并用1064 nm照射小鼠的肿瘤温度迅速升高至53℃,而注射PBS并联合激光照射小鼠的肿瘤温度变化不大。这些结果表明TTB-2 NPs可以光热触发肿瘤内有效的温度变化。之后将肿瘤体积约为80 mm3的4T1荷瘤小鼠随机分为四组分别进行不同的治疗手段。如图4d-f所示,TTB-2 NPs联合激光照射治疗组小鼠的肿瘤在治疗后第二天几乎完全消融,并且在治疗后的14天内没有任何复发的迹象。相比之下,单独给予TTB-2 NPs和仅激光照射对肿瘤生长无明显影响。如图4g所示,不同治疗后小鼠肿瘤的苏木精和伊红(H&E)染色显示TTB-2 NPs光热治疗诱导引发肿瘤部位明显的核分裂和核坏死。此外,TUNEL和PCNA测试也表明TTB-2 NPs的光疗消融肿瘤效果。
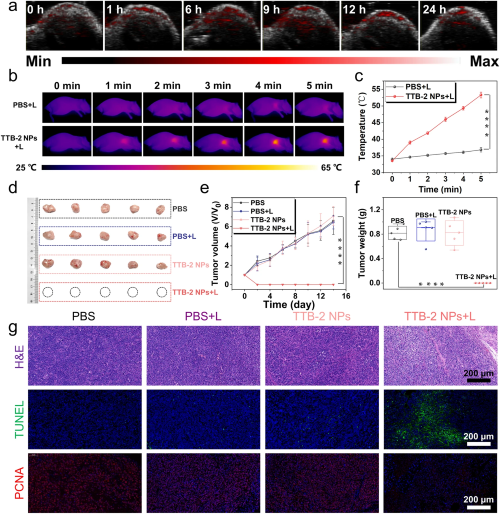
图4. a. TTB-2 NPs注射后不同时间对肿瘤的体内PA成像; b,c. 不同处理组小鼠肿瘤的代表性热像图和相应的温度变化图; d. 治疗14天后不同治疗组小鼠分离的肿瘤; e. 不同治疗组的肿瘤相对生长曲线随治疗时间的变化; f. 治疗14天后肿瘤质量对比; g. 治疗14天不同组小鼠分离肿瘤的H&E、TUNEL和PCNA染色。
V 生物安全性评估不同治疗后的第14天,进一步研究了TTB-2 NPs的初步生物安全性。对治疗14 天后的小鼠主要脏器心、肺、脾、肺、肾进行H&E染色分析,结果显示主要脏器未见明显异常,治疗组与对照组无明显区别 (图5a)。其次,检测主要血常规指标及血液生化指标(图5b),结果表明TTB-2 NPs治疗与激光照射都对小鼠无明显毒副作用。
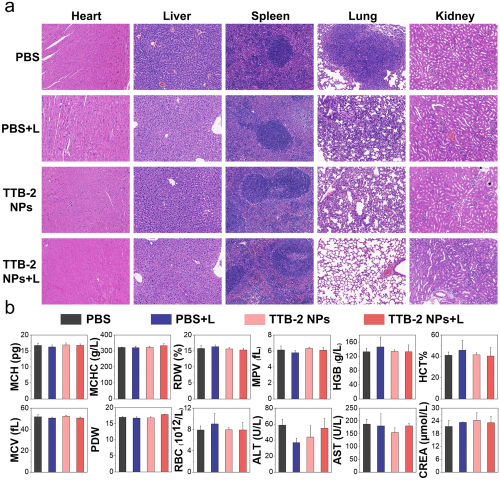
图5. a. 治疗14天后不同组小鼠的主要脏器的H&E染色结果; b. 治疗14天后不同组小鼠的血常规和血液生化结果分析。VI 体内光热联合免疫疗法最后,通过联合αPD-1(抗PD-1抗体)在侵袭性肺转移瘤模型中评估TTB-2 NPs的抗肿瘤转移活性。治疗过程和参数如图6a所示。于治疗后第18天对不同组小鼠实施安乐死,分析肿瘤转移情况。采用流式细胞术检测不同治疗后肿瘤组织中CD8+细胞毒性T淋巴细胞(CTL)和成熟树突状细胞(DC) (CD80+CD86+)的变化,发现TTB-2 NPs 光热联合免疫治疗的细胞毒性T细胞和成熟DC细胞明显高于其他组,证明TTB-2 NPs 光热联合免疫治疗可促进DC成熟,增强全身抗肿瘤免疫应答。为了进一步证实免疫应答水平,采用酶联免疫吸附试验(ELISA)检测血清中细胞因子和促炎介质的水平。如图6d-f所示,TTB-2 NPs PTT联合αPD-1免疫治疗后小鼠血清IL-6、TNF-α、IFN-γ水平有不同比例的升高。各种治疗后进一步分析乳腺癌的肺部转移,如图6g所示。除光热联合免疫治疗组外,其他各组小鼠肺中均出现明显的白色结节,而TTB-2 NPs + PTT + αPD-1联合治疗后小鼠肺部转移瘤明显受到抑制。这些结果表明TTB-2 NPs 光热联合免疫疗法可有效激活免疫应答,用于抗转移性肿瘤的治疗。
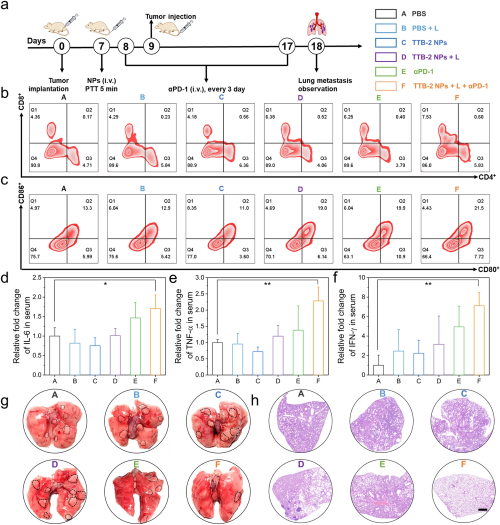
图6. a. 光热联合免疫抗乳腺癌肺转移模型治疗方案示意图; b. 不同治疗后肿瘤组织CD8+ T细胞(CD3+CD8+)的流式细胞术分析c. 流式细胞术分析不同处理后4T1荷瘤小鼠肿瘤中CD80+ CD86+ T细胞的变化; d-f. ELISA法检测不同治疗后小鼠血清中IL-6、TNF-α、IFN-γ水平; g. 不同治疗后小鼠全肺代表性图像; h. 不同治疗后小鼠肺组织H&E染色。
作者简介

高一剑
本文第一作者
苏州大学 博士生
▍主要研究领域(1)近红外生物材料与纳米药物设计;(2)光学抗肿瘤治疗探索。
▍个人简介:苏州大学药学院2022级博士研究生,在《Nano-Micro Letters》、《Advanced Materials》、《Advanced Science》、《Journal of Nanobiotechnology》、《ACS Applied Materials & Interfaces》以第一(含共同第一)作者发表 SCI 研究论文 5 篇。致力于光功能生物医用高分子材料开发及高效肿瘤诊疗的研究。

李盛亮
本文通讯作者
苏州大学 特聘教授
▍主要研究领域(1)近红外光学药物、探针;(2)药物递送;(3)生物材料。
▍个人简介:苏州大学特聘教授,博士生导师。入选江苏特聘教授(重点资助)、姑苏创新青年领军人才等国家及省市项目。研究兴趣主要聚焦于光功能生物医用高分子材料范畴,发展光热磁技术实现精准与高效低毒的重大疾病治疗、生物成像和生物活性调控。近年来发表高水平SCI论文90余篇,其中包括以第一或通讯作者在Adv. Mater., Angew. Chem. In. Ed., ACS Nano等国际权威刊物上发表的论文50余篇,其中ESI高被引论文4篇。申请 PCT 国际专利 4项,获授权中国专利 4 项,参与撰写2本纳米材料领域书籍。同时长期担任Angew. Chem. In. Ed., Adv. Mater., ACS Nano, Adv. Funt. Mater.等30余个国际期刊的独立审稿人。
▍Email:lishengliang@suda.edu.cn

李振声
本文通讯作者
香港城市大学 讲座教授
▍主要研究领域(1)有机光电材料及器件;(2)材料界面科学;(3)纳米生物医学。
▍个人简介:主要研究领域主要集中于有机光电材料及器件、材料界面科学、纳米生物医学等。在相关领域发表SCI论文800余篇,被引用70000余次(H-index 136)。目前担任《Thin Solid Films》的副编辑、Nature Publishing group-《Asian Materials》的顾问委员会成员、《Materials Today》及《Physica Status Solidi》等多个国际期刊的编委会成员。
▍Email:apcslee@cityu.edu.hk
%

张晓宏
本文通讯作者
苏州大学 教授
▍主要研究领域有机和纳米光电材料与器件
▍个人简介:教育部“苏州纳米科技协同创新中心”常务副主任,江苏省先进负碳技术重点实验室主任。是国家杰出青年基金获得者,国家“万人计划”科技创新领军人才,国家重大研究计划项目(973)首席科学家,英国皇家化学会会士,国务院政府特殊津贴获得者。长期从事有机和纳米光电材料与器件的研究,近年来先后主持国家基金委创新研究群体项目、基金委重大研究计划集成项目、基金委重点项目等20余项国家级科研项目,在Nat. Photon., Nat. Energy, Nat. Mater., Nat. Commun., Adv. Mater., Angew. Chem. Int. Ed. 等国际知名学术期刊发表论文500余篇,获美国和中国专利50余项。相关成果获国家自然科学二等奖1项(排名1)、省部级科学技术一等奖3项。
▍Email:xiaohong_zhang@suda.edu.cn
关于我们

Nano-Micro Letters《纳微快报(英文)》是上海交通大学主办、在Springer Nature开放获取(open-access)出版的学术期刊,主要报道纳米/微米尺度相关的高水平文章(research article, review, communication, perspective, highlight, etc),包括微纳米材料与结构的合成表征与性能及其在能源、催化、环境、传感、电磁波吸收与屏蔽、生物医学等领域的应用研究。已被SCI、EI、PubMed、SCOPUS等数据库收录,2022JCR影响因子为 26.6,学科排名Q1区前5%,期刊分区1区TOP期刊。多次荣获“中国最具国际影响力学术期刊”、“中国高校杰出科技期刊”、“上海市精品科技期刊”等荣誉,2021年荣获“中国出版政府奖期刊奖提名奖”。欢迎关注和投稿。
Web: https://springer.com/40820
E-mail: editor@nmlett.org
Tel: 021-34207624
https://blog.sciencenet.cn/blog-3411509-1418362.html
上一篇:成均馆大学Jaeyun Kim等综述:水系液态/凝胶态电解质在可持续/安全/高性能锂电池中的发展趋势
下一篇:浙江大学冯刚、齐义营等:图案化超分子水凝胶上原位沉积药物和基因构建定向骨软骨塞刺激骨软骨再生