博文
甲基化衰老与癌变风险
||
甲基化衰老与癌变风险
今年6月发表的综述《DNA Methylation, Aging, and Cancer》引用了“甲基化-癌症”及“甲基化-衰老”相关的文献,得出结论:衰老与癌症,在分子层面上,共享着同一套驱动密码——DNA甲基化的异常改变。
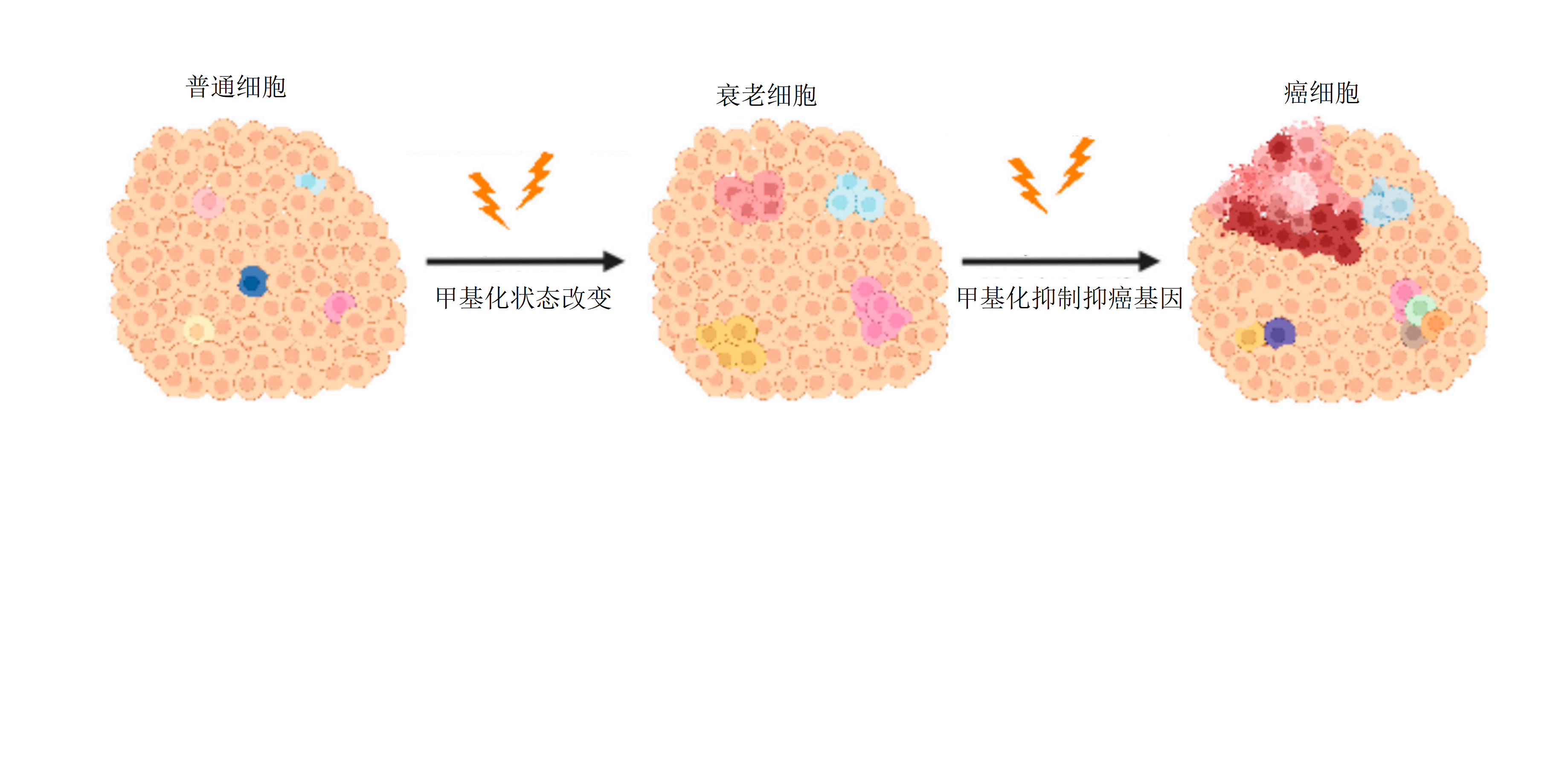
一、甲基化的双重变化
长期以来,科学家观察到癌细胞中存在一个看似矛盾的现象:全基因组低甲基化与局部CpG岛高甲基化并存。全基因组低甲基化:原本被沉默的DNA被激活,引起基因组不稳定和原癌基因的异常表达。局部高甲基化:在关键的基因调控区域,特别是抑癌基因的CpG岛上,却出现了异常的、致密的甲基化。
这篇综述指出,这两种模式正是衰老细胞的普遍特征。随着年龄增长,甲基化标记逐渐丢失(低甲基化)。同时,某些特定区域的甲基化又会异常积累(高甲基化)。
二、核心机制
相关的文献提出了两个核心概念:
有丝分裂时钟假说:DNA甲基化漂移的速度,与细胞分裂的次数直接相关。新陈代谢旺盛、干细胞频繁更替的组织甲基化“衰老”的速度也更快,这完美解释了为何这些部位癌症高发。甲基化“熵”增:“熵”代表系统的混乱度。在年轻的细胞群体中,甲基化模式是整齐划一的(低熵态)。随着年龄增长,甲基化状态变得千差万别,这种表观遗传的高熵态为少数细胞突破枷锁、走向癌变创造了机会。
三、早发性癌症的警示
生物学年龄,而非实际年龄,才是真正的风险标尺。近年来,50岁以下人群的早发性癌症发病率显著上升,这对传统“衰老是最大风险因素”的观点提出了挑战。环境暴露(污染物、抗生素滥用)、慢性炎症和生活方式,都可以在年轻人身上加速其表观遗传衰老。即使在没有典型基因突变的情况下,表观遗传重编程也可能添加细胞未来癌变的几率。
这打破了“年轻即安全”的错觉,将癌症预防的关口大幅前移。评估一个人的甲基化年龄,可能比查看身份证年龄更能预警癌症风险。
四、重要意义
理解甲基化衰老与癌症的同源性,为我们开辟了全新的体检方向。
风险预测的革新:表观遗传时钟(测生物学年龄)可以辅助症风险评估,从而实现更早、更个体化的预警。
预防医学的核心:所有能延缓表观遗传衰老的措施,本质上都是在抗癌。健康饮食、规律运动、减少环境毒素暴露等生活方式干预,在分子层面直接维护甲基化基因组稳定性,是真正的“抗癌化疗”。
结语
在基因序列之下,还存在着一个动态的、可塑的甲基化调控。关注甲基化健康,就是在关注生命最底层的叙事逻辑;延缓表观遗传衰老,就是在根本上构筑起抵御癌症的坚固防线。
https://blog.sciencenet.cn/blog-3140696-1513906.html
上一篇:目标区间甲基化重测序(Hi-MethylSeq)应用领域
下一篇:线粒体:细胞死亡交响乐的总指挥