博文
生物能理论的应用前景(2)
||
三、代谢疾病的能量视角:肥胖、糖尿病与胰岛素抵抗
从生物能学视角看,肥胖、糖尿病与胰岛素抵抗是同一根本问题的不同表现:全身性的能量代谢稳态崩溃。其核心矛盾在于“能量摄入过剩”与“能量利用低效”的失衡,导致能量在错误的地方(如脂肪组织、肝脏、肌肉)以错误的形式(如游离脂肪酸、脂质中间产物)堆积,最终破坏胰岛素信号和全身代谢平衡。为把握这三者的能量联系与核心差异,表5概括了它们的关键特征:
表5 肥胖、糖尿病与胰岛素抵抗的联系与差异
疾病/状态 | 核心能量失衡特征 | 关键细胞/组织 | 对全身能量流的主要影响 |
肥胖 | 能量储存过剩:长期摄入 > 消耗,过剩能量以甘油三酯形式在白脂肪中异常扩张储存。 | 白色脂肪组织(尤其内脏脂肪) | 分泌紊乱的脂肪因子,引发慢性低度炎症,是胰岛素抵抗的“始动器官”。 |
胰岛素抵抗 | 能量信号失灵:细胞对胰岛素发出的 “摄入并利用能量”指令不敏感。 | 骨骼肌、肝脏、脂肪组织 | 葡萄糖无法被有效摄入和氧化,同时脂肪分解不受抑制,导致血脂异常和能量利用障碍。 |
2型糖尿病 | 能量调控系统崩溃:胰岛β细胞代偿衰竭,无法分泌足够胰岛素来克服抵抗,导致“能量浪费”(血糖极高但细胞缺能)。 | 胰腺β细胞、肝脏 | 血糖失控(能量货币无法进入细胞),身体被迫分解蛋白质和脂肪供能,引发多系统损害。 |
1. 分子机制:能量网络如何一步步失灵?
其病理演变遵循一个清晰的能量逻辑链条:
(1)起点:能量过剩与脂毒性
长期过量营养(尤其高脂高糖)导致能量底物超出线粒体的即时氧化能力。多余的脂肪酸在非脂肪细胞(如肝细胞、肌细胞)中转化为毒性脂质中间产物(如神经酰胺、二酰甘油)。它们会:①直接干扰胰岛素信号通路,阻碍葡萄糖转运蛋白GLUT4向细胞膜转移;②诱导线粒体氧化应激和功能障碍,降低细胞“燃烧”燃料的能力。
(2)核心:线粒体功能障碍
骨骼肌和肝脏的线粒体出现数量减少、功能受损(如最大耗氧率下降、ATP合成效率降低)。这使得:①脂肪酸氧化不全,加剧脂质中间产物积累;②葡萄糖的有氧氧化受阻,细胞更依赖低效的糖酵解;③活性氧(ROS)产生增加,进一步损害胰岛素信号蛋白。
(3)枢纽:能量感应器失调
关键的能量感受器在失衡环境中功能紊乱:
AMPK活性受抑制:在高营养状态下,AMPK(本应在能量不足时激活)活性降低,导致其促进脂肪酸氧化、增强胰岛素敏感性的作用减弱。
mTORC1过度激活:持续的营养信号使mTORC1(合成代谢主控开关)异常活跃,抑制自噬(细胞自我清理),并加重胰岛素信号通路中的负反馈抑制。
(4)放大:炎症与内质网应激
能量过剩触发脂肪组织巨噬细胞浸润,释放炎症因子(如TNF-α,IL-6),这些因子可直接干扰胰岛素信号。同时,细胞内脂质堆积和ROS引发“内质网应激”,破坏蛋白质折叠,进一步加剧胰岛素抵抗和β细胞凋亡。
(5)终局:胰岛β细胞代偿衰竭
为克服胰岛素抵抗,胰岛β细胞最初会代偿性增生、超量分泌胰岛素。但长期超负荷工作,加上脂毒性、高糖毒性(葡萄糖毒性)和炎症的持续攻击,最终导致β细胞功能耗竭和凋亡。胰岛素分泌量绝对不足,标志着进入不可逆的2型糖尿病阶段。
2. 前沿与治疗启示:从“对抗症状”到“恢复能量稳态”
基于能量视角,现代治疗策略正从单纯降糖转向改善整体能量代谢:
(1)生活方式干预(根本):饮食控制与运动是恢复能量平衡最有效的方式。运动直接激活AMPK,增强线粒体生物合成与功能,并改善胰岛素敏感性。
(2)核心药物机制
二甲双胍:经典药物,其核心机制之一是激活AMPK。
GLP-1受体激动剂(如司美格鲁肽):通过中枢和外周作用,抑制食欲、改善β细胞功能,从源头上减少能量摄入、增强能量调控。
SGLT2抑制剂(如恩格列净):通过尿液直接排出多余葡萄糖(能量),强行制造“能量负平衡”,减轻体重和内脏脂肪。
(3)新兴研究方向
靶向线粒体功能:研发药物增强线粒体生物合成、改善其效率。
调节脂肪组织代谢:促进白色脂肪“褐变”,增加能量以热的形式耗散。
改善细胞间能量救援:探索如何增强健康细胞向代谢紊乱细胞的能量支援。
3. 总结
因此,从能量视角看:肥胖是能量储存的失控,胰岛素抵抗是能量利用的失灵,而2型糖尿病则是能量调控系统的全面崩溃。理解这一能量链条,不仅揭示了疾病的本质,也为预防和治疗提供了根本性的思路:核心在于恢复机体对能量的高效、平衡利用,而非仅仅处理作为表象的血糖或体重数字。这再次印证了生物能学作为理解生命与疾病基础框架的强大力量。
四、饥饿疗法对物质代谢、能量转化及其生理学影响
“饥饿疗法”(通常指间歇性断食或热量限制)是一种通过主动调控能量摄入窗口,来系统性重塑身体物质代谢与能量转化模式的干预策略。其生理学影响深远且复杂,核心在于触发从“饱食-储存”模式向“饥饿-动员”模式的代谢转换。图1是其作用的系统性解析:
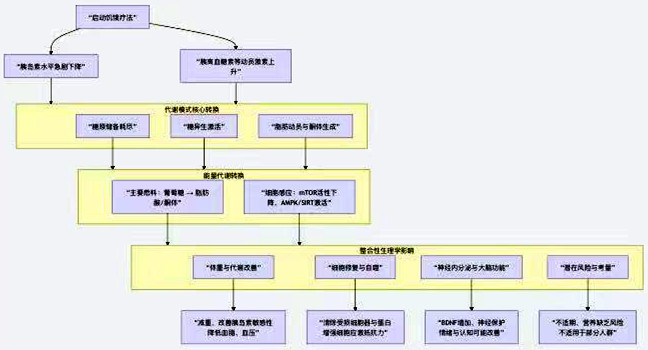
图1 饥饿疗法对物质代谢、能量转化及其生理学影响
下面,我们深入到分子与生理层面,具体解析其机制与影响。
1. 对物质代谢与能量转化的重塑
饥饿触发的激素变化(胰岛素↓,胰高血糖素、肾上腺素、皮质醇↑)直接重编程代谢通路:
表6 饥饿触发的激素变化及代谢通路的重新编程
代谢层面 | 具体变化与机制 |
碳水化合物代谢 | ①肝糖原迅速耗尽(24小时内);②糖异生成为血糖主要来源:利用乳酸、甘油(来自脂肪)和生糖氨基酸(来自肌肉蛋白)在肝脏合成葡萄糖;③全身胰岛素敏感性提升:细胞对胰岛素信号反应更灵敏。 |
脂肪代谢 | 脂肪动员增强:①激素敏感性脂肪酶被激活,脂肪组织释放大量游离脂肪酸入血;②肝脏脂肪酸氧化与酮体生成:脂肪酸在肝脏β-氧化产生乙酰辅酶A,进而合成酮体,为大脑、心脏等提供替代燃料;③能量底物切换:身体从主要燃烧葡萄糖转为主要燃烧脂肪酸和酮体。 |
蛋白质代谢 | ①初期蛋白质分解增加:提供生糖氨基酸,可能导致肌肉流失(后期随酮体代谢增加和生长激素升高而减缓);②后期蛋白质保护:酮体本身有节氮效应,且长期适应后蛋白质分解率回归基线。 |
能量感应与转化 | ①AMPK通路激活:细胞能量“传感器”AMPK在ATP/AMP比率下降时激活,促进脂肪酸氧化、葡萄糖摄取,并抑制合成代谢;②Sirtuins家族激活:依赖NAD⁺的去乙酰化酶SIRT1等被激活,增强线粒体功能、自噬和应激抵抗;③mTOR通路抑制:生长相关的合成代谢通路被抑制,与自噬激活和寿命延长相关。 |
2. 整合性生理学影响
基于上述代谢重编程,饥饿疗法产生多系统影响:
(1)潜在益处
体重与身体成分:促进减脂,尤其在减少内脏脂肪方面效果显著。
代谢健康:改善胰岛素抵抗,降低空腹血糖、胰岛素和甘油三酯水平,可能改善血压。
细胞修复与自噬:这是其核心益处之一。自噬被激活,细胞能更有效地清除受损的蛋白质和细胞器(如功能失调的线粒体),实现“细胞大扫除”,这可能延缓衰老并降低某些疾病风险。
大脑与神经:酮体是大脑的高效燃料,且可能增加脑源性神经营养因子,具有神经保护潜力,或能改善情绪和认知功能。
抗炎与应激抵抗:可降低全身慢性炎症水平,并通过激活细胞应激抵抗通路(如NRF2)增强整体抵抗力。
(2)风险与考量
初期不适:饥饿感、头痛、乏力、易怒等。
营养不良风险:如模式设计不当或食物质量不高,可能导致维生素、矿物质或蛋白质摄入不足。
肌肉流失:尤其在蛋白质摄入不足或训练不当的情况下。
不适用人群:孕妇、哺乳期女性、未成年人、有进食障碍病史者、体重过轻者、以及某些慢性病患者(如晚期糖尿病、严重肝肾功能不全)需在专业指导下进行或避免。
3. 一种代谢应激源
本质上,适度的饥饿疗法是一种有益的代谢性应激。它通过暂时撤除能量供应,迫使身体切换至一种更古老、更灵活的代谢模式,从而激发了一系列保守的细胞修复和适应性反应。其效果取决于模式、时长、个体健康状况及营养质量。
这再次印证了生物能学原理:生命是一个动态的能量平衡系统,其对能量供应的变化会产生深远而系统性的适应与重塑。
五、神经退行性疾病:阿尔茨海默病、帕金森病中的线粒体功能障碍
(未完待续)
https://blog.sciencenet.cn/blog-279293-1515393.html
上一篇:生物能理论的应用前景(1)
下一篇:生物能理论的应用前景(3)