博文
补偿,你做对了吗?--补偿原则基础篇
|||
在做流式实验中,也许第一个遇到的有趣而陌生的概念就是补偿。补偿是什么呢,是你在机器上各个通道间百分比的调整吗?那些数字又代表什么意思呢?为什么当你只做一个颜色如FITC的时候,却在其他通道也看到荧光呢?补偿对你的实验结果到底有什么样的影响?如果这些问题困扰你的话,让我们一起学习一下,那些似懂非懂的补偿概念及我们实验中要遵循的补偿原则吧。
文中提到四大补偿原则总结:
1.实验中用到的所有荧光都要各自做一个单标
2.可替换原则,可以用其他荧光强的同荧光抗体来替换实验所用的抗体;可以用捕获微珠来替换实验细胞。
3.所选择的单标一定要至少和你实验所用抗体信号一样强或者更强
4.跑样时的PMT设置要和跑补偿对照单标的PMT设置一样
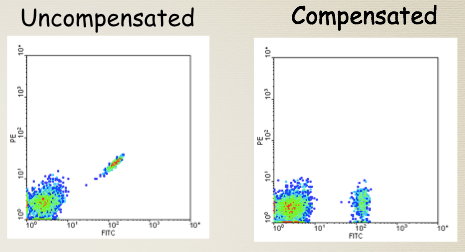
当一个荧光经过激光之后,激发发射光及发射波长,而各个荧光发射光之间有一定的重叠,即它会溢漏一部分的荧光到其他邻近的通道里,这就是荧光溢漏。如果我们要检测一个通道的信号的时候必须要将其他通道溢漏过来的光减掉,才能检测到目标通道的真正信号,而这个纠正荧光溢漏的过程就是我们所说的荧光补偿。而你在机器上看到的那些个百分比就是我们减去的数值。这也是当你仅仅做一色实验的时候,在其他通道看到的荧光信号就是你的荧光溢漏到这些通道的光。
我们可以用下图来简洁的理解:曲线分别是FITC和PE的发射波长,柱状物是滤镜检测信号范围,可以明显的看到PE通道检测的信号,有一部分是来自的FITC通道的,那真正的PE信号就是
True PE =total FL2 -FITC spill over。
而这个溢漏系数是可以通过计算得到的。如果要计算这个系数我们就需要分别得到只有FITC及只有PE信号的值,这就是我们通常说的单染或者单标,就是一管样本只加一个染料,
补偿原则1:实验中用到的所有荧光都要各自做一个单标。如果你做6色实验就需要6管单标。
下面用FITC为例,来计算FITC溢漏到PE的溢漏系数,左上图为FITC单标,可以看到有相当一部分的信号溢漏到了PE通道。通过FlowJo软件得到阳性细胞群的FITC及PE的中位荧光值。我们的最终目的是让阳性群和阴性群的PE通道中位数一致。
FITC溢漏到PE的溢漏系数:
%spill over Coefficeincy= MFIPE/MFIFITC = 1650/3540=46.6%
这个溢漏系数不仅和荧光本身特质有关,和2个通道的PMT设置也有关。
而另外一个概念是补偿系数,补偿系数算的是阴性及阳性信号中位数值变化之比,及如果你在阴性群和阳性群之间画一条直线的话,补偿系数就是直线斜率。
补偿系数= (MFIPE+- MFIPE-)/(MFIFITC+ -MFIFITC-)=(1650-185)/(3540-125)=42.9%
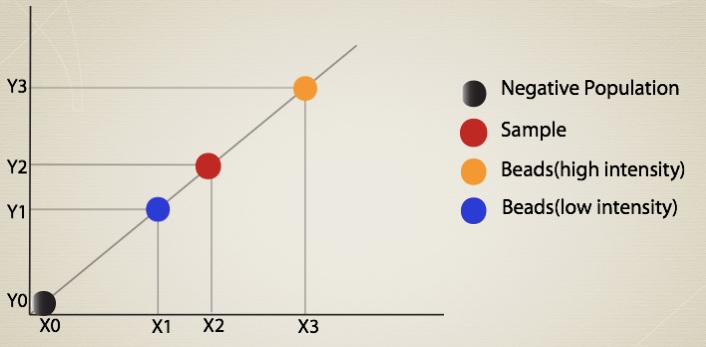
而这个补偿系数,理论上来说,对于特定的荧光素,在PMT值不变的情况下,和你抗体检测的目标蛋白表达量没有关系,和你的实验所用细胞没有关系。,是保持不变的,它是我们看到的直线斜率(Slope)。如下图所示,同一荧光的不同抗体荧光表达强度不同,但是他们都保持在一条线上,补偿系数即斜率保持不变。
正是这个原因,有了
补偿原则2:可替换原则,可以用其他荧光强的同荧光抗体来替换实验所用的抗体;可以用捕获微珠来替换实验细胞。具体来说就是,如果你实验中用IFNg-FITC来检测IFNg的表达量,因为其表达强度很低,荧光很弱,不是一个很好的单标选择,你可以用CD3-FITC来替换IFNg-FITC。 当然不是所有的抗体都可替代,像PE-Cy7等偶联抗体就不能替代,因为这些抗体的批次独特性,必须使用同批次同抗体来做单标。
同样的,如果你样本细胞非常珍贵,没有足够的细胞来做单标,那么我们就可以买市面上的一种用于做补偿的叫捕获微珠(Capture Beads)的产品来替代细胞。这些微珠和你的抗体孵育后,荧光抗体会结合上去,成为信号非常强的一种完美的单标。使用这些微珠的时候要注意微珠和抗体要物种匹配(人,鼠及大鼠)及轻键(kapper, lamda)匹配。
既然同一荧光素的补偿系数是一样的,那是不是我们完全不需要考虑到补偿对照的荧光强弱呢?在实际检测过程中,不可避免的会引进误差,对于表达弱的信号,误差对它的影响会比表达强的大很多,由此我们有了
补偿原则3:所选择的单标一定要至少和你实验所用抗体信号一样强或者更强。
没有遵循这个原则是补偿做不好的一个最大的罪魁祸首。如果你的单标信号太弱,将不能很好衡量真正的溢漏值,用这样的单标来补偿你的样本,易造成过度补偿或者补偿不足。有的用户会说,可是我的抗体表达就是很弱啊。在这种情况下,我们就可以使用补偿原则2,将弱表达的抗体换成强表达的抗体来达到最佳补偿效果,譬如像之前举例的,用CD3-FITC来替换弱表达的IFN-g FITC. 或者使用微珠来得到信号很强的单标。在这里还要澄清一点,我们要求的是补偿对照的荧光强度要强,而不是表达量要很高。你可以是低表达的强荧光,但是不能是高表达的弱荧光,也就是说补偿对照的表达要在参数轴上的强荧光处。
另外一个很重要的补偿原则就是补偿时候的PMT设置。我们提到荧光溢漏是受PMT影响很大的,PMT值不同,光信号也大不同,进而影响到溢漏值。所以我们要遵循补偿原则4.
补偿原则4:跑样时的PMT设置要和跑补偿对照单标的PMT设置一样。换句话说,PMT一旦设置好,在跑样本和对照的时候就不要再改变。 有关PMT的设置我会在另外的文章里在详细讨论。
这些补偿对照原则你都做到了吗?欢迎留言讨论!
https://blog.sciencenet.cn/blog-349948-839155.html
上一篇:流式实验的生物安全--你做好防护了吗?
下一篇:最近FlowJo激活的一些问题(APEC蓝走了,一切恢复正常)