博文
Nature: AIM2对于调节免疫力至关重要(附原文)
||
Nature: AIM2对于调节免疫力至关重要(附原文)
诸平

据美国北卡罗莱纳大学卫生保健(University of North Carolina Health Care)2021年1月28日提供的消息,该大学的科学家发现,AIM2对于调节性T细胞即Treg细胞(Treg cells)的正常功能很重要,并且在缓解自身免疫性疾病中起关键作用。Treg细胞是适应性免疫细胞的重要种群,可防止过度狂热的免疫反应,例如自身免疫性疾病中发生的反应。
人体中的许多分子可以帮助我们的免疫系统保持健康,而不会过度反应,以免免疫细胞引起自身免疫疾病等问题。一种被称为AIM2的分子是我们天生的免疫力的一部分——这是自出生以来建立的防御系统——与病原体作斗争并保持我们的健康。但是对AIM2对T细胞适应性免疫的贡献知之甚少——这种防御是针对特定病原体和我们一生中出现的健康问题而开发的。
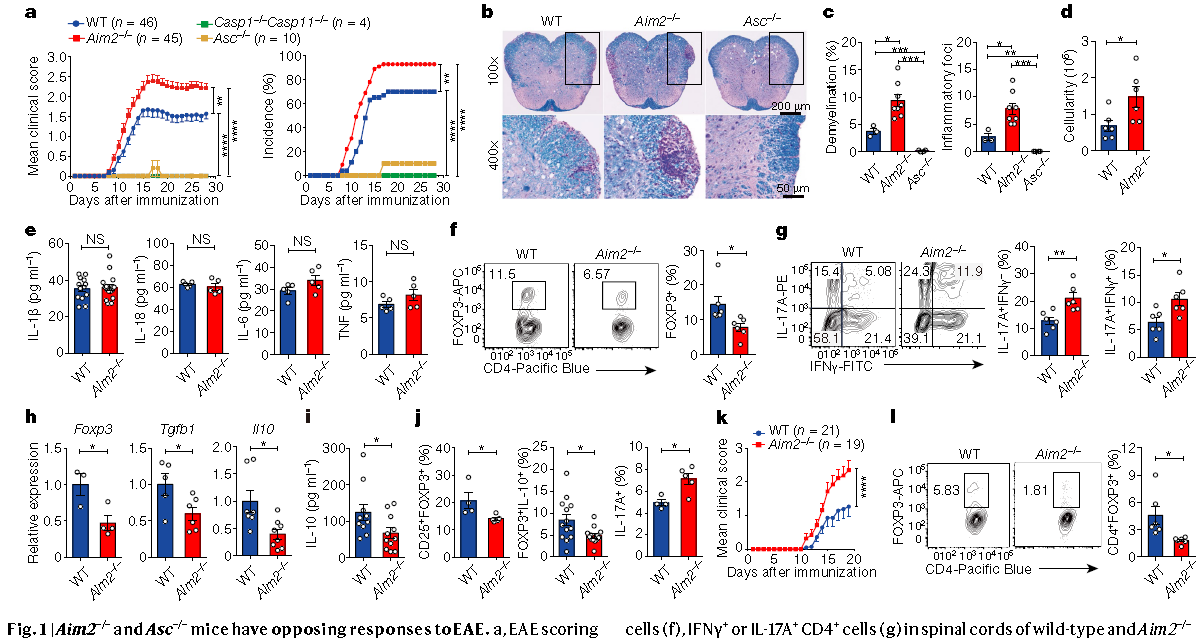
现在,由威廉·肯南(William Kenan)杰出遗传学教授珍妮·丁(Jenny Ting)博士和微生物学和免疫学教授万宜松(Yisong Wan音译)博士领导的北卡罗莱纳大学(University of North Carolina,UNC)医学院(UNC School of Medicine)科学家发现,AIM2对于调节性T细胞或Treg细胞的正常功能很重要,并在减轻自身免疫性疾病中起关键作用。Treg细胞是适应性免疫细胞的重要种群,可防止过度狂热的免疫反应,例如自身免疫性疾病中发生的反应。
该研究已经于2021年1月27日在《自然》(Nature)杂志网站发表——Wei-Chun Chou, Zengli Guo, Hao Guo, Liang Chen, Ge Zhang, Kaixin Liang, Ling Xie, Xianming Tan, Sara A. Gibson, Elena Rampanelli, Yan Wang, Stephanie A. Montgomery, W. June Brickey, Meng Deng, Leslie Freeman, Song Zhang, Maureen A. Su, Xian Chen, Yisong Y. Wan, Jenny P.-Y. Ting. AIM2 in regulatory T cells restrains autoimmune diseases. Nature, 2021; DOI: 10.1038/s41586-021-03231-w.
AIM2inregulatoryTcellsrestrainsautoimmunediseases.pdf此论文表明AIM2实际上在适应性免疫系统的Treg细胞中的表达水平要高于先天免疫细胞。参与此项研究的有来自美国北卡罗来纳大学教堂山分校(University of North Carolina at Chapel Hill)莱恩伯格综合癌症中心(Lineberger Comprehensive Cancer Center)、遗传学系、微生物学与免疫学系、牙科学院口腔及颅面生物医学教研室、生物化学与生物物理学系、病理与检验医学系以及小儿科学系的研究人员。
莱恩伯格综合癌症中心成员、转化免疫学中心主任,也是该研究的共同通讯作者Jenny P.-Y. Ting说:“我们的研究揭示了AIM2在Treg细胞的适应性免疫中具有意想不到的作用,而这一作用此前从未被人认识到,它独立于AIM2在先天免疫中的经典功能。”
另外一位共同通讯作者,也是莱恩伯格综合癌症中心成员Yisong Y. Wan补充说:“由于Treg细胞是多种疾病(包括自身免疫性、炎症和癌症)的知名分子,我们的发现将有助于我们确定新的分子靶标并开发出新的治疗策略来对抗衰弱和致命的疾病。”
正常的免疫反应通过先天免疫和适应性免疫来进行,以抵抗病原体并保持生物学稳定性。但是需要对这些反应进行调节,以使它们不会升级,并且除了病原体最初引起的原因之外,不会引起很多其他健康问题。不同的细胞类型和分子在先天免疫和适应性免疫的下调中起着不同的作用。这项工作表明,Treg细胞中的AIM2是其中之一。Treg细胞会抑制过度旺盛的免疫反应,因此它们对于免疫系统的制衡至关重要。
Treg细胞功能受损通常会扰乱免疫系统的稳定性,并可能引发自身免疫和炎症性疾病。
在由Jenny P.-Y. Ting实验室研究助理、上述论文的第一作者Wei-Chun Chou博士领导的实验室实验中,UNC科学家发现,在小鼠和人类中,Treg细胞中AIM2的表达水平都高于先天免疫细胞。
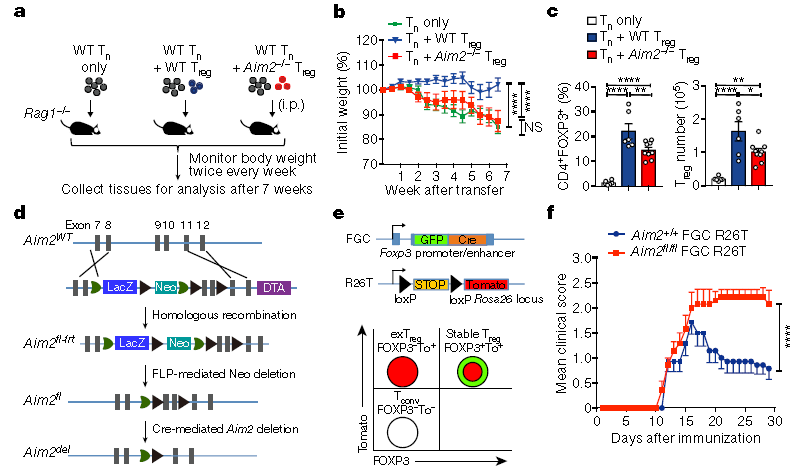
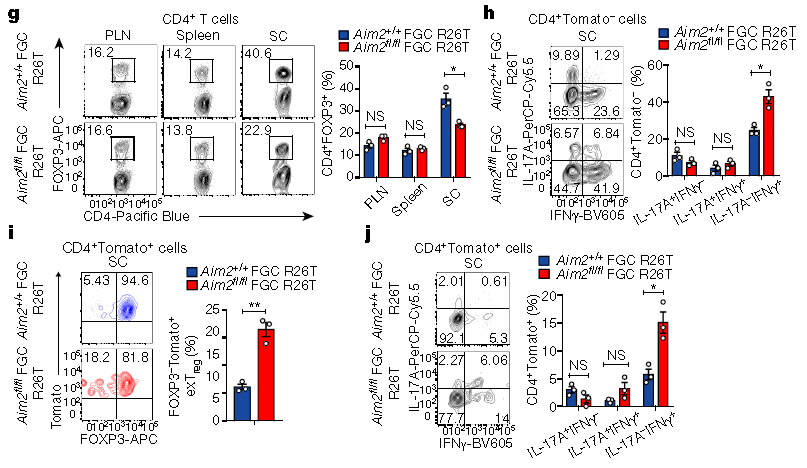
Wei-Chun Chou说:“这表明AIM2在Treg细胞中起着重要作用。” “我们发现,AIM2对于维持Treg细胞的正常功能很重要,如果没有AIM2,Treg不能有效地保护小鼠免受自身免疫性脑脊髓炎和炎性结肠炎的侵害。”这两个条件是人类疾病多发性硬化症和结肠炎的模型。“我们进行了进一步的分子和生化分析,以揭示Treg细胞中蛋白质分子的新细胞信号传导途径-称为AIM2-RACK1-PP2A-AKT途径-调节Treg细胞的代谢和功能以减轻自身免疫性疾病。”更多信息请注意浏览原文
AIM2inregulatoryTcellsrestrainsautoimmunediseases.pdf
或者相关报道。
The inflammasome initiates innate defence and inflammatory responses by activating caspase-1 and pyroptotic cell death in myeloid cells1,2. It consists of an innate immune receptor/sensor, pro-caspase-1, and a common adaptor molecule, ASC. Consistent with their pro-inflammatory function, caspase-1, ASC and the inflammasome component NLRP3 exacerbate autoimmunity during experimental autoimmune encephalomyelitis by enhancing the secretion of IL-1β and IL-18 in myeloid cells3,4,5,6. Here we show that the DNA-binding inflammasome receptor AIM27,8,9,10 has a T cell-intrinsic and inflammasome-independent role in the function of T regulatory (Treg) cells. AIM2 is highly expressed by both human and mouse Treg cells, is induced by TGFβ, and its promoter is occupied by transcription factors that are associated with Treg cells such as RUNX1, ETS1, BCL11B and CREB. RNA sequencing, biochemical and metabolic analyses demonstrated that AIM2 attenuates AKT phosphorylation, mTOR and MYC signalling, and glycolysis, but promotes oxidative phosphorylation of lipids in Treg cells. Mechanistically, AIM2 interacts with the RACK1–PP2A phosphatase complex to restrain AKT phosphorylation. Lineage-tracing analysis demonstrates that AIM2 promotes the stability of Treg cells during inflammation. Although AIM2 is generally accepted as an inflammasome effector in myeloid cells, our results demonstrate a T cell-intrinsic role of AIM2 in restraining autoimmunity by reducing AKT–mTOR signalling and altering immune metabolism to enhance the stability of Treg cells.
https://blog.sciencenet.cn/blog-212210-1269922.html
上一篇:[转载]人教社中学数学编辑室的回复缺乏说服力
下一篇:解决电池争议,推动研究前行