博文
基因治疗,从学术界到工业界
 精选
精选
|
经历了一系列挫折之后,基因疗法终于从小规模临床试验开始走向正规医疗。
20年前公众对于基因治疗十分狂热,一个重要的因素是如果治疗是通过将遗传物质转入细胞来实现的,这些药物就可以很快地制备。伦敦玛丽皇后大学的Nick Lemoine回忆说,通常的药物开发需要数年的时间。对于小分子药物来说,通常需要15年才能上市。但是在开发第一个针对乳腺癌的基因疗法时,从概念验证到临床实践只花了5年时间。
Lemoine和他的同事在1999年发表了他们的研究结果。但是仅仅几个月后,一个志愿者在宾州大学一项针对代谢疾病的基因疗法实验中死亡。病毒载体引发了一场致命的免疫风暴。在随后的几年里,一些在法国和英国参与基因治疗实验的先天性免疫缺陷患者被诊断患上了白血病。
随着类似事件的不但发生。基因治疗的相关公司开始将它们的重心转移到其他疗法,也引发了人们的严重质疑——大家开始怀疑基因疗法到底是否有用。
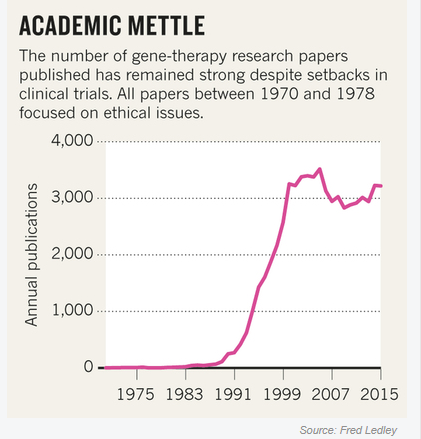
尽管疗效不佳,投资也有所减少,学术界还保持了对基因疗法的热情。研究者试图开发更有效安全的载体,并在临床试验中测试。时至今日,已有超过2300项针对不同疾病的临床试验,其中多数是小规模的学术性质。这些尝试已经带来了有益的结果,在2008年之后生物科技产业的爆发中,很多相关初创公司得到了投资。一个典型例子是西雅图的Juno,成立一年之后的2014其市值就达到了40亿美元。
但是正式上市的基因疗法还比较少,第一个是Gendicine,在中国上市被用以治疗头颈部肿瘤。2012年,欧洲药监局批准了Glybera的上市,用以治疗一种罕见的胰腺疾病。不过该疗法可能是史上最昂贵的一种疗法,在商业上并不成功。今年,欧洲药监局又批准了GSK的Strimvelis,用以治疗一种少见的免疫失调。美国药监局迄今为止还没有批准任何基因疗法,不过治疗基因导致的眼病和血液病的一些疗法在几年内可能会被通过。上市申请之所以比较少,主要还是由于相关临床实验设计的不合理。UniQure的首席医疗官表示,直到最近几年,工业界的项目的质量,可靠性和安全性才达到管理标准。
病毒载体
基因疗法有很多变体,不过它们都面对一项挑战,如何引发目标细胞中的基因变化。宾州大学基因治疗项目主任James Wilson表示,呈递过程(Delivery)永远是最重要的限速步。Wilson领导了导致1999年致死事件的临床试验。早期的多数研究采用的是逆转录病毒,搭载RNA。而Wilson但是采用的是腺病毒。他接下来发展了腺病毒相关病毒(AAV),目前已成为临床实验的主流载体。
腺病毒相关病毒是一种不会激活很多免疫反应的小病毒,可以搭载单链DNA。不过AAV不会把基因材料整合进染色体,所以它们适用于不分裂细胞,比如大脑或者视网膜。在分裂细胞中,AAV搭载的DNA由于不会复制所以会被丢失。AAV比较小,不能装太大的基因,但它们通常可以被注射进血液或者组织。
属于逆转录病毒的慢病毒,有时也被用以基因治疗。慢病毒的好处在于需要改造的细胞可以从体内提取出来,改造后再输回体内。慢病毒可以携带更大的DNA片段,但缺点在于无法控制在哪里将外源片段整合进基因组,这有时会带来安全上的问题,虽然目前在实验中还没有发现严重后果。基于单纯疱疹病毒1(HSV-1)的疗法可以针对神经系统。来自匹兹堡大学的遗传学家JosephGlorioso和他的同事利用HSV-1通过提高内源类阿片活性肽(opioid)分泌成功治疗了疼痛。最近几年,基因编辑技术,尤其是CRISPR-Cas9体系也为改善基因疗法提供了可能。2016年7月,在华西医院一项针对肺癌的T细胞体外实验通过了伦理审查,这是第一例将CRISPR应用于人体的研究。有些公司试图进行体内应用,比如Editas,计划在2017年利用CRISPR治疗一种眼病。
罕见病
很多基因疗法关注的是单基因突变导致的疾病。视网膜是比较好的一个靶标,由于它比较小,容易操作,变化也可以测量。另外研究者也可以利用一个眼睛作为control。宾州大学的Jean Bennett从上世纪80年代就开始治疗眼科疾病,他在2007年开始一项针对RPE65突变导致的遗传性失明的治疗,并在2015年的一个包括31名病人的三期实验中取得了良好结果。相关公司计划在2016年底前递交申请,使得该项目有可能成为FDA批准的第一个基因疗法。
血液病是另外一个热点,2016年6月,Spark公司宣布他们在一项针对血友病B型的治疗中取得了满意结果。一个月后BioMarin公司报道了基因治疗针对血友病A型(主要类型)是有效的。研究也在向其他单基因缺陷血液病拓展,包括地中海贫血以及镰刀细胞病。在治疗中,患者的造血干细胞被提取出来,将其中的β-globin基因换成一个正确的拷贝。在2015年末,蓝鸟生物(Bluebird Bio)报道了他们成功治疗了两例地中海贫血。该公司也利用类似策略在治疗肾上腺脑白质营养不良(cerebraladrenoleukodystrophy),一种全球发病率为1/20000的疾病。改造后的造血干细胞可以到达脑部,提供正确的蛋白来补偿ABCD1基因缺陷。2016年,芝加哥得AveXis报道了治疗脊髓性肌萎缩的比较成功的早期结果。
癌症治疗
目前引发最多关注的还是自体适应性T细胞移植。患者的T细胞被改造后回输体内,从而治疗血癌。目前有两大类改造T细胞,抗体嵌合型T细胞(CART)以及T细胞受体T细胞(TCRT)。前者已经在白血病中取得了显著成绩。
很多公司已经开始追逐这一浪潮,但事情并不总是一帆风顺。在2016年7月Juno声明,在三名受试者死亡后,FDA已经暂停了了他们利用CART疗法治疗急性淋巴细胞性白血病的实验。不过这些死亡案例是由于治疗准备期间的一种药物而非CART疗法导致的。在更换药物后,FDA又许可了该项实验。TCRT细胞可以识别肿瘤表面或者内部的蛋白,需要更进一步的改造,同时目前的相关实验更少一些。
进入市场
基因治疗和小分子药物之间有一个很大的不同,那就是基因治疗时没有办法停止的。病人需要被长时间的追踪来判断疗效是否持续。另外目前有的临床试验规模较小而时长较短,导致我们并不清楚它们的完整后果。所以人们必须十分的谨慎。有些研究者将它和单抗药物进行对比。30年前单克隆抗体药物出现时,人们也有很大的疑虑,不过随着研究的积累和越来越多公司的参与,人们也放下了恐惧。
另外基因疗法还面对经济上的问题。很多支持者不得不面对天文数字的费用。比如上文提到的Glybera疗法,费用是120万美元,虽然这种治疗只在这个价格被消费一次。能够治疗罕见病的疗法费用仍然会很高昂——覆盖研发费用。不过它们对一些疾病仍然有吸引力,比如血友病。如果打一针就可以见效,何乐而不为呢,毕竟省掉了一辈子的费用。
本文摘译自 http://www.nature.com/nature/journal/v537/n7619_supp/full/537S57a.html
https://blog.sciencenet.cn/blog-927304-1012591.html
上一篇:科学界的1%:加剧的收入不平等
下一篇:如何衡量研究者学术影响力的变化