博文
免疫沉淀常见问题解答 | MedChemExpress
|
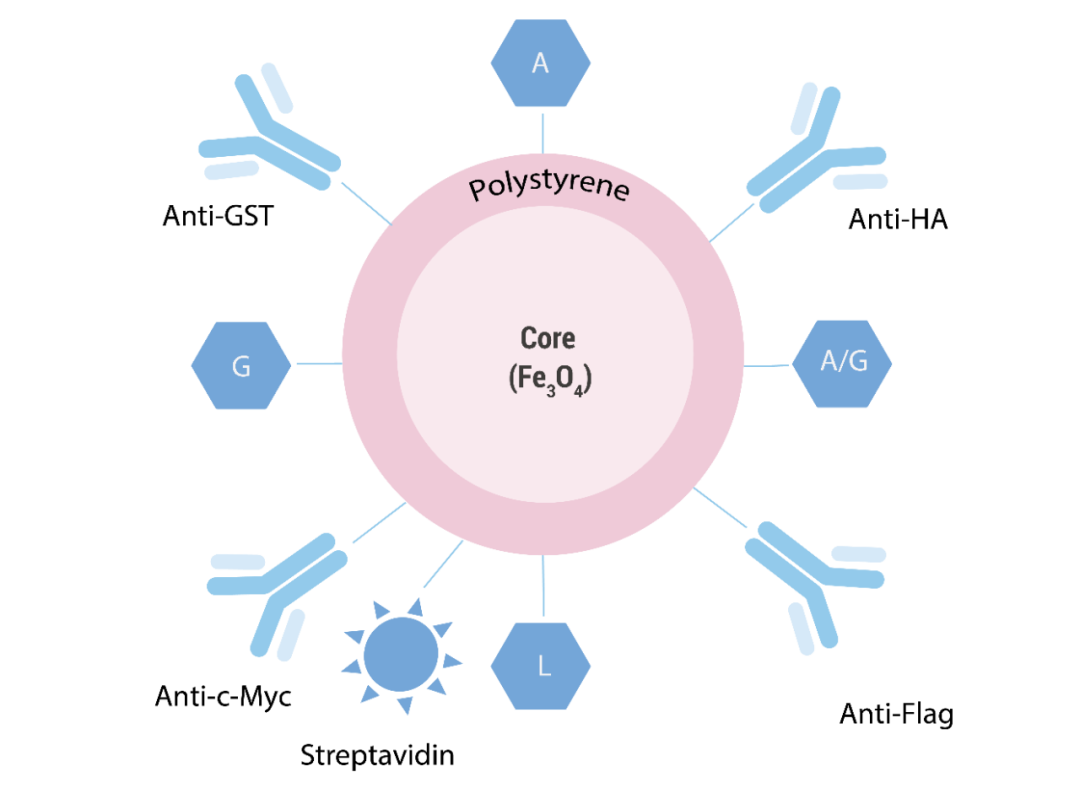
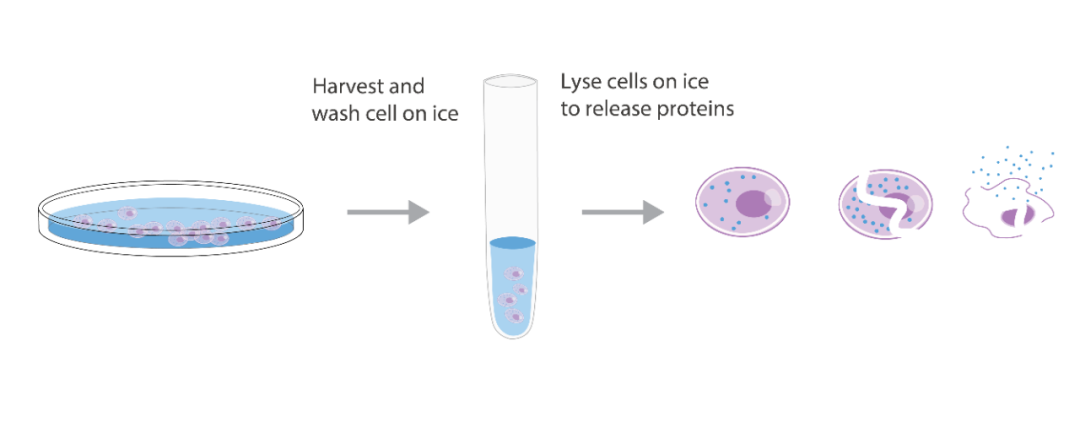
1) 超强顺磁性,在磁场中能够迅速聚集,离开磁场后又能均匀分散; 2) 合适且均一的粒径,保证其具有足够强的磁响应性又不会沉降; 图 1. MCE 磁珠组成 A、G、L、A/G 代表 Protein A、Protein G、Protein L 及 Protein A/G; Anti-HA、Anti-Flag、Anti-c-Myc、Anti-GST 代表 Anti-HA 抗体、Anti-Flag 抗体、Anti-c-Myc 抗体及 Anti-GST 抗体 选磁珠时,首先关注磁珠磁性 (磁吸时间)、粒径 (大小及均一度) 等。其次根据实验目的,选择合适的表面活性基团以及由此衍生的偶联方式、蛋白结合量等。 比如,如果您的目标蛋白带有融合标签,可一步到位选择: · Anti-HA Magnetic Beads (HY-K0201) · Anti-Flag Magnetic Beads (HY-K0207) · Anti-c-Myc Magnetic Beads (HY-K0206) · Anti-GST Magnetic Beads (HY-K0222) 如果您的目标蛋白带有生物素标记,可选择 · Streptavidin Magnetic Beads (HY-K0208) 如果您有可识别靶蛋白的抗体,可选择 · Protein A/G Magnetic Beads (HY-K0202) · Protein A Magnetic Beads (HY-K0203) · Protein G Magnetic Beads (HY-K0204) · Protein L Magnetic Beads (HY-K0205) 下面以 Protein A/G 磁珠为例,详述 IP 实验步骤、可能存在的问题及解决方法。 制备抗原样品 (细胞裂解物) 是 IP 的第一步,也是关键的一步。正确的细胞裂解液可以稳定天然蛋白质构象、抑制酶活性、最大限度地减少抗体结合位点变性并释放细胞或组织中的蛋白质。一般可选 NP-40、RIPA、Western 及 IP 细胞裂解液等。抗原样品应始终保存在冰上,并将蛋白酶抑制剂 添加到裂解液中以防止蛋白水解。 注 1:Co-IP 实验时,常用 NP-40 等非离子型裂解液,以免破坏蛋白-蛋白相互作用。 注 2:确保目的蛋白在抗原样品中有较高水平表达。 通过此步骤,您将获得磁珠—抗体—抗原样品复合物。磁珠、抗体、抗原样品的加样顺序对靶蛋白得率有一定影响。 All in one——直接将磁珠、抗体、抗原样品混合到一起; 直接结合——抗体和磁珠先结合,再和抗原样品结合; 间接结合——抗体和抗原样品先结合,再和磁珠结合。 可选步骤 2——抗体的交联固定:如果不希望抗体与目标蛋白共洗脱,可在直接结合时,使用交联剂将抗体共价连接到 Protein A/G 上。后续使用酸性洗脱法洗脱靶蛋白。
■ Step 2——样本结合
一般情况下,如果靶蛋白丰度较高,直接结合与间接结合差别不大,均可选;如果靶蛋白丰度不高,可选间接结合以获得更高的靶蛋白得率。
一般根据下游应用选择洗脱方法:
设计好实验,优化好条件,配好各种 buffer 和工作液,按照 protocol,小心翼翼的丝毫不敢怠慢,一通操作猛如虎,一看结果。
灵魂五问:蛋白表达了吗?上样量足够吗?孵育时间充足吗?裂解液选的合适吗?洗脱方法合适吗?
解决方案详戳 “冬风吹,战鼓擂,蛋白纯化,我怕谁!
2) 高背景值或多条带
f. 对抗原样品预处理 (将抗原样品单独与 Protein A/G 磁珠或同型对照抗体结合),可减少部分非特异性结合。
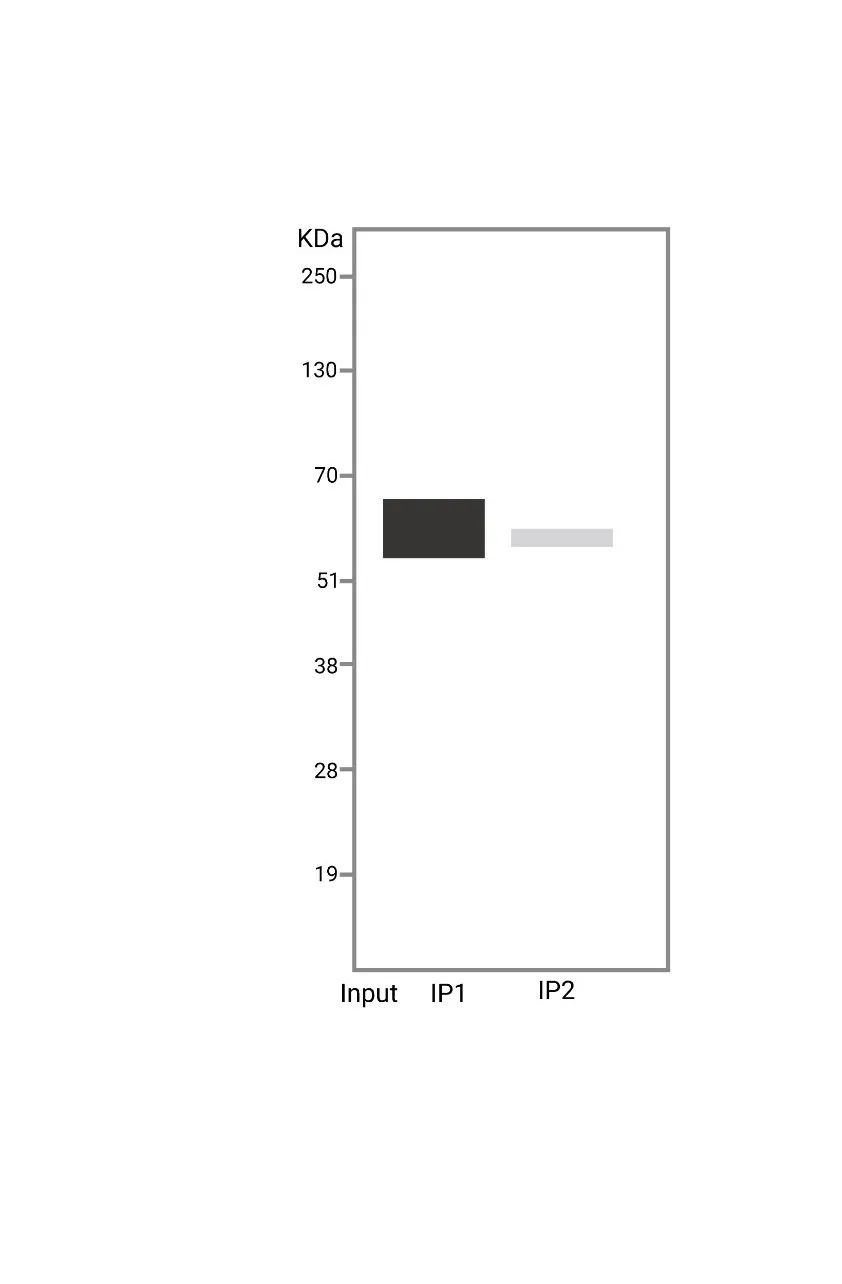
成功的条带总是相似的,失败的条带各有各的不同。分析结果时,有阴性、阳性对照能一步到位帮您分析原因。
阳性对照:证实细胞裂解物中确实存在靶蛋白 (IP) 或者互作蛋白对 (Co-IP,比如诱饵蛋白 X 和靶蛋白 Y),即为常说的 input。可直接使用细胞裂解物或者抽提好的蛋白溶液进行 Western Blot。
阴性对照:IP/Co-IP 后靶蛋白或者互作蛋白对都检测到了,固然是值得高兴的,但是这结果是不是假阳性呢?还得做个阴性对照。例如,同型对照抗体 (没有特异靶标的一抗,但在类别和亚型上,其跟实验应用中的靶标一抗一致) 等。
Output:在某些 Co-IP 实验中,实验人员会把 IP 后的上清分别进行诱饵蛋白 X 和靶蛋白 Y 的 WB 检测,该对照组称为 output 组。
......
好了,说了这么多,希望本篇对大家有所帮助,祝伙伴们拿到心仪的实验结果。
https://blog.sciencenet.cn/blog-3506747-1357005.html
上一篇:JAK-STAT 通路与炎症和自身免疫性疾病 | MedChemExpress
下一篇:AstraZeneca重磅产品白介素5抑制剂获批 | MedChemExpress
全部作者的其他最新博文
- • 药物筛选化疗药物库是肿瘤治疗研究的有效工具 | MedChemExpress (MCE)
- • 趋化因子化合物库是癌症、艾滋病和伤口愈合等相关药物研究的有用工具 | MedChemExpress (MCE)
- • 化学探针化合物库是靶点鉴定及机制研究的重要工具 | MedChemExpress (MCE)
- • 化学致癌物化合物库是研究人类肿瘤疾病的有力工具 | MedChemExpress (MCE)
- • 细胞死亡化合物库是筛选细胞死亡药物的有用工具 | MedChemExpress (MCE)
- • 肿瘤干细胞化合物库是进行肿瘤干细胞相关研究及抗癌药物开发的有用工具 | MedChemExpress (MCE)