博文
代谢学人--Nature Metabolism:脂肪组织单细胞测序再立新功
||
代谢学人
Nature Metabolism:脂肪组织单细胞测序再立新功
撰文 | 朱爽爽 张俊 仲银召 姚静
编辑 | 孟美瑶
校对 | 郭明伟

人间四月芳菲尽
山寺桃花始盛开
夏天提着它的裙摆正悄悄走来
在这个鸟语花香的时节里
有的人下定决心减肥锻炼

而有的人忙着偷偷发胖

不过Don’t worry
最近有研究人员发现
由CD142+细胞亚群分泌的RSPO2
是脂肪生成的功能性调节因子
它通过作用于LGR4受体
抑制脂肪的生成
大风车吱呀吱悠悠的转
这里的风景呀真好看
快让我们一起来看看叭!
背景介绍
在正常状态下,机体通过调节能量摄入和能量消耗的平衡来维持代谢稳态。然而,当机体长久地处于能量摄入大于消耗的状态时,多余的能量会以甘油三酯的形式沉积在脂肪组织中,最终导致肥胖的发生发展。尽管脂肪组织是主要的脂质储存器官,但白色脂肪组织(white adipose tissue, WAT)只含有20-30%的成熟脂肪细胞,在这些成熟脂肪细胞周围存在着许多异质性细胞亚群,如脂肪前体细胞(adipocyte progenitor cells, APCs)、内皮细胞、巨噬细胞等,这些细胞统称为血管基质组分(stromal vascular fraction, SVF)。当机体在能量摄入大于能量消耗状态下,脂肪组织将会扩张,表现为脂肪细胞数量和体积增加,同时SVF中的细胞组分也相应改变,从而调节机体能量平衡。脂肪组织扩张主要依赖于两个方面:第一个是APCs的增殖和分化,该方面被证明可以预防肥胖相关疾病;第二个是成熟脂肪细胞的肥大,它与脂肪组织中由胰岛素抵抗而导致的代谢紊乱的发展有关。因此,脂肪组织的扩张在影响脂肪组织可塑性和机体代谢健康中发挥重要作用。综上所述,适应性脂肪生成在机体维持能量稳态中举足轻重,它驱动脂肪组织的可塑性,并可能成为治疗肥胖相关性疾病的一种新途径。
近年来,许多研究试图解析脂肪的分化过程,以更好地理解驱动这一过程的细胞和分子机制。从2018年开始,单细胞RNA测序(scRNA-seq)就开始被应用于鉴定不同脂肪组织的APCs异质性。在2019年,Merrick等人通过scRNA-seq揭示了小鼠和人的皮下脂肪组织中APCs细胞亚群的层次结构,其中有三组细胞在SVF中具有较高的比例,且均表达经典脂肪祖细胞标志,分别为Dpp4+细胞亚群、ICAM1+亚群和CD142+亚群,Dpp4+细胞亚群可转变为ICAM1+和CD142+细胞亚群,而ICAM1+和CD142+细胞可以互相转化。在功能上,三种亚群在体内均具有较强的成脂能力,然而相对于其他亚群,Dpp4+细胞亚群具有更高的增殖能力和多向分化能力,但在体外的成脂能力却不如另外二者。与此同时,Christian Wolfrum研究团队在此前关于成人腹股沟WAT(ingWAT)的工作也证明了APCs的三个细胞亚群的存在:Lin-Sca1+CD55+(P1亚群)、Lin-Sca1+VAP1+(P2亚群)和Lin-Sca1+CD142+(P3亚群)。与Merrick等人的结论类似,P1亚群表现出显著的干细胞特征和脂肪生成能力,对应着Merrick研究中的Dpp4+亚群;P2亚群高表达脂肪生成相关基因(如Pparγ和Fabp4),表明P2亚群代表着脂肪分化谱系中的脂肪前体细胞,与前述的ICAM1+亚群对应。然而与Merrick团队的研究结果有所区别的是,Wolfrum团队利用CD142标记的P3细胞亚群不仅自身不能分化为成熟脂肪细胞,还能通过旁分泌蛋白降低其他脂肪前体细胞的成脂分化能力。上面两篇工作的争论焦点就在于利用CD142分离出来的细胞亚群存在着相反的功能。因此在本篇文章中,Wolfrum研究团队基于实验室的前期研究成果,进一步详细解析了调控脂肪生成的细胞和分子机制。

敲黑板啦!
1、APC scRNA-seq数据揭示了脂肪前体细胞的异质性
2、深入分析小鼠脂肪组织中不同细胞亚群的功能
3、P3细胞亚群旁分泌Rspo2,并通过结合Lgr4受体调节脂肪生成
4、Rspo2抑制体内P1细胞亚群向P2转变进而影响脂肪生成
5、Rspo2导致小鼠异常的脂肪组织扩张和胰岛素抵抗
6、单细胞核测序再次证明Rspo2抑制体内脂肪形成
研究结果
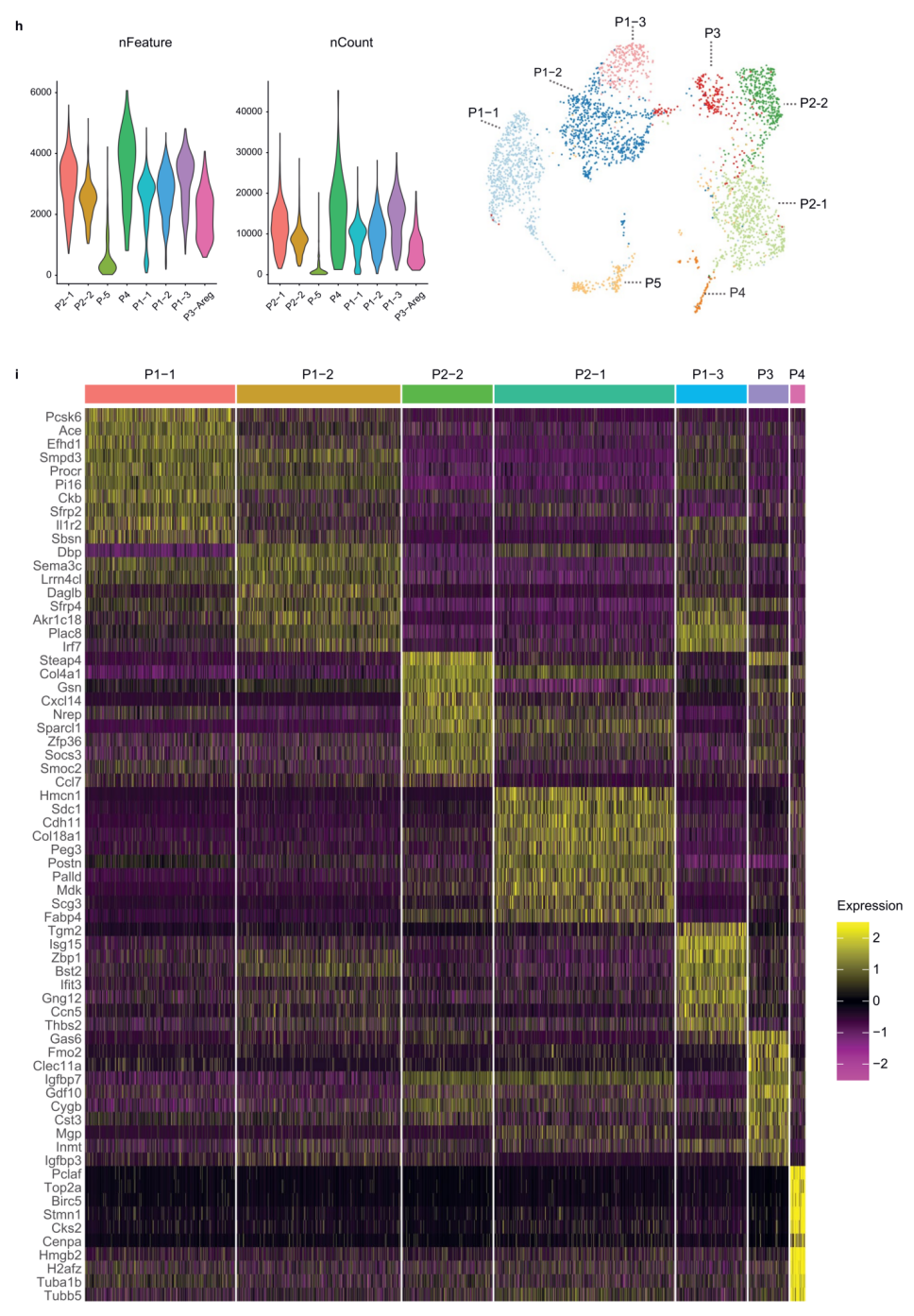
在此前的研究中,研究人员将Lin-Sca1+CD142+APC定义为脂肪生成调节细胞(Areg),并证明这些细胞通过旁分泌信号抑制成熟脂肪细胞的形成。相比之下,Merrick 等人观察到Lin-CD142+细胞可分化为脂肪细胞。两项研究都利用CD142表面marker区分出一种细胞亚群,然而二者的功能却完全相反,为了探究出现这一矛盾现象的原因,研究人员用最新的计算机算法重新对Lin-细胞群(SVF中去除免疫细胞、内皮细胞和红细胞的细胞组分)进行10X Genomics scRNA-seq,然后转录本的非监督聚类分析揭示了七个不同的亚群(图1A)。新发现的表达CD55和DPP4的P1-1、P1-2和P1-3亚群代表了早期的脂肪祖细胞亚群(图1B),类似于先前发现的G1/G4/Group 1细胞亚群(不同文章里名称不同)。先前确定的G2/Group 2细胞亚群代表定型(committed)的APCs,作者进一步根据CD142表达分为两种细胞亚群(扩展数据图1A,B),即P2-1(Cd142-)和P2-2(Cd142+)(图1B)。新定义的P3细胞亚群代表先前确定的Areg/Group 3细胞亚群,它特异性表达CD142、Clec11a和Fmo2(图1B),这点使得它们与P2-2亚群分开。此外,增殖中的P4亚群高表达细胞周期相关基因(扩展数据图1C)。
为了确定这些细胞之间的关系,研究人员接下来通过两种工具Velocyto和scVELO对RNA剪接事件进行动态建模来预测这些细胞亚群的细胞轨迹(图1C)。结果表明,P1细胞可以分化成P3细胞,并进一步过渡到P2-1或P2-2细胞。用Monocle(图1D和扩展数据图1D)进行另一种细胞轨迹分析推断,一部分P1细胞可以通过第一个分支点转变为增殖的P4细胞簇,或者通过第二个分支点转变为P2-1细胞簇。而另外一部分P1细胞亚群则通过第三分支点形成P2-1、P2-2或P3细胞簇(图1D)。这些数据与上一篇文章的结果一致,表明P1细胞亚群代表着一组早期的APCs,而P2细胞簇代表已定型的APCs(扩展数据图1A,B)。
鉴于新发现的CD142+APCs可分离成P3和P2-2细胞,研究人员认为他们和Merrick等人的结论差异可能是因为这两个细胞亚群在Merrick等人的研究中被混淆了。为了解决这个问题,研究人员比对了他们和来自Merrick等人的小鼠数据集的数据,并使用典型相关分析(canonical correlation analysis)与研究人员自己的数据进行对比(扩展数据图1E),并根据对比结果进行聚类分析。结果研究人员观察到了两个截然不同的Cd142+细胞簇(cluster 0 and 2)(扩展数据图1F,G)。与新定义的P3细胞亚群类似,cluster 2表达CD142、Clec11a和Fmo2;而cluster 0则类似于P2-2,它表达CD142、Icam1和Vap1(扩展数据图1F,G)。
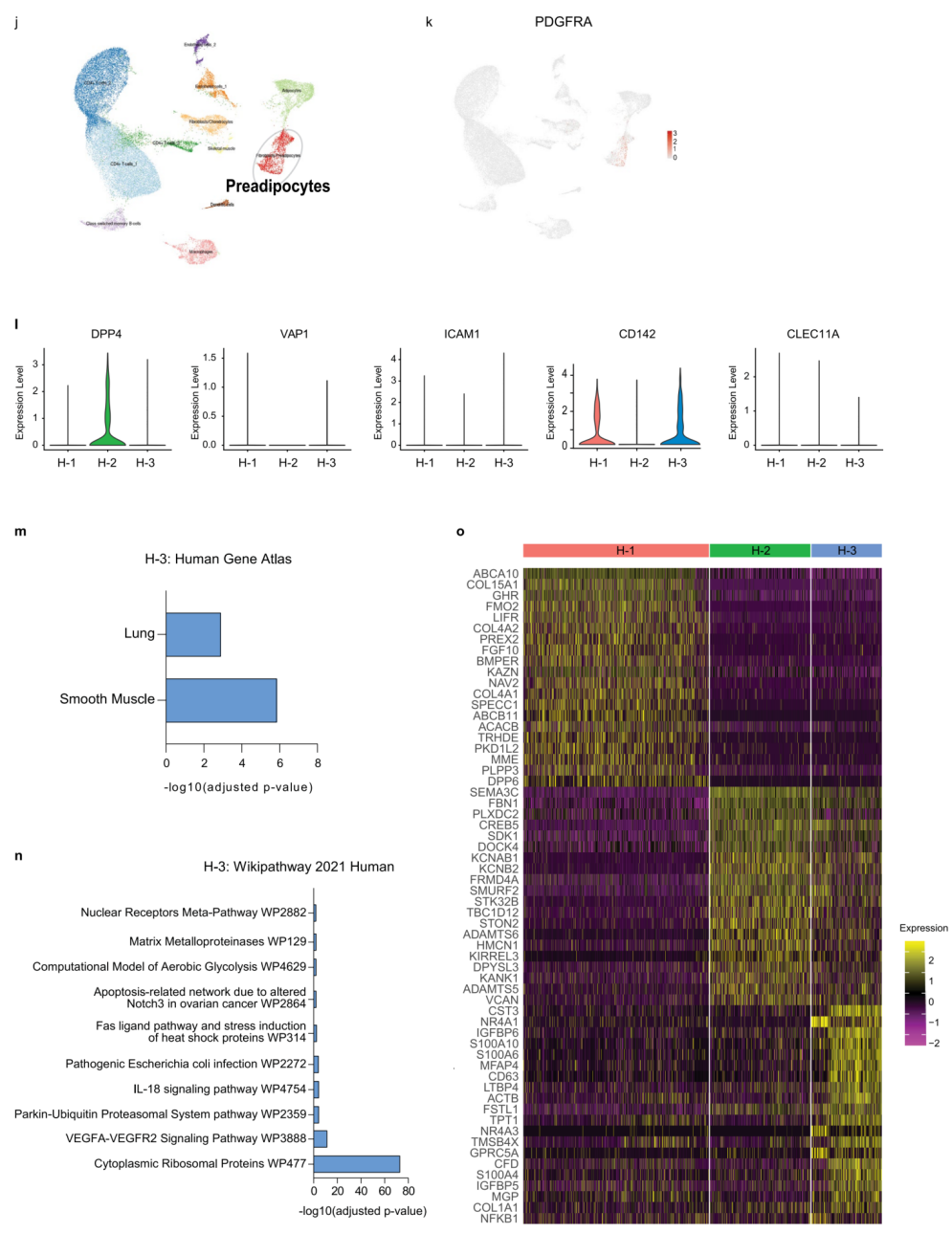
因为人们对早期或晚期APCs的存在知之甚少,于是研究人员想将分析扩展到人类。研究人员解析了人类颈部皮下脂肪组织(SAT)中脂肪细胞的异质性,从而定义12个亚群(扩展数据图1J)。以标记PDGFRA(扩展数据图1K)为特征的APCs亚群可以进一步细分为三个亚群,称为H1-H3(图1E)。然而,作者发现小鼠P3标志性基因(图1F)和CD142的表达(扩展数据图1L)在H1和H3细胞亚群中富集,因此H1或H3细胞在功能上很有可能类似于小鼠的P3细胞。H1亚群中的Pparγ富集分析表明这些细胞可能构成人SAT中的已定型的APCs(图1G),而对H3标志性基因的富集分析表明,这个细胞亚群是一个平滑肌细胞样亚群(扩展数据图1M),它具有丰富的调节通路,例如VEGFA-VEGFR2信号通路或基质金属蛋白酶信号通路。该亚群可能与脂肪组织微环境的调节(扩展数据图1N)和脂肪生成调控基因的表达调控有关。以上数据表明H3可能构成了人类SAT中的一种调节细胞类型,然而,还需要更多的研究来描述H3细胞的功能。
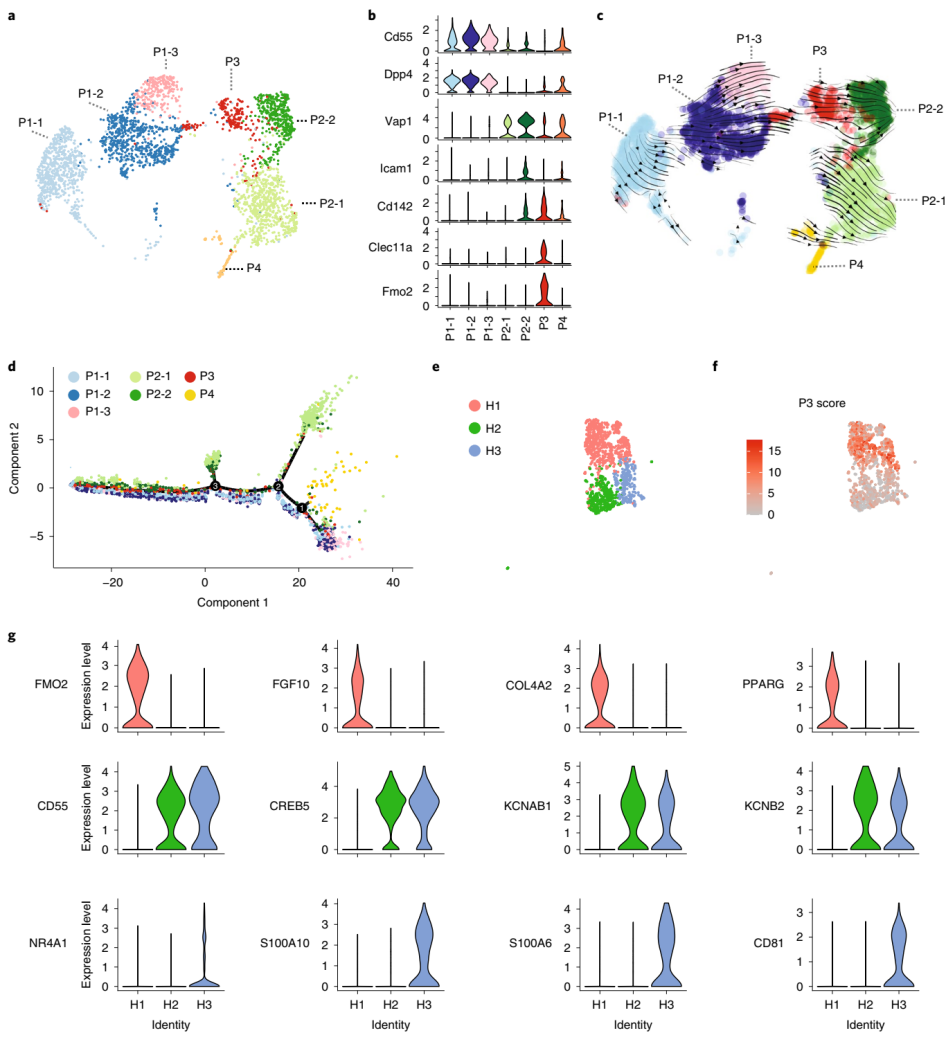
图1 进一步整合不同的scRNA-seq数据来揭示脂肪前体细胞的异质性
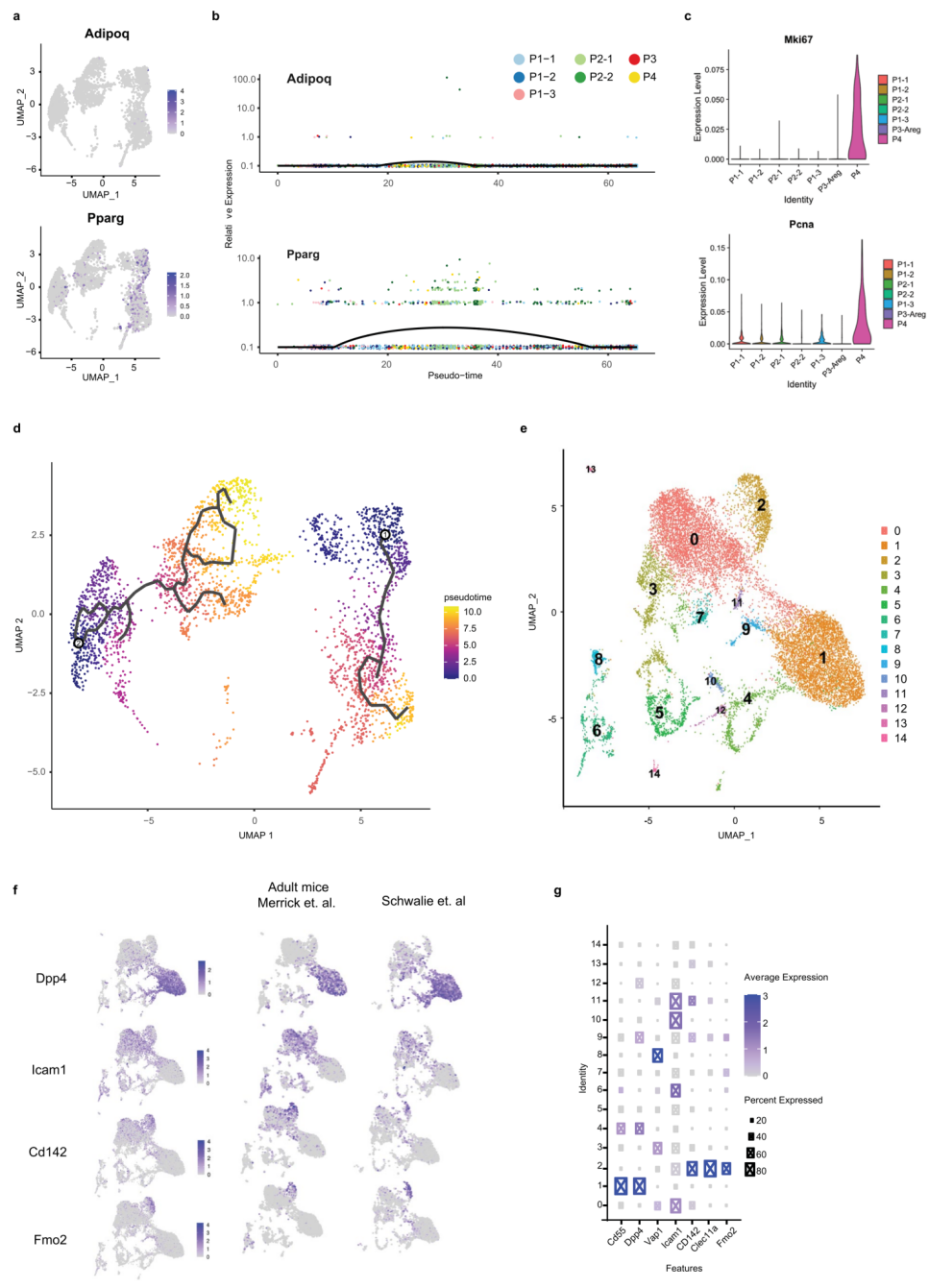
扩展数据图S1 整合来自小鼠iWAT的Lin-组分的scRNA-seq数据,并通过单核细胞测序解析人类脂肪组织中脂肪前体细胞的异质性
拓展阅读
单细胞测序技术平台
单细胞转录组测序技术主要包括以下四个步骤:单细胞的捕获/分选、反转录/PCR扩增、建库测序和生物信息分析。其中最重要的一点就是如何进行单细胞的捕获/分选,这是决定单细胞检测成本和通量的关键步骤。在细胞分选的方法里,主要包括特异性分选和非特异性分选两类方法。早期出现的技术都属于特异性分选技术,通常就是基于荧光分子标记或细胞形态筛选到目标细胞,然后对目标细胞开展扩增和测序,如FACS。然而这类方法存在着效率低、标记依赖性强、成本高等局限性。因此,随着技术发展,非特异性分选平台便出现在人们视野中,包括微流控技术和微液滴技术。首先,微流控代表性的技术是Fluidigm公司的微流控芯片Fluidigm C1。然而该芯片一次只能检测96个细胞,因此需要一个更高通量的技术。
10X Genomics单细胞转录组测序是使用液滴作为隔离单细胞的载体,该平台一次可以捕捉100-80000个细胞,具有极高的细胞通量。此外,其测序通量平均也在50000 reads/per cell 左右,而如果使用细胞核进行测序则平均通量为25000 reads/per nuclei。该技术的出现极大地促进了解析组织异质性的相关研究。
2.深入分析小鼠脂肪组织中不同细胞亚群的功能
为了探究小鼠脂肪组织中不同细胞亚群的成脂能力,研究人员利用流式细胞术(FACS)分选出各个细胞亚群,从而进行下一步实验。当利用CD142作为标志物来分选P3细胞时,同时会收集到表达CD142的P2-2成脂细胞,这也解释了作者为何与Merrick等人有着不同的结论。在上一篇工作中,研究人员观察到在Lin-Sca1+(富含APCs)细胞组分中存在着CD142+的细胞亚群,即Lin-Sca1+CD142+(扩展数据图2A)。本文与之不同的是,作者新分离出一种细胞亚群,即Lin-Sca1+CD142++(在第一部分中,作者是利用10X Genomics测序平台将他们上一篇工作中的P2亚群根据是否表达CD142而进一步分成了P2-1和P2-2,二者都能分化。在这一部分中,作者为了验证他们定义的细胞亚群的功能,通过FACS技术将Lin-Sca1+分成三部分:1、不表达CD142的组分CD142-,也就是P1-1/2/3和P2-1;2、低表达CD142的组分Lin-Sca1+CD142++,在上一篇工作中这个组分就是Areg,在本篇工作中,这个组分是P2-2,两篇文章中虽然用的名称一样,但不是同一群细胞;3、高表达CD142的组分CD142+,也就是这篇文章中的P3),并且它表达的P3特征基因水平更高(扩展数据图2B),因此它也与P3细胞亚群更相似。此外,在Lin-Sca1+CD142+组分中混合了大量的P1和P2细胞,而在Lin-Sca1+CD142++组分中其他细胞较少(扩展数据图2C),并且其P1和P2标记基因的表达结果也证实Lin-Sca1+CD142++组分的不同(扩展数据图2D,E)。于是,研究人员接下来检测了以下细胞亚群在不同脂肪细胞分化液诱导下的成脂能力:Lin-Sca1+细胞、Lin-Sca1+CD142-VAP1+细胞(P2-1)、Lin-Sca1+CD142+细胞(P2-2)和Lin-Sca1+CD142++细胞(P3)。研究人员观察到,在脂肪诱导分化液作用下,Lin-Sca1+CD142++细胞类似于先前描述的Areg亚群,并不能诱导分化为成熟脂肪细胞,而Lin-Sca1+CD142+细胞可以通过诱导而形成脂肪细胞 (扩展数据图2F,G)。
为了更可靠地分离P3细胞,并进一步探究上文定义的细胞亚群的功能(图1A和扩展数据图1E),研究人员构建了一种新的FACS策略来分离不同的细胞亚群。如图2A所示,用Lin-Sca1+CD55+VAP1-CD142-门控策略(gating strategy)分离了由P1-1到P1-3细胞组成的P1细胞组分(eP1)。将VAP1+细胞进一步分离为P2-1(也定义为eP2 ,Lin-Sca1+CD55-VAP1+CD142-)和P2-2(Lin-Sca1+CD55-VAP1+CD142+)细胞。并且P3细胞组分(eP3)则采用Lin-Sca1+CD55-VAP1-CD142+门控策略来分离。在诱导分化后,eP1、eP2和VAP1+CD142+(P2-2)细胞具有成脂分化能力。然而从Lin-Sca1+VAP1-CD55-细胞中去除eP3细胞后,显示脂肪生成能力显著提高,这表明eP3细胞对脂肪生成有着抑制作用(图2B,C)。此外,基因表达分析显示P3特异性基因在eP3亚群中表达丰富(图2D)。总之,研究人员利用FACS分离出的eP1、eP2、P2-2和eP3细胞能与10X scRNA-seq方法鉴定出的P1、P2-1、P2-2和P3细胞一一对应(图1A)。此外,与eP2细胞相比,无论给eP1细胞提供何种脂肪诱导分化液,它都表现出较低或相似的分化能力(图2E-G)。因此,表达低水平Pparg的eP1细胞(扩展数据图1A,B)处于脂肪形成的早期阶段,并不直接形成成熟的脂肪细胞。
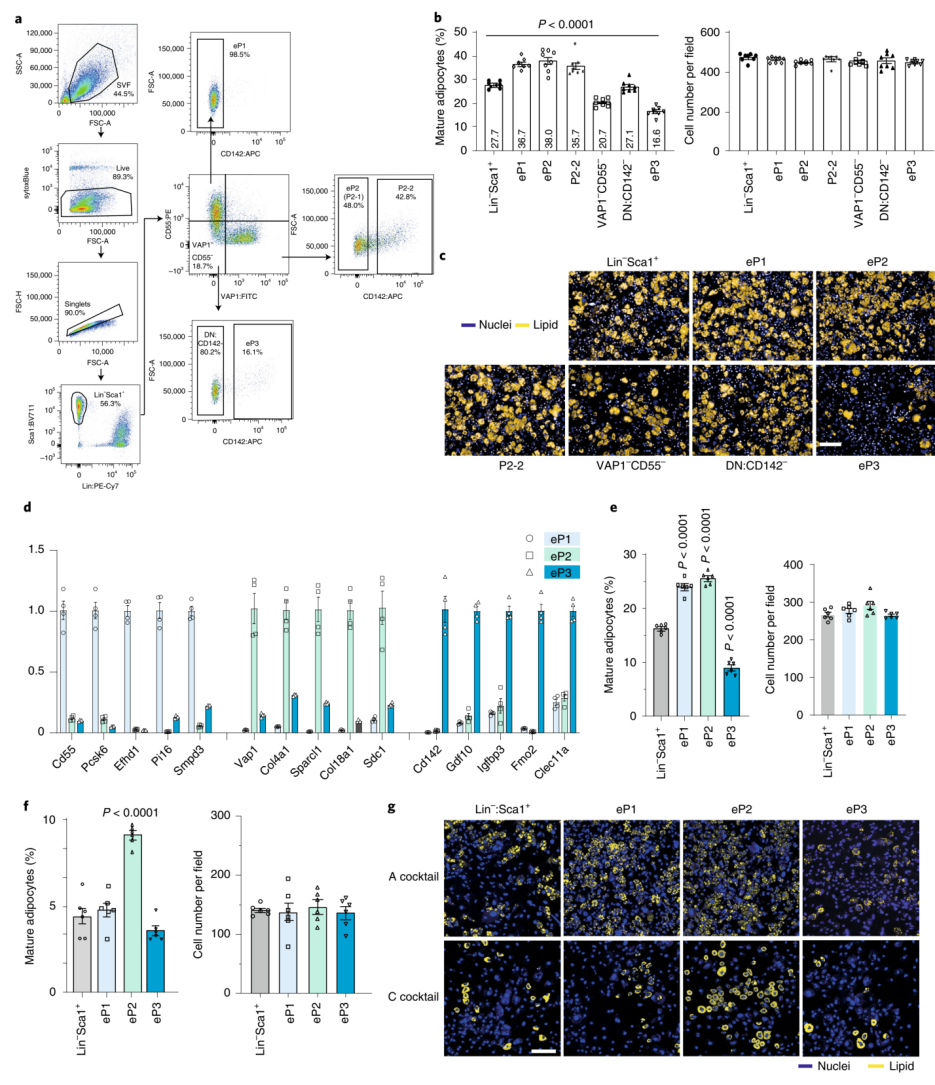
图2 脂肪组织中不同细胞亚群的分类
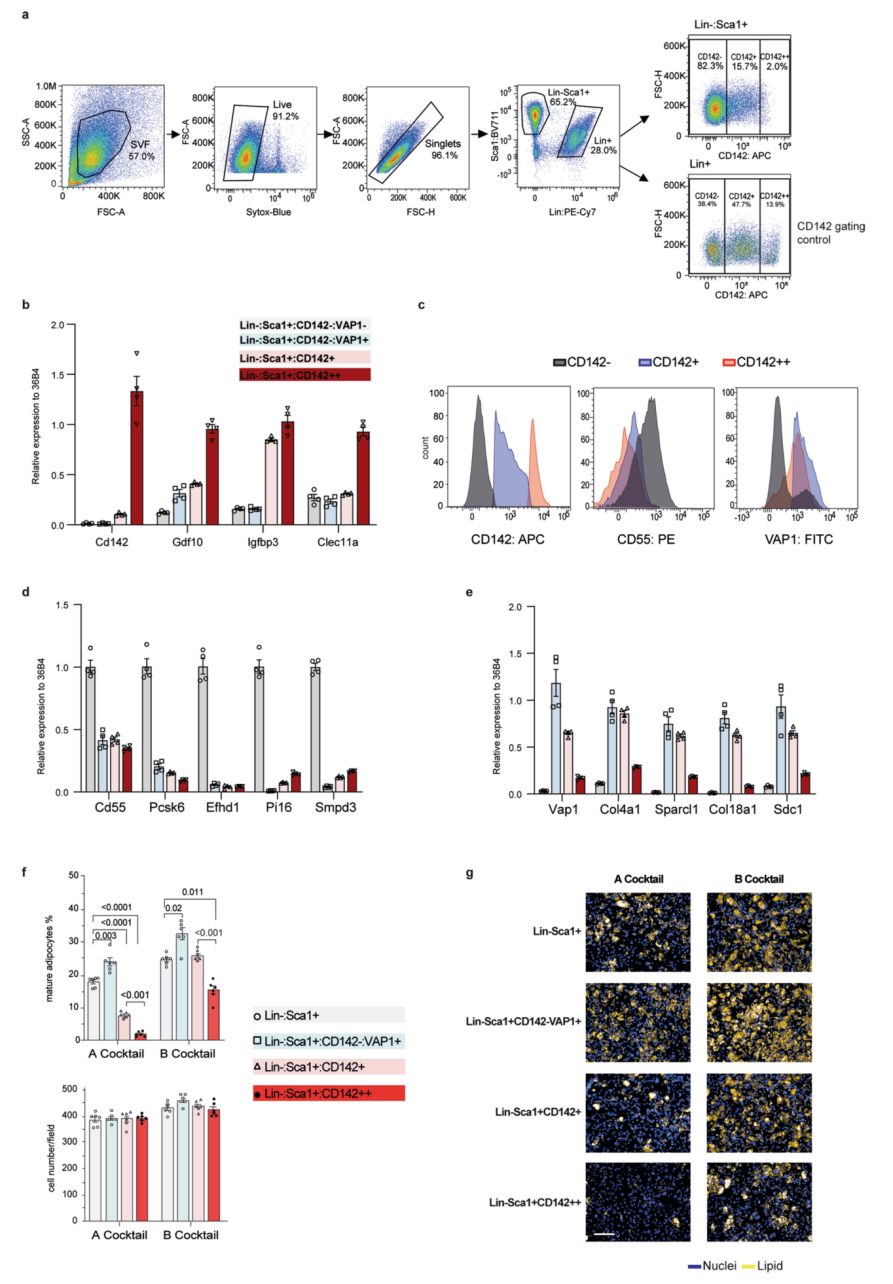
扩展数据图S2 Aregs的分类和分化能力测定
拓展阅读
不同文献中的脂肪单细胞测序结果比较
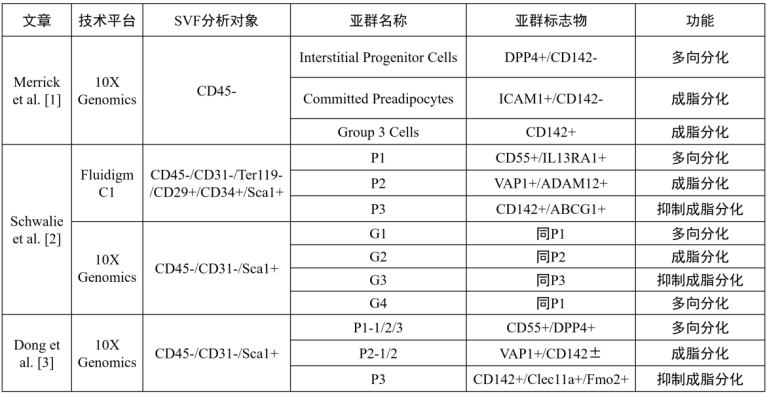
3. Rspo2是P3细胞亚群的新标志物
在上一篇工作中,该研究团队发现Areg/P3细胞通过旁分泌Spink2和Rtp3来调节脂肪生成。为了更详细地描述P3细胞的功能,研究人员比较了之前工作中有关Areg细胞的RNA-seq数据,发现在216个调控基因中,有56个编码分泌蛋白的基因富集在Areg/P3细胞(扩展数据图3A)。排除在成熟脂肪细胞或其他细胞亚群中表达的基因后,可选择的基因减少到41个。紧接着,作者筛选出在eP1和eP2细胞中表达的因子,最终剩下13个候选基因(扩展数据图3B),它们仅在eP3细胞中富集(图3A和扩展数据图3C)。
为了检测13个候选基因的功能相关性,研究人员首先在ingWAT SVF中使用siRNA来降低这些基因的表达水平。结果显示,在Rspo2(图3B-D)、Cpb1、Lgi1、Nog、S100a9、Cgref1或Serpinb6c(扩展数据图3D)敲减后,SVF的成脂作用增强。接下来,为了测试哪些基因以旁分泌的方式调节P3细胞的抑制成脂能力,研究人员在Transwell中共培养eP3细胞和Lin-Sca1+CD142-APCs (图3E)。结果显示,在eP3细胞中敲减Rspo2(图3F-H)、Cgref1或Serpinb6c等基因(扩展数据图3e)后,CD142- APC的成脂作用显著增强。因此,P3细胞可能旁分泌潜在的效应因子Rspo2、Cgref1、Serbinb6c或Spink2来调节脂肪的形成。
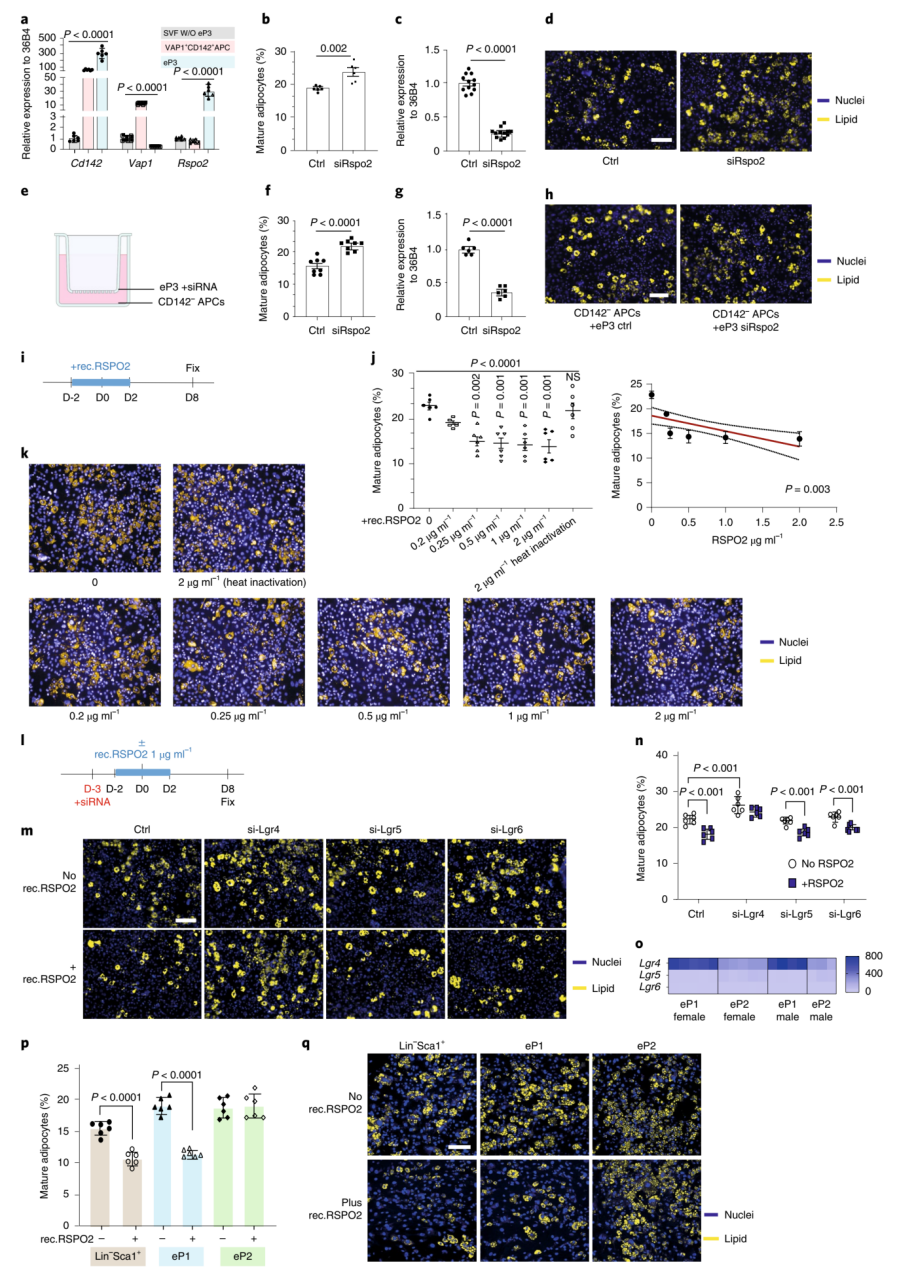
图3 Rspo2是P3细胞亚群的新标志物
4.重组RSPO2蛋白通过Lgr4抑制SVF原代细胞的成脂作用
为了检测RSPO2是否在体外抑制脂肪生成,研究人员在给SVF处理分化试剂前2天(D-2)到处理后2天(D2)的过程中加入重组RSPO2(rec.RSPO2)。结果观察到RSPO2含量越高,成熟脂肪细胞数量就越少(图3J,K),并且不同剂量对细胞总数没有影响(扩展数据图3I)。然而当rec.RSPO2被加热灭活时,它对脂肪形成的抑制作用就消失了(图3J)。在富含亮氨酸重复序列的G蛋白偶联受体4-6(LGR4-6)的三种RSPO2受体中,研究人员发现只有Lgr4在Lin-细胞中高表达(扩展数据图3J)。Lgr4敲除则会诱导SVF中更多脂肪细胞的形成,而Lgr5或Lgr6的敲除并不改变脂肪的生成情况(图3M,N)。此外,当Lgr4的表达被抑制时,rec.RSPO2则不能发挥抑制SVF的成脂作用(图3M,N)。
Rspo2是Wnt信号通路的增强子,在脂肪细胞定型的调节中起关键作用。由于单细胞轨迹分析(图1C,D)表明P1细胞会定向P2细胞转变,研究人员接下来的目标是确定调节这种转变的机制。通过对eP1和eP2细胞的差异表达基因的分析,作者发现eP1细胞中富集Wnt信号通路基因(扩展数据图3K,L),eP2细胞中富集脂肪生成基因(扩展数据图3M,N)。值得注意的是,与P2细胞相比,Rspo2受体Lgr4在P1细胞中富集(图3O和扩展数据图3J),这表明P1细胞是RSPO2的靶标,而不是P2细胞。根据研究人员的假设,当在脂肪形成过程中给eP1和eP2细胞处理rec.RSPO2时(图3I),仅仅只有eP1细胞被抑制形成成熟脂肪细胞,而eP2细胞还是能正常分化(图3P-Q)。相比于eP2细胞,eP1细胞处于脂肪形成的早期阶段,研究人员推测RSPO2可能影响脂肪细胞的定型,进一步影响晚期脂肪细胞的形成,这一点得到以下实验证实:当在细胞分化的第3天到第6天(晚期)处理rec.RSPO2时,脂肪生成没有明显变化(扩展数据图3R-S)。
同时,作者还发现随着rec.RSPO2的处理时间越长,SVF内β-连环蛋白水平也逐渐升高,表明rec.RSPO2上调Wnt信号呈现一种时间依赖性(扩展数据图3T-W)。除此之外,给eP1细胞同样处理rec.RSPO2 24小时后,细胞内Wnt信号也被显著激活(扩展数据图3X,Y),并在用siRNA敲减Lgr4后该激活效果被抑制(扩展数据图3X-Z)。总之,RSPO2在脂肪形成过程中抑制了P1向P2的转化,该过程可能是通过调节Lgr4介导的Wnt/β-连环蛋白信号通路来实现的。


拓展阅读
RSPO-LGR及下游信号通路的功能
R-spondin(Rspo)又称R-脊椎蛋白,是近年来新发现的分泌蛋白家族,包括4个成员(Rspo1~4)。Rspo蛋白家族所有成员均为分泌性蛋白,均有两个富含半胱氨酸的furin-like结构域、1个TSP1结构域和富含碱性氨基酸的C端区域。LGR4 (Leucine-rich repeat-containing G protein-coupled receptor 4,又称为GPR48)是G蛋白偶联受体(G-protein-coupled receptor s,GPCRs)家族成员,是具有7个跨膜蛋白和17个富含亮氨酸重复序列的大分子蛋白。LGR4是Rspo的受体,两者结合可激活Wnt/β-catenin信号通路,参与对细胞增殖和分化的调控,从而影响骨骼、肌肉、脂肪等组织的发育以及性腺的形成,并在多种疾病的发生过程中起重要作用。
研究表明,LGR4的敲除,可诱使白色脂肪向棕色脂肪转换,而其突变可抵抗饮食和瘦素突变诱导的小鼠肥胖并增强机体葡萄糖代谢。人脂肪间充质干细胞(hASCs)是骨组织工程理想的种子细胞之一,在骨组织工程再生治疗中具有重要价值。快速而高效启动hASCs成骨分化是以hASCs为基础的骨组织工程再生技术的关键。有研究人员发现RSPO3-LGR4通过调控 ERK/FGF信号通路进而调控hASCs成骨分化作用,这一发现为hASCs成骨分化调控。
此外有研究人员利用Rspo1/3和Lgr4敲除小鼠研究Rspo1/3-LGR4对肝脏胆固醇合成的影响,AMPKα激动剂、拮抗剂和shRNA用于探索Rspos-LGR4信号传导的下游靶点。Rspo1和Rspo3逆转OA诱导的胆固醇合成,伴随AMPKα Thr172磷酸化增加,SREBP2核转位减少,Srebf2 mRNA表达减少。在体外和体内,肝脏LGR4敲除增加肝脏胆固醇合成,降低AMPKα磷酸化。该研究表明,肝细胞中的Rspo1/Rspo3-LGR4信号通过AMPKα-SREBP2途径抑制胆固醇合成。
[1] 张敏等.全国口腔生物医学年会论文汇编.2016:311-312.
[2] Wang J, et al. Nat Cell Biol. 2013;15(12):1455-1463.
[3] Liu FA. et al. SEB J. 2020 Nov;34(11):14946-14959.
接下来为了探究RSPO2在体内的功能,研究人员首先构建了一个腺相关病毒(AAV),将鸡的β-肌动蛋白启动子(CAG)与RSPO2连接,同时使用pAAV-CAG-GFP作为对照组。其次,将来自ingWAT的eP1或eP2细胞注入含有pAAV-CAG-Rspo2或pAAV-CAG-GFP的基质胶,并将混合体系移植到小鼠皮下(图4A)。此外,由于AAV介导的表达需要至少5天,因此作者还将rec.RSPO2添加到基质胶中,以确保细胞在脂肪形成的初期也能被处理到RSPO2。随后,给移植后小鼠喂养4周的高脂饮食(HFD)来诱导脂肪垫的形成。结果显示,在实验组中,Rspo2 mRNA水平显著增加(图4B),并且eP1细胞的成脂作用也降低了(图4C-D和扩展数据图4A)。然而,RSPO2并不抑制小鼠eP2细胞的脂肪生成作用(图4E,F和扩展数据图4B)。
为了研究肥胖状态下ingWAT的脂肪生成,研究人员给6周龄的AdipoCre-NucRed小鼠尾静脉注射pAAV-CAG-GFP或pAAV-CAG-Rspo2,随后将小鼠分为两组。一组喂养12周的普通饮食,另一组普通饮食喂养2周后给与10周的HFD饮食喂养(图4G)。在AdipoqCre-NucRed转基因小鼠中,脂肪组织可以表达红色荧光蛋白tdTomato,因此可以利用qPCR来量化脂肪细胞数量(扩展数据图4C-D)。结果表明,在AAV感染12周后,肝脏和ingWAT中RSPO2水平较高(图4H,I)。在HFD喂养10周后,过表达RSPO2组的小鼠脂肪细胞数量减少(图4J),而给小鼠喂养普通饲料,就算其体内过表达RSPO2,小鼠ingWAT中脂肪细胞的数量也不会改变。此外,在内脏白色组织(visWAT)中,在两种饮食条件下RSPO2过表达的小鼠都被检测到脂肪细胞数量减少(图4K)。上述结果表明肥胖状态下,RSPO2也能抑制脂肪形成。
虽然尾静脉介导的AAV能提高RSPO2在WAT中的表达,然而在肝脏、体循环和其他的组织器官中仍可能存在高水平的RSPO2。因此,作者为了仅在ingWAT内实现RSPO2的过表达,于是将AAV直接注射到ingWAT(图4L),从而使ingWAT的RSPO2蛋白水平增加两倍(图4M,N),而血浆和肝脏中RSPO2的水平无明显变化(扩展数据图4E-4F)。与上面的结果一致,在ingWAT中,HFD诱导的脂肪细胞的形成减少(图4O)。
为了排除Rspo2增加会导致脂肪细胞凋亡的干扰因素,作者对凋亡标记物caspase-3进行了染色。然而并没有观察到两组小鼠之间的脂肪细胞凋亡有任何显著差异(扩展数据图4G)。总而言之,Rspo2能够抑制肥胖中HFD诱导的脂肪细胞的形成。

图4 Rspo2在体内抑制eP1细胞的脂肪生成
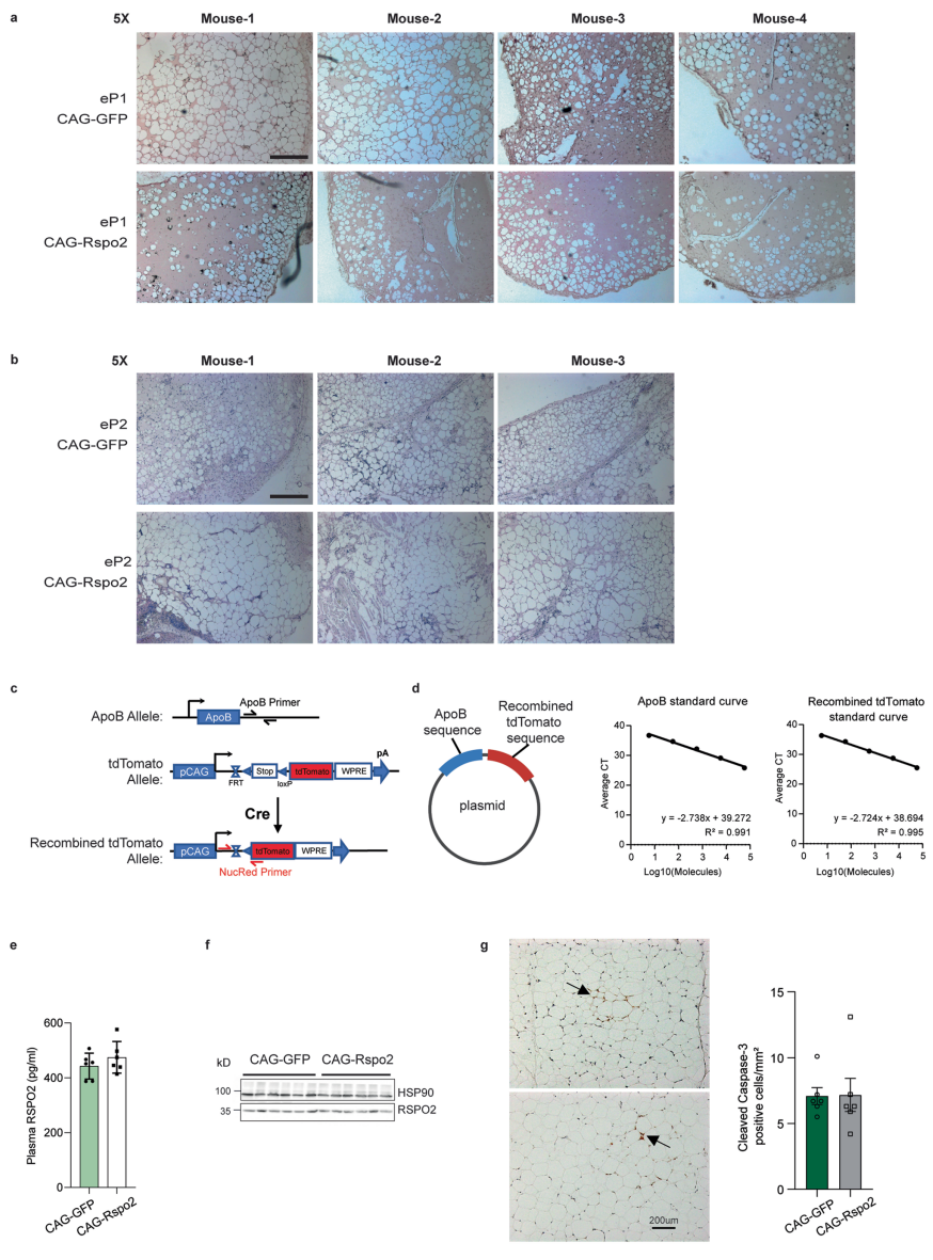
扩展数据图S4 Rspo2在体内抑制eP1细胞的脂肪生成
前面提到,P1细胞可以转变成P2细胞。为了建立一个P1到P2细胞的体内转化模型,研究人员从ROSAmT/mG小鼠中分离出tdTomato+eP1细胞,并将它们移植到WT小鼠的ingWAT中(图5A)。移植10天后,FACS证明大约23%的植入eP1细胞已经转变为eP2细胞(图5B),并且来源于eP1细胞的VAP1+P2细胞失去了P1标志物,如CD55、Dpp4、Pi16和Pcsk6(图5C),而且获得了P2标志物(VAP1、Icam1、Col4a1和Sparcl1)以及定型的APCs标志物如Pparγ和Cebpα(图5E)。然而,来自eP1细胞的VAP1+和VAP1-细胞都不表达P3标志物(图5F)。以上结果都提示这个体内转换模型可以作为探究体内P1细胞到P2转变的工具。
为了进一步研究RSPO2是否参与上述细胞转变过程,研究人员给小鼠ingWAT的两侧分别感染AAV-Rspo2/GFP(图5G)。6周后,RSPO2组的蛋白水平是GFP组的两倍(图5H-I),而mRNA水平提高约100倍(图5J)。FACS分析显示,尽管CD55+VAP1+细胞数量没有差异(图5M),但在RSPO2过表达的ingWAT中,eP1细胞数量增加(图5K),eP2细胞数量减少(图5L),因此表明Rspo2抑制了eP1到eP2的转换。由于在体外利用rec.RSPO2处理eP1或SVF细胞时,它们的细胞数量没有变化(扩展数据图3I,S),研究人员推测eP1细胞的增加可能不是由于增殖导致的。接下来,研究人员将ROSAmT/mG小鼠的eP1细胞移植到已感染AAV-RSPO2的ingWAT中(图5N)。移植10天后,对tdTomato+细胞进行FACS分析。结果显示,在GFP组中,大约45%的eP1细胞获得了P2标志物(Vap1),表明它们已经转换到P2细胞,而在过表达RSPO2组的ingWAT中,只有30%的eP1细胞获得了P2标志物(图5O)。综上所述,脂肪组织SVF内不同亚群是通过旁分泌RSPO2介导的Wnt信号通路来调控早期脂肪干细胞到定型的脂肪前体细胞的转换过程,从而影响脂肪细胞的形成。
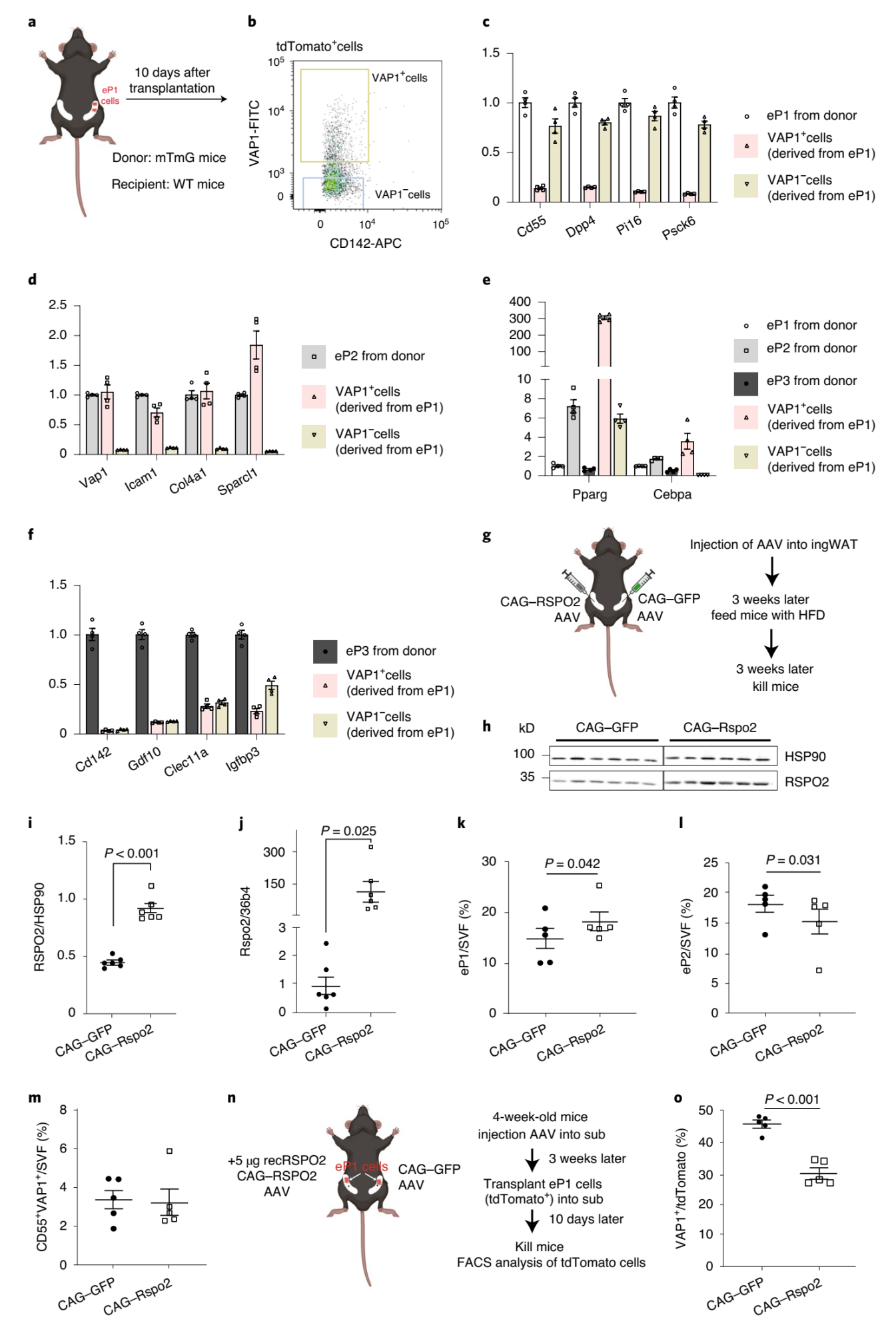
图5 Rspo2抑制eP1细胞向eP2细胞的转化
拓展阅读
mT/mG mice
mT/mG 小鼠品系在表达后定位于膜上的 tdTomato (mT) 盒两侧具有 loxP 位点,并在检测的所有组织和细胞类型中表达强红色荧光,尾部或全身荧光足以区分 mT/mG 小鼠和野生型小鼠。在与表达 Cre 重组酶的小鼠杂交时,获得的后代在表达 Cre 的组织中敲除了 mT 盒,允许表达位于下游的膜定位的 EGFP (mG) 盒。该双荧光系统允许重组和非重组细胞以单细胞分辨率来进行活体成像,为 Cre 诱导的嵌合突变体的表型分析提供内部对照,并为谱系追踪应用提供第二标记物。此外,荧光蛋白定位到膜结构反应了细胞形态的轮廓,并允许分辨精细的细胞过程。这些 mT/mG 小鼠可用作 Cre 报告基因品系,在广泛的细胞和组织类型中,Cre 介导的重组之前表达红色荧光,之后表达绿色荧光。
由于Rspo2抑制体内脂肪细胞的形成,研究人员接下来探究Rspo2是否影响肥胖状态下的脂肪组织扩张。因此,他们将pAAV-CAG-Rspo2尾静脉注射到8周龄DIO小鼠中(扩展数据图5A),结果导致肝脏(图6A,B)和血浆(图6C)中RSPO2蛋白水平提高5倍,ingWAT(图6D)和visWAT(图6E)则提高2倍。研究人员观察到感染pAAV-CAG-Rspo2的小鼠体重增加减少(图6F),同时ingWAT和visWAT(图6H和扩展数据图5B)的脂肪质量(图6G)减少,并且这种减少与食物摄入量(扩展数据图5C)或能量消耗(扩展数据图5D)无关。此外,RSPO2的过表达不仅减少了脂肪细胞的形成(图4J),而且还导致了脂肪细胞的肥大(图6I-K)。值得注意的是,尽管RSPO2过表达减少了体重增加,但在胰岛素耐量试验(ITT)中,过表达RSPO2的小鼠表现出更差的胰岛素敏感性(图6L,M),但空腹血糖(图6N)或肝脏葡萄糖分泌(扩展数据图5G,H)没有明显变化。除此之外,虽然空腹甘油三酯(TG)水平在pAAV-CAG-GFP与pAAV-CAG-Rspo2两组之间没有变化(图6O),但是在RSPO2过表达的小鼠肝脏中TG的积累较少(扩展数据图5E-F),并且这种积累减少与肝脏分泌无关(扩展数据图5I-J)。这些数据表明,由于RSPO2水平升高而导致的脂肪细胞肥大可能是代谢表型恶化的因素之一。
因此,研究人员接下来探究了在ingWAT内过表达RSPO2是否会损伤小鼠的胰岛素敏感性(扩展数据图5K)。结果显示,ingWAT中RSPO2蛋白水平明显升高(扩展数据图5L),然而并不影响体重(扩展数据图5N),但在不改变能量消耗(扩展数据图5P)的情况下,ingWAT组织重量略有下降(扩展数据图5O)。此外,在HFD喂养 7周后,在过表达RSPO2的ingWAT中观察到体积大的脂肪细胞的数量增加(图6P-Q)。然而,ingWAT脂肪细胞肥大并没有损害胰岛素敏感性(图6R)。综上所述,Rspo2循环水平的增加一方面会抑制新生脂肪细胞的形成,另一方面会促进脂肪组织的扩张,进而降低全身性胰岛素敏感性。
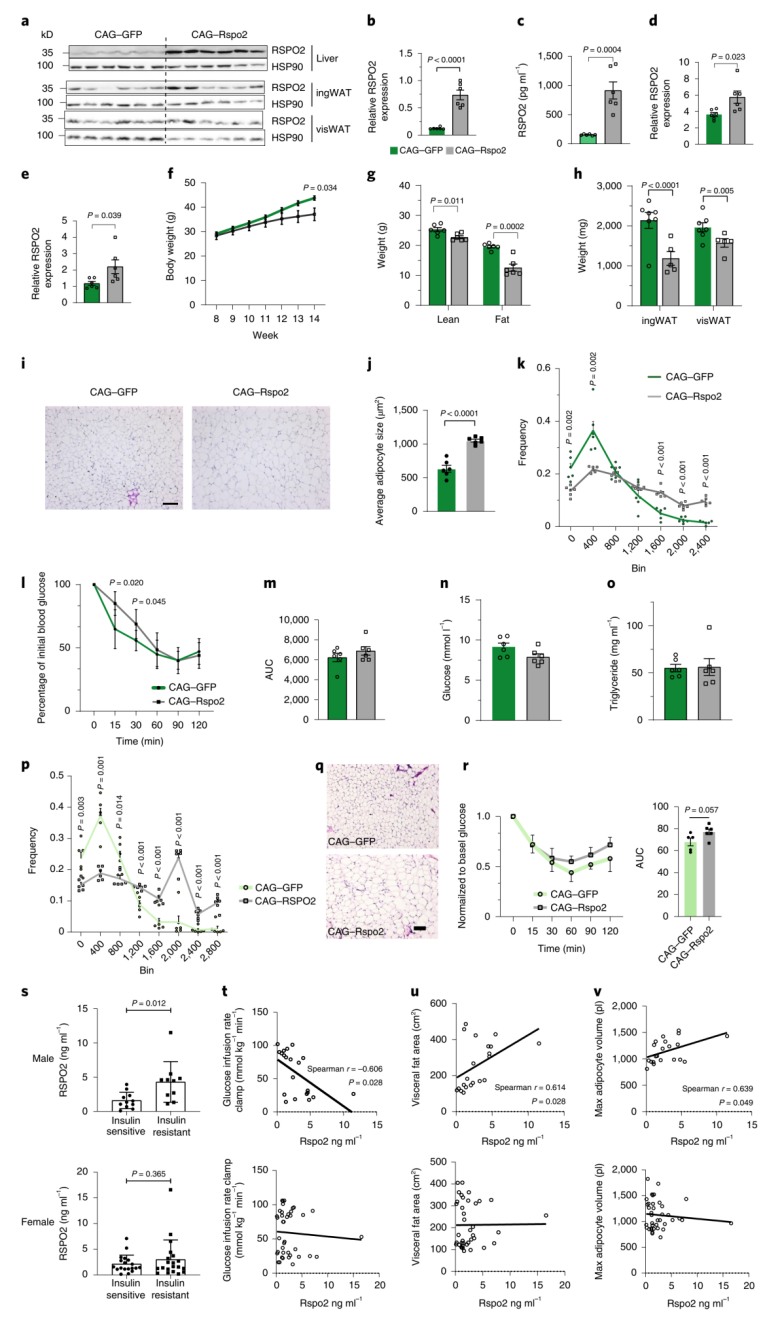
图6 体内循环的RSPO2导致异常的脂肪组织扩张和胰岛素抵抗
8
8.肥胖个体中血清RSPO2水平与胰岛素抵抗相关
由于肥胖小鼠循环中较高的RSPO2水平会导致全身性胰岛素抵抗,研究人员利用来自代谢健康和代谢损伤的肥胖个体的血清来研究二者的相关性。60名(BMI为45.6±5.6kg/m2)患者分为胰岛素敏感组(胰岛素抵抗指数为0.9±0.4)和胰岛素抵抗组(胰岛素抵抗指数为3.8±0.9)。在男性中,胰岛素抵抗组的RSPO2水平明显更高,并且女性中也存在同样的趋势(图6S)。与小鼠研究相似,仅有男性中的循环RSPO2水平与葡萄糖输注率(glucose infusion rate)呈负相关(图6T)。除此之外,研究人员注意到循环中的RSPO2水平与男性的内脏脂肪面积(图6U)和最大脂肪细胞体积(图6V)相关,但在女性中就没有此种相关性。
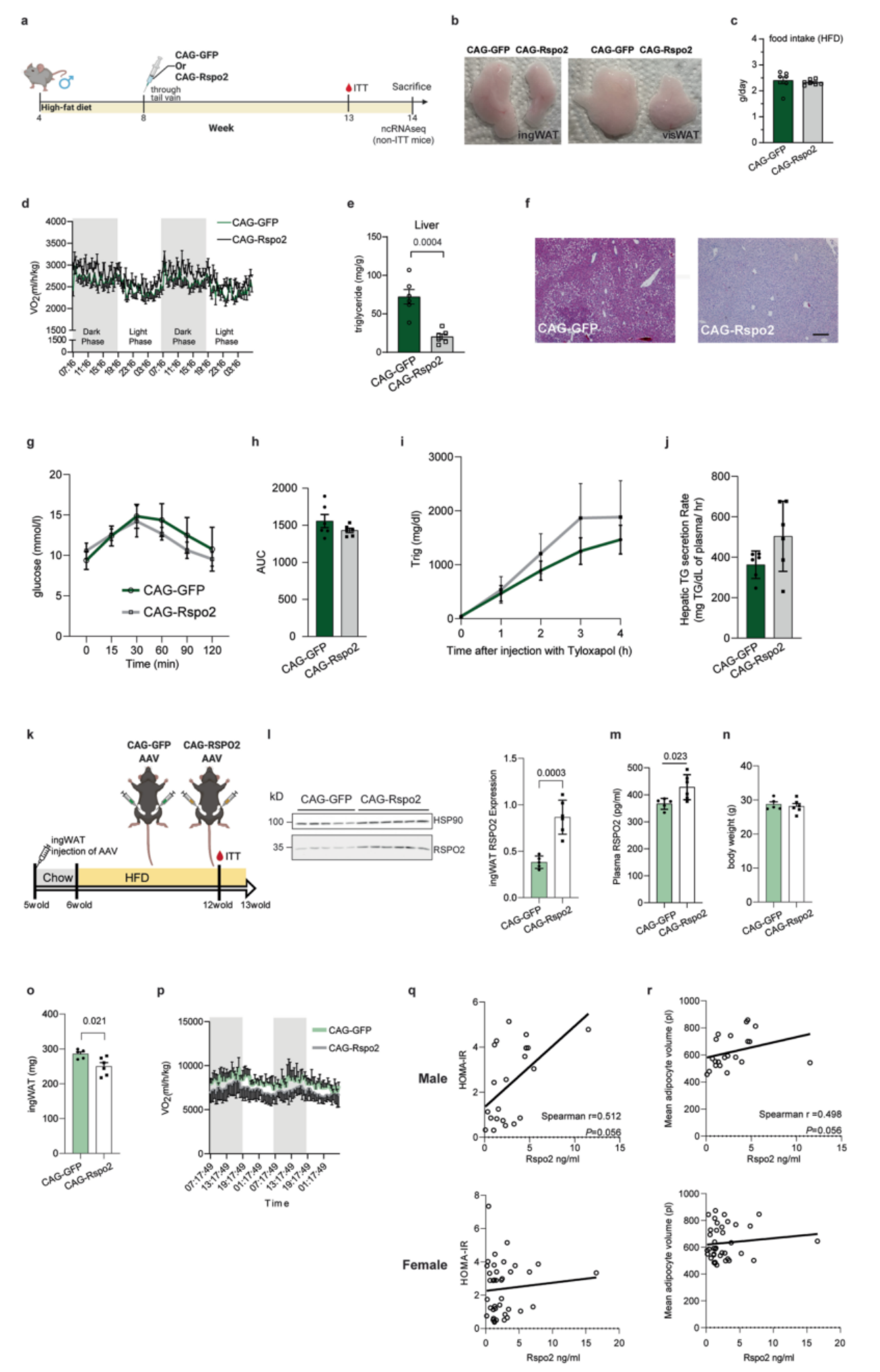
扩展数据图S5 在HFD条件下使小鼠过表达RSPO
9.单细胞核测序表明RSPO2在体内抑制脂肪细胞的形成
为了全面评估Rspo2对不同APC亚群的影响,研究人员对iWAT感染pAAV-CAG-GFP和pAAV-CAG-Rspo2后的细胞核进行10X snRNA-Seq。非监督聚类分析鉴定出7个细胞亚群(图7A),并且这些细胞亚群是根据已知的细胞标记基因(图7B)进行注释的。在所有细胞亚群中,脂肪细胞标记基因(adipoq、Lep、PLin1、Cidec和Dgat2)在成熟脂肪细胞亚群中高表达(图7B和扩展数据图6C),而脂肪前体细胞标志物(Ly6a和Pdgfra)在APC亚群中高表达(图7B)。10X SnRNA-seq分析显示,在pAAV-CAG-Rspo2感染的ingWAT中,脂肪细胞数量减少(图7C),这与前文的发现一致,并再一次证明RSPO2可以抑制脂肪细胞的形成。RSPO2除了减少脂肪细胞的数量外,还促进巨噬细胞的浸润(图7A,C),这可能与胰岛素抵抗有关。同时RSPO2的过表达也影响了许多已鉴定的细胞亚群的基因表达谱(图7D和扩展数据图6E-G)。
接下来,研究人员将3种脂肪前体细胞再一次分为5种亚群,并命名为PA-1至 PA-5(图7E)。PA-1代表非定型的APC(P1),表达P1标记基因(图7F和扩展数据图6H)、Sema3e、Pi16(扩展数据图6H)以及低水平的Pparγ(图7F)。PA-2代表P2-2亚群,尽管在PA-2细胞核中几乎检测不到P2-2标记物Vap1或Icam1,但与定型相关的APCs标记物Pparγ在PA-2细胞核中高表达(图7F)。类似于P2-2,研究人员观察到一些PA-2细胞核中表达P3标志物,如Fmo2和Cd142(图7F和扩展数据图6H)。此外,PA-3表达一些P3标志物基因,如Cd142、Fmo2和Meox2,因此它也可能代表着P3亚群(图7F和扩展数据图6H)。PA-4被定义为高表达细胞周期基因(Top2a和Mki67)的增殖细胞亚群(扩展数据图6K)。PA-5代表另一种表达Pparγ的定型APCs亚群(图7F和扩展数据图6J)。由于RSPO2 的过表达会导致Cttnb1的表达升高,所以RSPO2能显著激活Wnt信号传导(扩展数据图 6I),并导致脂肪干细胞(PA-1)增加,定型的脂肪前体细胞(PA-5)减少(图7G,H)。总而言之,Rspo2抑制肥胖状态下的脂肪细胞的形成,导致脂肪细胞肥大和巨噬细胞浸润,二者共同导致了小鼠胰岛素抵抗的形成。

图7 snRNA-seq表明Rspo2在体内降低脂肪细胞数量
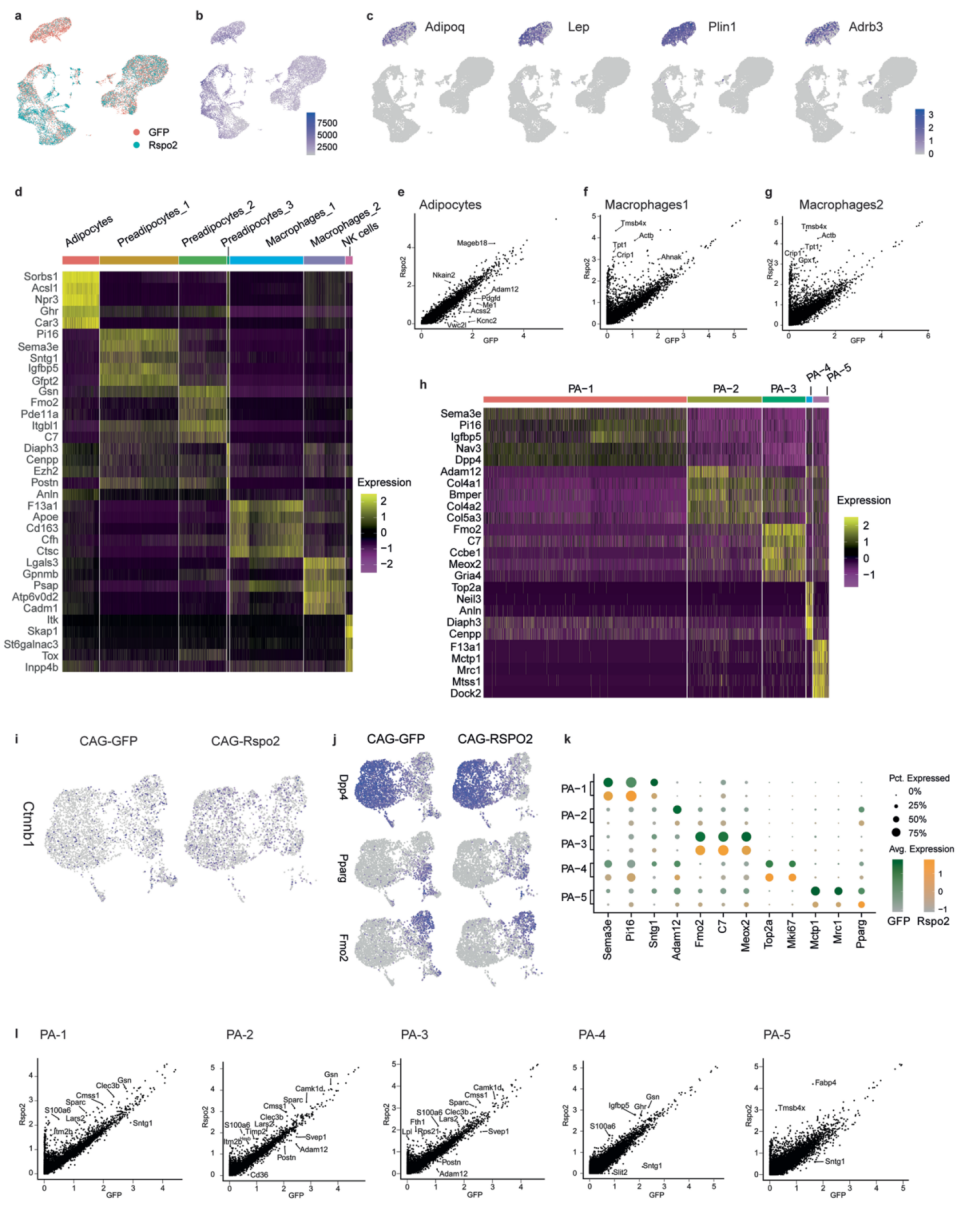
扩展数据图S6 小鼠ingWAT的snRNA-seq

扩展数据图S7 在成脂细胞亚群中其他标志物的表达
总结
健康的脂肪组织重塑依赖于脂肪细胞增殖和脂肪细胞肥大的平衡。脂肪生成已被证明可以促进健康的脂肪组织扩张,从而保护机体免受肥胖相关的胰岛素抵抗的影响。本文中,研究人员利用小鼠脂肪前体细胞的单细胞RNA测序数据集,定义了不同的脂肪前体细胞亚群的功能和细胞发育轨迹,并进一步阐明了脂肪生成过程的机制和细胞发育轨迹。研究人员发现RSPO2是脂肪生成的功能性调节因子,它由CD142+细胞亚群分泌,通过作用于LGR4受体抑制早期祖细胞的成熟。小鼠血液循环中RSPO2的增加导致脂肪组织肥大和胰岛素抵抗,而男性肥胖患者中的RSPO2水平增加与葡萄糖稳态受损相关。总而言之,这些发现鉴定了一种复杂的抑制脂肪生成并破坏脂肪组织稳态的细胞间交流机制。
原文链接:https://doi.org/10.1038/s42255-021-00509-1
注微信公众号代谢学人
了解更多前沿资讯

转载本文请联系原作者获取授权,同时请注明本文来自徐凌燕科学网博客。
链接地址:https://blog.sciencenet.cn/blog-3483272-1331888.html
https://blog.sciencenet.cn/blog-3483272-1335016.html
上一篇:代谢学人--Nature Cell Biology:铁死亡的导火索
下一篇:代谢学人--Cell Metabolism 4月刊代谢精选