博文
[转载]肌肉干细胞研究最新进展 2017-2021 第1-4期
|||
肌肉干细胞研究最新进展(第1期)
来源:本站原创 2017-08-30 20:47
2017年8月30日/生物谷BIOON/---肌肉干细胞可发育分化为成肌细胞(myoblasts),后者可互相融合成为多核的肌纤维,形成骨骼肌最基本的结构。人类胚胎和成人体内都存在肌肉干细胞。胚胎和胎儿的肌肉干细胞增殖使得肌肉组织发展;成年人体内的肌肉干细胞亦被称为卫星细胞,处于休眠状态,沿着肌肉纤维而分布。在经过强烈运动或是受到外界伤害之后,成人的肌肉干细胞会被激活并开始自我增殖,从而增加或是恢
2017年8月30日/生物谷BIOON/---肌肉干细胞可发育分化为成肌细胞(myoblasts),后者可互相融合成为多核的肌纤维,形成骨骼肌最基本的结构。
人类胚胎和成人体内都存在肌肉干细胞。胚胎和胎儿的肌肉干细胞增殖使得肌肉组织发展;成年人体内的肌肉干细胞亦被称为卫星细胞,处于休眠状态,沿着肌肉纤维而分布。在经过强烈运动或是受到外界伤害之后,成人的肌肉干细胞会被激活并开始自我增殖,从而增加或是恢复成人的肌肉组织。对于老年人,肌肉干细胞不再具有自我复制的活性,从而表现为肌肉组织的萎缩。
小编针对近年来肌肉干细胞研究取得的进展进行一番盘点,以飨读者。
1.Science:首次在体内实时观察肌肉干细胞再生受损组织初始步骤
doi:10.1126/science.aad9969

在一项新的研究中,来自澳大利亚莫纳什大学澳大利亚再生医学研究所(Australian Regenerative Medicine Institute, ARMI)的研究人员首次发现证据证实当遭受损伤时如何触发受损肌 肉再生或愈合。这一发现可能为改善老年人和患上肌肉萎缩症的病人的生活和甚至增强运动员肌肉恢复铺平道路。相关研究结果于2016年5月19日在线发表在Science期刊上,论文标题 为“Asymmetric division of clonal muscle stem cells coordinates muscle regeneration in vivo”。
在这项研究中,莫纳什大学ARMI主任Peter Currie教授和他的团队利用模式生物斑马鱼研究肌肉再生。
这种模式生物斑马鱼中,研究人员着重关注成体肌肉干细胞,它们与成熟的肌纤维靠得很近。当肌纤维受损时,它们产生突出部分来捕获肌肉干细胞,将它们拉回,从而再生受损的组织。 尽 管科学家们长期以来就已猜测这些干细胞在肌肉再生中发挥作用,但是它们是如何被激活和控制的仅在细胞样品中进行过充分研究,但未在模式动物体内开展过研究。如今,研究人员以斑马 鱼为研究对象在动物体内开展研究。
利用专门的显微镜,Currie教授和他的同事们能够实时地观察和拍摄活的肌肉组织再生,因而能够首次看到这些干细胞如何移动、作出表现和修复受损的组织。
2.PNAS:炎症意料之外的作用——促进肌肉干细胞再生
doi:10.1073/pnas.1705420114
炎症反应是一把双刃剑,它既能保护我们的身体免受病原体感染,又是诸多疾病的罪魁祸首。在日常生活中,我们提到炎症往往指的是它不利的一面。不过,近日来自斯坦福大学医学院的一项研究揭示了一种常见的炎症因子——PGE2(前列腺素E2)的一种保护作用。在肌肉损伤或剧烈运动后,PGE2能够激活负责修复损伤的肌肉干细胞,促进肌肉再生。利用PGE2处理受伤的实验小鼠,能够加速动物修复损伤和恢复肌肉力量的能力。但是,我们常用的非甾体类抗炎药,如阿司匹林或布洛芬,将会阻断PGE2的作用,显著抑制小鼠的肌肉修复,并导致力量的减弱。这项研究于6月12日发表于PNAS上。
研究人员下一步计划在实验室检测PGE2对人类肌肉干细胞的影响,并研究衰老在这一过程中所扮演的角色。因为PGE2是由胎儿和胎盘在怀孕期间产生的,并且已经被FDA批准用于引产,因此如果应用于临床会相对快捷。
3.JAHA:用肌肉干细胞补片治疗心力衰竭
doi:10.1161/JAHA.116.003918
一项最新研究对一种治疗心力衰竭的突破性方法进行了检测。研究人员利用患者自身的肌肉干细胞成功地修复了受损的心脏,取得了令人鼓舞的成果。
本周发表在《美国心脏协会杂志》上的一项最新研究,对肌肉干细胞在修复受损心脏中的应用进行了探讨。来自日本的研究人员之前已经在小鼠模型中展示了该项技术的潜在益处,所以,现在是进入人类试验研究的时候了。
研究小组一共选择了 27 名心衰患者,他们的运动能力有限却对其他治疗没有反应。其中缺血性心肌病 15 例,扩张型心肌病 12 例。I 期临床试验包括从患者自己的大腿肌肉上取下细胞补片(特别是股内侧肌)。然后,通过手术将这些所谓的自体体细胞衍生细胞补片粘在心脏左心室表面。
手术后,患者并没有发生明显的并发症,术后 1 年,患者的运动能力和心功能均出现明显改善。作者得出以下结论:“第一阶段的研究发现,细胞片移植作为治疗心肌病唯一疗法是可行。在这项研究中所看到的该项治疗方法的安全和功能恢复是极具前途的。该研究结果还应进行进一步的临床随访和更大规模的研究以确认自体骨骼干细胞片治疗重度充血性心脏衰竭的疗效如何。”
4.BMC Medicine 肥胖导致肌肉干细胞重编程
doi:10.1186/s12916-017-0792-x

肥胖与肌肉质量降低及代谢异常相关。根据一项来自瑞典德隆大学的新研究,影响新肌细胞形成的表观遗传学变化可能是诱因之一。 在这项新研究中,博士研究生Cajsa Davegårdh研究了肥胖及正常个体肌肉干细胞的DNA甲基化。DNA甲基化是一个表观遗传学过程,发生DNA甲基化时,甲基会结合到基因上并像调灯开关一样调节基因活性。通过比较健康个体不成熟及成熟肌肉干细胞的甲基化水平,Cajsa Davegårdh发现实际甲基化水平对肌肉干细胞的成熟过程有重要影响。
“非成熟肌肉干细胞在发育成成熟肌肉干细胞过程中,许多表达水平改变的基因的甲基化水平也发生了变化,这表明甲基化与基因表达相关。”她解释道。她发现一个叫做IL-32的炎前因子基因对成熟过程及胰岛素敏感性至关重要。胰岛素敏感性异常在肥胖患者体内很常见,是2型糖尿病的一个危险因素。“减弱该基因的表达可以增加肌肉胰岛素敏感性。”这些发现也在小鼠实验中得到了验证。
随后,Cajsa Davegårdh比较了体重正常及肥胖个体(BMI大于30)肌肉干细胞DNA甲基化水平的差别。她发现肥胖个体和正常个体肌肉干细胞成熟过程中调节的基因不同,且基因的甲基化水平改变程度也有着显著性差异。
5.Nat Commun:科学家发现调节肌肉干细胞命运关键因子
doi:10.1038/ncomms8140
近日,来自德国的科学家在国际学术期刊Nature Communications在线发表了一项最新研究进展,他们通过蛋白组学的方法对成年期骨骼肌干细胞进行了筛选,发现精氨酸甲基转移酶prmt5对于骨骼肌干细胞具有重要作用,并进行了深入研究。
在该项研究中,研究人员利用蛋白组学的方法对骨骼肌干细胞中的蛋白组进行了功能缺失筛选,发现了120个对骨骼肌干细胞功能发挥具有重要作用的基因,其中包括精氨酸甲基转移酶prmt5。在成年小鼠的骨骼肌干细胞中特异性抑制prmt5的活性能够阻止骨骼肌干细胞的扩张,消除骨骼肌干细胞的长期维持并削弱骨骼肌的再生。研究人员还发现在小鼠胚胎发育过程中,prmt5对于pax7阳性的肌源性祖细胞的增殖和分化并非不可或缺,这表明胚胎期和成年期肌肉生成过程存在显著差异。研究人员还从机制上进行了解释,他们证明prmt5是通过细胞周期抑制因子p21调节了成年期骨骼肌干细胞的增殖过程。
6.Dev Cell:肌肉干细胞促进肌肉生长和修复的机制
doi:10.1016/j.devcel.2012.07.014

肌肉能提供干细胞来促进肌肉的生长和受伤肌肉的再生,但肌肉干细胞必须驻留在特殊的部位才能有助肌肉的生长和修复。德尔柏林布吕克分子医学中心(MDC)发育生物学家Dominique Bröhl和Carmen Birchmeier教授已经阐明这些干细胞是如何定植于肌肉干细胞“巢穴”中的。
在本研究中,Bröhl博士和教授Birchmeier表明,小鼠的肌肉祖细胞缺乏Notch信号后,不能定植于干细胞“巢穴”。相反,肌肉祖细胞会定植于肌纤维之间的组织中。发育生物学家认为,这是肌肉弱化的原因。干细胞定植于错误的地方就不再像以前那样拥有多种生物学功能,难以有助于肌肉生长。
此外,Notch信号通路在肌肉的发育过程中具有第二大功能。它可以通过抑制肌肉发育促进因子MyoD防止干细胞分化成肌肉细胞,从而确保肌肉中总会存在能保存有修复和再生功能的干细胞“巢穴”。这项工作对肌肉再生和肌肉无力的研究具有重大意义。
7、8. 两篇Nature:法国科研人员发现肌肉干细胞胚胎起源 治帕金森病有望
doi:10.1038/nature03594; doi:10.1038/nature03572
法国国家科研中心和巴斯德研究院的两组科研人员,近日同时发现了肌肉干细胞的胚胎起源,这项研究成果将有助于人类更好地认识和了解肌肉组织的发展过程。6月16日出版的英国《自然》杂志分别刊登了这两组研究人员的研究报告。
人类胚胎和成人体内都存在肌肉干细胞。胚胎和胎儿的肌肉干细胞增殖使得肌肉组织发展;成年人体内的肌肉干细胞亦被称为卫星细胞,处于休眠状态,沿着肌肉纤维而分布。在经过强烈运动或是受到外界伤害之后,成人的肌肉干细胞会被激活并开始自我增殖,从而增加或是恢复成人的肌肉组织。对于老年人,肌肉干细胞不再具有自我复制的活性,从而表现为肌肉组织的萎缩。
法国国家科研中心马塞生物发展研究院的科研人员以雏鸡为对象,研究后发现,无论是胚胎或是成体,其肌肉干细胞都拥有一共同的胚胎起源———“体节”的胚胎结构。与此同时,巴斯德研究院以老鼠为研究对象的科研小组也发现,肌肉干细胞的出现取决于两种基因Pax3和Pax7的作用。一旦上述两种基因丧失活性,肌肉干细胞就会缺失,并导致所有的肌肉组织停止增长。
9.Science:法科学家肌肉干细胞研究取得进展
doi:10.1126/science.1114758
成年人肌肉干细胞具有快速生长为肌肉组织的神奇功能,然而提取自然状态下的这种细胞比较困难,因此,一直是医学界关注的课题。法国科学家日前在这一研究中取得进展,为肌肉损伤治疗开辟了新前景。
在成人体内,肌肉干细胞的数量非常少,很难提取出自然状态下的这种细胞,这大大地限制了肌肉干细胞治疗研究的发展。
法国巴斯德研究所遗传分子生长研究组的迪迪·埃·蒙特拉斯等人日前在美国《科学》杂志上报告说,他们发现,过去人们培育的成年肌肉干细胞,不能都发育成肌肉纤维,因为这些肌肉干细胞实际上并不纯,影响了肌肉纤维的快速生长。因此,科学家进行了技术改良。他们从成年鼠身上提取自然状态的肌肉干细胞,然后再对它们加以复杂的“净化”,如此提取的肌肉干细胞功能大有长进。在原先的老鼠实验中,需要培育100万个此类细胞才能用于促进肌肉纤维增长,现在只需要移植2万个细胞就可以达到同等效果。
10.JCB:研究显示女性肌肉干细胞再生能力较卓越
doi:10.1083/jcb.200612094
根据英国匹兹堡大学医学中心(University of Pittsburgh Medical Center;UPMC)儿童医院的研究者最新研究显示,由女性肌肉中所分离出的干细胞再生能力优于男性。这项结果于4月9日发表在Journal of Cell Biology期刊中,是首次着眼于性别差异的干细胞再生相关研究。
「这项发现对于以干细胞为基础的各项相关疗法会带来不小的影响。」干细胞研究中心主任Johnny Huard博士表示,「未来以干细胞来发展组织再生药物的相关应用时,应当视性别为一个重要的决定因素。」
研究者在找寻研究杜馨氏肌肉失养症(Duchene muscular dystrophy,DMD)等肌肉萎缩遗传疾病疗法时发现,分离的雌性个体干细胞具有优良的再生新骨骼肌组织的能力。在给予患有DMD的实验鼠分别注射雌性与雄性干细胞之后,他们发现仅10%的注射雄性干细胞老鼠其再生系数(regeneration index,RI)超过200者,而注射雌性干细胞者则高达40%。(生物谷 Bioon.com)
肌肉干细胞研究最新进展(第2期)
来源:本站原创 2017-09-10 08:43
2017年9月10日/生物谷BIOON/---肌肉干细胞可发育分化为成肌细胞(myoblasts),后者可互相融合成为多核的肌纤维,形成骨骼肌最基本的结构。人类胚胎和成人体内都存在肌肉干细胞。胚胎和胎儿的肌肉干细胞增殖使得肌肉组织发展;成年人体内的肌肉干细胞亦被称为卫星细胞,处于休眠状态,沿着肌肉纤维而分布。在经过强烈运动或是受到外界伤害之后,成人的肌肉干细胞会被激活并开始自我增殖,从而增加或是恢
2017年9月10日/生物谷BIOON/---肌肉干细胞可发育分化为成肌细胞(myoblasts),后者可互相融合成为多核的肌纤维,形成骨骼肌最基本的结构。
人类胚胎和成人体内都存在肌肉干细胞。胚胎和胎儿的肌肉干细胞增殖使得肌肉组织发展;成年人体内的肌肉干细胞亦被称为卫星细胞,处于休眠状态,沿着肌肉纤维而分布。在经过强烈运动或是受到外界伤害之后,成人的肌肉干细胞会被激活并开始自我增殖,从而增加或是恢复成人的肌肉组织。对于老年人,肌肉干细胞不再具有自我复制的活性,从而表现为肌肉组织的萎缩。
小编针对近年来肌肉干细胞研究取得的进展进行一番盘点,以飨读者。
1.Molecular Cell:成体肌肉干细胞的生长与分化调节机制
doi:10.1016/j.molcel.2007.08.021

肌肉干细胞是用来修复受损的肌肉组织的。在肌肉再生的微环境中,一些分子信号刺激物会被释放并产生外成性的修改,从而控制那些负责调控肌肉干细胞生长与分化的基因的表达。一个来自美国伯翰姆医学研究所(Burnham Institute for Medical Research)的科学家小组对这一过程的机理进行了深入研究。
在最近一期的《分子细胞》(Molecular Cell)中,这个由医学博士Pier Lorenzo Puri领导的科研小组发表的文章,说明了两个信号通路——PI3K/AKT和p38——是怎样共同作用来聚集构成负责肌肉特异性转录的蛋白复合体的成分,以及每个通路是怎样分别负责转录过程的一个明确步骤的。而且,这个小组还能够在药理学上分离这两个步骤,证明了选择性地对任何一个通路进行干涉都会导致蛋白复合体的不完全聚集,从而阻止肌肉特异性基因表达。
2.肌肉干细胞能长期有效治疗尿失禁
新闻来源:Muscle Stem Cells Effectively Treat Urinary Incontinence Long Term
美国匹兹堡大学医学院和多伦多Sunnybrook健康科学中心的研究人员进行的一项研究显示,通过给女性压力性尿失禁(SUI,stress urinary incontinence)患者注射肌肉干细胞来加强她们的括约肌的方法能够长期改善她们的病情。这项研究的结果在美国泌尿科协会年会上公布。
这项研究对患者进行了一年的跟踪研究,调查结果显示,这种干细胞注射方法很安全,能够改善患者的生活质量并可能有效治疗SUI。
匹兹堡大学之前对SUI动物模型进行的研究证实,将干细胞注射到尿道肌肉中能够增加漏尿点压(leak point pressure),从而使肌肉功能得以恢复。这些研究的结果成为了临床试验的基础。在这项研究中,研究人员先获得8名女性患者的骨骼肌组织活组织切片,并从这些组织中分离出干细胞,然后进行扩增培养。研究人员给门诊患者注射了这种肌肉干细胞。他们利用三种不同的注射技术给患者注射了相同剂量的干细胞。
目前,加拿大进行的一项多个研究机构参与的研究和美国的一项相关研究正在进行中,这些研究将使研究人员能够确定出有效治疗SUI的最佳干细胞注射剂量。
3.Science子刊:植入肌肉干细胞的老鼠抵御因衰老而导致的肌肉萎缩
doi:10.1126/scitranslmed.3001081
10月10日,美国研究人员报告说,他们以腿部肌肉受伤的年轻实验鼠为研究对象发现,植入肌肉干细胞可以使实验鼠肌肉恢复得比受伤前更强大,还可帮助实验鼠抵御因衰老而导致的肌肉萎缩。该相关研究成果发表在美国《科学·转化医学》杂志上。
研究人员植入的肌肉干细胞来自健康的年轻实验鼠。植入手术后,受伤实验鼠腿部肌肉不仅在几天内得以恢复,而且这一部位的肌肉质量增大为受伤前的1.7倍。研究人员最初认为,这可能是暂时现象,但他们最终发现,实验鼠肌肉终其一生(约为两年)都保持这一水平,而且与普通老鼠相比,它们的肌肉更能够抵御老化过程,肌肉力量和质量能持续保持。
研究人员提醒说,他们在实验中发现,将肌肉干细胞植入健康实验鼠不能起到同样效果。他们认为,这表明干细胞被植入的环境非常重要,不同环境下,干细胞反应的方式也不一样。
4.Developmental Cell:限制营养供给可抑制肌肉干细胞分化
doi:10.1016/j.devcel.2008.02.004

美国国立卫生研究院的科研人员近日研究发现,限制营养的供应可以阻碍肌肉干细胞发育为成熟的肌细胞。
研究人员发现,葡萄糖限制(GR)会削弱骨骼肌成肌细胞的分化,而且会激活腺苷酸活化蛋白激酶(AMPK)。这些结果表明了一个路径,即对低葡萄糖水平做出响应的AMPK的活化会刺激NAD+合成酶Nampt的表达。已知NAD+是SIRT1 的一种辅助因子,后者在众多生理过程中扮演着一个重要的角色,包括骨骼肌细胞的分化,而且还牵扯到了寿命和衰老的调整。重要的是,抑制AMPK、Nampt或 SIRT1导致骨骼肌细胞不介意一个营养不良的环境,而且可以在一些本不适合的环境下分化。
这些结果表明了一个响应低营养环境、积极地控制肌肉分化的详细路径。研究人员推测,AMPK-Nampt-SIRT1路径的作用就像一个细胞检查站,它可能被营养物质供应的减少而活化,从而阻止细胞在缺乏热量的条件下从事需要能量的过程——诸如细胞分化。另一方面,一旦营养物质供应恢复,这条路径就被关闭,从而让生理发育恢复。
5.Nature:肌肉卫星细胞被证实是干细胞
doi:10.1038/nature07384
肌肉卫星细胞是骨骼肌中位于肌细胞膜和基膜之间的具有增殖分化潜力的肌源性细胞。它们在一般情况下是处于静息状态的,当被激活后,具有增殖分化、融合成肌管、再形成肌细胞的能力。在那里它们通过形成与肌肉纤维融合的先驱细胞来对损伤做出反应。有研究报告说,它们能充当干细胞,但卫星细胞群的混合性质意味着,它们的干细胞身份难以证明。
最新一期Nature刊登由美国斯坦福大学医学院的Sacco等人的研究结果:研究小组通过利用克隆分析证实卫星细胞的确是干细胞、能够自我更新,从而澄清了相关问题。他们将一个表达荧光素酶的卫星细胞移植进了小鼠的肌肉中,发现它能够大量增殖,有助于肌肉纤维的形成,而且可以被再次移植。因此断定肌肉卫星细胞也是一种干细胞。
6.PLoS ONE:研究者揭示卫星细胞促进肌肉损伤修复的新分子机制
doi:10.1371/journal.pone.0037218

近日,来自奥克兰儿童医学研究中心的研究者发现了骨骼肌干细胞如何对肌肉损伤做出反应,这就给了我们一些提示,帮助我们改善杜兴氏肌肉营养不良症患者的肌肉修复能力,杜兴氏肌肉营养不良症一种严重的肌肉遗传疾病,可以导致患者体弱、残疾,最终心脏和呼吸衰竭。研究者在研究中揭示了一种脂质信号分子鞘氨醇-1-磷酸盐(S1P),这种分子可致炎症应答反应,刺激肌肉干细胞进行增值并且协助肌肉进行修复作用。研究者在mdx小鼠中进行研究,这种小鼠患上了类似于杜兴氏肌肉营养不良症的疾病,并且伴随S1P的功能缺失,研究者在小鼠中增加S1P的水平可以帮助小鼠肌肉再生。相关研究成果于近日刊登在了国际著名杂志PLoS One上。
S1P是一个脂质信号分子,可以控制许多人类细胞的移动和增殖,科学家证明S1P可以激活卫星细胞,但是具体是如何激活的并不清楚。研究者Saba表示,目前他们已经研究S1P很多年了,2003年,他们刊登出研究成果表示,S1P代谢缺失的果蝇突变体不能够飞行了,因为果蝇患上了肌肉疾病导致飞行肌肉衰老退化。基于研究者的发现,他们认为S1P信号路径在肌肉稳定性和平衡性上扮演着重要角色。不仅仅是在果蝇及其它哺乳动物中,甚至在人类中也是如此。
Saba的研究小组如今在研究S1P是如何在肌肉损伤时激活干细胞进行修复作用的,这就涉及到了S1P激活S1P受体2的能力了,S1P受体2是5个细胞表面受体之一,可以导致受转录因子STAT3控制的炎症途径活性的下降。研究者揭示,在肌肉损伤后,S1P可以迅速产生,因此就会产生S1P信号路径,通过S1P受体2激活该途径,导致STAT3的活化,最终引发基因表达的变化,促使卫星细胞激活来修复受损肌肉组织。
Saba教授表示,他们的研究发现对于特定的肌肉疾病或者儿童的肌病的治疗非常重要,最常见和最严重的肌病就是杜兴氏肌肉营养不良症,这种疾病可以导致病人在20多岁时呼气衰竭或者心力衰竭,最后死亡。尽管病人机体中存在卫星细胞可以进行肌肉修复,可是修复的速度根本赶不上患者机体肌肉退化的速度。研究者在类似疾病的mdx小鼠中发现,用药物封堵的方法可以增加S1P的水平,这种方法可以增加卫星细胞的数量,进而提高卫星细胞进行肌肉修复的速度和效率。
7.Nature:“卫星细胞”与肌肉衰老
doi:10.1038/nature13013
对成年哺乳动物干细胞的功能来说至关重要的特性之一是,长时间保持静止状态的能力以及需要再生时做出反应的能力。骨骼肌数量及功能的损失是人类晚年衰老的共同特征,与被称为“卫星细胞”的骨骼肌干细胞的再生能力的丧失有关。
Pura Muoz-Cánoves及同事发现,衰老中的“卫星细胞”发生从静止状态向衰老前状态的不可逆转变,这与已被发现是衰老的一个标志的肿瘤抑制蛋白p16INK4a的表达水平增加有关。成年期间p16INK4a的抑制被发现能将“卫星细胞”保持在一个可逆的静止状态,使肌肉能够再生;p16INK4a在老年人的“卫星细胞”中失调,肌肉再生潜力丧失。
8.Science:卫星细胞与骨骼肌的再生
doi:10.1126/science.1114758
肌肉的卫星细胞(Satellite cells of muscle)被认为能为肌肉的修复和再生提供原始粒子(progenitors),但是数目很少并且很难分离。
Montarras等人用流式细胞术的方法(flow cytometry)成功地从一种表达绿色荧光蛋白(green fluorescent protein)的小鼠种系分离出了肌肉的卫星细胞。当从隔膜(diaphragm)上分离出的卫星细胞被移植到mdx小鼠的肌肉中时(即肌肉萎缩症(muscular dystrophy)模型),这些细胞有效地支持了肌肉的修复和固定的卫星细胞的建立。然而,移植前的体外扩增实验会减弱细胞的再生能力。(生物谷 Bioon.com)
肌肉干细胞研究最新进展(第3期)
来源:本站原创 2019-10-29 07:06
2019年10月29日讯/生物谷BIOON/---肌肉干细胞可发育分化为成肌细胞(myoblasts),后者可互相融合成为多核的肌纤维,形成骨骼肌最基本的结构。人类胚胎和成人体内都存在肌肉干细胞。胚胎和胎儿的肌肉干细胞增殖使得肌肉组织发展;成年人体内的肌肉干细胞亦被称为卫星细胞,处于休眠状态,沿着肌肉纤维而分布。在经过强烈运动或是受到外界伤害之后,成人的肌肉干细胞会被激活并开始自我增殖,从而增加或
2019年10月29日讯/生物谷BIOON/---肌肉干细胞可发育分化为成肌细胞(myoblasts),后者可互相融合成为多核的肌纤维,形成骨骼肌最基本的结构。
人类胚胎和成人体内都存在肌肉干细胞。胚胎和胎儿的肌肉干细胞增殖使得肌肉组织发展;成年人体内的肌肉干细胞亦被称为卫星细胞,处于休眠状态,沿着肌肉纤维而分布。在经过强烈运动或是受到外界伤害之后,成人的肌肉干细胞会被激活并开始自我增殖,从而增加或是恢复成人的肌肉组织。对于老年人,肌肉干细胞不再具有自我复制的活性,从而表现为肌肉组织的萎缩。
小编针对近年来肌肉干细胞研究取得的进展进行一番盘点,以飨读者。
1.Nat Metab:衰老肌肉细胞为何愈合能力下降?
doi:10.1038/s42255-019-0110-3
来自卡耐基大学的生物学家Chen-Ming Fan领导的一项研究表明,随着年龄的增长,肌肉损伤的恢复能力的下降是由一种蛋白质介导的。该蛋白质能够抑制肌肉干细胞分化形成新肌肉组织的能力。相关结果发表在最近的《Nature Metabolism》杂志上。

图片来源:Www.pixabay.com。
骨骼肌中的肌肉干细胞具有制造新肌肉组织的强大能力。这些细胞不仅擅长“制造”肌肉,而且还可以不断分裂产生更多的干细胞,这一过程称为“自我更新”。但是它们的相关能力会随着年龄的增长而减弱,从而导致肌肉创伤后的再生能力下降。
最近,来自卡内基大学的研究者们发现一种叫做GAS1的蛋白质是导致这种情况的罪魁祸首。作者解释说:“ GAS1蛋白由生长抑制特异性基因编码,它介导了衰老导致的肌肉干细胞的功能衰退。”
他们发现,这种蛋白质大量表达于所有老化的肌肉干细胞中。人为从从衰老的肌肉干细胞中去除GAS1可使它们恢复年轻状态,从而支持强大的再生能力。他们还发现,GAS1抑制了另一种称为RET的细胞表面受体,而后者对于肌肉干细胞的更新是必需的。相应的,GAS1蛋白越多,RET的功能就越降低。GAS1对RET的抑制作用可以被第三种称为GDNF的蛋白逆转,该蛋白能够结合并激活RET。当研究人员将GDNF直接注射到衰老小鼠的肌肉中时,肌肉干细胞功能和肌肉再生得以恢复。
2. Mol Ther:CRISPR-Cas9技术能够治疗杜氏肌营养不良
doi:10.1016/j.ymthe.2019.06.012
杜氏肌营养不良症(DMD)是一种罕见但十分严重的遗传性疾病,可导致肌肉的流失与机体的损伤。最近,由密苏里大学医学院的研究人员作出的一项研究表明:基因编辑技术CRISPR可以为纠正导致该疾病发生的基因突变提供终生性的手段。
“基于动物模型的研究表明,CRISPR可用于纠正导致肌肉细胞异常死亡的基因突变,”该文章的资深作者Dongsheng Duan博士说到:“然而,由于这些基因编辑的肌肉细胞会随着时间的推移而逐渐老去。因此,如果我们可以纠正肌肉干细胞中的相关突变,那么再生的肌肉细胞将不再携带该突变。”
首先,研究人员通过AAV9向正常小鼠肌肉注入基因编辑载体。 “我们将AAV9处理的肌肉移植到免疫缺陷的小鼠体内。移植的成年肌肉细胞会率先死亡,然后干细胞中再生新生的肌肉细胞。如果干细胞能够被成功编辑,那么再生的肌肉细胞也应携带编辑的基因。”
研究人员的推理是正确的,因为他们在再生肌肉中发现了大量的,已经经过编辑细胞。并且这些细胞能够正常产生dystrophin蛋白。
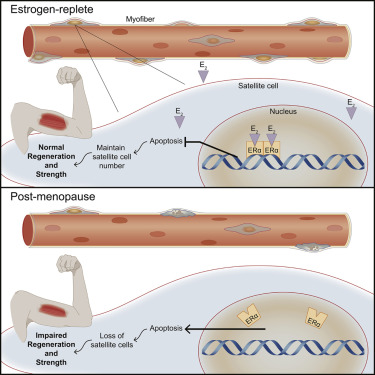
3.Cell Rep:研究人员揭示女性更年期肌肉萎缩的原因
doi:10.1016/j.celrep.2019.06.025
在最近发表在《Cell Reports》的一篇文章,明尼苏达大学医学院康复医学系教授Dawn Lowe博士首次确定了雌激素对女性肌肉干细胞的维持和功能是必不可少的。
这项研究调查了通过手术切除卵巢的小鼠以及肌肉干细胞中没有雌激素受体的小鼠,并评估了肌肉再生的能力。研究发现,肌肉干细胞中雌激素的缺失或雌激素受体的基因缺失导致5块不同肌肉中的肌肉干细胞(也称为卫星细胞)数量下降30%-60%。存活的细胞在受伤后很难自我繁殖和生成新的肌肉。这项研究还包括与芬兰科学家的合作,他们对绝经前后的女性进行了肌肉活检。研究结果显示,在人类中,卫星细胞的数量与血清雌激素水平的变化密切相关。"这是第一个表明雌激素缺乏会影响卫星细胞数量和功能的研究,"lowe说。
图片来源:Cell Reports。
众所周知,更年期症状的雌激素替代疗法可以帮助维持肌肉健康。但是这种治疗肌肉衰弱的激素替代疗法也会增加由于雌激素对组织(如乳房和子宫内膜)的影响而患癌症的风险。研究团队发现了一个新的药物,该药物可以与已知的雌激素受体以一种不影响乳房或子宫内膜组织的方式相互作用,这种药物能够刺激肌肉干细胞中的雌激素信号,因此可能可以防止衰老女性由于更年期导致的肌肉干细胞下降,这种药物治疗不会产生与常规激素替代疗法相似的风险。
4.Gene Dev:新研究揭示肌肉干细胞分化的“震荡”效应
doi:10.1101/gad.322818.118
当肌肉受伤时,肌肉干细胞必须随时准备好开始“行动”:例如,在体育活动期间,他们有责任尽快分化产生新的肌肉细胞。然而,与此同时,身体需要有一种机制可以阻止干细胞的不受控制的分化 - 否则这些细胞在肌肉中的供应会迅速耗尽。根据研究小组最近在《Genes&Development》杂志上的报道,MyoD和Hes1蛋白调节肌肉干细胞的分化,导致产生的细胞数量存在周期性波动。
“在我们的实验中,我们首先将Hes1和MyoD连接到蛋白质上,发光 - 即发光 - 蛋白质,以便我们更好地跟踪它们的发育,”该研究的主要作者Ines Lahmann博士解释道。然后,研究小组能够观察到 - 在分离的细胞,肌肉组织和活体动物中 - 作为Notch信号通路的一部分的Hes1蛋白以振荡方式产生。
“生产每两到三个小时达到高峰,然后再次下降,”Lahmann报告说,他们在MyoD蛋白中遇到了同样的现象。 “只要干细胞中MyoD的数量周期性波动,细胞就会生长和分裂,从而自我更新”。
5.PNAS:细胞替代疗法可用于治疗肌营养不良症
doi:10.1073/pnas.1808303116
明尼苏达大学医学院最近一项研究为利用细胞疗法治疗肌营养不良带来了新的希望。在这一发表在美国国家科学院院刊(PNAS)上的研究中,作者深入地研究了体外产生的细胞如何达到肌肉再生的目的。
多年来,研究者们率先在体外从多能干细胞培养分化产生肌肉干/祖细胞。这些细胞在移植到患有肌营养不良症的小鼠后能够产生新的功能性肌肉。如今,研究人员已经推进了这些研究结果,首次确定了培养皿中产生的肌肉干细胞的分子特征。
“我们早就已经知道知道肌肉干细胞在移植之后会发育产生新的肌肉细胞,但对组织环境在这一过程中的影响并不清楚。对此,我们这一研究了解了环境起着的具体作用,这是一个令人兴奋的发现,”作者说到。 “在分子和功能水平上了解移植后这些细胞发生的变化,对于为未来的治疗应用提供理论基础尤为重要。”
6.Cell Rep:肌肉干细胞也能够驱动癌症的发生?
doi:10.1016/j.celrep.2018.12.089
患有杜氏肌营养不良症(DMD)的人有时会发展出一种罕见的肌肉癌,称为横纹肌肉瘤,这是由于肌细胞不断努力重建受损组织导致的。然而,人们对这种癌症是如何产生的知之甚少,因此阻碍了癌症风险预测、治疗或检测的发展。
现在,Sanford Burnham Prebys医学发现研究所(SBP)的科学家已经证明,肌肉干细胞可能会导致DMD期间发生的横纹肌肉瘤,并确定了与肿瘤生长相关的两个基因。这项使用严重DMD小鼠模型进行的研究有助于科学家更好地了解横纹肌肉瘤在DMD中的发展情况,并表明正在开发的刺激肌肉干细胞治疗的努力应考虑潜在的癌症风险。该研究于2019年1月15日发表在Cell Reports上。

图片来源:Sanford Burnham Prebys Medical Discovery Institute (SBP)。
在这项研究中,科学家们发现,患有更严重DMD的小鼠更早发生了横纹肌肉瘤,这表明增加的肌肉退化促进了癌症的发展。接下来,他们从患有严重DMD的小鼠中分离出几个参与肌肉再生的细胞,并测试了它们成为肿瘤的能力。与其他细胞相比,肌肉干细胞在独立生长时具有增强的复制能力(自我更新)和形成的肿瘤。肌肉干细胞也显示出它们会发展成肿瘤的早期迹象,包括增加的自我更新,DNA损伤的积累和类似于人横纹肌肉瘤中所见的基因表达模式。
利用RNA测序,科学家们还发现了与肿瘤生长相关的两个基因Ccl11和Rgs5,这些基因与炎症和伤口愈合有关。当科学家们将Ccl11和Rgs5蛋白质添加到肿瘤细胞中时,它会减少它们的生长 - 这表明这些基因参与了癌症的生长。
7.Cell Stem Cell:研究人员发现控制干细胞分化的药物!干细胞疗法或将终结肌肉萎缩症!
doi:10.1016/j.stem.2017.12.010
一个由UBC研究人员一起创造的药物也许可以克服干细胞治疗面临的主要挑战之一——干细胞可能会太早及太快分化变成特定的组织细胞。如果这个药物可以像在实验室小鼠身上那样发挥作用的话,也许将使干细胞疗法更接近现实。
UBC和斯坦福大学的研究人员对于使用干细胞辅助肌肉组织再生治疗肌肉萎缩症很感兴趣,肌肉萎缩症是一种遗传疾病,病人肌肉会随时间而受损变弱。干细胞具有分化产生组成人体特定组织的新细胞,因此具有治愈这类疾病的潜力。理论上,干细胞可以产生新组织替代受损的组织。但是科学家们却鲜有成功,尤其是对于肌肉,因为干细胞一旦从实验室培养皿中分离出来就开始分化,不再是干细胞。就肌肉萎缩症而言,肌肉干细胞会停止分裂、分化形成肌纤维,而肌纤维的移植效果并不好。
研究人员发现一个叫做Setd7的蛋白在控制干细胞生长以及分化为肌纤维过程中发挥关键作用。通过一个药物,他们可以抑制Setd7蛋白,防止干细胞分化,这样干细胞就会不断分裂。随后他们将干细胞移植到肌肉萎缩症小鼠模型的后腿上,发现这些细胞与肌肉很好地融合在一起,再生组织并提高了肌肉的强度。
“这项发现揭示了一种增强肌肉干细胞治疗效果的新方法,这种方法允许这些细胞在移植到受损组织后促进组织再生并改善肌肉功能。”研究第一作者、UBC博士后研究员、STEMCELL科技资深科学家Robert Judson说道。
8.Nat Commun:iPS技术帮助科学家们成功将皮肤细胞转化为骨骼肌组织
doi:10.1038/s41467-017-02636-4
最近,生物医学工程师们利用诱导多能性干细胞技术成功地培育出了功能性的人源骨骼肌细胞。这项研究是建立在2015年的一项研究成果的基础上。当时杜克大学的研究者每年首次利用肌肉样本培育出了功能性的骨骼肌组织。而最近的这项研究则利用了非肌肉组织进行转化。该方法使得基因编辑用于细胞治疗更近了一步。相关结果发表在最近一期的《Nature Communications》杂志上。
在这项研究中,作者首先分离了成年人的分肌肉组织,例如皮肤或者血液,并且通过重编程的技术将其转化为初生状态。多能性干细胞进一步在有Pax7的刺激下培养,该分子能够释放信号将初生组织转化为肌肉组织。随着细胞的不断增殖,其形态变得与成体肌肉干细胞十分相似,只是致密程度哺乳后者。虽然此前研究也有类似的进展,但从没有人成功地将这些中间体最终转化为成熟的,有功能的骨骼肌。一旦细胞开始向肌肉的方向顺利分化,作者等人立即停止了Pax7的刺激,并且给细胞以充足的养分,以帮助其能够最终走向成熟。
在这项研究中,作者等人发现在经历了2-4周的3D培养之后,肌肉细胞开始形成肌纤维,并且在外界刺激,例如电信号或化学信号,的作用下能够成功收缩。之后,他们还将这些新生成的肌纤维移植进入小鼠体内,结果表明这些细胞能够最终存活而且通过血管生成的方式与内部组织相连,并且行使至少三周的功能。
9.Cell Stem Cell:科学家利用畸胎瘤成功衍生出肌肉干细胞
doi:10.1016/j.stem.2018.06.010
近日,来自明尼苏达大学医学院的科学家们通过研究开发了一种新方法,能通过名为畸胎瘤的良性肿瘤为肌营养不良症的小鼠机体再生骨骼肌细胞,相关研究刊登于国际杂志Cell Stem Cell上。
文章中,研究人员描述了他们如何寻找细胞来源来重新制造骨骼肌;Michael Kyba教授说道,这项研究中我们旨在通过搜索未被科学家们探索的地方来寻找合适的细胞来源,当特殊细胞被移植后其就能再生骨骼肌,同时文章中我们也发现这种新生的骨骼肌在力量和弹性方面能发生显著的改善。
图片来源:phys.org。
研究人员对来自动物畸胎瘤中的细胞进行靶向作用,结果发现,通过对畸胎瘤细胞进行提纯分类,就能为肌营养不良症的小鼠再造骨骼肌,畸胎瘤是一种特殊类型的肿瘤,其能产生所有类型的细胞,包括腺体细胞和毛囊细胞等。研究人员表示,他们并未研究自发产生的病例性畸胎瘤。
相反,研究人员利用未分化的多能细胞注入到免疫缺陷的小鼠机体中制造出了畸胎瘤,同时他们发现,除了含有多种细胞类型,畸胎瘤中还含有大量的肌肉干细胞。研究结果表明,利用这些畸胎瘤中的干细胞能够有效分化再生出骨骼肌细胞,而细胞分化再生的潜力超过了研究人员之前的想象,随后研究者将一小部分畸胎瘤衍生细胞注射到患病肌肉中,结果发现,相比当前方法所产生的5%-10%的再生率而言,畸胎瘤中细胞的再生率能达到80%,此外,畸胎瘤衍生细胞还能填充成为含有肌肉干细胞的新生肌肉。
指示肌肉功能的其它参数包括强直力、比力和疲劳时间等,利用畸胎瘤产生的肌肉在肌肉功能控制上表现出了明显的改善。当前的研究结果非常有前景,研究人员指出,这项研究的关键就在于,与目前疗法相比,这些畸胎瘤细胞具有产生有再生潜力细胞的能力,尽管这些新生的肌肉组织并没有表现出任何畸胎瘤的迹象,也并未出现任何其它不良事件,但研究人员认为,在考虑治疗应用之前首先确保这种方法的安全性是最重要的。
10.JCI Insight:洗清冤屈!“坏蛋白”TAK1或许能促进机体肌肉生长!
doi:10.1172/jci.insight.98441
近日,一项刊登在国际杂志JCI Insight上的研究报告中,来自路易斯维尔大学的研究人员通过研究揭示了特殊分子在维持肌肉健康上所扮演的关键角色;当研究人员深入研究肌肉生长和健康的机制时,他们就发现了名为TAK1信号蛋白的特殊角色,TAK1即为转化生长因子β激活激酶1,由于TAK1能够激活和肌肉萎缩相关的通路表达,因此其对于肌肉健康是有害的。
Ashok Kumar博士表示,TAK1是机体中的一种非常重要的分子,其几乎能够调节所有类型的细胞,而且会参与到机体中许多信号过程中,同时还扮演着许多生理性角色,但TAK1在骨骼肌中的角色目前研究人员并不清楚。文章中,研究者假设,通过移除TAK1是否能够减缓肌肉萎缩(单一动作)相关的两种下游通路所产生的负面效应,研究人员设计了一系列细胞培养物和动物模型实验来确定是否移除TAK1就能够保留肌肉量和肌肉强度。
研究人员对TAK1进行研究的第一个线索就是对小鼠进行遗传化修饰移除骨骼肌中的TAK1,结果发现,这些小鼠在出生后不久全都会死亡;转变策略后,研究人员就开始对成年小鼠进行研究,他们发现,在成年小鼠机体中,代替增加肌肉量的话,降低TAK1的水平就能导致小鼠出现严重的肌肉萎缩,同时小鼠肌肉细胞的线粒体和氧化性压力还会出现异常,这些改变常常与肌萎缩侧索硬化症、2型糖尿病、癌症及老化患者机体肌肉的表现相一致。
11.Nature子刊:巨噬细胞有助让衰老的肌肉焕发青春
doi:10.1038/s41551-018-0290-2
许多退行性肌肉疾病直到成年时才会出现,并且在实验室中培养肌肉来测试这些患者的药物反应将受益于患者自身的成体细胞的使用。不过还存在着一个问题:实验室制造的成体肌肉组织不具有与新生儿组织相同的再生潜力。
在一项新的研究中,在添加多种已知有助肌肉修复的药物和生长因子遭遇失败后,Bursac实验室的前博士生Mark Juhas考虑加入一种对肌肉损伤作出反应并激活肌肉再生的支持细胞(supporting cell)群体。
在肌肉遭受损伤后,一类巨噬细胞出现在现场,清除留下的破坏,增加炎症和激活免疫系统的其他部分。它们招募的细胞之一就是另一类被称作M2的巨噬细胞,它们降低炎症和促进组织修复。尽管这些抗炎性巨噬细胞在此之前已用于修复肌肉损伤的治疗当中,但是它们从未被整合到在体外培养复杂的肌肉组织的平台中。
当这些研究人员利用一种毒素破坏成体衍生的工程肌肉时,他们没有观察到这种工程肌肉发生功能性愈合,而且肌纤维也无法再生。但是,当他们将这些抗炎性巨噬细胞添加到这种工程肌肉中时,他们发现它在15天内愈合损伤,并且几乎像损伤出现之前一样收缩。
这种成功似乎主要源于这些巨噬细胞起着阻止受损的肌肉细胞发生凋亡。与新生儿的肌肉细胞不同的是,成体肌肉细胞需要这些巨噬细胞来协助它们在不进入细胞死亡的情况下修复初始的损伤。随后,这些存活下来的肌纤维为肌肉干细胞提供“支架”,从而持续执行它们的再生功能。Bursac认为这一发现可能会为潜在的再生疗法提供一种新的研究方向。(生物谷 Bioon.com)
肌肉干细胞研究最新进展(第4期)
来源:本站原创 2021-03-29 15:23
2021年3月29日讯/生物谷BIOON/---肌肉干细胞可发育分化为成肌细胞(myoblasts),后者可互相融合成为多核的肌纤维,形成骨骼肌最基本的结构。人类胚胎和成人体内都存在肌肉干细胞。胚胎和胎儿的肌肉干细胞增殖使得肌肉组织发展;成年人体内的肌肉干细胞亦被称为卫星细胞,处于休眠状态,沿着肌肉纤维而分布。在经过强烈运动或是受到外界伤害之后,成人的肌肉干
2021年3月29日讯/生物谷BIOON/---肌肉干细胞可发育分化为成肌细胞(myoblasts),后者可互相融合成为多核的肌纤维,形成骨骼肌最基本的结构。
人类胚胎和成人体内都存在肌肉干细胞。胚胎和胎儿的肌肉干细胞增殖使得肌肉组织发展;成年人体内的肌肉干细胞亦被称为卫星细胞,处于休眠状态,沿着肌肉纤维而分布。在经过强烈运动或是受到外界伤害之后,成人的肌肉干细胞会被激活并开始自我增殖,从而增加或是恢复成人的肌肉组织。对于老年人,肌肉干细胞不再具有自我复制的活性,从而表现为肌肉组织的萎缩。
小编针对近年来肌肉干细胞研究取得的进展进行一番盘点,以飨读者。
1.Nature子刊:揭示一种化学物混合物可产生大量的肌肉干细胞
doi:10.1038/s41551-021-00696-y
在一项新的研究中,来自美国加州大学洛杉矶分校的研究人员鉴定出一种化学物混合物,它能够大量地产生可以自我更新并可产生所有类型骨骼肌细胞的肌肉干细胞。这一进展可能导致开发基于干细胞的疗法,以治疗因受伤、年龄或疾病而导致的肌肉损失或损伤。相关研究结果近期发表在Nature Biomedical Engineering期刊上,论文标题为“Skeletal muscle regeneration via the chemical induction and expansion of myogenic stem cells in situ or in vitro”。

图片来自Nature Biomedical Engineering, 2021, doi:10.1038/s41551-021-00696-y。
肌肉干细胞在人的一生中负责肌肉生长、修复和受伤后的再生。在完全成长的成年人中,肌肉干细胞是静止的---它们一直处于非活动状态,直到它们被要求通过自我复制和产生修复受损组织所需的所有细胞类型,对损伤作出反应。但是,随着人们年龄的增长,这种再生能力会下降;它也会因外伤和杜兴氏肌肉营养不良等遗传性疾病而受到损害。
2.Nat Commun解读!新研究揭示肌肉生长的关键调节因素 有望开发肌肉损伤新疗法!
doi:10.1038/s41467-021-21631-4
当一块肌肉生长时,这块肌肉中的一些干细胞会发育成新的肌肉细胞。这是因为它的主人正在成长或定期锻炼。当受伤的肌肉开始愈合时,也会发生同样的事情。然而与此同时,肌肉干细胞必须产生更多的干细胞,也就是自我更新,否则它们的供给会很快耗尽。这就需要各种参与肌肉生长的细胞相互交流。
在近期一项研究中,Birchmeier和MDC的其他四位科学家与来自日本和法国的研究人员一起发现了第三种蛋白质的关键作用,它与Hes1和MyoD一起,在细胞内形成了一个动态网络。相关研究发表在Nature Communications杂志上,标题为Oscillations of Delta-like1 regulate the balance between differentiation and maintenance of muscle stem cells。
这篇报告中称,这种蛋白质是Notch配体Delta-like1,简称Dll1。“激活的肌肉干细胞以周期性波动的方式产生Dll1,振荡周期持续两到三个小时。每当一部分干细胞表达更多Dll1时,其他细胞中的数量就相应减少。”这种节律性信号决定了干细胞是成为新的干细胞还是发育成肌肉细胞。”Birchmeier解释道。
3.Nature论文解读!发现一种天然蛋白促进肌肉干细胞增殖,可逆转疾病、衰老和创伤造成的严重肌肉萎缩
doi:10.1038/s41586-021-03199-7
当我们撕裂肌肉时,肌肉内的干细胞会进行修复。我们不仅可以看到这种情况发生在严重的肌肉萎缩疾病中,如肌肉萎缩症和在战争中幸存下来的退伍军人的灾难性肢体损伤,而且在我们的日常生活中,当我们拉伤肌肉时,也会发生这种情况。另外,当我们年老体弱时,我们会失去很多肌肉,而我们的干细胞似乎不能像我们年老时一样发挥作用。

图片来自Nature, 2021, doi:10.1038/s41586-021-03199-7。
在一项新的研究中,来自澳大利亚莫纳什大学和荷兰乌特勒支大学医学中心的研究人员发现了一种触发这些肌肉干细胞增殖和愈合的因子。在严重肌肉损伤的小鼠模型中,注射这种天然存在的蛋白,可使肌肉完全再生,并在严重肌肉创伤后恢复正常运动。相关研究结果于2021年2月10日在线发表在Nature期刊上,论文标题为“Macrophages provide a transient muscle stem cell niche via NAMPT secretion”。论文通许作者为莫纳什大学澳大利亚再生医学研究所所长Peter Currie教授。
4.Front Cell Dev Biol:寡聚DNA促进肌肉分化
doi:10.3389/fcell.2020.616706
成肌细胞是肌肉的祖细胞,在维持肌肉稳态方面起着重要作用。然而,据报道,成肌细胞的分化能力随年龄和疾病而降低,这被认为是肌肉萎缩的原因之一。为了预防或治疗肌肉萎缩症,由信州大学农学部Tomohide Takaya副教授领导的研究小组研究了促进成肌细胞分化的分子。
该研究小组专注于寡核苷酸DNA(短单链DNA),其在体内表现出多种活性。在源自乳杆菌基因组序列的50种寡核苷酸DNA中寻找促进成肌细胞分化的序列的结果,他们发现具有端粒序列的18个碱基的寡DNA对成肌细胞的分化具有极强的诱导作用。这种“成肌寡聚DNA”(myoDN)充当适体,通过形成特征性的三维结构与成肌细胞中的蛋白核仁蛋白结合。结果,发现myoDN通过抑制核仁蛋白功能并最终激活p53信号通路来促进成肌细胞分化。
5.Cell子刊解读!揭秘科学家们如何利用组织干细胞来开发新型靶向性再生医学疗法!
doi:10.1016/j.stem.2020.09.011
干细胞(SCs)能够维持组织稳态并修复创伤,尽管在组织结构和再生需求方面存在一定差异,但干细胞在微环境生境沟通从静态过渡到再生状态方面通常会遵循相似的模式,日前一篇发表在国际杂志Cell Stem Cell上题为“Tissue Stem Cells: Architects of Their Niches”的研究报告中,来自洛克菲勒大学等机构的科学家们通过利用机体中受压力最大的组织中的皮肤上皮组织和骨骼肌组织进行研究强调了干细胞神经成分的相似性和差异性,同时还阐明了干细胞如何介导天然的组织再生并执行损伤所引起的机体的再生行为,此外,研究人员还讨论了在机体老化期间这些通讯网络是如何中断的,以及理解组织中干细胞的特性如何帮助改善再生医学疗法的研究和开发。
文章中,研究人员从:1)皮肤干细胞及其生境;2)静态及与肌肉干细胞生境之间的关联;3)脉管系统在肌肉干细胞生境中的关键角色;4)损伤后的组织修复;5)机体衰老等方面进行了详细阐述;这篇综述文章中,研究人员强调了组织干细胞作为“建筑师”设计并创造自身生境的自我调节角色,这需要精心的设计细胞外基质的结构组分,并将干细胞牢牢锁定到其生境中,合成生长因子和其它细胞类型也参与的细胞因子等;同时还能呈现出接收来自细胞邻居信号的特殊受体,研究者发现了干细胞的显著共性,其在各自的组织再生中的功能并不相同。
6.Nature:谷氨酰胺防止肌肉受伤和衰老
doi:10.1038/s41586-020-2857-9
近日,Massimiliano Mazzone教授(VIB-KU鲁汶癌症生物学中心)领导的团队与Emanuele Berardi博士和Min Shang博士合作,揭示了炎症细胞和肌肉干细胞之间的新的代谢对话。研究人员表明,用GLUD1的抑制剂加强这种代谢串扰可促进谷氨酰胺的释放,并在创伤,局部缺血和衰老等肌肉变性实验模型中改善肌肉再生和身体机能。除了具有转化潜力外,这项工作还在包括肌肉生物学,免疫代谢和干细胞生物学在内的多个研究领域中提供了重要的进展。
Massimiliano Mazzone教授的研究小组观察到,在受损或衰老过程中,肌肉中谷氨酰胺的正常水平由于死去的肌肉组织而降低。研究人员确定了损伤后到达的炎症细胞与驻留的肌肉干细胞之间的代谢对话。这种细胞串扰可重新建立肌肉中谷氨酰胺的原始水平,并在此过程中促使肌肉纤维再生。
7.Cell Stem Cell:深度剖析!科学家开发出首个人类骨骼肌发育的细胞路线图谱!
doi:10.1016/j.stem.2020.04.017
近日,一项刊登在国际杂志Cell Stem Cell上的研究报告中,来自加州大学洛杉矶分校等机构的科学家们通过研究开发出了首个路线图,其能清楚地揭示人类骨骼肌发育的机制,包括肌肉干细胞的形成机制。

图片来源:Broad Stem Cell Research Center。
目前研究人员并不清楚人类骨骼肌的发育轨迹以及祖细胞和干细胞状态之间的过渡阶段,文章中,研究人员利用单细胞RNA测序技术对胚胎、胎儿及出生后阶段的人类骨骼肌组织进行了深入分析,在硅片材料中研究人员识别出了肌原性细胞和其它类型的细胞,并且构建出了一个不同发育阶段的人类骨骼肌个体发育路线图,以类似的方式,研究人员还分析了由多个人类多能干细胞(hPSC)肌原性分化步骤所产生的异质性细胞培养物,并将hPSC衍生的肌原性祖细胞定位了到胚胎-胎儿的过渡时期。
8.Nature子刊:运动使老鼠的肌肉干细胞返老还童!
doi:10.1038/s42255-020-0190-0
根据斯坦福大学医学院研究人员的一项新研究,每天晚上在转盘上进行短途旅行可以增强年老老鼠的肌肉修复能力。只有年龄较大的老鼠能得到这种益处,研究人员发现这是由于动物肌肉干细胞的再生。
"这对老年动物的影响是非常显着的," 医学博士Thomas Rando说,他是斯坦福大学神经学和神经科学教授,同时也是斯坦福大学格伦衰老生物学中心的主任。"我们发现,有规律的锻炼可以使组织修复恢复年轻。他们的肌肉干细胞的外观和行为开始像那些年轻得多的动物。"
研究人员还发现了一种参与逆转细胞时钟的分子途径。他们认为,控制这一途径的药物可能是运动的有效替代品。Rando是这项研究的资深作者,这项研究于近日发表在Nature Metabolism杂志上。
9.Cell Rep:肌肉干细胞汇编成“地图集”
doi:10.1016/j.celrep.2020.02.067
肌肉修复是一个十分复杂的业务。许多不同类型的细胞不断碰撞,颤抖,并在再生过程中相互协调。
由康奈尔大学Meinig生物医学工程学院助理教授Ben Cosgrove领导的研究人员团队使用了一种新的细胞谱分析技术来探测和分类参与肌肉修复的几乎所有细胞的活性。他们将研究结果整理成肌肉再生的“细胞图册”。该资源提供了组织自我修复中许多错综复杂的细胞相互作用的全面描述,并且可能导致更好的康复策略以及为肌肉损伤中康复患者提供支持。相关结果发表在《Cell Reports》杂志上。
10.Science:全文解读!揭示Pax3 mRNA控制肌肉干细胞命运机制
doi:10.1126/science.aax1694; doi:10.1126/science.aaz4859
组织保持稳态和再生取决于组织特异性的干细胞群体,其中的一些干细胞群体长时间处于静止状态。在脊椎动物中,肌肉干细胞(MuSC)是骨骼肌再生所必需的。近期的研究已表明,久坐不动小鼠中的MuSC对成年肌纤维的维持起着重要的作用,它们对隔膜肌(diaphragm muscle)的贡献较大,而对下后肢肌(lower hindlimb muscle)的贡献较小。
在一项新的研究中,为了理解确定MuSC对成年肌纤维贡献程度的机制,美国斯坦福大学医学院的Thomas Rando及其研究团队测量了MuSC在不同的未遭受损伤的肌肉中激活并进入细胞周期的程度。当在体内用核苷酸类似物5-乙炔基-2'-脱氧尿苷(5-ethynyl-2'-deoxyuridine, EdU)对小鼠进行刺激以标记正在经历DNA复制的细胞后,他们观察到了广泛的EdU掺入。隔膜肌、股薄肌(gracilis)和三头肌(triceps muscle)表现出最高的MuSC数量,它们在稳态条件下自发地打破静止状态并进入细胞周期,而后肢肌(hindlimb muscle)表现出最低的MuSC数量。

Pax3控制处于稳态条件下的肌肉干细胞激活,图片来自Science, 2019, doi:10.1126/science.aax1694。
隔膜肌、股薄肌和三头肌中的MuSC表达高水平的转录因子Pax3,然而在大多数肢体肌肉(limb muscle)中的MuSC不表达Pax3。鉴于Pax3在胚胎发生期间促进细胞增殖和应对应激中已确立的作用,这些研究人员研究了Pax3是否在稳态期间调节MuSC激活过程。他们观察到在来自不同肌肉的MuSC中,Pax3与EdU掺入呈正相关。为了直接测试Pax3是否在MuSC的静止和激活之间保持平衡中发挥作用,他们使用Pax7-CreERT2对成年MuSC中的Pax3进行条件性剔除(所获得的小鼠称为Pax3cKO小鼠),发现隔膜肌MuSC和后肢肌MuSC中的Pax3 mRNA分别平均下降了96%和88%。在隔膜肌MuSC、股薄肌MuSC和三头肌MuSC中,不论在体外还是在体内,剔除Pax3导致静止标志物增加、MyoD减少和EdU掺入减少。(生物谷 Bioon.com)
https://blog.sciencenet.cn/blog-3482820-1298707.html
上一篇:[转载]蒲慕明院士:谈科研诚信
下一篇:[转载]神经生物学的入门书籍有哪些?