博文
水煤气反应平均摩尔定压热容的热力学计算
|
本文拟探究水煤气反应平均摩尔定压热容( )与温度的关系.
)与温度的关系.
1. 研究体系的确定
研究体系选择为水煤气反应,即:CO(g)+H2O(g)=CO2(g)+H2(g);有关物质的热力学性质参见如下表1[1].
表1. 25℃标态下有关物质的热力学性质
| 物质 | ΔfHθm(/kJ·mol-1) | ΔfGθm(/kJ·mol-1) | Sθm(/J·K-1·mol-1) | Cp,m(/J·K-1·mol-1) |
| CO(g) | -110.525 | -137.168 | 197.674 | 29.142 |
| H2O(g) | -241.818 | -228.572 | 188.825 | 33.577 |
| CO2(g) | -393.509 | -394.359 | 213.74 | 37.11 |
| H2(g) | 0 | 0 | 130.684 | 28.824 |
设水煤气反应相关气体的摩尔定压热容通式为:Cp,m=a+bT+cT2, 有关气体摩尔定压热容与温度
关系参见如下表2[1].
表2. 有关气体的摩尔定压热容与温度的关系
| 物质 | a (/J·K-1·mol-1) | 103b (/J·K-2·mol-1) | 106c (/J·K-3·mol-1) | 温度范围 (/K) |
| CO(g) | 26.537 | 7.6831 | -1.172 | 298~1500 |
| H2O(g) | 29.16 | 14.49 | -2.022 | 273~3800 |
| CO2(g) | 26.75 | 42.258 | -14.25 | 298~1500 |
| H2(g) | 26.88 | 4.347 | -0.3265 | 273~3800 |
研究温度范围选择为:298~1500K.
2. 水煤气反应的热力学计算
2.1 水煤气反应的ΔrHθm(298.15K)及ΔrCp,m(298.15K)计算
由表1可得水煤气反应:
ΔrHθm(298.15K) =ΔfHθm(H2,g,298.15K)+ΔfHθm(CO2,g,298.15K)-ΔfHθm(H2O,g,298.15K)
-ΔfHθm(CO,g,298.15K)
=0-393.509kJ·mol-1 -(-241.818kJ·mol-1 )-(-110.525kJ·mol-1 )
=-41.166kJ·mol-1 (1)
另:ΔrCp,m(298.15K)=Cp,m(H2,g)+Cp,m(CO2,g)-Cp,m(H2O,g)-Cp,m(CO,g)
=28.824+37.11-29.142-33.577=3.215(J·K-1·mol-1) (2)
2.2 不同温度下水煤气反应的ΔrHθm,T及 计算
计算
由表2可得水煤气反应:ΔrCp,m=Cp,m(H2,g)+Cp,m(CO2,g)-Cp,m(H2O,g)-Cp,m(CO,g)
=-2.067+24.4319×10-3T-11.3825×10-6T2 (J·K-1·mol-1) (3)
另依基希霍夫公式可得:
ΔrHθm(T) = ΔrHθm(298.15K) +∫ΔrCp,mdT (4)
将式(1)及(3)分别代入式(4)可得:
ΔrHθm(T) =-41.166kJ·mol-1+∫(-2.067+24.4319×10-3T-11.3825×10-6T2)dT (5)
另:ΔrHθm(T) =-41.166kJ·mol-1+ (6)
(6)
由式(5)及(6)可计算出不同温度下水煤气反应的标准摩尔焓变(ΔrHθm,T),及水煤气反应的平均摩
尔定压热容(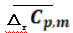 ),具体结果参见如下表3.
),具体结果参见如下表3.
表3. 不同温度下水煤气反应的标准摩尔焓变(ΔrHθm,T)及平均摩尔定压热容( )
)
| 温度(/K) | ΔrHθm,T(/kJ·mol-1) |  |
| 298.15 | -41.166 | 3.215 |
| 400 | -40.650 | 5.065 |
| 500 | -39.989 | 5.832 |
| 600 | -39.197 | 6.523 |
| 700 | -38.298 | 7.138 |
| 800 | -37.313 | 7.677 |
| 900 | -36.266 | 8.141 |
| 1000 | -35.180 | 8.528 |
| 1100 | -34.078 | 8.840 |
| 1200 | -32.078 | 9.076 |
| 1300 | -31.913 | 9.236 |
| 1400 | -30.897 | 9.320 |
| 1500 | -29.955 | 9.328 |
表3显示:温度区间不同,水煤气反应的平均摩尔定压热容(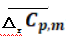 )数据不同.
)数据不同.
3. 结论
水煤气反应平均摩尔定压热容是温度的函数,温度区间不同,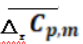 数据有差别.
数据有差别.
参考文献
[1]天津大学物理化学教研室编. 物理化学(第四版,上册).北京:高等教育出版社, 2001,12:310-314.
https://blog.sciencenet.cn/blog-3474471-1374161.html
上一篇:范特霍夫平衡箱—理想热力学反应器
下一篇:有趣的动力学悖论