博文
《细胞》:李佳学/李晓淳等揭示磷酸鞘氨醇的转运机制
||
北京时间2023年5月23日晚23时,美国圣裘德儿童研究医院的李佳学课题组和德克萨斯大学西南医学研究中心的李晓淳课题组,在Cell上发表了题为“Structural and Functional insight into Spns2-mediated transport of sphingosine-1-phosphate”的文章,报道了淋巴管/血管内皮细胞中由 Spns2介导的磷酸鞘氨醇的转运机制。
李晓淳课题组博士后陈洪文、李佳学课题组博士后Shahbaz Ahmed和赵宏图为本文的共同第一作者。
淋巴细胞的迁入和迁出对于维持淋巴组织的稳态和免疫功能的发挥是至关重要的。磷酸鞘氨醇(sphingosine-1-phosphate,S1P)是一种重要的溶血脂类信号分子,在淋巴细胞迁出中扮演着关键作用。然而,S1P信号异常升高时会引起外周淋巴细胞过度活跃,导致自身免疫疾病,例如多发性硬化症(Multiple Sclerosis,MS)。S1P分子在细胞内合成,但必须经跨膜转运进入循环系统,与细胞表面的GPCR受体S1PR1~5结合才能执行其信号传递功能。芬戈莫德(fingolimod)是一种靶向S1PR1的药物,已进入临床用于治疗MS。
MS是一种自身免疫性疾病,主要攻击中枢神经系统(脑、脊髓和视神经)。该疾病的特点是炎性脱髓鞘,即免疫系统攻击了神经纤维的髓鞘,导致电信号传递障碍和神经系统功能障碍,表现为感觉异常、肌肉无力、共济失调、语言障碍等症状。作为S1PR1的激动剂,芬戈莫德作用于淋巴细胞使其表面的S1PR1脱敏,导致这些淋巴细胞不能从淋巴结迁移进入输出淋巴管,从而缓解MS的症状。然而,芬戈莫德同样也会作用于内皮细胞和心肌细胞表面的S1PR1受体,引起严重的副作用,包括黄斑水肿和心动过缓。
S1P的跨膜转运主要通过特定的次级转运蛋白完成,目前已鉴定出的两种转运蛋白包括Spns2和Mfsd2b。淋巴液中的S1P主要来源于Spns2的转运,而血液中的S1P则主要来自于红细胞和血小板中的另一转运蛋白Mfsd2b。那么特异性抑制Spns2从而减少淋巴液中的S1P将有可能避免芬戈莫德这类S1PR1激动剂引起的副作用。此外,在小鼠模型的实验显示Spns2的功能缺陷能够减少癌细胞转移对肺部的侵袭。因此,Spns2是一个用于治疗自身免疫疾病和癌细胞转移的极具潜力的靶点,其结构和功能的研究对揭示S1P的转运机制和小分子抑制机制具有重要意义。
为了研究Spns2如何特异性的识别底物S1P,以及如何通过构象转变将S1P从细胞膜内侧运输到外侧,研究人员利用冷冻电镜技术解析了人源Spns2四种不同构象的结构,包括分别结合底物S1P和小分子抑制剂16d的向内开放状态、不结合底物的部分阻塞状态和向外开放状态(图1)。结合计算生物学和细胞功能实验,这些结构展示了Spns2介导S1P跨膜转运的完整循环过程,为理解该蛋白家族转运溶血脂类的工作机制奠定了基础,也为优化开发新型小分子抑制剂提供了依据。
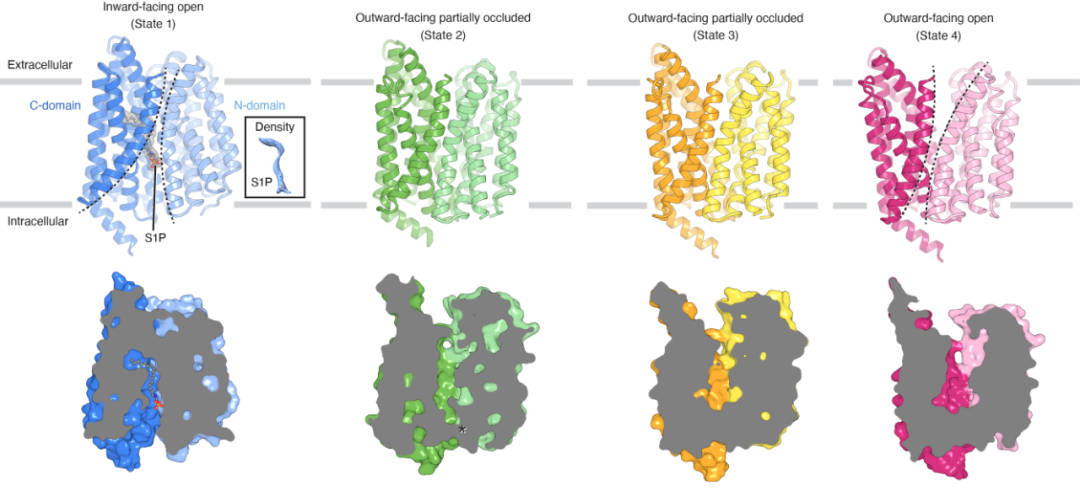
图1. 不同构象的Spns2结构
Spns2的整体结构属于典型的MFS折叠构型,包含12个跨膜螺旋,分为N端和C端两个相对伪对称的结构域。值得注意的是,在所有构象中只有向内开放状态下的Spns2结合有S1P,说明在这一构象的Spns2对S1P有较高的亲和力。在循环转运过程中,Tyr246/Gly333、Tyr246/Asp445、Asp220/Arg456等成对的氨基酸像开关一样控制脂质转运通道的开放与闭合,以及底物结合口袋的形状变化。例如,在向内开放状态下,Tyr246和Gly333形成的氢键会阻塞脂质转运通道;当进入状态2时,这两个氨基酸残基之间不再存在氢键,而TM4的Asp220和TM11的Arg456之间形成盐桥,这两个跨膜螺旋近膜内端之间的距离随之缩短,从而使得内向开口关闭。对这些结构分析直接展示了在相同实验条件下多个状态之间的分子转变。
去年,有研究报道了首个Spns2特异性小分子抑制剂16d。为了研究该抑制剂的工作机制,研究人员还解析了结合16d的Spns2结构。当Spns2结合16d时,只有一种构象,即向内开放状态的结构被捕捉并解析。16d与S1P结合在Spns2相似的位置。与结合S1P的构象相比,Trp440发生了明显的构象变化,并远离结合位点,表明Trp440对16d的特异性结合起重要作用。该结构表明,16d通过直接与S1P竞争同一位点,并将转运蛋白锁定在向内开放状态以阻止其转运活性。
Spns2转运S1P需要偶联质子的跨膜转运(proton-coupled),还是仅仅依靠S1P的顺浓度梯度仍存在争议。研究人员利用细胞实验,证明了Spns2转运S1P并不依赖细胞膜内外两侧的质子浓度(即pH)和Na+离子浓度。此外,当细胞外的S1P浓度足够高时,Spns2还能将S1P转运至细胞内。这些实验表明,Spns2是一个S1P的协助扩散转运蛋白(facilitated-diffusion uniporter)(图2)。
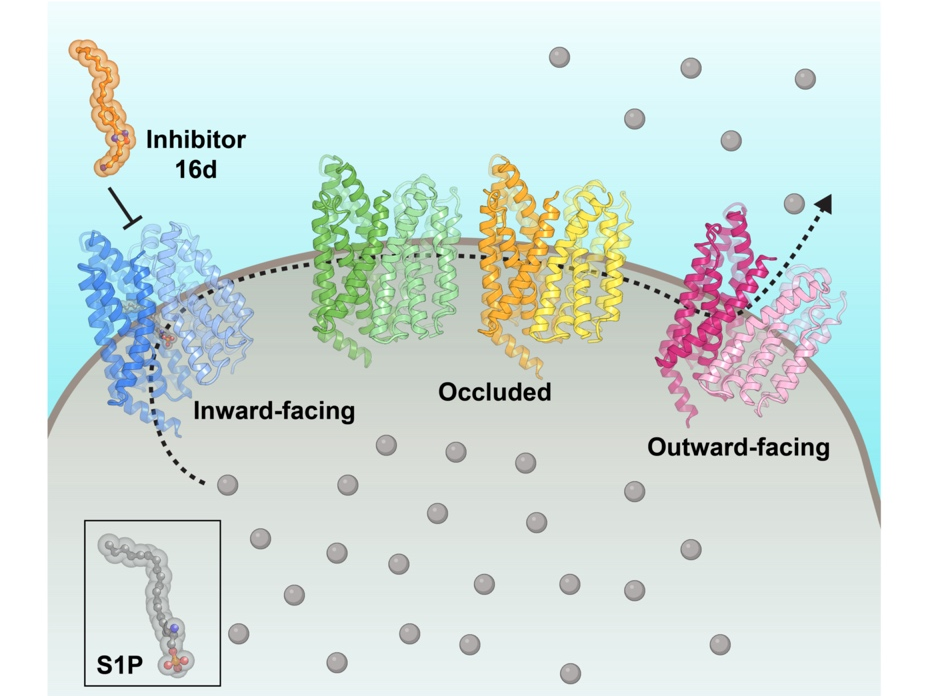
图2. Spns2转运S1P的工作模型
总而言之,该项研究通过结构和功能分析阐明了Spns2的工作机制,为理解 S1P代谢和信号传导提供了重要的分子基础。
李晓淳课题组目前招聘2-3名博士后,申请者需要结构生物学或生物化学研究经历,有意向申请者请把简历发送至xiaochun.li@utsouthwestern.edu
相关论文信息:
https://doi.org/10.1016/j.cell.2023.04.028
https://blog.sciencenet.cn/blog-3423233-1389208.html
上一篇:《自然—生物技术》:徐升团队开发全集成自主可穿戴式超声系统贴片
下一篇:《细胞》:以色列团队揭示兔和小鼠的沙漏型原肠运动模型