博文
《自然—结构与分子生物学》:张凯团队解析中央微管复合物结构并发现其主动调节机制
 精选
精选
||
北京时间2022年5月16日晚23时,美国耶鲁大学张凯课题组在Nature structural & Molecular Biology期刊发表题为 “Cryo-EM structure of an active central apparatus” 的文章,对该领域内长期存在的大量有关中央微管复合物(central apparatus, CA, 包括中央微管对和大量附着蛋白)的争议性问题在近原子层次上给出了确定性答案。
课题组首次解析了中央微管这一超大复合物的高分辨率冷冻电镜结构,从头搭建(de novo model building)原子模型,对中央微管的功能区域完成了更精细的划分,为理解中央微管的功能提供了重要的结构基础,并分析了该超大体系结构动态特性方面的重要规律。而此前领域关于CA的最好结果为2019年G. Fu等关于C1部分的23埃结构【1】。
特别地,该组首次在结构上获得了以联排方式结合在CA上的驱动蛋白KLP1两种不同的微管结合态(microtubule-binding states,MTBS1 和 MTBS2)构象,在结构上直接观察到了处于主动运动态的完整CA近原子分辨率结构。

细胞获得自主运动能力是进化史上至关重要的事件之一,使得生命体相对于无生命物质在运动行为上有了质的飞跃。真核纤毛(cilium)和鞭毛(flagellum)(以下统称纤毛)是负责真核细胞自主运动的主要细胞器。纤毛总体呈尾状,直径通常在250-500纳米,从细胞表面伸向细胞外大约5到10微米,主体由纤毛膜及其包裹的轴丝(axoneme)所组成,而轴丝最终和胞质内的基体(basal body)直接相连接【2】。
纤毛大体可分为两种型态,一种称为运动纤毛(motile cilia ),其轴丝的主体骨架为 “9+2” 微管结构,即9根微管二联管(microtubule doublet,MTD)围绕两根中央微管对(central microtubules,C1和C2);另一种是原纤毛(primary cilia),大多为 “9+0” 结构,一般用作感应细胞器。纤毛起源几乎可以追溯到真核生物最早的共同祖先,从单细胞生物到人类体细胞都广泛存在纤毛结构,是真核生物的重要印记。许多单细胞生物, 如衣藻(Chlamydomonas)和四膜虫(Tetrahymena)等,它们的自主运动和感应环境信号等行为均由纤毛活动直接决定或与其密切相关。
人体内具有多种运动纤毛,如大脑脑室管膜上皮组织的运动纤毛负责驱动脑脊液的流动,在维持中枢神经系统的物质交流和稳态方面有重要作用;气管内的运动纤毛能够保持呼吸道的湿润与清洁;生殖系统的运动纤毛负责推动生殖细胞进入附睾和子宫等。因此,纤毛功能缺陷会导致一系列遗传发育方面的疾病,使得神经、运动、呼吸、生殖、泌尿等系统功能异常。此类疾病统称为纤毛病(ciliopathies),大多数为复杂的综合症。特别的,运动纤毛的功能缺陷可导致不孕不育、发育异常、脑积水、听觉异常等原发性纤毛运动障碍症(primary ciliary dyskinesia,PCD)【3】 ,并且和冠状病毒等呼吸道病原物清理异常、易感及复发性感染、长期咳嗽、呼吸困难等密切相关【4】。
虽然纤毛病病例多为罕见病,但因其机制复杂、种类繁多,因此总体而言不但不罕见,反而影响甚广,严重缺乏有效治疗方案,保守估计全球现有上千万人群正饱受折磨。其背后一个关键原因是系统极其复杂,仅常见组分蛋白就多达上千种,大尺度高动态前提下的高分辨率结构信息长期匮乏,这种局面造成了对改系统深入研究的诸多技术瓶颈。
从列文虎克发现运动纤毛算起的三个多世纪里,人类从未停止对其背后机制的持续探索。基于已有的研究和证据,目前认为运动纤毛的主要动力源自附着在微管二联管上的动力蛋(dynein)【5】【6】,包括外臂动力蛋白(outer-arm dynein, OAD)和内臂动力蛋白(inner-arm dynein, IAD)。OAD是第一个被发现的动力蛋白,也是纤毛运动最主要的能源提供者,IAD更有可能对OAD进行力学上的调控。除此以外,OAD的活性还受到细胞内外各种机械化学信号(mechanochemical )的调节,最终综合决定了纤毛的运动方式,进而决定细胞主动运动的命运。更加详细内容参考张凯组近期关于OAD的研究【5】。
过去的研究表明中央微管复合物(central apparatus, CA, 包括中央微管对和大量附着蛋白)对几乎所有运动纤毛都至关重要,其功能被认为主要通过radial spoke将其机械化学信号传递到微管二联体上的其它响应分子,进而调节OAD功能【7-9】。然而,迄今为止人们尚不清楚CA(也即‘9+2’结构中的‘2’)是否也会像外周的‘9’一样具备“自主运动”能力。大多数观点认为,CA可能仅仅只是一个被动的机械力学的反馈装置,其结构组成并不重要(言外之意就是说CA上的很多蛋白可以随便换,只要大小形态等几何特性合适,cilia依然可以正常工作),更有部分观点认为CA在机械上完全是一个“多余的结构”,只有dynein和外周的9根微管二联体对真核纤毛运动才是essential的。
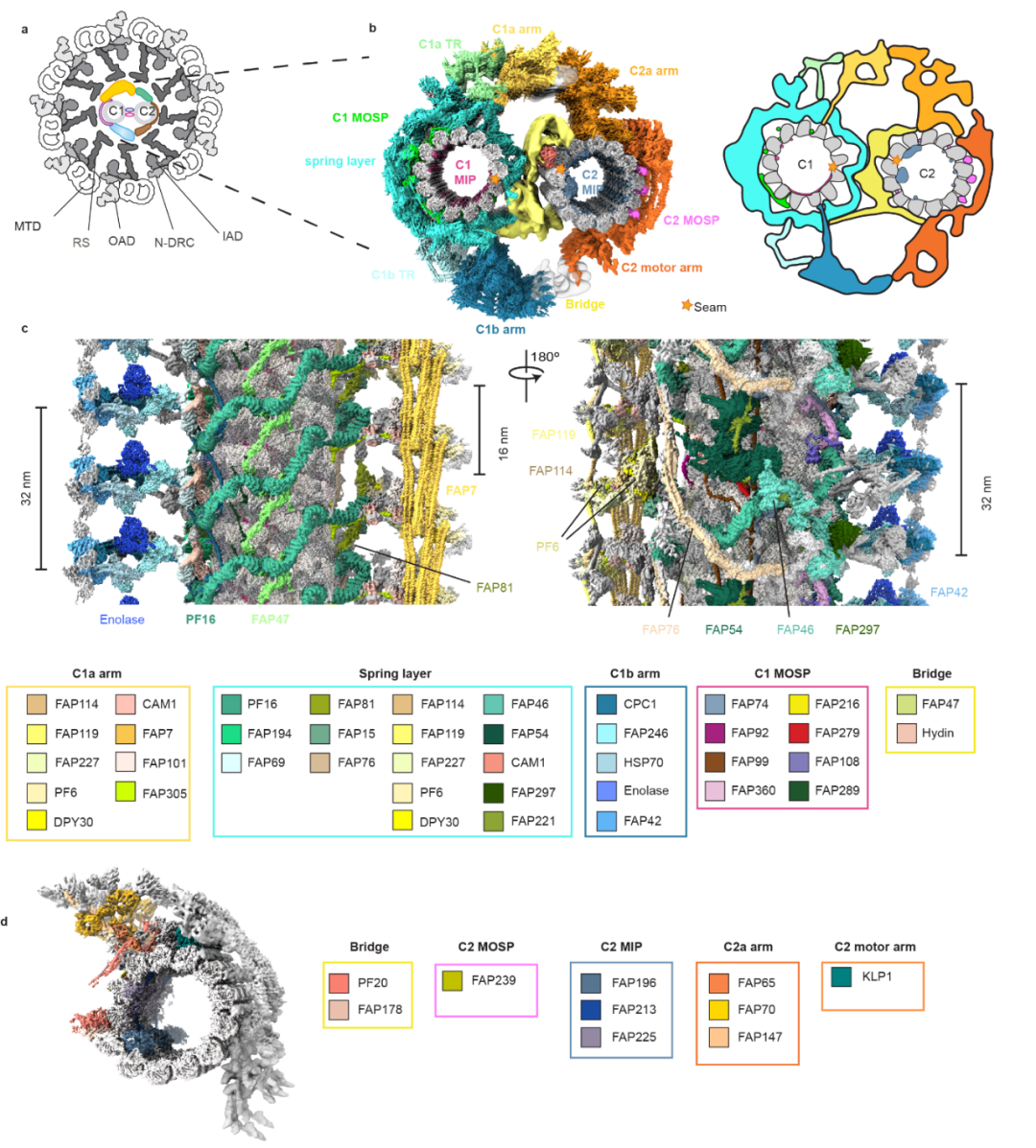
图1:运动纤毛横截面示意图, 中央微管的高分辨率冷冻电镜结构。
中央微管是不对称性的结构,其基本重复单元是32 nm 的结构,在每一基本单元内,研究人员共搭建了208 个微管蛋白和196 个(45种)非微管蛋白(图1)。通过对中央微管高分辨率结构的分析,研究组对其功能区域做了更合理,更精细的划分。除微管外,C1可分五个功能区域:微管内蛋白层(MIP); 微管外表面层(MOSP); 弹簧结构层 (spring layer);两个大的延伸臂(C1a and C1b);连接延伸臂到弹簧层的转换区(C1a TR and C1b TR))。C2 同样含有相应的MIP 和 MOSP功能区,外围结构由一个延伸臂和动力臂组成的。这种不对称的、精细的中央微管结构是其调节纤毛各种高度复杂的运动的结构基础。

图 2: KLP1队列结合微管的两种连续构象。
和动力蛋白OAD正好相反,驱动蛋白KLP1是沿着微管正向移动的分子马达。研究组发现,KLP1位于CA动力臂的一端 (C2微管第9号微管原纤维附近),其头部结合在C2 微管上,为整个动力臂的位移提供能量。在ATP预处理的样品中,作者发现了KLP1 的两种连续的微管结合态(MTBS1和MTBS2)的构象变化(图2)。每一种MTBS状态下的KLP1都以dimer方式存在,并且都处于ATP水解、磷酸释放、ADP结合的中间态,但dimer中的每一个KLP1亚基处于不同构象,然后相邻KLP1 dimers在微管上形成有规则的联排结合。从一种微管结合态(MTBS1)到另一种微管结合态(MTBS2)的过程中,前导驱动蛋白会沿着微管移动8 nm, 从而带动整个动力臂向着微管正端移动。动力臂的另一端最终通过C1和C2中央微管中间的桥联结构固定在C1上,这种结构特征能够使得C2上KLP1的构象变化被传递到C1,从而带动整个中心微管的变化,进而对纤毛运动进行调节。于此同时,研究组还发现KLP1联排队列是高度协同的,即局部的KLP1采用相同的构象,这一机制类似于OAD分子间的协同机制4。
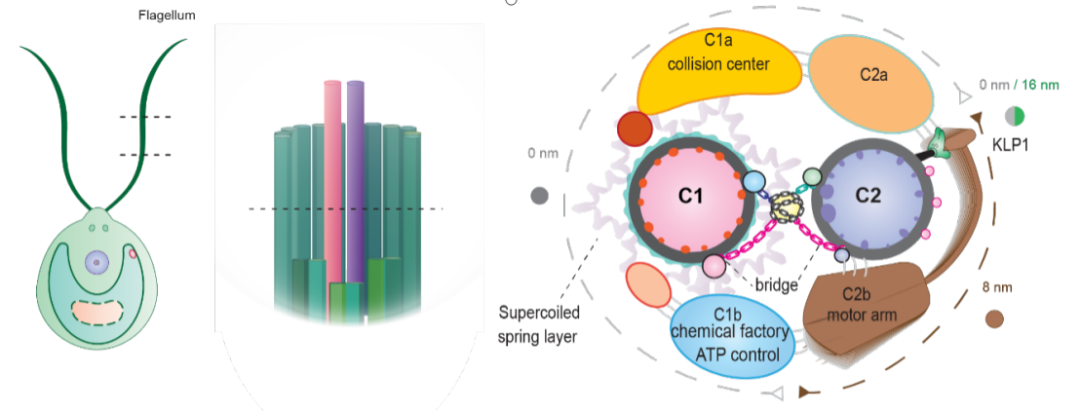
图3:中央微管的功能区域划分模型。中央微管是一个非常精致的装置(图3):两根微管的内表面和外表面都有结合蛋白形成的复杂网络来稳定微管,同时为延伸蛋白提供一系列不同的结合位点,将其固定在微管上特定的位置上;C1微管上有一层弹簧结构用于连接整个延伸结构,让C1整体非常稳定;C2上有一个动力臂来驱动整个中央微管的构象变化;结合在外表面上的一系列的延伸臂作为和辐射轴的作用位点,会随着整个中央微管的变化而对辐射轴施加不同的作用力,从而对整个纤毛运动进行调节。
最后,研究人员通过冷冻电镜断层技术获得超大尺度CA结构信息,并结合高分辨率原子结构信息,跨尺度分析了该体系的动态特性和曲率变化等规律,提出了关于CA如何通过联排KLP1分子间的构象协同主动调节纤毛运动的可能模型。不过该模型目前尚需要更多证据支持和更加深入的后续研究。
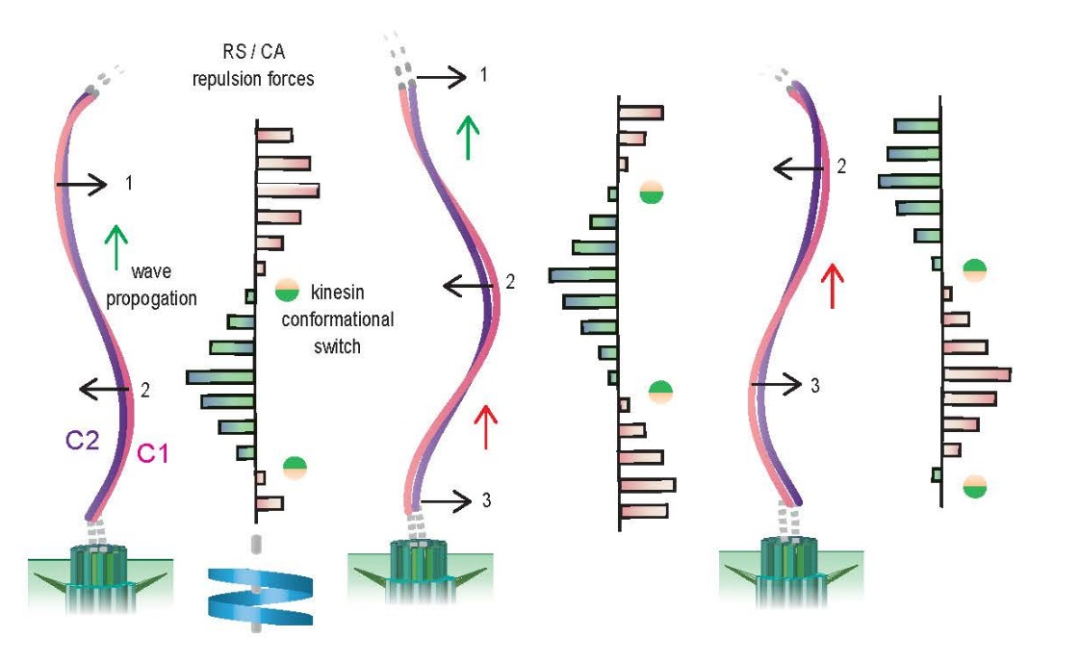
图4:CA在大尺度主动构象变化的模型。
耶鲁大学张凯组博士后韩龙、饶钦辉、杨仁斌(已离职,目前在NIH)、王玥以及博士研究生柴鹏鑫为共同第一作者,张凯为通讯作者。耶鲁大学熊勇教授深入参与了课题讨论,并在论文准备方面给予重要改进建议。J. Howard, G. Whitman和S. King等教授在本论文科学观点和论据方面提供了宝贵意见。耶鲁大学电镜平台吴申平以及凯斯西储大学李鲲鹏和黄围等为本研究提供了重要技术支持。本项目得到了耶鲁大学启动经费、博士后基金和美国国立卫生研究院(NIH)的资助。
相关论文信息:
https://doi.org/10.1038/s41594-022-00769-9
参考文献
1,Fu, G. et al. Structural organization of the C1a-e-c supercomplex within the ciliary central apparatus. J Cell Biol 218, 4236-4251, doi:10.1083/jcb.201906006 (2019). 2,Mitchell, D. R. Evolution of Cilia. Cold Spring Harb Perspect Biol 9, doi:10.1101/cshperspect.a028290 (2017). 3,Reiter, J. F. & Leroux, M. R. Genes and molecular pathways underpinning ciliopathies. Nat Rev Mol Cell Bio 18, 533-547, doi:10.1038/nrm.2017.60 (2017). 4,https://pcdfoundation.org/overview/. 5,Rao, Q. et al. Structures of outer-arm dynein array on microtubule doublet reveal a motor coordination mechanism. Nat Struct Mol Biol 28, 799-810, doi:10.1038/s41594-021-00656-9 (2021). 6,Axonemal Dynein Arms Stephen M King. Cold Spring Harb Perspect Biol. 2016 7,Loreng, T. D. & Smith, E. F. The Central Apparatus of Cilia and Eukaryotic Flagella. Csh Perspect Biol 9, doi:ARTN a028118 10.1101/cshperspect.a028118 (2017). 8,Gui, M. et al. Structures of radial spokes and associated complexes important for ciliary motility. Nat Struct Mol Biol 28, doi:10.1038/s41594-020-00530-0 (2021). 9,Grossman-Haham, I. et al. Structure of the radial spoke head and insights into its role in mechanoregulation of ciliary beating. Nat Struct Mol Biol 28, doi:10.1038/s41594-020-00519-9 (2021).
https://blog.sciencenet.cn/blog-3423233-1338899.html
上一篇:《细胞》杂志报道阻止帕金森氏病恶化的新靶点
下一篇:《核酸研究》:郑杰/陈伟/李丹团队揭示天然免疫RNA受体RIG-I介导的自身免疫疾病新机制