博文
北大魏文胜课题组报道升级版RNA编辑技术LEAPER 2.0
||
RNA编辑是近年来兴起的基因编辑技术。2019年,北京大学魏文胜课题组在Nature Biotechnology杂志报导了新型RNA编辑技术LEAPER【1】。与以CRISPR为基础的DNA或者RNA编辑技术不同,LEAPER仅需要在细胞中表达特殊设计的RNA(ADAR-recruiting RNA, arRNA)即可招募细胞中内源脱氨酶ADAR,实现靶向目标RNA中腺苷A→肌苷I(鸟苷G)的编辑。由于无需引入外源编辑酶或效应蛋白,避免了由此引起的递送以及相关的免疫原性等问题。另外作为RNA精准编辑工具,LEAPER不会引起基因组序列改变,在安全性方面具有优势。
尽管LEAPER在科研和疾病治疗中具有可观的潜力,该技术还存在一定的局限:一是LEAPER利用的是内源编辑酶,其编辑效率会因此受限;另外,具有一定长度的arRNA可能使目标编辑位点邻近的碱基发生脱靶编辑,因此该技术亟需优化升级。
北京时间2022年2月11日凌晨,北京大学魏文胜课题组在Nature Biotechnology杂志发表“Engineered circular ADAR-recruiting RNAs increase the efficiency and fidelity of RNA editing in vitro and in vivo”的研究长文。 该研究发现,通过优化表达载体中的启动子增强arRNA表达可以显著提升LEAPER系统的编辑效率,表明arRNA在细胞中的丰度对于编辑效率十分重要。然而线性arRNA在细胞内容易被降解的特点成为了制约因素。为了克服这一问题,课题组通过设计并运用可招募ADAR的环形RNA(circular ARAR-recruiting RNA, circ-arRNA),实现了编辑效率提升。

环形RNA没有5’或3’末端,可以避免核酸外切酶的切割,在细胞内相比于线性RNA具有更好的稳定性和更长的半衰期。研究发现,circ-arRNA能够维持较长时间的高水平表达。在多个内源转录本位点中,circ-arRNA平均编辑效率相比于线性版本提升了超过3倍,同时也可维持长达近半个月的有效编辑。通过腺相关病毒(AAV)递送,遗传编码的circ-arRNA可以在人的原代细胞和类器官中实现长时程的RNA编辑。另外,体外合成的circ-arRNA也可实现高效的靶向编辑,并且与遗传编码的circ-arRNA具有类似的特征。
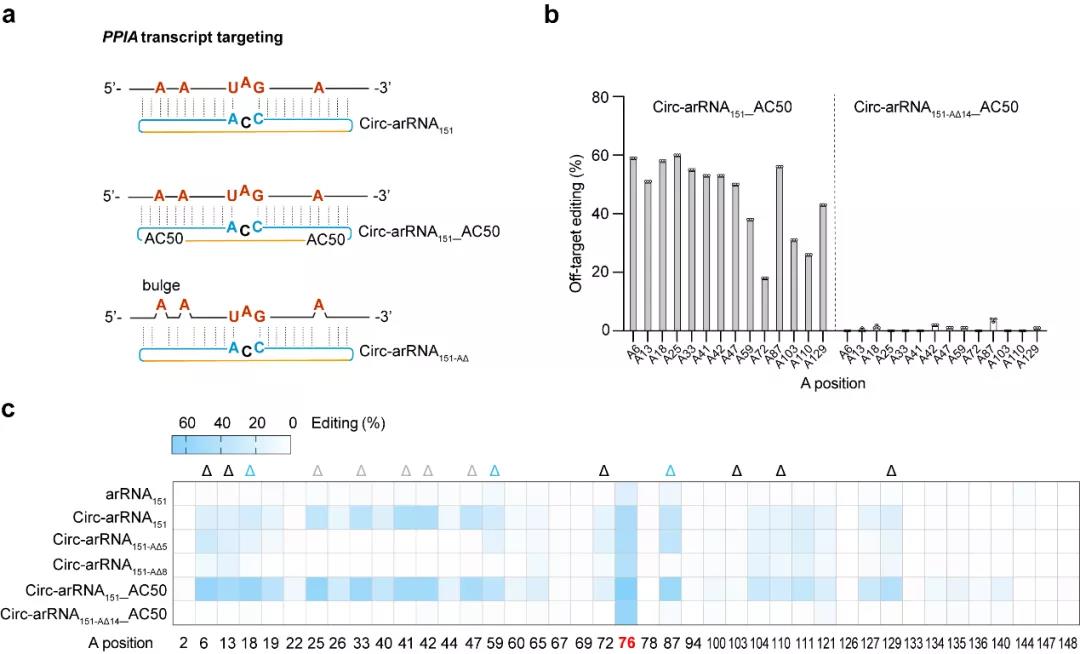
图一、Circ-arRNA在内源转录本上实现高效、精准的编辑
由于ADAR蛋白的底物为双链RNA,靶向RNA与circ-arRNA形成的双链区域内的腺苷酸会有不同概率的脱氨风险。消除这种邻近碱基的脱靶编辑(bystander off-target editing)是实现更加精准的单碱基编辑的关键。进一步研究发现,当删除arRNA或circ-arRNA上非靶向腺苷酸对面的核苷酸后,可以有效避免非靶向腺苷酸的编辑。据此重新设计的circ-arRNA在内源转录本上基本消除了双链RNA区域内目标转录本上的脱靶,同时维持了较高的精准靶向编辑效率。近期,Thorsten Stafforst课题组报道了名为CLUSTER的RNA编辑技术【2】,该技术虽然降低了邻近碱基的脱靶编辑效率,但是其靶向编辑效率仍处于和线性arRNA类似的水平。与此相比,circ-arRNA不仅提升了RNA编辑效率,还消除了邻近碱基的脱靶编辑,这一升级版技术被命名为LEAPER 2.0。
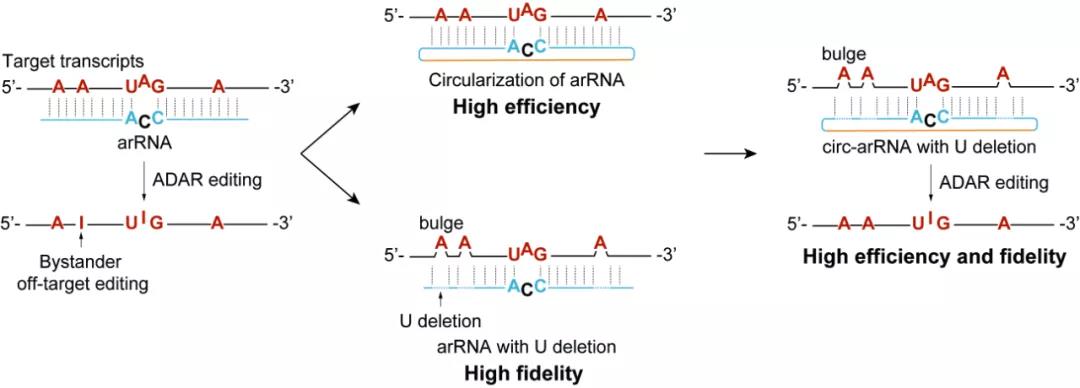
图二、LEAPER 2.0 — 通过工程化的circ-arRNA实现高效、精准的RNA编辑
接下来对LEAPER 2.0应用潜能的评估显示,circ-arRNA可以成功激活Wnt信号通路,修复TP53基因中的致病突变使其表达的p53恢复转录调节功能。使用AAV将circ-arRNA递送至Hurler综合征疾病模型小鼠体内,可以成功修复Idua致病突变并恢复IDUA的酶活。这些结果表明,LEAPER 2.0在科研和疾病治疗中具有令人期待的优势与潜能。
北京大学魏文胜课题组博士研究生伊宗裔(CLS)、博士后璩良和博士研究生唐慧贤(BIOPIC)为该论文的共同第一作者。该研究项目得到了国家重点研发计划、国家自然科学基金重点项目、北京市科委生物医学前沿创新推进项目、北京未来基因诊断高精尖创新中心、北大-清华生命科学联合中心以及中国博士后科学基金的支持。
相关论文信息:
https://www.nature.com/articles/s41587-021-01180-3
参考文献
1.Qu, L. et al. Programmable RNA editing by recruiting endogenous ADAR using engineered RNAs. Nat Biotechnol 37, 1059-1069 (2019).
2.Reautschnig, P. et al. CLUSTER guide RNAs enable precise and efficient RNA editing with endogenous ADAR enzymes in vivo. Nat Biotechnol (2022).
https://blog.sciencenet.cn/blog-3423233-1324862.html
上一篇:《神经元》:华中农大曹罡课题组揭示神经系统感知病原感染,精调免疫应答新机制
下一篇:杜克大学王小凡/李启靖研究组合作揭示神经递质GABA在肿瘤免疫中的关键作用