博文
开启诱导多潜能干细胞 (iPSC)的新时代
||
自15年前发现诱导多潜能干细胞 (iPSC) 技术以来,干细胞生物学和再生医学取得了重大进展。通过iPSC的研究,一些新的病理机制得到确定,经iPSC筛选确定的一些新药正在研发过程中,第一个使用人类iPSC衍生细胞所做的临床试验业已启动。
iPSC可用于探索疾病发生和发展的原因,创造和测试新的药物和疗法,并有可能治疗以前无法治愈的疾病。用于重编程生成iPSC的体细胞主要包括皮肤细胞和血细胞,在较小范围,也有采用其他类型体细胞,如毛囊、脐带血和尿液。
iPSC的细胞商业化用途
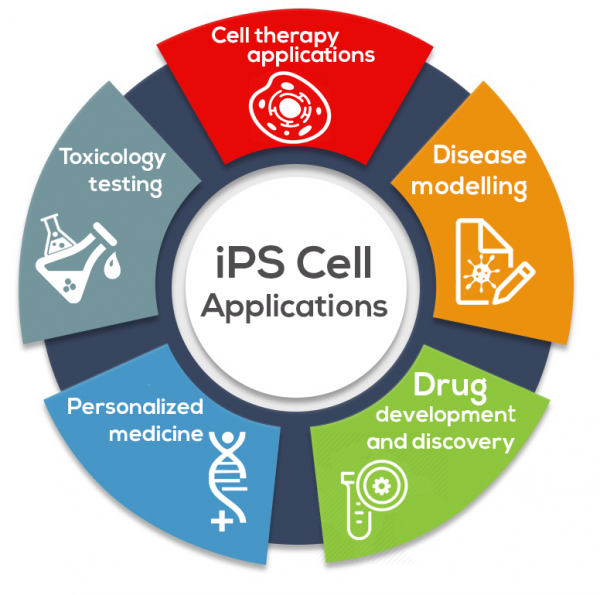
目前iPSC商业化用途的主要领域包括:
1. 细胞疗法:iPSC正在各种细胞疗法应用中进行探索,目的是逆转机体损伤或疾病。
2. 疾病建模:通过从感兴趣的疾病患者中生成 iPSC,并将其分化为疾病特异性细胞,通过这种方法,iPSC 可以“在培养皿中”有效地建立疾病模型。
3. 药物的开发和发现:iPSC具有提供生物学同类的细胞类型的潜力,这些细胞可以用于针对各类组织细胞的化合物鉴定,化合物筛选,靶标验证,和作为新药发现的工具。
4. 个体化医学:使用CRISPR等基因编辑技术,可以在许多类型细胞中精确,定向地进行基因敲除或敲入,包括单碱基改变,纠正干细胞基因组内的基因差误。将患者iPSC与基因组编辑技术相结合,为个性化医疗增添了新的途径。
5. 毒理学测试:iPSC可用于毒理学测试和筛查,即使用iPSC或其衍生的特定组织的细胞,通过活细胞来评估该组织的细胞对化合物或药物的安全性。
此外,iPSC也可以用于其他产品的研发,如3D生物打印,组织工程等。在工业规模生物反应器大规模生产和分化iPSC技术也在以惊人的速度发展。
近年来,iPSC和其衍生细胞已用于临床前的测试和早期临床试验。首次使用iPSC的临床试验始于2008年,如今,这一数字在全球已超过100宗。当前的大多数临床试验并不涉及将iPSC 移植到人体,而是以临床应用为目的,建立和评估 iPSC 细胞株。在这些试验中,iPSC细胞株是从特定的患者群体中建立的,用来确定这些细胞株是否可以成为对应疾病的良好模型。
目前,iPSC在针对临床治疗方向的研究也显著增加。自2006年发现iPSC以来,2013年第一个iPSC衍生细胞产品移植到人类患者中仅用了7年时间。2013年是具有里程碑意义的一年,见证了第一个将iPSC移植到人体中的细胞治疗。这项工作是由位于神户的日本理化学中心(RIKEN)Dr. Masayo Takahashi领导的团队,使用iPSC衍生细胞片在黄斑变性患者中所作的临床安全性研究。从2013年至今,使用人类iPSC及衍生细胞的由生物公司主导的和由医生主导的临床试验研究业已启动。
2016年,Cynata Therapeutics公司获准启动同种异体iPSC衍生的MSC细胞产品 (CYP-001) 治疗移植物抗宿主反应(GvHD)的首个临床试验。在这项历史性试验中,CYP-001达到了所期望的临床终点,为治疗类固醇耐药性急性GvHD提供了安全性和有效性数据。鉴于这一早期的成功,Cynata Therapeutics目前正在将其iPSC衍生的MSC推广到与COVID-19相关的严重并发症,GvHD和严重肢体缺血 (CLI) 的2期临床试验。Cynata Therapeutics也正在启动一项令人印象深刻的3 期试验,将在440名骨关节炎(OA)患者中使用iPSC衍生的MSC产品CYP-004。这项试验是世界上首个涉及iPSC衍生细胞治疗产品的3期临床试验。Cynata Therapeutics特有的技术平台(Cymerus™)克服了以商业规模制造细胞产品的许多复杂性和挑战,可以在成本条件可行,符合良好生产规范 (GMP) 要求的情况下,生产大量和良好均质性的iPSC衍生MSC。
日本商业巨头FUJIFILM(富士胶片)跨国企业集团通过其9%的公司股权,参与了Cynata Therapeutics的iPSC衍生MSC的共同开发和商业化。FUJIFILM是再生医学领域最大的参与者之一,通过收购Cellular Dynamics International和Japan Tissue Engineering Co.,两家生物工程公司,在再生医学多个治疗领域建立了广泛的基础。此外日本药物公司Healios K.K.还与住友制药公司合作,正在开启同种异体 iPSC衍生的视网膜细胞治疗老年黄斑变性 (AMD) 的临床试验。
借助 CAR-T 领域的发展势头,2007年成立,总部在加州的美国Fate Therapeutics药物公司正在开发产品FT819,是其iPSC衍生CAR-T细胞的现货产品。FT819是世界上第一个源自克隆性iPSC细胞株的CAR T疗法,用于CD19+ 的恶性B细胞肿瘤,具有多项技术来提高CAR T细胞疗法安全性和有效性的新特点。使用克隆性iPSC细胞株作为起始细胞来源,可以大规模生产并以工业化规模交付现货CART细胞产品,以应对大量的临床需要。2020年7月,Fate Therapeutics宣布FDA批准其全球首个iPSC衍生CAR T细胞FT819的新药研究(IND)申请。
2019年2月,明尼苏达大学与Fate Therapeutics合作开发的异基因iPSC衍生自然杀伤(NK)细胞获得FDA批准进行临床试验。Fate Therapeutics 正在探索其iPSC产品FT516和FT500的临床应用,这两种细胞产品是iPSC衍生的NK成品细胞的候选者。2019年12月,该公司发布了其1期临床研究的有希望的临床数据。
2019年12月,美国国立卫生研究院 (NIH) 宣布将在美国开展的第一项iPSC 衍生细胞治疗的临床试验。该试验的这项I/IIa 期临床试验治疗12名晚期老年黄斑变性患者的地图状萎缩(geographic atrophy),将iPSC衍生的视网膜色素上皮 (RPE)细胞植入单眼,目标是恢复垂死的视网膜细胞。
一般而言,诱导多潜能干细胞iPSC的细胞治疗目标,包括没有其他可行治疗方法以及需要修复或替换功能失效组织的任何疾病或损伤。尽管在疾病建模和药物开发应用中使用 (iPSC) 取得了进展,但在人类患者中实现iPSC及各种类型的衍生细胞治疗的广泛应用仍是一条漫长的道路。
https://blog.sciencenet.cn/blog-3302154-1309827.html
上一篇:想为您的生活增添健康岁月吗?看看长寿研究怎么说?
下一篇:iPSC细胞治疗的公司和技术管线(2021)