博文
2019年总结3-上海药物所发展出药物结合口袋的动态特征及相关性分析新方法与应用平台:D3Pockets
|
一、引言
药物分子一般都是通过与靶标蛋白结合而发挥药效的。蛋白质上往往同时存在多个空腔,其中能和小分子结合并发挥调控蛋白质功能的空腔称为可药性口袋。不同于结晶状态,生物体中的蛋白质结构总是不停地运动变化着的。因此,蛋白质上药物结合口袋位置及动态性质等信息对基于结构的药物设计及先导化合物优化非常关键。现有可药性口袋的预测研究方法多为基于打分函数或机器学习的分类模型方法。这些方法大多只针对口袋的静态结构,而不能描述蛋白质在运动变化过程中其口袋所发生的变化情况。
近日,中科院上海药物研究所朱维良课题组发展了一种基于分子动力学模拟轨迹或构象集而研究口袋动态特性的理论方法,并开发了相应的应用程序平台D3Pockets,可用于研究蛋白质上潜在药物结合口袋的稳定性、连续性和相关性等性质,进而发现新可药性口袋,提高药物研究的创新性。该方法在HIV-1 (human immunodeficiency virus protease)、BACE1 (β-secretase 1)、L-ABP (L-arbinose binding protein)、GPX4 (glutathione peroxidase)、GR (glucocorticoid receptor)等体系上的测试结果表明,D3Pockets可帮助药物设计及药物化学等研究领域的研究人员系统地探索靶标蛋白上多个潜在结合口袋的动态特性,进而选择最优的可药性结合口袋以开展活性化合物发现与结构优化研究工作。为了方便使用,研究人员还建立了可通过互联网提交任务并下载预测结果的D3Pockets网络服务器 (http://www.d3pharma.com/D3Pocket/index.php),可用于包括内源性活性位点、别构调节口袋等多种可药性口袋的发现预测。
该研究结果已经发表于JCIM并受到同行的高度关注。论文主要作者陈照强博士、徐志建副研究员及张鑫贲等一直致力于化学信息学及药物设计方法发展与软件程序开发方面的研究工作。
二、研究结果
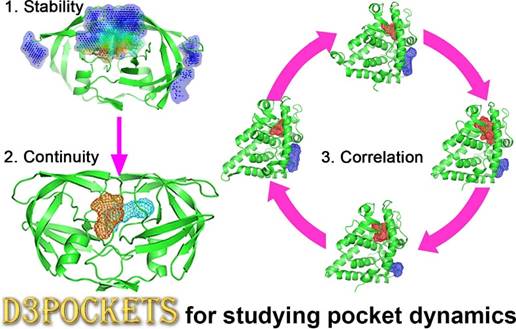
D3Pockets可用于研究药物靶标蛋白上潜在可药性位点的稳定性、连续性及相关性。
稳定性
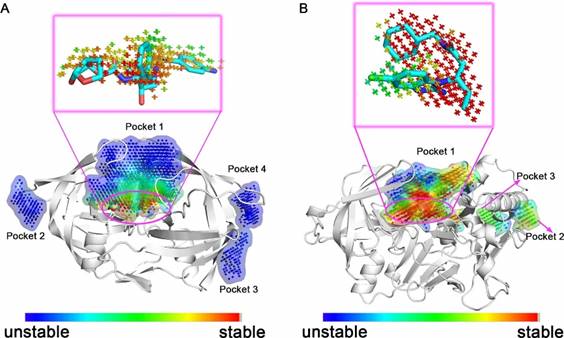
D3Pockets可以分析口袋的稳定性。如图1所示,D3Pockets通过对口袋中的格点进行着色来描绘口袋的稳定性。格点的颜色越红,说明该格点出现的次数越多;格点的颜色越蓝,说明该格点出现的次数越少。因此,由红色格点组成的口袋要比其他颜色的口袋更加稳定。图1A表明HIV-1蛋白酶表面有4个口袋。口袋2、3、4中的格点的颜色是蓝色的。口袋1是内源性配体口袋,它和口袋2、3、4相比更加稳定。进一步观察发现,口袋1的顶部是不稳定的,以蓝色为主;中间部位是比较稳定的,以绿色为主;底部是最稳定的,以红色为主。该结果和HIV-1的运动是一致的,分子动力学模拟表明HIV-1的flap区域会进行打开和关闭的周期性运动。随着flap的关闭,口袋的顶部区域会消失。蛋白质晶体结构表明,HIV-1蛋白酶的抑制剂主要是结合在口袋的稳定区域即口袋底部。
图1B表明BACE1蛋白质表面有3个口袋。口袋1是配体结合的口袋,比其他口袋更加稳定。观察发现由于flap区域的运动导致口袋1的左上角区域不稳定。BACE1的配体也主要结合于口袋的稳定区域。因此,口袋的稳定性是一个重要的特性,可以用来进一步确定药物设计的位点。
|
图1 HIV-1和BACE1蛋白口袋的稳定性分析 |
连续性
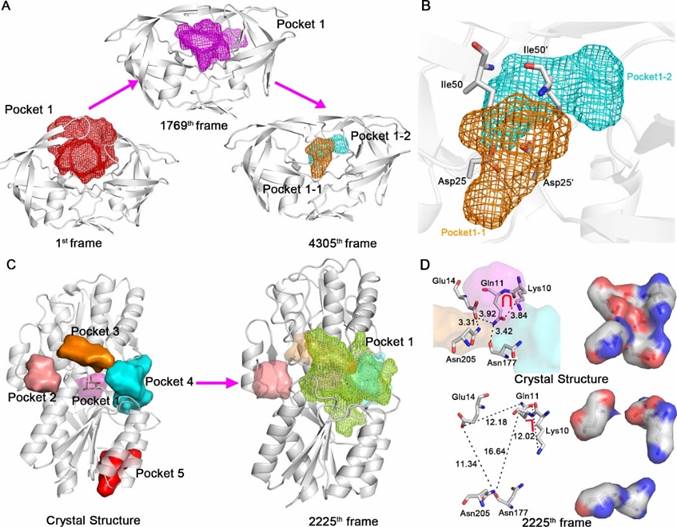
D3Pockets可以分析口袋的变化情况(图2)。如图2A所示,HIV-1蛋白酶从开放状态向闭合状态的转变过程中,其配体结合口袋逐渐变小。配体结合口袋在蛋白质的运动变化过程中可分裂成2个亚口袋:口袋1-1和1-2,它们之间的氨基酸残基有Ile50、 Ile50’、Asp25和Asp25’ (图2B)。Ile50和Ile50’ 位于运动的flap区域。HIV-1蛋白酶的活性位点包含6个残基,即每个单体上的三联残基“Asp25-Thr26-Gly27”。Asp25和Asp25’ 位于口袋的底部,直接和底物作用水解酰胺键。绝大部分HIV-1蛋白酶的抑制剂和Asp25、Asp25’、Ile50、Ile50’这些残基形成氢键作用。所有FDA批准的HIV-1抑制剂药物都与残基Asp25和Asp25’形成氢键作用,而Ile50和Ile50’通过水分子和药物(Tipranavir除外)形成氢键网络。Tipranavir酯基中的氧原子占据了原来水分子的位置,直接和残基Ile50及Ile50’形成氢键作用。
L-ABP蛋白质表面有5个口袋(图2C所示)。口袋1是内源性配体结合口袋,属于封闭型结合口袋。在L-ABP蛋白质的动态变化过程中,口袋1、3、4融合形成一个大口袋,从而为配体分子进出口袋1提供了一条通道(图2C)。口袋1、3、4间的氨基酸残基有Lys10、Gln11、Glu14、Asn177和Asn205 (图 2D)。在口袋变化过程中这些残基的位置都发生了显著变化,如残基Asn205到Glu14的距离从3.31 Å 变化到11.34 Å、Glu14到 Gln11从3.92 Å 变化到12.18 Å、Asn177到Gln11从3.42 Å 变化到16.64 Å、而Lys10到Gln11也从3.84 Å 变化到12.02 Å 。同时,“Gln11-Lys10”二联体的形状从关闭状态的U型变化到打开状态的L型(图2D)。这些变化使得口袋1、3、4之间的门控通道从关闭到打开,为配体提供了进出口袋1的通道。
|
图2 HIV-1和L-ABP蛋白口袋的连续性分析 |
相关性
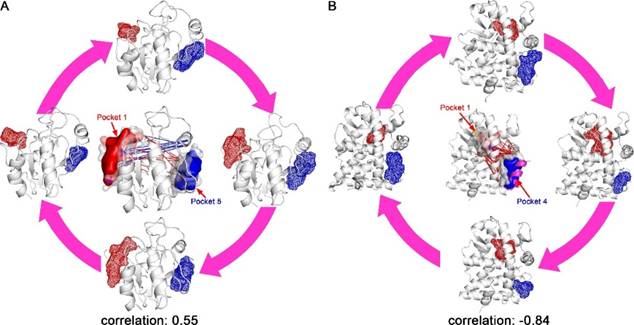
D3Pockets可以分析口袋的相关性。例如,对于GPX4蛋白,在MD模拟过程中至少可以观察到5个不同的口袋。口袋1是底物结合口袋,其附近还有口袋2、3、4,而口袋5远离口袋1。D3Pockets分析发现,口袋1和5在动态变化过程中存在正相关性(0.55),即口袋1变大的同时口袋5也会同时变大(图3A),它们体积变化范围分别是132到287Å3和98到300Å3。Li等人报道口袋5是一个潜在的别构位点,并基于该位点找到了相应的别构激动剂。因此,D3Pockets可用于别构口袋的发现。
GR蛋白质在动态变化过程中出现了6个口袋。口袋1是底物结合口袋。D3Pockets分析发现,口袋1和口袋4在动态变化过程中存在负相关性(-0.84),即口袋1变大的同时口袋4会同时变小(图3B),相应的体积变化范围分别是91到273 Å3和224 到92 Å3。已有研究结果表明,口袋4是辅酶结合口袋,可以结合核受体共激活因子2,亦可能是一个重要的功能口袋,并可用于创新药物研究。
|
图3 GPX4和GR蛋白口袋的连续性分析 |
三、总结
D3Pockets可用于研究药物靶标蛋白上配体结合口袋的动态行为及相互关系,为寻找靶标蛋白上潜在成药性新位点提供了理论方法与应用平台,可用于包括内源性活性位点、别构调节口袋等多种可药性口袋的发现预测,为First-in-class药物设计提供理论指导。
致谢
本研究工作受到国家重点研发项目等基金的资助。
参考文献
Zhaoqiang Chen, Xinben Zhang, Cheng Peng, Jinan Wang, Zhijian Xu, Kaixian Chen, Jiye Shi, Weiliang Zhu, D3Pockets: A Method and Web Server for Systematic Analysis of Protein Pocket Dynamics, Journal of Chemical Information and Modeling 2019, 59(8), 3353-3358
备注:此文曾发表于公众号“ComputArt计算有乐趣”:
https://mp.weixin.qq.com/s/BQTEmmSrACumCyHKNbt6Jw
“ComputArt计算有乐趣”由JCIM副主编王任小老师创立,经常更新化学信息学和药物设计的相关文章,欢迎大家关注。
https://blog.sciencenet.cn/blog-2877557-1210918.html
上一篇:2019年总结2-“博爱”的弱相互作用:卤键的本质与特征
下一篇:2020年(1): 抗新冠肺炎的药物靶标预测及虚拟筛选网络应用平台D3Targets-2019-nCoV