博文
《自然》:从猪到人,异体器官移植获得新生
 精选
精选
|
异种移植
就在六小时前,位于巴尔地摩的马里兰大学医学院的外科医生从一个健康的猪身上摘下肺,将其移植到一个六岁大的狒狒胸腔里。尽管看起来就和肉铺卖的内脏一样,这块躺在碎冰上略显苍白的肺,很快便会因为新注入的血液而重回生机。这场需要5个小时和5万美金的手术,涉及到气管和复杂的动静脉的缝合。如果狒狒的免疫系统能够接受这个“外来”肺,那么手术就取得了初步成功。
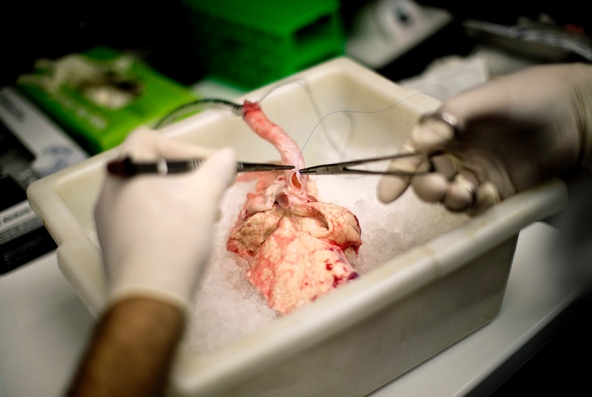
图片来源:Chris Maddaloni/Nature
Robin Pierson领导的这项研究试图测试“转基因猪”和“免疫抑制剂(一种用于抑制免疫系统功能的药物,从而抑制排斥)”不同组合的作用。在已经完成的大约五十例从猪到灵长类的器官移植手术中,却还没有一只猴子在手术后能活过一个星期的时间。巨大的物种差异,复杂的免疫系统和潜在的猪源病毒造成的感染风险令人望而生畏,早在2000年代早期,制药巨头便纷纷退出“异种移植”。
然而随着免疫抑制剂的发展和基因组编辑技术的进步,“异种移植”或将迎来复兴!今年十月份,位于波士顿的一家名为eGenesis的生命科学公司,其创始人为遗传学大牛George Church,在《科学》杂志上发表了一篇文章称:他们利用CRISPR/Cas9技术一次性地在猪的基因组中删除了62个内源逆转录病毒(endogenous retroviruses)。相比于以往的ZFN和TALEN等基因编辑技术,高效简单的CRISPR/Cas9在全球掀起了基因编辑的热潮,科学家希望借此修改猪的基因组,解决免疫排斥或者降低猪内源病毒感染的风险。
也许是重新看到了希望,位于马里兰的一家名为United Therapeutics的公司决定再度投资“异种器官移植”。仅在去年便豪掷一亿美金用于加速研究从转基因猪中获得可供移植的肺。要知道这可是十多年来工业界第一笔大投入!这家雄心勃勃的公司希望在2020年之前获得可供临床实验的猪肺。然而很多人却觉得这个目标根本不现实,因为监管机构对于猪来源器官的安全性和猪源疾病可能传给免疫系统受抑制病人的风险仍然感到很不安。
异种移植的历史
早在上世纪60年代,外科医生已经开始尝试把狒狒和猩猩的肾移植到人。可是他们几乎没有成功过:病人手术后活不过几个月,通常是由于自体免疫系统攻击和排斥外来的器官。然而,关于异种移植的想法却一直没有停止,要知道全世界每年有数以万计的病人因为等不到合适的供体器官而遗憾地告别人世。所以如果能够从饲养的大动物中获得一个稳定的器官供应实在是太美妙了。屠宰场每天都在都为我们提供肉类,然而那些重要的诸如心肺肾的器官往往就是被我们吃掉或者扔掉,着实太可惜了。
我们知道人体会排斥这些动物器官,然而具体的机制却一直不得而知。第一丝曙光出现在1993年,美国匹兹堡大学外科医生David Cooper和同事发现猪细胞的表面会表达α-半乳糖,而人体的血液中存在天然抗α-半乳糖的抗体,因而在移植之后的数分钟之内,超急性排斥反应被启动,移植的猪器官很快被排斥了。α-半乳糖苷转移酶是产生α-半乳糖的主要酶,当我们将编码α-半乳糖苷转移酶的基因敲除后,超急性排斥反应被抑制住了。
这样的发现很快就吸引了制药巨头的注意力,原本毫无头绪的问题似乎变得有迹可循,异体器官移植研究很快迎来了井喷式发展。1996年,位于瑞士的制药巨头诺华(Novartis),投资了超过10亿美金。美国食品药品监督局(FDA)甚至开始制定一些准则用来规范“异种移植”的临床实验。
然而人类显然低估了人体免疫系统的复杂性,即使抑制了α-半乳糖的表达,接受了猪器官移植的狒狒也从没有活过几个星期。另一个诸如FDA这样的监管者十分关心的问题是移植后感染的风险,因为猪的基因组里散布着内源逆转录病毒,这些病毒会不会入侵人体,依然不得而知。FDA遇到这种问题的时候,总是非常谨慎,这无疑增加了“异种移植”进入临床的难度。于是在2000年代早期,诺华放弃了,相关的研究团队也被解雇了。
技术的复兴
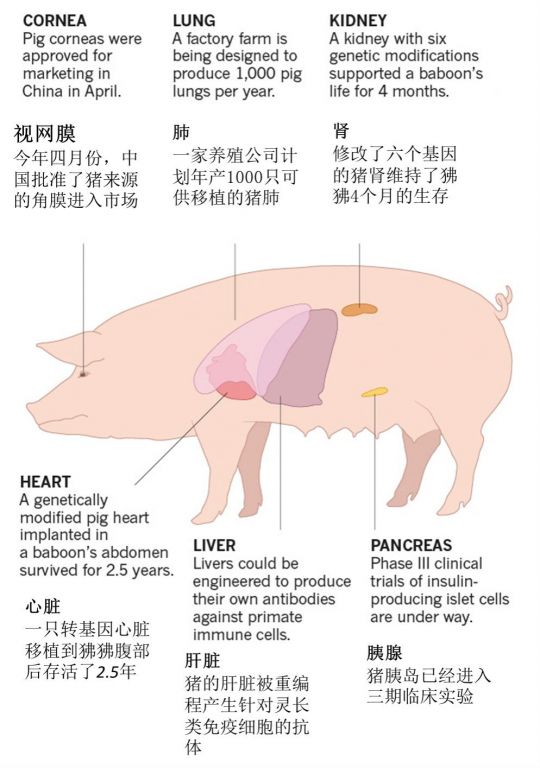
即使失去了工业界的巨额投资,关于“异种移植”的研究依然在顽强进行着。今年四月份,中国药监局批准了猪角膜进入市场,研发人员剔除了猪角膜中容易引起排斥的细胞,保留了具有一定功能的细胞外基质,这些细胞外基质在进化上保守,却不易引起排斥反应。
澳大利亚的一个研究小组另辟蹊径,他们试图让猪产生能够中和人类免疫细胞的抗体。在他们的构想中,只有移植的猪肝脏细胞能够分泌这样的抗体,从而只在移植的肝脏周围产生一个不受免疫细胞攻击的免疫豁免区。
新西兰的研究者从猪的胰腺中分离胰岛,胰岛能够分泌胰岛素,猪的胰岛素和人类最为接近,只有一个氨基酸的不同。因此临床上移植胰岛有望控制糖尿病。为了解决排斥问题,他们将猪胰岛包裹在类似于果冻的水凝胶中,水凝胶之所以能够保护猪胰岛不受免疫排斥,因为自体免疫细胞和抗体不能透过水凝胶。新西兰这家名叫Living Cell Technologies的公司将这种产品命名为“DIABECELL",目前正在若干国家进行三期临床测试,有数据表明,经过水凝胶保护的猪胰岛能够在病人体内存活超过九年的时间。
2003年,在美国弗吉尼亚州有一家名为Revivicor的公司生产出了将α-半乳糖完全剔除的猪。此后公司一直致力于尝试敲除其他可能引起排斥或者导致凝血的抗原,并且取得了可喜的成绩:一只转基因心脏移植到狒狒腹部后存活了2.5年;修改了六个基因的猪肾维持了狒狒4个月的生存。
图片来源:nature
在动物中敲除或者敲入基因原本是件费时费力费钱的事情,通常需要将动物繁殖好几代去筛选。例如,做出第一只敲除α-半乳糖的猪花了整整三年时间。然而CRISPR/Cas9的出现改变了游戏规则:甚至可以直接在猪胚胎中进行多个基因的加减法。有一种可能是我们在猪中删除若干基因再增加若干人类基因,从而在源头上解决排斥问题。这样的想法虽然很不现实,但并非没有可能。明尼苏达大学的外科医生Bernhard Hering精通移植胰岛来治疗一型糖尿病,他率领的研究小组正在利用CRISPR技术试图创造出不引起排斥的猪胰岛。
Revivicor公司试图抓住基因组编辑技术这个机会,生产出更多能够提供器官供体的小猪。在公司给我们描绘的美好愿景里头,如下图所示,位于北卡的新工厂每年会生产超过1000头清洁无菌的转基因猪用于供应器官。工厂利用太阳能板产生能源,同时预留的直升机停机坪用于快速地将器官运送到各地。毕竟,在器官移植领域,时间就是金钱。

图片来源:United Therapeutics
原文链接:http://www.nature.com/news/new-life-for-pig-to-human-transplants-1.18768
https://blog.sciencenet.cn/blog-282107-937018.html
上一篇:《新英格兰医学杂志》:可降解的冠状动脉支架
下一篇:Nat Biotech:首次利用细菌一步合成可降解塑料PLGA